Альдегіди






























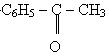
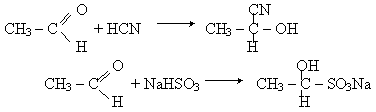
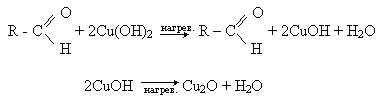
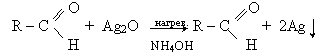
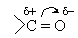
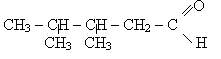
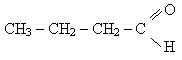
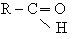
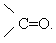 Слово "альдегід" буквально означає "спирт, позбавлений водню" (від лат. alcohol dehydrogenatus), тобто окислений спирт.
Слово "альдегід" буквально означає "спирт, позбавлений водню" (від лат. alcohol dehydrogenatus), тобто окислений спирт.
Карбонільні сполуки містять в молекулі карбонільну групу Карбонільні сполуки діляться на альдегіди и кетони.
Альдегіди (алканалі). В молекулах альдегідів карбонільна група сполучена з вуглеводородним радикалом і атомом водню (або двома атомами водню ), тобто спільна формула цих сполук:
Назви альдегідів по замісній номенклатурі в співвідношенні з правилами іЮПАК виводять з назви відповідного вуглеводню з додаванням закінчення -аль. Перед корнем назви записують бокові замісники з вказівкою їх положення їх числа. Нумерація атомів вуглецю починається з вуглеводного атома карбонільної групы. Приклади:
бутаналь 3,4-диметилпентанель
Физичні властивості: Перший член гомологічного ряду деяких альдегідів НСНО - безбарвний газ, декілька наступних альдегідів - рідини. Вищі альдегіди - тверді речовини. Карбонільна група обслуговує високу реакційну здатність альдегідів. Температура кипіння альдегідів підвищується зі збільшенням молекулярної масы. Кипять вони при більш низькій температурі, ніж відповідні спирти, наприклад пропіоновий альдегід при 48,8 оС, а пропіловый спирт - при 97,8 оС. Густина альдегідів меньша за одиницю. Мурашиний та оцетний альдегіди добре розчинюються у воді, послідуючі - гірше. Нищі альдегіди мають різкий, неприємний запах, деякі вищі - приємний запах.
Химичні властивості. Присутність карбонільної групи визначає велику реакційну здатність альдегідів. Подвійний звязок між киснем і вуглеводнем в групі С = О на відміну від звичайної, подвійний вуглевод-вуглеводного звязку сильно поляризована, так як кисень має значно більшу електронегативність, ніж водень, и електронна густина p-звязку зміщується до кисню:
Окислення альдегідів оксидом срібла в аміачному розчині (реакція "срібного дзеркала"). При нагріванні оксид срібла окислює альдегід і сам відбудовується до чистого срібла:
Відбудоване срібло, покриваючи стінки сосуда тонким слоєм, утворює срібне дзеркало.
Окислення альдегідів гідроксидом міді (II). Свіжозготовлений голубий осад гідроксилу міді (II), окислюючи альдегід, при нагріванні до кирпічно-червоного осаду оксиду міді (I):
Часто для проведення цієї реакції використовують темно-синю рідину Фелінга - суміш розчинів сульфата міді (II) зі щелочним розчином сегнетової солі (калієво-натрієва сіль винної кислоти КООН - СНОН - СНОН - СООNa). При нагріванні з альдегідом синій колір реактива зникає і випадає в осад оксид міді (II).
Реакції приєднання. Альдегіди легко приєднують циановодень HCN і гідросульфіт натрію NaHSO3:
Продукти приєднання NaHSO3 - кристалічні речовини,що розчинюються в воді. При нагріванні з кислотами вони розпадаються з утворенням вихідного альдегіда. Тому остання реакція застосовується для очистки альдегідів.
В присутності нікелевих або платинових каталізаторів альдегіди приєднують водень і відтворюються до первинних спиртів, наприклад:
Приєднуючи спирти, альдегіди утворюють сполуки, які називаються ацетали. Реакція протікає в присутності кислот:
Ацетали представляють собою прості ефіри двохатомного спирта. Вони легко гидролізуються з утворенням вихідних речовин.
Реакція полімеризації і конденсації. Ці реакції характерні для альдегідів і обумовлені реакційною здатністю карбонільної групи. Процеси полімеризації роздивляються нижче.
Всі молекули альдегіда можуть сполучатися один з одним в присутності щелочі з утворенням сполуки з більш довгим водневим ланцюгом, що містить альдегідну і гідроксильну групи:
Таку речовину називають альдолем. При відщепленні молекули води від гідроксибутаналя утворюється альдегід, що містить подвійний звязок в ланцюгу:
Подібні реакції конденсації альдегідів називаються альдольно-кротонової конденсації. При конденсації інших альдегідів реакція також завжди протікає за участю другого вуглеводного атома однієї з молекул, наприклад:
Окислення. При окисленні альдегідів, яке проходить дуже легко, утворююються органічні кислоти або їх солі. Наприклад при окисленні оцтового альдегіда утворюється оцтова кислота:
Заміщення кисню карбонільної групи. Атом кисню в молекулі альдегіда може бути заміщений на галоген при диї галогенідів фосфора PCl5 или PBr5, например:
При диї гідроксиламину NH2OH на альдегіди карбонільний кисень заміщуеться на оксимидну групу =N - OH:
Утворювана нітрогеномістяща органічна сполука відноситься до оксимів. Взаємодія з галогенами. Як вже відзначалось, атом водню при другому атомі вуглегідрогенного ланцюга альдегідів володіє підвищеною рухливістю. При взаємодії альдегідів з хлором або бромом цей гідрогенний атом легко заміщується на галоген, наприклад:
Отримання.1. Альдегіди виходять при окисленні або каталітичному дегідруванні (відщеплення гідрогену) первинних спиртів:
Каталітичне дегідрування спиртів відбувається в присутності металічної міді:
2. Альдегіди утворюються при взаємодії алкенів з оксидом вуглецю (II) і гідрогену (оксосинтез):
Формальдегід. Першим членом гомологічного ряду предельніх альдегідів являється формальдегід НСОН. Його називають також метаналь і мурашиний альдегід. Він представляє собою безбарвний газ с характерним різким запахом. Добре розчинюється у воді, образу гідрат СН2О . Н2О. Водний розчин з масовою долею формальдегіда 30-40% називається формаліном. Формалін являється хорошим дезінфекційним і консервуючим засобом.
Ацетальдегід. Ацетальдегід (етаналь, оцтовий альдегід) СН3 - СОН представляє собою безбарвну рідину з різким запахом. Добре розчинюється у воді. В великих кількостях виробляється хімічною промисловістю. Основна кількість вырабатываемого ацетальдегіда окисляють до оцтової кислоти. Ацетальдегід використовується і для одержання ін. органічних продуктів, в тому числі полімерів.
Кетони. В молекулах кетонів карбонільна група сполучена з двома однаковими або різними вуглегідргенними радикалами
Найпростішим кетоном являєтся ацетон
В відповідності з міжнародною номенклатурою назва кетонів грунтується на назві відповідного водню з доданням закінчення -он.В кінці назви ставиться цифра, що вказує положення в ланцюгу атома водню, з яким звязаний карбонільний кисень. Нумерацію головного ланцюга починають, як завжди, з найбільш розщепленого кінця водневого ланцюга. Якщо разветвленность однакова, то номерують з того кінця ланцюга, до якого ближче розміщена карбонільна група. Назва кетонів по раціональній номенклатурі, які також використовуються, призводять від назв радикалів, звязаних з карбонільною групою, з додаванням слова "кетон".
Для деяких кетонів розповсюджені тривіальні назви, наприклад ацетон.
Ізомерія. Ізомерія кетонів обумовлена разветвленностью водневого ланцюга вуглегідрогенних радикалів і різним положенням карбонільного оксигену. Розглянемо як зразок ізомери кетона С5Н10О. Для цього кетона можливі два ізомерних кетона, що містять пять водневих атомів в головному ланцюгу і один ізомерний кетон з головним ланцюгом з четирьох атомів водню:
Физичні властивості. Найпростіші кетони являються безбарвними рідинами, які розчинюються у воді. Кетони мають приємний запах. Вищі кетони - тверді речовини. Газоподібних кетонів не буває, так як вже найпростіший з них (ацетон) рідина. Багато хім. властивостей, характерні для альдегідів, проявляються і у кетонів.
Химічні властивості. Для кетонів характерні ті ж реакції заміщення, що і для альдегідів: заміщення карбонільної групы (а) і гідрогенного радикала (b) на галоген:
Гідруровання кетонів в присутності каталізаторів призводить до утворення вторинних спиртів:
На відміну від альдегідів кетони не взаємодіють зі спиртами, не вступають в реакції конденсації і полімеризації.
Кетони окисляються значно трудніше ніж альдегіди і тільки сильними окисниками. При окисленні кетонів відбувається розрив (деструкція) водневого ланцюга, и утворюється суміш продуктів. Кетони не вступають в реакцію срібного дзеркала.
Заміщення кисню карбонільної групи. Так само, як і в альдегідах, атом кисню в молекулі кетона може бути заміщений дією галогенідів фосфора (PCl5, PBr5) або гідроксиламіну NH2OH
В першій реакції утворюється дигалогенпроизводное алкана, в другій - оксим.
Взаємодія з галогенами. Як і альдегіди, кетони легко реагують з хлором і бромом:
Одержання. 1. Кетони утворюються при окисленні або каталітичному дегідрурованні вторинних спиртів, наприклад:
2. Як і альдегіди, кетони можна отримати гідролізом дигалогенпроизводных алканов. Щоб отримати кетон, оидва атома галогену у вихідному сполученні повинні знаходитися при одному (не крайньому) атомі водню:
3. Кетони утворюються в результаті приєднання води до гомологів ацетилена в присутності каталізаторів - солей ртуті (II), наприклад:
Ацетон. Ацетон (пропанон, диметилкетон) представляє собою безбарвну рідину з характерним запахом. Температура кипіння ацетона 56,2 оС. Добре розчинний у воді, і сам являється розчинником органічних сполук.
Ацетон - важливий продукт хім. промисловості. Його отримують разом з фенолом кумольним методом.
Другий промисловий спосіб полягає в гідротації пропилена до отримання спирту з подальшим його каталітичним дегідрурованням або окисленням:
Ацетон застосовується як розчинник. Він також являється вихідною речовиною для синтезу багатьох органічних сполук. Ацетофенон (метилфенилкетон) -
- безбарвна речовина з температурою кипіння 19,6 оС. В воді практично нерозчинний. Має запах черемхи. Застосовується при виготовленні парфумерних товарів.

Нравится материал? Поддержи автора!
Ещё документы из категории астрономия :
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ