Ферменты дереворазрушающих грибов


 ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«МОРДОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИМ. Н.П. ОГАРЁВА»
Факультет биологический
Кафедра биотехнологии
КУРСОВАЯ РАБОТА
ФЕРМЕНТЫ ДЕРЕВОРАЗРУШАЮЩИХ ГРИБОВ
Автор курсовой работы: К.С. Мешкова
Специальность 240901 биотехнология
Руководитель работы:
канд. биол. наук, доц. Н.А. Атыкян
Саранск 2010
Реферат
Курсовая работа содержит 35 листов, 4 рисунка, 32 использованных источника.
ДЕРЕВОРАЗРУШАЮЩИЕ ГРИБЫ, КСИЛОТРОФЫ, БАЗИДИОМИЦЕТЫ, ЛИГНИН, ЛИГНИНПЕРОКСИДАЗА, ЛАККАЗА, Mn-ПЕРОКСИДАЗА, ЦЕЛЛЮЛАЗЫ, ЦЕЛЛОБИОЗОДЕГИДРОГИНАЗА, ЭКЗОЦУЛЛЮЛОЗА, ЭНДОЦЕЛЛЮЛОЗА, ЦЕЛЛОБИОЗА.
Цель работы – изучение литературных источников по ферментам дереворазрушающих грибов.
В результате проведенной работы были рассмотрены основные представители ксилотрофных базидиальных грибов, их лигнолитический и целлюлолитический ферментативные комплексы, и их применение в промышленности.
Содержание
Введение
1. Характеристика дереворазрушающих грибов
1.1 Грибы, участвующие в разрушении древесины
1.2 Базидиомицеты – основные представители дереворазрушающих грибов
2. Лигнолитический ферментативный комплекс дереворазрушающих грибов
3. Целлюлитический ферментативный комплекс дереворазрушающих грибов
4. Практическое применение дереворазрушающих грибов и их ферментов в биотехнологии
Заключение
Список использованных источников
Введение
Структурный каркас почти всех наземных растений состоит из полимеров: лигнина, гемицеллюлозы, целлюлозы. Объединяясь в различных пропорциях, они образуют лигноцеллюлозный материал. На его долю приходится основная часть биомассы, остающейся в огромных количестве в виде отходов сельского хозяйства, деревообрабатывающей промышленности и других отраслей хозяйственной деятельности человека (древесина, солома, рисовая шелуха, использованная бумага, картон и т.д.). Эти отходы необходимо перерабатывать или использовать в качестве промышленного сырья [1].
Грибы всегда вызывали интерес человека загадочностью своей природы. Их плодовые тела несущие миллиарды спор, появляются на почве, на деревьях, на травянистых растениях, включая культуры [2]. Они относятся к третьему царству природы Fungi или Mucota. Их относят к главным мусорщикам – утилизаторам мертвого органического вещества [3].
Превращение древесины в природе сводится в конечном итоге к ее полному разложению и гумификации. Основную роль в нём безусловно играют различные грибы-ксилотрофы. На их долю приходится более 90% разлагаемой древесины. Несмотря на то, что бактерии обладают широким набором целлюлаз, гемицеллюлаз и пектиназ, они в очень ограниченной степени разлагают лигнин [4].
Благодаря мощной внеклеточной ферментативной системе грибов-ксилотрофов позволяют им утилизировать труднодеградируемые полимеры клеточных стенок древесины вплоть до полного разложения. Это стимулирует интерес к их интенсивным исследованиям [5]. Традиционно ксилотрофы рассматриваются как источники разнообразных ферментов для трансформации древесины. В настоящее время перспективно использовать как транспортные средства, способные доставить ферменты в нужные компартменты древесной клетки. Это может использовать для направленной трансформации древесины, получения смешанных композитов высокой прочности. В качестве потенциальных связующих в древесных композитах, за счет образуемых ими красителей хиноидной структуры, склонные к дальнейшей конденсации [3].
Выращивание ксилотрофов на лигноцеллюлозных отходах можно получать не только дополнительный источник белка, но и ценные компоненты для медицины, получаемые из плодовых тел, мицелия (полисахариды, стерины). При этом решается проблема загрязнения окружающей среды.
В связи с этим были рассмотрены основные представители ксилотрофных базидиальных грибов, их лигнолитический и целлюлолитический ферментативные комплексы, и их применение в промышленности.
1. Характеристика дереворазрушающих грибов
1.1 Грибы, участвующие в разрушении древесины
На древесину в процессе эксплуатации воздействует целый ряд факторов окружающей среды, приводя к ее старению и разрушению. Среди них: климатические (УФ – излучение, влажность, ветровые нагрузки, кислород воздуха) и биологические (грибные поражения, поражения насекомыми, бактериями, водорослями). Процесс деструкции заложен самой природой для поддержания экологического равновесия, поэтому в естественных условиях древесина, с течением времени, разрушается до углекислого газа и воды – самых простых химических соединений [6]. Грибы приспособлены к существованию в порах плотного субстрата, бедного питательными веществами, но содержащие трудноусваиваемые источники углерода – лигнин и кристаллическая целлюлоза [4].
Грибы, развивающиеся на древесине (ксилофилы, ксилотрофы), практически все принадлежат к трем классам высших грибов, имеющие разделенные на клетки (септированные) гифы. Это аскомицеты (Ascomycetes, сумчатые грибы), дейтеромицеты или несовершенные грибы (Deuteromycetes, Fungi imperfecti), и базидиомицеты (Basidiomycetes) – наиболее сильные разрушители [2].
На первой стадии при поражении, на древесине появляются грибы, питающиеся соками живого дерева. Такие как плесневые грибы Penicillium, Aspergillus, живущие на поверхности древесины. Затем в подготовленных плесневыми грибами оптимальных условиях начинают размножаться деревоокрашивающие грибы. Завершают процесс разложения древесины дереворазрушающие грибы. Они вызывают сильное гниение древесины, приводящее к появлению продольных и поперечных трещин, а затем и минерализации древесины [7].
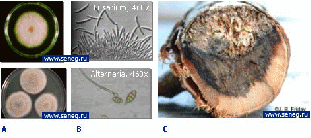
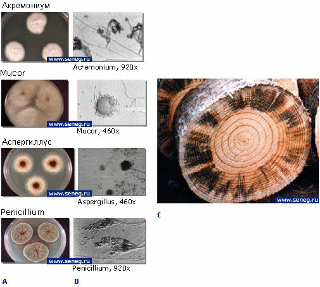
У плесневых грибов поверхностная часть грибницы развивается на поверхности древесины и образует на ней налет в виде скопления окрашенных спор, мицелия и органов спороношения, как показано на рисунке 1.1. На древесине обычно встречается плесень зеленоватая и белая, но иногда розовая, желтая или темная. Плесневые грибы развиваются в температурном диапазоне 24°С − 30°С. Они являются возбудителями окислительного брожения. В качестве промежуточных продуктов этого биохимического процесса образуются органические кислоты, такие как глюконовая, фумаровая, винная, яблочная, щавелевая, янтарная и лимонная. Эти кислоты разъедают органические материалы, т.е. древесину. Основные виды плесневых грибов: Sporotrichum, Trichoderma, Penicillium, Mucor, Thamnidiu, Cladosporium.
Рисунок 1.1 − Плесневые грибы:
Вид колонии на чашке; B) Под микроскопом; C) На древесине
Деревоокрашивающие грибы вызывают специфическую синевато-серую окраску заболони, называемую «синевой», в соответствии с рисунком 1.2.
Рисунок 1.2 − Деревоокрашивающие грибы
А) Колонии; B) Под микроскопом; C) На древесине
Макроскопические признаки поражения древесины этими грибами в виде окраски обычно проявляются уже на 2-3 сутки после инфицирования. Это обусловлено тем, что молодой мицелий бесцветен и начинает выделять типичный пигмент не сразу. На поверхности древесины может развиваться воздушный мицелий и органы спороношения в виде пушистого или порошкообразного окрашенного налета [6].
В зависимости от характера заражения и распространения в древесине гиф грибов различают поверхностную и глубокую синеву. Ограниченное распространение грибов в глубь древесины связано с задержкой их роста в результате подсыхания древесины. Глубокие окрасы проникают в древесину более чем на 2 мм. Среди них различают сплошные, охватывающие всю заболонь (глубокая синева) и пятнистые, поражающие отдельные участки заболони. Глубина залегания окраски при подслойной синеве зависит от вида гриба, размера свойственной ему зоны бесцветного молодого мицелия (зоны скрытой синевы), ширина которой колеблется от 5 до 12 мм. Грибы-возбудители синевы, попавшие из воздуха на поверхность свежеспиленной древесины в виде спор, не дают сразу окраски в течение двух и более недель (период бесцветной, скрытой синевы). Окрашивание появляется на третий-четвертый день. Деревоокрашивающие грибы оптимально развиваются в диапазоне влажности 50-90%. В древесине, насыщенной водой, деревоокрашивающие грибы не способны развиваться из-за отсутствия кислорода. Для прорастания грибов этой группы необходима высокая влажность и аэрация [4].
Основными возбудителями синевы на хвойных породах являются грибы из класса Ascomycetes: Ophistoma coerulea, O. piceae, O. pini, Endoconidiophora sp. и из класса Deuteromycetes: Hormonema dematiodes, Trichosporium tingens, Claosporium herbarum, а также грибы следующих групп: Stemphulium, Cladosporium, Alternaria, Sporodesmium, Phialophora, Aposhaeria, Discula, Burgoa, Leptographium, Sortaria, Verticillium, Fusarium, Aspergillius, Penicillium, Paecilomyces, Trichoderma, Chaetomium, Trichosporium, Pullularia [9]. Эти грибы вызывают разрушения древесины по типу «умеренной гнили», вызывая разрушения анатомически различного характера, в разной степени снижают механические свойства древесины. Глубина поражения этими грибами составляет 0,5-3 мм. Особые деструктирующие гифы, в соответствии с рисунком 1.3, способны поражать стенки паренхимных клеток сердцевинных лучей и смоляных ходов, что приводит к увеличению скорости водо- и влагопоглощения древесины [6].
Рисунок 1.3 − Плесневые и деревоокрашивающие грибы под
электронным микроскопом
Деревоокрашивающие грибы в различной степени способны изменять свойства древесины. При дальнейшем развитии грибов многие из них способны разрушать стенки сердцевидных лучей и вторичных слоёв клеточных стенок по типу, близкому к умеренной гнили [9]. Деревоокрашивающие грибы -это только начало процесса. Они способствует дальнейшему разрушению древесины дереворазрушающими грибами [6].
Некоторые классы грибов могут разрушать клеточные стенки древесины и существенно изменять ее физико-механические свойства. Такой процесс называется гниением древесины, а вызывающие его грибы – дереворазрушающими, пример на рисунке 1.4. Гниение является основной причиной разрушения древесины [10].
Рисунок 1.4 − Дереворазрушающие грибы на древесине
А) Вид поврежденной древесины; Б) Колонии Serpula lacrimans
Возбудители деструктивных гнилей, разлагающих целлюлозу, проникают в клетки древесины из сердцевинных лучей отдельными разветвленными гифами, а лигнинразрущающие грибы – пучком гиф, который затем обильно разветвляется. Затем такой гриб заполняет полость клетки густым переплетение гиф, причем мицелий иногда собирается в клубки, как у Serpula frustulosum [3]. Существует множество дереворазрушающих грибов. Они различаются между собой по форме, строению и окраске грибницы, шнуров, плодовых тел и спор, а также по скорости и силе разрушения древесины [3].
1.2 Базидиомицеты – основные представители дереворазрушающих
грибов
Наиболее сильными разрушителями являются грибы, относящиеся к классу базидиомицетов. Ксилотрофные базидиомицеты – это грибы, образующие крупные плодовые тела (карпофоры), спорообразующий слой которых называют гименофором [1]. Среди них выделяют ксилопаразитов, развивающиеся на живой древесине и кустарниках. Например губки Heterobasidionannosum, паразитирующая на соснах и елях, ложный трутовик Phellinus igniarius, паразитирующий на лиственных породах особенно часто на осинах и ивах. Большая часть этой группы относится к ксилосапротрофам, развивающиеся на мертвой древесине. Например трутовик настоящий Fomes fomentarius, опёнок осенний Armillariella mellea [2].
На поверхности древесины они помимо воздушного мицелия образуют и другие вегетативные мицелиальные структуры. Основная форма размножения – базидиоспоры. Они формируются в результате полового процесс в спорогенных клетках – базидиях, располагающихся в плодовых телах – базидиомах. Базидиома является специализированным талломным образованием из функционально дифференцированных тканей мицелия [3].
Дереворазрушающие грибы способны увлажнять древесину в процессе освоения за счет воды, образующейся при разложении целлюлозы. Возбудители биоповреждений древесины, относятся в основном к следующим группам грибов: Coniophora, Tyromyces, Zentinus, Serpula, Gloeophyllum, Trametes, Pleurotus, Schizophyllum [9].
Характер гниения зависит от того, какими ферментами гриб воздействует на древесину, какие компоненты клеточных оболочек и в какой последовательности он разрушает. В начале деятельности дереворазрушающих грибов внешний вид древесины не изменяется, и присутствие грибных нитей в ней можно обнаружить только под микроскопом, в тонком срезе. В дальнейшем древесина изменяет свой естественный цвет, становится желтой или красноватой, а затем бурой и коричневой. Плотность и прочность древесины постепенно снижаются, она становится лёгкой, мягкой, теряет вязкость. Гниль такого типа называют деструктивной [4].
Некоторые грибы, поражающие растущие деревья, вызывают гниль другого типа – коррозионную, при которой вначале появляются небольшие светлые пятна и ямки, а затем древесина расщепляется на отдельные волокна. Эта группа грибов использует в первую очередь лигнин древесины, оставляя нетронутой целлюлозу, белые пятна и выцветы которой видны на поверхности среза. К коррозионной гнили также относятся сердцевинные гнили: пестрая, ямчатая, ситовая [6].
При развитии умеренной гнили поверхностные слои древесины теряют свою структуру и превращаются в мягкую темную грязеподобную массу. После подсушивания древесины в пораженном слое наблюдается сильное усыхание и появление мелких продольных и поперечных трещин. Все без исключения дереворазрушающие грибы вырабатывают фермент целлюлазу, расщепляющую целлюлозу [11]. В зависимости то состава ферментного комплекса условно подразделяют их на следующие: Белая гниль разрушает все структурные компоненты древесины, приводя к появлению характерного волокнообразного и бледного внешнего вида. Бурая гниль «раскалывает» целлюлозу, что вызывает расщепление древесины. Участок дерева, пораженный такой гнилью, становится коричневым. Дерево темнеет, трескается и рассыпается. Их представлено значительно меньшим числом видов, чем грибы белой гнили. Они преобладают в хвойных лесах и гораздо быстрее разрушают древесину [6].
Мягкая гниль. Гниение здесь в основном затрагивает древесину, контактирующую с почвой и находящуюся в морской среде. Сильнее всего поражается древесина с высоким содержанием влаги [6].
Возбудители белой гнили представлены базидиомицетами (афиллофоровым и пластинчатым), сохраняют форму и волокнистое строение древесины, но вызывают ее осветление вплоть до светло-желтого или белой окраски. Деградация сопровождается уменьшением прочности и увеличением набухания. К ним относят, например, сосновая губка. Большинство из них предпочитает лиственную древесину [3].
Возбудители бурой гнили относятся к базидиомицетам. Древесина под их действием буреет – накапливаются ароматические хромофоры в видимой области спектра (хиноны, хинонметиды, карбоксильные группы, устойчивые феноксильные радикалы, переходит в видимую область спектра поглощение лейкохромофорных групп). Одновременно она становится хрупкой. Деструкция сопровождается продольным сморщиванием и деформацией клеточных стенок. Типичными возбудителями являются большинство домовых грибов, трутовики Швейница, серножелтый и окаймленный, лиственничная губка [9].
Возбудители мягкой гомогенной гнили разлагают в клеточной стенке древесины преимущественно вторичный слой с образованием темноокрашенных гумусовых веществ (шоколадного цвета), постепенно разрушая ее внутреннюю структуру, из-за чего влажная древесина приобретает консистенцию густой пасты легко царапаемой ногтем. Мягкую гниль вызывают некоторые аскомицеты несовершенные грибы. Они разрушают хвойную и лиственную древесину [3].
Грибы белой гнили известны также как активные деструкторы широкого ряда поллютантов, включая полихлорированные фенолы, нитро- и аминозамещенные фенолы, диоксины [12]. Это единственные эукариоты способные разлагать полициклические ароматические углеводороды (ПАУ). Например, они могут метаболизировать фенантрен, нафталин, антрацен, флюорантен, флюорен, пирен, бензaпирен, бензaантрацен, хризен, карбазол и многие другие [13]. В отличие от бактерий, они могут метаболизировать ПАУ с 4 и более конденсированными кольцами. В настоящее время неизвестно ПАУ полностью устойчивых к деградации грибами белой гнили [8].
Эти грибы не используют ПАУ, также как и лигнин, в качестве единственного источника углерода и энергии, но способны кометаболизировать их. Полная минерализация ПАУ грибами белой гнили ограничена и составляет, по данным разных авторов, от 0,17% до 10%, большая часть этих веществ метаболизируется в гидрофильные гидроксилированные продукты, например дигидродиолы, хиноны и 2,2'-дифеновую кислоту – продукт расщепления ароматического кольца. Процесс деградации ПАУ, также как и процесс деградации лигнина является окислительным и протекает наиболее интенсивно при рН 4,0-5,0 [13].
Современные исследования деградации ПАУ грибами белой гнили направлены на детальное изучение метаболических путей и вовлеченных в них ферментных систем. Деградативную активность этих грибов в основном связывают с их внеклеточной лигнинолитической ферментной системой [11].
Для прикрепления к твердому субстрату и сохранения внеклеточных ферментов вблизи поверхности гифов грибы используют особые структуры – гифальные чехлы, построенные из слизистых полисахаридов предположительно β-1,3-β-1,6-глюканов [4].
2. Лигнолитический ферментный комплекс дереворазрушающих
грибов
Способность грибов разрушать лигниновый компонент древесины известна давно. Наиболее активными деструкторами лигнина в природе являются грибы белой гнили, которые образуют гетерогенную группу, состоящую большей частью из базидиомицетов, относящихся к семействам Agaricaceae, Corticaceae, Pleurotaceae, Strophariaceae и нескольких аскомицетов [6]. Так как в качестве лигнинолитиков изучены преимущественно базидиомицеты, то в узком смысле под грибами белой гнили обычно понимают лигнинолитические базидиомицеты. Наиболее подробно изучены Phanerochaete chrysosporium, Coriolus versicolor и Pleurotus ostreatus. [4]
Хотя лигнин является потенциально богатым энергией материалом, он не может служить единственным источником углерода и энергии, его деградация возможна при наличии в среде ростового субстрата, такого как целлюлоза или глюкоза. Деградация лигнина является событием вторичного метаболизма и происходит когда в среде культивирования исчерпываются источники углерода, азота или серы. [14] Разложение лигнина – процесс окислительный, стимулирующее действие кислорода на биодеградацию лигнинового полимера характерно для всех грибов белой гнили. Лигнинолитический процесс у этих грибов подвержен влиянию рН, максимум лигнинолитической активности приходится на рН 4,5 [13].
Структура высокомолекулярной полимерной гидрофобной молекулы лигнина определяет свойства расщепляющей его ферментативной системы. Такая система должна быть внеклеточной негидролитической и неспецифической. Лигнинолитическая система грибов белой гнили является внеклеточной окислительной и неспецифической, и включает лигнин пероксидазу, Mn-пероксидазу и лакказу [4].
Лигнин – глобулярный нестереорегулярный нерастворимый полимер. Его молекулярная масса более 10 000. Состоит из остатков фенилпропана, соединенных несколькими типами углерод – углеродных и эфирных связей. Молекулы этого ароматического вещества при образовании лигнина соединяются друг с другом случайным образом с помощью разных химических связей не подающиеся химическому расщеплению. У растений лигнин образует комплекс с гемицеллюлозой, в которой заключены проводящие пучки. Лигнин обусловливает ригидность растений, а также их устойчивость к механическим повреждениям и действию микробов [1].
С развитием биотехнологии базидиомицеты становятся доступным источником ферментов различных классов. Способность базидиомицетов синтезировать внеклеточные ферменты, характеризующиеся высокой активностью и стабильностью, дает возможность использовать их ферментные комплексы для практических целей [14].
В настоящее время во всем мире ведется интенсивная разработка технологий на основе базидиальных лигнинолитических грибов и их ферментов как для обработки лигниноцеллюлозных материалов, так и для утилизации лигнинсодержащих отходов, накапливающихся в природе в огромных количествах [15].
Дереворазрушающие базидиомицеты отличаются высоким содержанием окислительно-восстановительных ферментов, в первую очередь пероксидазы, Мп-пероксидазы, тирозиназы и лакказы [8]. Высшие базидиомицеты по составу лигнолитических ферментов объединяют в следующие группы:
В первую группу вошли грибы, обладающие лакказой, лигнин- и марганецпераксидазой активностью Phellinus ріпі, Trametes hirsuta, Bjerkandera adusta, Phanerochaete chrysosporium.
Вторая группа представлена грибами Lentinus edodes, Panus tigrinus, P. chrysosporium, Dichomitus squalens, обладающих Mn-пероксидазной и лакказной активностью.
Третья группа характеризуется лигнинпероксидазной и лакказной активностью – грибы Trametes versicolor, Phlebia radiate, Pleurotus ostreatus.
Грибы, составляющие четвертую группу определены как Pleurotus ostreatus, P. eringii, В. adusta и для них характерна лакказа, арилалкогольоксидаза и другие ароматические оксидазы [12].
Разнообразное сочетание ферментативных комплексов у лигнинразрушающих грибов связано в первую очередь с экологическими особенностями грибов, трофической специализацией и является следствием длительной эволюции растений и грибов [7]. Представители различных таксономических и экологических групп обладают сходным составом ферментов. Однако уровень активности внеклеточных ферментов имеет существенную штаммовую и видовую вариабельность [10].
Внеклеточные лигнинолитические ферментные комплексы грибов белой гнили включают следующие типы окислительно-восстановительных ферментов: I. гем-содержащие ферменты, П. флавинсодержащие ферменты, III. целлобиозодегидрогеназа, IV. медьсодержащие ферменты [4].
Помимо лигнинразрушающих ферментов эти грибы образуют также системы гидролаз, гемицеллюлозы и целлюлозу [9].
I. Гемсодержащие ферменты, среди которых принято особо выделять лигнинпероксидазы (LiP) и марганец-пероксидазы (МnР). Основная функция этих ферментов – прямое, как у LiP или опосредованное медиатором (вератролом у LiP и ионами Мn у МnР) одноэлектронное окисление ароматических субстратов до соответствующих радикалов и двухэлектронное восстановление перекиси водорода до воды [4].
Лигнинпероксидаза (диарилпропаноксигеназа, Н202-зависимая оксигеназа, лигниназа, КФ 1.11.1.14) – гемсодержащий фермент с молекулярной массой 39-42 кДа, являющийся донором Н202. Катализирует различные реакции одноэлектронного окисления ароматических соединений (предпочтительно нефенольных) за счет кислорода перекиси водорода, с восстановлением ее до воды. К ним относят:
Сα−Сβ – разрыв пропильной группы лигнина и модельных соединений.
Гидроксилирование бензильных метиленовых групп.
Окисление бензиловых спиртов до соответствующих альдегидов и кетонов.
Окисление фенолов и расщепление ароматического кольца в нефенольных модельных соединениях лигнина [16, 17].
Полученный арильный катион-радикал спонтанно разрушает различные связи в зависимости от структуры и наличия реактанов. Лигнинпероксидаза способна окислять и фенольные соединения. При этом образуются в результате окисления ферментов нефенольных соединений. Выделено около 15 изоформ данного фермента [16]. Лигнинпероксидаза обнаружена лишь у немногих базидиальных грибов: Phanerochaete chrysosporium, Trametes versicolor, Trametes hirsuta, Panus tigrinus, Coriolopsis occidentalis [13].
Мn-зависимая пероксидаза – гемсодержащий фермент (КФ 1.11.1.3), участвующий в деполяризации синтетического лигнина [16]. Она окисляет фенольные соединения в присутствии перекиси водорода. Проявляет активность в среде, содержащей Мn, имеет молекулярную массу 46 кДа [8]. Впервые выделена из культуральной жидкости гриба Ph. chrysosporium. Принцип функционирования фермента заключается в окисление Мn2+ до Мn3+ с использованием пероксида водорода в качестве окислителя. Активность фермента стимулируется простыми органическими кислотами, которые стабилизируют ион Мn3+. В результате взаимодействия последнего с кислотами образуется хелат, обладающий окислительными свойствами [16]. Регенерация Мn осуществляется сопряженной реакцией разложения перекиси водорода. При отсутствии в среде Н202 Мn-зависимая пероксидаза способна продуцировать пероксид водорода. Мn-зависимая пероксидаза отмечена у таких грибов как Trametes versicolor, Phlebia radiate, Dischomitus squalens и др. [13].
П. Флавинсодержащие ферменты, осуществляющие, в основном двухэлектронное восстановление молекулы кислорода до перекиси водорода и одновременно двухэлектронное окисление ОН-группы, соответствующих субстратов, до карбонильных групп. Среди них – глюкозооксидазы, пиранозо-2-оксидазы, метанол-оксидазы, арилалкогольоксидазы [13].
Глюкозооксидаза – флавинсодержащая оксидаза с молекулярной массой 80 кДа, катализирующая окисление глюкозы, восстанавливая при этом кислород до перекиси водорода. Глюкозооксидаза выявлена у грибов Panus tigrinus, P. Chrysosporium [8].
Пираноза-2-оксидаза ароматических спиртов, катализирует окисление низших первичных и ароматических спиртов до соответствующих альдегидов и пероксида водорода [13].
Арилалкогольоксидаза (вератрил-алкоголь оксидаза), внеклеточная флавин-оксидаза с молекулярной массой 72,5-78 кДа, катализирует окисление ароматических спиртов до альдегидов, восстанавливая кислород до перекиси водорода. Арилалкогольоксидаза отмечена у грибов, вызывающих белую гниль древесины: Phanerochaete chrysosporium, Trametes versicolor [13].
Метанолоксидаза (МеО), внеклеточный флавин-содержащий фермент с молекулярной массой 75 кДа, катализирует окисление метанола, выделяющийся при деградации лигнина в реакциях деметилирования фенолов, до формальдегида, восстанавливая кислород до перекиси водорода. Выделена и охарактеризована у Phanerochaete chrysosporium, Trametes versicolor, Panus tigrinus [13].
III. Медьсодержащие ферменты. Разделяют на две группы.
III.1 Голубые оксидазы – лакказа и родственные или им неголубые оксидаза, осуществляющие четырехэлектронное восстановление кислорода до воды с параллельным одно- или двухэлектронным окислением преимущественно фенольным субстратом до соответсвующих феноксирадикалов или хинонов. [8]
Катехолоксидаза участвует в гидроксилировании монофенолов до дифенолов и окислении дифенолов в ортохиноны. Она широко распространена среди микроорганизмов и имеет названия, соответствующие катализируемому субстрату: монофенолоксидаза, полифенолоксидаза, фенолаза, крезолаза, тирозиназа и т. п. [13].
Лакказы (бензидол: кислород оксидоредуктаза, КФ 1.10.3.2) – голубая медьсодержащая оксидаза, которая катализирует четырехэлектронное окисление фенолов, ароматических аминов и фенилендиамина, используя кислород как акцептор электронов с восстановлением его до воды. Практически все исследованные лакказы – это мономеры, гликопротеины с углеводной частью от 1 до 15% массы фермента, которая состоит из остатков маннозы и N-ацетилглюкозамина [16]. Окисляют широкий круг субстратов преимущественно фенольной природы с образованием феноксильных радикалов, а также нефенольные соединения в присутствии специфических электронных переносчиков ABTS или HBT (1-гидроксибензотриазол) [16]. Лакказы древоразрушающих грибов имеют более низким Ph-оптимумом окисления фенольных субстратов, совпадающим с оптимум действия большинства грибных целлюлаз. Так, для лакказ Gaeumannomyces graminis var. tritici, древоразрушающего базидиомицета PM1, Coriolus histris он близок к 4,5Ph, для лакказ других трутовиков (C. zonatus, Tramenas sanguinea, Polyporus pinsitus) составляет 4,9 Ph -5Ph [4].
III.2 Медьсодержащие ферменты, осуществляющие двухэлектронное восстановление кислорода до перекиси с одновременным двухэлектроным окислением подходящей спиртовой или альдегидной группы (глиоксальоксидаза, галактооксидаза) [8].
Наибольшей оксидазной активность обладают штамма Trametes hirsute D-5 и Gerrena unicolor М-2 [18].
Лигнин под действием бурых гнилей преимущественно гидроксилируется и деметилируется и в меньшей степени депомилиризуется. Окисление непосредственно идет до углекислоты с изъятием углерода в основном из боковых цепей и метоксильных групп [13].
Предположительно, лигнинразрущающие ферменты действуют на поверхности гиф, находящихся в контакте с клеточной стенкой. Вместе с тем, разложение наблюдается не только в местах контакта, но и по всей поверхности люмена, если там находятся всего одна-две гифы гриба, и даже в толще вторичной оболочки. Снижение выхода низкомолекулярных продуктов окисления лигнина (ароматических кислот и альдегидов) после обработки древесины лигнинразрушающими грибами объясняет их окислительным и конденсирующим действием. Однако разные грибы в разной степени окисляют и конденсируют остаточный лигнин [4].
Так было показано, что выявленная на поверхности мицелия внеклеточная лакказа штамма гриба Pleurotus ostreatus Dl могут участвовать в начальных этапах метаболизма полициклических ароматических углеводородов (в данной работе хризена). Тогда как гибридная Mn-пероксидаза окисляла образующиеся метаболиты (фталевая кислота) [12].
3. Целлюлитический комплекс дереворазрушающих грибов
Целлюлоза очень ценный материал из которого можно получать множество продуктов, например этанол. Она является наиболее простым компонентом лигноцеллюлозного материала и самым распространенным природным полимером. Его длинные цепи состоят из остатков D-глюкозы соединенных β-1,4 связями. Целлюлоза отличается по строению от крахмала. В целлюлозе полимерные цепи упакованы так, что образуют кристаллоподобную структуру, непроницаемую для воды. Поэтому она не растворяется в воде и устойчива к гидролизу [1].
Целлюлолитические ферменты, осуществляющие биодеградацию целлюлозы, самого распространенного биополимера на Земле, занимают центральное место в круговороте органического углерода [2]. Основными микроорганизмами, продуцирующими целлюлазы, являются грибы возбудители мягкой и бурой гнили, а также различные виды аэробных и анаэробных бактерий. История исследования целлюлаз насчитывает уже более 50 лет, В течение этого периода важнейшим свойством, характеризующим целлюлазный комплекс, считалась его способность к глубокой деструкции целлюлозосодержащих субстратов (так называемая «сахаролитическая» активность). Поэтому исследования, в основном, были направлены на поиск ферментных препаратов и их продуцентов, эффективно осуществляющих гидролиз целлюлозы до глюкозы [19]. Целлюлазы этих препаратов, как правило, проявляли максимальную активность в кислой среде (рН 4-5) [14], но различались по субстратной специфичности, адсорбционной способности и термостабильности. Целлюлазы находят все более широкое применение в текстильной, целлюлозно-бумажной, пищевой и других отраслях промышленности [6]. В последнее время усилия исследователей направлены на поиск целлюлолитических ферментов, способных мягко воздействовать на поверхность целлюлозного субстрата, не приводя к глубокой деструкции целлюлозной матрицы [4]. Обнаружение ферментов с такой (тополитическая активность) активностью открыло новые возможности их применения. Например, для депигментации джинсовых изделий с целью придания им более привлекательных потребительских свойств (альтернатива традиционным химическим способам «варки», а также обработке пемзой); для биополировки текстильных материалов с целью удаления микродефектов и ворса; как компонента моющих средств и т, д. В связи с этим наиболее перспективными для использования являются так называемые «нейтральные» целлюлазы, демонстрирующие высокую активность [20].
Разрушение материала клеточных стенок под действием ферментов грибов наблюдается по появлению зон растворения вокруг гиф. Зона растворения постепенно увеличивается и гифа проникает сквозь внутренний слой клеточной стенки [4].
Всего выделяют 3 основных типа целлюлаз, которые катализируют различные типы реакции:
а) Эндоцеллюлаза разрывает внутренние связи, для того чтобы нарушить кристаллическую структуру целлюлозы. В результате образуются отдельные полисахаридные цепи целлюлозы.
б) Экзоцеллюлаза отщепляет от концов 2 или 4 остатка, в результате образуются тетрасахара или дисахариды, состоящие из целлобиозы. Выделяют два основных типа экзоцеллюлаз (или целлобиозодегидрогеназ). Первый тип отщепляет от редуцирующего конца. Второй тип от нередуцирующего конца целлюлозы.
в) Целлобиоза или бета-глюкозидаза гидролизуют продукты экзоцеллюлаз до моносахаров.
Оксидативные целлюлазы деполимеризуют целлюлозу радикальными реакциями. В случаи акцептора может выступать целлобиоза [21].
Целлюлитический комплекс грибов включает две большие группы:
1. Гидролазы, осуществляющие расщепление структурных полисахаридов клеточной стенки древесины, в том числе большая группа гликозилгидролаз, эндо- и экзополигалактуроназа и целый ряд других гликаназ и глюкозидаз, отщепляющих боковые остатки в основной цепи гемицеллюлаз и пектиназ. В это группу также включают некоторые эстеразы, помогающие гликозилгидролазам в расщеплении основных цепей структурных полисахаридов клеточной стенки (пектин-метилэстераза, ферулоилэстераза, ацетилксиланэстераза). Под гликозилгидролазой понимают ряд ферментов, такие как эндо- и экзоцеллюлаза, гемицеллюлаза, эндо- и экзоксиланазы, эндо- и экзоманназы, β-глюконаза.
2. Оксидоредуктазы, действующие на углеводные компоненты древесины. К ним относят глюкозооксидаза, галактозооксидаза, целлобиозодегидрогеназа [8].
Эндоглюканаза гидролизует β-1,4 связи между соседними остатками глюкозы в плотно упакованных областях целлюлозы, образуя разрывы в середине цепи.
Экзоглюканаза расщепляет разорванные целлюлозные цепи с нередуцирующих концов с образованием глюкозы, целлобиозы или целлотриозы.
Целлобиогидролаза отщепляет фрагмент из 10 остатков и более числа остатков глюкозы с нередуцирующих концов молекулы целлюлозы.
Целлобиоза или β-глюконаза катализирует превращение целлобиозы и целлотриозы в глюкозу [1].
Особый интерес среди внеклеточных ферментов представляют целлобиозодегидрогеназы. Это оксидаза, специфичная к окислению восстанавливающих сахаров 1,4-β-гликозидной связью (целлобиоза и целлоолигосахариды, маннобиоза и манноолигосахариды, лактоза), но не действующая на моносахариды и их олигомеры с α-глюкозидной связью, найдена (наряду с эндоцеллюлазами) во всех основных группах ксилотрофов, вызывающие мягкие, деструктивные и коррозионные гнили [4].
Фермент окисляет восстанавливающее звено подходящего ди- или олигосахарида до лактона, одновременно восстанавливая двух или одноэлектронный акцептор. Акцепторами могут быть хиноны и феноксирадикалы, образуемые лакказами или неспецифическими пероксидазами, либо ионы трехвалентного железа или двухвалентной меди. Принципиально возможно и каталитическое восстановление кислорода до перекиси водорода, хотя он является плохим субстратом целлобиозодегидрогеназы [4].
Ферментные системы мягких гнилей полностью разлагают упорядоченную целлюлозу в отсутствии кислорода, чем принципиально отличаются от ферментов возбудителей белой гнили, скорость действия которых на целлюлозу заметно снижалось при удалении растворенного кислорода. Обнаружение внеклеточной целлобиозодегидрогеназы у представителей термофильного микромицета Myceliophthora thermophila предположили о возможности двух механизмов гидролазного и в присутствии ионов железа оксидазного, через свободнорадикальный процесс, запускаемый реактивом Фентона (Fe +2 +H2O2) в кислой среде [8].
Целлобиозодегидрогеназа имеет большое сродство к целлюлозе, может действовать на удаленном расстоянии, в глубине целлюлозных волокон, где образуется ее основной субстрат – целлобиоза [8].
4. Практическое применение дереворазрушающих грибов и их
ферментов в биотехнологии
гриб разрушение древесина фермент биотехнология
Люди давно и широко используют грибы как продукт питания. Грибы богаты белками: в их сухом веществе 20-30% приходится на долю чистого белка. В них содержатся жиры, минеральные вещества, микроэлементы. К последним относят железо, кальций, цинк, йод, калий, фосфор. В сыроежках например, содержится 3,2% фосфора (от общего веса золы), в свинушке толстой – 9,3, в свинушке тонкой – 3,9%. При этом шляпки содержат больше фосфора, чем ножки. В промышленных масштабах выращивают около 10 видов грибов, среди них такие как вешенка устричная и шиитаки. Грибы богаты витаминами и каратинойдамим, содержат немного жиров и углеводов. Некоторые виды используются как продуценты биологически активных веществ, антибиотиков, ферментов [15, 25].
Протеолитические ферменты базидиомицетов давно и успешно применяются в пищевой промышленности. Например, из культур Irpex lacteus, Fomitopsis pinicola и Russula decolorans выделены, детально изучены и используются в сыроделии протеиназы, заменяющие сычужный фермент. Также является перспективным использование протеиназы плодовых тел вешенки обыкновенной [22]. Сыроежка красная содержит фермент, способствующий свертыванию молока. Ленинградские ученые и вологодские специалисты создали ферментный препарат из сыроежки для изготовления высококачественных сортов сыра, назвав его руссулин – от ее латинского родового названия Руссула. Он заменяет сычужный фермент в производстве творога и сыров. Активность руссулина очень высока: полграмма за полчаса створаживает 100 л молока [2, 23].
Инженерное воплощение получили биопластики, для склеивания которых используют культуральную среду гриба. К настоящему времени в FPL разработана система обработки технологической щепы, построенная на основе использования двух ленточных конвейеров. Щепа, перемещаясь по первому конвейеру, подвергается паровой стерилизации. На втором конвейере она остужается очищенным воздухом и подвергается обработке специальной суспензией, содержащей культуру гриба и пищевые регуляторы. После этих процедур щепа поступает в бурты, где проходит двухнедельную ферментацию. По указанной схеме сотрудниками FPL был заложен крупномасштабный эксперимент с 50 т древесной щепы, итоги которого продемонстрировали высокую воспроизводимость результатов, полученных в лабораторных условиях. Таким образом, сотрудники FPL доказали возможность использования биопластинка в промышленных масштабах [10, 11].
Еще одно применение дереворазрушающие грибы получили в бумажно-целлюлозной промышленности. Концепция применения биологических препаратов на основе дереворазрушающих грибов для улучшения качества древесных полуфабрикатов эксплуатируется в коммерческих целях уже более десяти лет. Уникальный препарат Sylvanex 97 выпускается известной компанией Clariant на основе культуры гриба Ophiostoma piliferum. Этот гриб позволяет существенно снизить содержание смоляных веществ древесного сырья, увеличить выход продукции, улучшить ее физико-механические свойства, регулировать микрофлору хранящейся щепы, предотвращая появление в ней деревоокрашивающих грибов. В настоящее время права на технологию принадлежат изобретательнице технологии Р. Фаррелл (Parrac Ltd, Новая Зеландия). Постоянным покупателем препарата с 1996 года является фабрика Rayonier Fernandina Beach Pulp Mill, штат Флорида (США). Продукция, выпускаемая этой фабрикой, используется для производства жидкокристаллических панелей, фармацевтических препаратов, ударопрочных пластиков, сигаретных фильтров, косметики, детергентов, красок, взрывчатых веществ и продуктов питания [23].
Лигнинпероксидаза – фермент, имеющий большое значение для биотехнологии и применяющаяся при делигнификации древесины и получение альтернативного источника топлива, при конверсии компонентов каменных углей до более низкомолекулярных фракций, служащие сырьем для химической промышленности. Также она используется для размягчения и отбеливания целлюлозы в бумажной индустрии, для удаления стойких органических соединений, при полимеризации в индустрии полимеров [24].
Не так давно на рынке появился фермент нового поколения – грибная сырная закваска, "meito" японского производства. Его получают из пищевого гриба шаиитаки, произрастающего в Японии. Данный пепсин растительного происхождения, но в то же время по своему аминокислотному составу и действию на молоко сравним с телячьим сычужным ферментом. Meito обладает достаточной активностью (не менее 300 000 единиц), малым расходом (всего 1 грамм на 100 литров молока), неприхотливостью и длительным сроком хранения [23].
Большое значение имеет получение в медицинских целях биологически активных веществ – витаминов, убихинонов (коферментов), ферментов, антиоксидантов, эссенциальных – жизненно необходимых – жирных кислот и аминокислот, микроэлементов и др. Доказана возможность применения отходов пищевой промышленности для выращивания базидиомицетов, при этом не теряют их полезные свойства [14].
Также созданы активные комплекс грибных ферментов целлюлолитического и гемицеллюлазного действия, которые обеспечивают более глубокую степень мацерации растительной ткани при производстве вин. Использование целлюлолитических и пектолитических ферментных препаратов позволяет усовершенствовать технологию переработки сладких виноградных выжимок. При этом увеличивается выход спирта-сырца и снижается процент примесей в осадке виннокислой извести [26].
В настоящее время выращивают мицелий вешенки в глубинной культуре на средах с бумагой, древесиной дуба, кукурузными кочерыжками либо веточками от виноградных гроздьев. Для развития дереворазрушающих базидиомицетов в глубинной культуре моно использовать отходы растениеводства и животноводства: меласса, растительные отвары, молочная сыворотка, концентрат клеточного сока картофеля, водный экстракт солодки, растительное масло. Что значительно делает процесс экономически выгодным и позволяет утилизировать отходы производств [14].
В последнее десятилетие целлюлазы стали широко использоваться в текстильной промышленности, где они применяются для удаления ворсинок и микродефектов при биополировке хлопчатобумажных тканей. Также они используются в процессе удаления индиго из джинсовой ткани (процесс ферментативной депигментации) с целью придания ей внешнего вида "вареных джинсов", где ферменты заменили использовавшуюся ранее пемзу и химическое воздействие. Для обработки джинсовой ткани используют как традиционные целлюлазные препараты, представляющие собой полиферментные системы, так и специально оптимизированные для данного процесса ферментные препараты, выпускаемые рядом зарубежных фирм [26].
В настоящее время используемые корма для сельскохозяйственных животных содержат в большом количестве клетчатку. Однако животные не способны её переваривать. И потому кормовые ферменты на основе грибных целлюлаз все шире используются в животноводстве для предварительной обработке сырья. Так создана кормовая добавка «Флекс 400» на основе гриба Lactiporus sulphureus в животноводстве, «Фловин» – Fusarium sambizium, комплексная добавка «ЗМВБЛГ» [27].
Высшие базидиальные грибы обладают не только большой питательной ценностью, но также служат источником биологически активных веществ, что их выдвигает на первый план в качестве дешевого сырья для получения фармакологически ценных компонентов [2, 14]. Гетерополисахариды и хитин-глюкановый комплекс Ganoderma applanatum, Flamulina vuliteps, Fomes fomentarius обладают выраженным иммуностимулирующим эффектом [28]. Липиды в комплексе с клеточными полисахаридами Agrocybe aegerita, Lentinus edodes, Lactiporus sulphureus проявляют противоопухолевой активностью. Создаются различные композиции на основе экстрактов из плодовых тел, мицелия. Препарат Микотон на основе гриба Fomes fomentarius проявляет активность к широкому спектру заболеваниям [29].
Препараты из чаги – стерильная форма трутовика ложного (Inonotus obligues), увеличивает сопротивляемость раку и используются для лечения язвенной болезни, гастритов и других желудочно-кишечных заболеваний. Вытяжки из плодовых тел некоторых видов маразмиусов (негниючников) подавляют рост туберкулезной палочки [15]. ООО «Гелла-Фарма» разработало и защитило патентами биотехнологию промышленного получения натуральных композиций биологически активных веществ продуцируемых мицелиальными грибами. Производимые субстанции представляют собой смесь из фосфолипидов, ферментов, полисахаридов, убихинонов, в том числе Q10, витаминов и др. [30].
Показано что экстракт гриба Pleurotus ostreatus обладает выраженной противовоспалительной активностью. Полисахариды трутовика Canoderma lucinum фукогалактан и ксиломаннан обладают в 99% случаях противоопухолевой активностью [31]. Выделены из плодовых тел Flammulina velutipes β-глюканпротеиновый комплекс (ЕА6), из мицелия – комплекс «профламин» обладают противоопухолевой активностью (против меланомы В-16, рака легких Льюиса, аденомы, иммунной стимуляцией на макрофаги [32].
Активные ферментные комплексы дереворазрушающих грибов могут быть использованы в промышленности для обесцвечивания сточных вод. Так, например, для обесцвечивания стоков, содержащих мелассу, отходы гидролизного производства. К факторам обесцвечивания сточных вод дереворазрушающими грибами относят также хелатирующие агенты. Наблюдалось значительное ослабление окрашивания сточных вод и на 50% снижение биологического и химического потребления кислорода. Pleurotus ostreatus может быть использован для обесцвечивания и снижения ХПК в сточных водах, содержащих винассу и экстракт кофейной гущи. Показана возможность использовать Trametes trogii и Trametes versicolor для обесцвечивания различных промышленных красителей. Лакказу применяют в биосенсорах например, анализ фенольных соединений. Показана возможность использования лакказы Coriolus versicolor для определения фенолов включая лигнины, в сточных водах промышленных предприятий [6].
Создана коллекция макромицетов как база для образовательного процесса и создание современных биотехнологий [32].
Использования лакказно-медиаторной системы является делигнификация и обесцвечивание бумажной пульпы, вторичной переработки макулатуры и детоксикация промышленных отходов. Принцип функционирования таких систем состоит в ферментативном окислении медиаторов лакказ с образованием продуктов с высокими редокс потенциалами. Последние могут взаимодействовать с карбогидратами, лигнином или другими экотоксикантами (красители, пестициды и др.) и проводить их деструкцию [6].
Заключение
В результате проведенной работы были изучены ферменты базидиальных грибов, участвующие в деструкции древесины, и их широкий спектр применения в биотехнологии медицины.
В нашей стране насчитывается около 300 видов съедобных грибов. Однако число видов, употребляемых в пищу, обычно невелико. Большинство съедобных грибов малоизвестно, например, гриб-зонтик, некоторые виды рядовок и т.д.
Важно отметить, что замена известных химических способов обработки целлюлозных материалов на ферментативные приводит к проведению процесса в более мягких условиях и уменьшает ущерб, наносимый окружающей среде.
Снижение токсичности древесных композиционных материалов возможно путем замены фенолформальдегидных и карбамидных смол различными добавками, в качестве которых могут быть использованы лигносульфонаты, белок мицелия, гидролизный лигнин.
Замена сычужных ферментов на грибные протеиназы имеют более низкую стоимость. Их производство не требует дорогостоящего забоя молодняка животных и их переработки (что особенно нравится движению "зелёные").
Биополимеры клеточных стенок высших грибов недостаточно изучены, хотя обнаружено в них высокое содержание полисахаридов, обладающих выраженной антираковой активностью, а также ряд растительных ферментов, присущим только некоторым видам растений.
Еще в 2002 году предполагалось, что применение энергосберегающих технологий на основе биопластика в США позволит сократить стоимость производства термомеханической древесной массы с 275 до 258 $ за тонну. Большинство представителей ксилотрофов не изучены, тем не менее, проводятся исследования по изучению их свойств и их ферментативных систем. Выявляют наиболее продуктивные штаммы ферментов.
Список использованных источников
Глик Б. Молекулярная биотехнология Принципы и применение: пер. с англ. / Б. Глик, Дж. Пастернал. − М.: Мир, 2002. − 589 с.
Кутафьева Н.П. Морфология грибов: учеб. пособие для студ. вузов, общ. по спец. Биология: доп. М-вом образов. Р.Ф. / Н.П. Кутафьева. – 2-е изд. исп. и доп. − Новосибирск: Сиб. унив. изд-во, 2003. – 215 с.
Гарибова Л.В. Основы микологии: Морфология и систематика грибов и грибоподобных организмов: учеб. пособие / Л.В. Гарибова, С.Н. Лекомцева. − М.: Товарищество научных изданий КМК, 2005. − 224 с.
Рабинович М.Л. Теоретические основы биотехнологии древесных композитов: В 2 кн., Кн. Ι Древесина и разрушающие ее грибы. / М.Л. Рабинович, А.В. Болобова, В.И. Кондращенко; под ред. М.Л. Рабинович. − М.: Наука, 2001. − 264 с.
Suki C. Croan Conversion of conifer wastesinto edible and medicinal mushrooms / Suki C. Croan // Forest products journal − 2004. − V.54, №2. − P. 68-76.
Факторы разрушения древесины [Электронный ресурс]: Сенеж-препараты: [сайт информ. – строительной компании]. −Электрон. дан. − М., 2006. − Режим доступа: http://www.seneg.ru/info/arts/23.htm. − Загл. с экрана.
Стороженко В.Г. Грибные сообщества лесных экосистем: мат. координационных исслед. РАН. / В.Г. Стороженко, В.И. Крутов, Н.Н. Селочник; под. ред. В.Г. Стороженко. − М.: Петрозаводск: Карельский науч. центр. РАН, 2000. − 320 с.
Болобова А.В. Теоретические основы биотехнологии древесных композитов: В 2 кн., Кн. ΙΙ Ферменты, модели, процессы. / А.В. Болобова, А.А. Аскадский, В.И. Кондращенко, М.Л. Рабинович; под ред. А.В. Болобова. − М.: Наука, 2002. − 343 с.
Семенкова И.Г. Фитопатология. Дереворазрушающие грибы, гнили и патологические окраски древесины (определительные таблицы): учеб. пособие / И.Г. Семенкова. − М.: ГОУВПОМГУЛ, 2008. − 72 с.
Гелес И.С. Древесное сырье – стратегическая основа и резерв цивилизации: / И.С. Гелес. − Петрозаводск : Карельский научный центр РАН, 2007. − 499 с.
Даниляк Н.И. Ферментные системы высших базидиомицетов / Н.И. Даниляк, В.Д. Семичаевский, Л.Г. Дудченко, И.А. Трутнева; под ред. Н.И. Даниляк. − Киев: Наук. Думка, 1989. − 280 с.
Никифорова С.В. Биоконверсия хризена грибом белой гнили Pleurotus ostreatus D1 / C. В. Никифорова, Н.Н. Позднякова, О.Е. Макарова, М.П. Чернышова, О.В. Турковская // Микробиология. − 2010. − Т. 79, №4. − С. 481-485.
Рисинова Т.В. Разработка технологий биосинтеза фермента лакказы базидиальными грибами Tramenes: дис. канд. технич. наук / Т.В. Рисинова − М., 2007. − 191 с.
Заикина Н.В. Основы биотехнологии высших грибов: учеб. пособие для студ. обуч. по напр. Биология / Н.В. Заикина. − М.: Проспект науки, 2007. − 336 с.
Лукаткин А.С. Биология с основами экологии: учеб. для студ. высш. учеб. заведений / А.С. Лукаткин, А.Б. Ручин, Т.Б. Силаев; под ред. проф. А.С. Лукаткина. − М.: Академия, 2008. − 398 с.
Кадималиев Д.А. Фундаментальные и прикладные основы биотехнологии экологически безопасных композиционных материалов / Д.А. Кадималиев, В.В. Ревин, Н.А. Атыкян, В.В. Шутова; под ред. проф. В.Д. Самуилова. − Саранск: Изд-во Мордов. ун-та, 2004. − 192 с.
Мира Ядав. Очистка и изучение свойств лигнинпероксидазы гриба Lenzitiy seperia MTCC – 1170 деминерализацию герминовой кислоты каменных углей / Мира Ядав, Пратиба Ядав, К.Д. С. Ядав // Биохимия. − 2009. − Т. 74, вып. 10 − С. 1386-1387.
Рагимова М.М. Биосинтез окислительных ферментов ксилотрофными базидиальными грибами семейства Coriolaсeae / М.М. Рагимова, П.З. Мурадов // Иммунопатология. Аллергология. Инфектология. − 2010.− №1. − С. 264-265.
Морозов А.И. Современное промышленное грибоводство / А.И. Морозов. − М.: АСТ, Сталкер, 2007. − 224 с.
Синицы А.П. Биоконверсия лигноцеллюлозных материалов: учеб. пособие / А.П. Синицы, А.В. Гусаков, В.М. Черноглазов; под ред. А.П. Синицы. − М.: Изд-во МГУ, 1995. − 224 с.
Chapin CΙΙΙ, F. S. Принципы экологичности экосистем / CΙΙΙ, F.S. Chapin, P.A. Matson, H.A. Mooney, N-Y, Springer-Verlang, NT, 2002 [Электронный ресурс]: Многоязычный архив от WorldLingo. − Электрон. дан. − Режим доступа: http://www.worldlingo/com/ma/enwiki/ru/cellulase. − Заглав. с экрана.
Лебедева Г.В. Очистка и характеристика молокосвертывающих ферментов вешенки обыкновенной / Г.В. Лебедева, М.Т. Проскуряков // Прикладная биохимия и микробиология. − 2009. − Т. 45, №6. − С. 690-692.
Грибные не содержащие амилазы ферменты эстеразы-липазы [Электронный ресурс]: Genesismilk: [сайт информ. – промышленной компании]. − Электрон. дан. − Режим доступа: http://genesismilk.by/?p=395. − Загл. с экрана.
Егорова Т.А. Основы биотехнологии: учеб. пособие / Т.А. Егорова, С.М. Клунова, Е.А. Живухина; под ред. Т.А. Егоровой. − 2-е изд. стер. − М.: Академия, 2005. − 208 с.
Загоскина Н.В. Биотехнология: теория и практика : учеб. пособие / Н.В. Загоскина, Л.В. Назаренко, Е.А. Калашникова, Е.А. Живухина; под ред. Н.В. Загоскиной. − М.: Оникс, 2009. − 496 с.
Евтушенков А.Н. Введение в биотехнологию: курс лекций / А.Н. Евтушенков, Ю.К. Фомичев. − Минск.: Изд-во БГУ, 2002. − 105 с.
Польских С.В. Применение зернового мицелия высших базидиальных лечебных грибов в птицеводстве / С.В. Польских, В.Е. Аксеновская, В.А. Федюшина // Иммунопатология. Аллергология. Инфектология. − 2010.− №1. − С. 262-263.
Кожемякина Н.В. Иммуностимулирующая активность мицелия некоторых базидиомицетов / Н.В. Кожемякина, Е.П. Ананьева, С.В. Гурина // Иммунопатология. Аллергология. Инфектология. − 2010.− №1. − С. 253-254.
Сенюк О.Ф. Использование грибного препарата микотон в лечении пациентов / О.Ф. Сенюк, Н.Ф. Курочко, Л.Ф. Горовой // Иммунопатология. Аллергология. Инфектология. − 2010.− №1. − С. 266-267.
Огарков Б.Н. Микро- и макромицеты как основа биотехнологических препаратов / Б.Н. Огарков, Т.Р. Огаркова, Л.В. Салусенок // Известия Иркутского государственного университета. Серия: Биология. Экология. − 2010.− Т. 3, №2. − С. 75-86.
Авагян И.А. Противовоспалительная активность экстракта культуры гриба Pl. Ostreatus / И.А. Авагян, С.Г. Нанагюлян, М.Г. Баласянян, А.Г. Жамгарян // Иммунопатология. Аллергология. Инфектология. − 2010. − №1. − С. 236.
Громовых Т.И. Коллекция культур макро и микромицетов как база для образовательного процесса и создание современных биотехнологий / Т.И. Громовых, Л.С. Кузнецова, В.С. Садыкова // Иммунопатология. Аллергология. Инфектология. − 2010.− №1. − С. 246.

Нравится материал? Поддержи автора!
Ещё документы из категории биология:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ