Клеточная поверхность рецепторы рециклирование мембран и передача сигналов
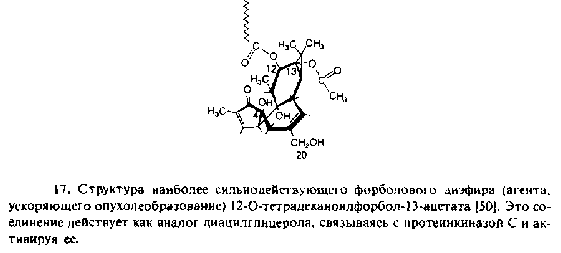




Клеточная поверхность: рецепторы, рециклирование мембран и передача сигналов
Введение
Все клетки должны иметь механизмы, позволяющие им контролировать состояние окружающей среды и отвечать на происходящие в ней изменения. В плазматических мембранах бактериальных, растительных и животных клеток содержится множество специализированных рецепторных молекул, которые, взаимодействуя с внеклеточными компонентами, вызывают специфические клеточные ответы. Одни рецепторы связывают питательные вещества или метаболиты, другие – гормоны или нейромедиаторы, третьи участвуют в межклеточном узнавании и адгезии или связывании клеток с нерастворимыми компонентами внеклеточной среды. Работа большинства рецепторных систем включает следующие стадии: 1) связывание лиганда или агониста с рецептором, расположенным на клеточной поверхности; 2) передачу внутрь клетки информации о связывании вещества с рецептором; 3) клеточный ответ, который в свою очередь делится ни первичный и вторичный. Эта бурно развивающаяся область исследований благодаря применению молекулярно-биологических подходов имеет блестящие перспективы. Становится ясно, что многочисленные, на первый взгляд не связанные друг с другом рецепторные системы имеют в своей основе много общего. Идентифицировано несколько семейств рецепторных белков с гомологичными первичными структурами; каждый белок связывается с характерным для него лигандом, что вызывает специфический клеточный ответ. Такие «суперсемейства» состоят из структурно родственных, но функционально различающихся белков. Это предполагает наличие неких модульных конструкций не только среди рецепторных белков в пределах данного семейства, но также среди других компонентов рецепторных систем, так что варианты одной и той же основной структуры рецепторного белка могут удовлетворять разнообразные потребности различных типов клеток, взаимодействующих с разными эффекторами. В частности, совершенно очевидна ключевая роль
Таблица 1. Некоторые суперсемейства структурно родственных рецепторов у эукариот
GTP связывающих белков и продуктов распада фосфатидилинозитола в самых разных системах.
Мы рассмотрим также тесно связанный с предыдущим вопрос о динамических свойствах самой клеточной поверхности, в частности поверхности животной клетки. Рассмотрим динамическое равновесие между плазматической мембраной животной клетки и пулом внутриклеточных мембранных везикул, называемых эндосомами или рецептосомами, которые отшнуровываются от плазматической мембраны и способны опять с ней сливаться. Все это является частью сложного механизма внутриклеточного мембранного транспорта, протекающего также с участием других клеточных мембранных органелл, например комплекса Гольджи и лизосом. При поступлении соответствующих сигналов специфические белки плазматической мембраны, инкапсулированные во внутреннем мембранном пуле, быстро высвобождаются и оказываются на поверхности мембраны в активной форме. Некоторые макромолекулы, например липопротеииы низкой плотности, поглощаются клетками путем захвата отшнуровывающихся от плазматической мембраны везикул в процессе, называемом рецепторзависимым эидоцитозом.
1. Поверхность животной клетки
Прежде чем переходить к обсуждению структур различных мембраносвязанных рецепторов и механизмов индукции клеточного ответа, полезно рассмотреть строение поверхности животной клетки, поскольку большинство исследований в этой области выполнено на клетках животных. Плазматическую мембрану отличают от других клеточных мембран две особенности.
Относительно высокое содержание холестерола. Оценить долю холестерола клетки, находящуюся в плазматической мембране, довольно трудно, но ясно, что она весьма существенна. Высоким содержанием холестерола отличаются и другие мембранные структуры эндоцитозного пути. Еще один липид, содержащийся в значительных количествах в этих мембранах, – сфингомиелин.
Относительно высокое содержание гликопроизводных. Гликопроизводиые содержатся не только в плазматической мембране. Однако они присутствуют в ней в большом количестве. Все углеводные группы гликопротеинов плазматической мембраны находятся на наружной поверхности клетки, и зная места их прикрепления, можно определить аминокислотные остатки мембранных белков, обращенные наружу. Большинство белков плазматической мембраны гликозилированы. Полезно также помнить, что некоторые белки плазматической мембраны прикрепляются к ней с помощью фосфоинозитола и могут высвобождаться под действием фосфолипазы С, а другие белки присоединяются через ковалентно связанные жирные кислоты.
Физико-химические свойства холестерола в составе модельных мембран широко исследовались, однако функциональная роль холестерола в плазматической мембране до сих пор неизвестна. Далека от выяснения и биологическая функция углеводных частей гликолипидов и гликопротеинов.
В качестве примера рассмотрим поверхность эритроцита. Два преобладающих в этой мембране белка – белок полосы 3 и гликофории А – являются достаточно хорошо охарактеризованными гликопротеинами. Около 75°7» всех моносахаридов клеточной поверхности входит в состав гликопротеинов, а остальные 25% содержатся в гликолипидах, которые состоят из простых глобозидов и длинноцепочечных полилактозаминцерамидов. Эти гликолипиды составляют лишь несколько молярных процентов от общего количества липидов. Основные углеводсодержащие компоненты мембраны эритроцитов схематически представлены на рис. 9.1; указана максимальная протяженность Углеводных цепей. Рис. 9.2 иллюстрирует поверхность эритроцита в истинном масштабе, дающем представление о расстоянии между различными гликопроизводными. На самом деле углеводные цепи не выступают над клеточной поверхностью так, как это изображено на рис. 9.1 и 9.2, однако эти структуры, вероятно, играют важную роль при взаимодействии клеток с их окружением.
Углеводсодержащие соединения придают клеточной поверхности ярко выраженный гидрофильный характер. При этом отрицательный заряд в значительной степени определяется остатками сиалоных кислот, которые составляют семейство производных нейраминовой кислоты. В некоторых случаях сиаловые кислоты маскируют специфические сайты узнавания на молекулах клеточной поверхности. Существенно, что гликопроизводные определяют свойства участка, выступающего над клеточной поверхностью на ~ 100 А. Кроме того, эти специфические компоненты обладают уникальными биологическими функциями.
Так, было показано, что углеводные компоненты гликолипидов и гликопротеинов изменяются при развитии и дифференцировке клетки и могут служить антигенными маркерами, ассоциированными с опухолями. Ганглиозиды, представляющие собой содержащие сиаловую кислоту гликосфинголипиды, служат местом связывания холерного и столбнячного токсинов. Что еще более интересно – ганглиозиды непосредственно участвуют в регуляции процессов клеточного роста и дифференцировки, а также, по-видимому, воздействуют на фосфорилирование рецептора фактора роста эпидермиса – возможно, путем прямого взаимодействия. При этом роль углеводного компонента гликопротеинов, и особенно рецепторных белков, не совсем ясна. Гликозилирование может играть модулирующую или регуляторную роль при функционировании некоторых рецепторов, необходимых для межклеточной адгезии.
2. Рецепторы, определяющие клеточную адгезию
Один из основных классов рецепторов клеточной поверхности участвует в клеточной адгезии. Этот класс включает рецепторы, которые необходимы для узнавания клетками друг друга и для их адгезии, а также рецепторы, ответственные за связывание клеток с нерастворимыми компонентами внеклеточного матрикса, такими, как фибронектин или коллаген у животных. За связывание ответственны взаимодействия, как между белками, так и между белками и сахарами. Способность клеток к специфическому взаимному узнаванию и адгезии крайне важна для эмбрионального развития; выявлены некоторые компоненты клеточной поверхности, необходимые для этого. У взрослого животного адгезивные взаимодействия «клетка – клетка» и «клетка – матрикс» продолжают оставаться существенными для поддержания стабильности тканей. Те специфические системы, которые удалось исследовать, включают межклеточное узнавание при иммунном ответе, при миграции лимфоцитов к местам их назначения и при индукции адгезивных свойств у тромбоцитов при свертывании крови. Большую роль в исследовании этих систем сыграло использование методов молекулярной биологии, выявившее структурные взаимосвязи между рецепторами. Рассмотрим некоторые из рецепторов адгезии.
2.1 Cвязывание бактерий с гликолипидами
Множество бактерий образуют колонии на твердых субстратах, а в некоторых случаях прилипают к специфическим поверхностям. Из бактериальных структур, участвующих в этом процессе, лучше всего охарактеризованы ворсинки. Это длинные нитевидные отростки, не имеющие аналогов среди высших организмов. Примером могут служить ворсинки, обнаруженные у патогенных штаммов Е. coli, которые вызывают инфекционные заболевания мочевых путей человека. Ворсинка содержит -1000 белковых молекул, образующих спираль, на конце которой находится рецепторный белок, специфически связывающийся с дигалактозидсодержащими гликолипидами. Эти липиды присутствуют на поверхности эпителиальных клеток, выстилающих мочевые пути, где и размножаются бактерии. Заметим, что необходимым условием выполнения адгезином его функций является локализация этого белка на значительном расстоянии от клеточной поверхности, обычно покрытой липополисахаридами. Адгезии функционирует как лектин, т. е. сахаросвязывающий белок.
2.2 «Хоминг» лимфоцитов: стволовым кроветворным клеткам тоже нужны гликопроизводные
Лимфоциты непрерывно циркулируют между кровью и лимфоидными органами. Именно в этих органах концентрируется антиген из всех межклеточных пространств, подвергается процессингу и становится доступным для антигенспецифичных лимфоцитов, вызывая иммунный ответ. Лимфоциты мигрируют между кровотоком и лимфоидными органами по лимфатическим сосудам, и из всех клеток крови только рециркулирующие Т- и В-лимфоциты прилипают к внутренним поверхностям стенок этих сосудов и затем мигрируют к лимфоидным органам. Такая миграция называется «хомингом», и для этого необходимы специфические рецепторы на клеточной поверхности. Хоминг-рецептор – это белок с мол. массой -90 кДа, который ковалентно присоединен к убиквитину. Убиквитин представляет собой низкомолекулярный полипептид, ковалентно связанный с многочисленными цитоплазматическими белками и участвующий во внутриклеточной деградации белков. Роль убиквитина, присоединенного к виецитоплазматическому домену этого рецептора клеточной поверхности, неизвестна. Вероятно, однако, что подобным образом модифицируются и другие белки клеточной поверхности, поэтому такой механизм может иметь большое значение.
Хоминг-рецептор, по-видимому, является также лектином, который узнает углеводную часть гликосоединений на поверхности эндотелиальных клеток. В этом процессе участвует маннозо 6 фосфат.
Стволовые кроветворные клетки тоже способны к хомингу. Эти клетки, дифференцирующиеся в макрофаги и в клетки других типов, обладают сродством к клеткам стромы костного мозга и селезенки. Именно здесь происходит пролиферация и дифференцировка этих клеток. Хотя соответствующий рецептор и не был выделен, можно предположить, что он узнает галактозные и маннозные остатки гликопроизводных в тканях-мишенях. Поэтому взаимодействия белок / сахар важны для адгезии.
2.3 Молекулы, участвующие в клеточной адгезии
Для идентификации белков клеточной поверхности, участвующих во взаимодействиях между клетками, с успехом использовались моноклональные антитела. Соответствующие белки были названы молекулами клеточной адгезии, или САМ. Наиболее полно охарактеризовано семейство гликопротеинов, участвующих в адгезии нейронов. Сходные молекулы были обнаружены в мозгу мыши, цыпленка и человека. Во время развития отдельного организма N-CAM экспрессируются в нескольких формах в разное время в различных тканях. Не исключено, что сложная картина адгезии нейронов во время развития мозга обусловлена дифференциальной экспрессией и посттрансляционными модификациями небольшого числа молекул, а не участием большого количества высокоспецифичных белков адгезии. N-CAM являются гомофильными соединениями, т. е. молекула N-CAM одной клетки связывается со сходной молекулой другой клетки. Хотя эти белки адгезии гликозилированы, углеводы не являются необходимыми для взаимодействия, приводящего к связыванию. Однако гликозилирование может влиять на взаимодействие, так, при переходе от эмбрионального мозга к мозгу взрослого организма число остатков сиаловой кислоты в N-CAM уменьшается в три раза, что коррелирует с увеличением адгезивиости. Возможно, гликозирование играет регуляторную роль.
Другие посттрансляционные модификации N-CAM включают фосфорилирование сериновых и треониновых остатков в цитоплазматическом домене, ацилирование жирных кислот и сульфирование N концевых олигосахаридов. Возможно, все эти модификации являются способами регуляции биологических функций N-CAM. Кроме того, из-за альтернативного сплайсинга мРНК N-CAM продуцируются в трех разных формах. Эти варианты N САМ экспрессируются в разное время и в различных местах. Два из них предположительно содержат гидрофобную спираль, погруженную в мембрану, и протяженные С-концевые домены на цитоплазматической стороне мембраны. Эти две формы отличаются наличием в цитоплазматическом домене участка длиной 261 аминокислотный остаток. У третьей формы гидрофобный домен отсутствует, и, по-видимому, этот белок связывается с наружной поверхностью мембраны с помощью фосфоинозитольного мостика. Специфические биологические функции разновидностей N-CAM неизвестны.
Анализ аминокислотной последовательности N-CAM, проведенный с помощью кДНК, показал, что N-CAM относятся к иммуноглобулиновому суперсемейству. N-CAM содержат пять смежных доменов протяженностью – 100 аминокислотных остатков каждый, которые гомологичны ие только друг другу, но и иммуноглобулинам. Следовательно, N-CAM состоят из иммуноглобулиноподобных доменов и филогенетически родственны иммуноглобулинам. Это суперсемейство включает также другие белки клеточной поверхности, которые функционируют как рецепторы, в том числе Т-клеточный рецептор и главные комплексы гистосовместимости МНС. В него входит также миелинсвязанный гликопротеин, который, вероятно, участвует во взаимодействии между аксонами и миелинизированными клетками периферической нервной системы. По своей структуре он весьма сходен с N-CAM, что предполагает наличие общей структурной основы у представителей одного класса молекул клеточной адгезии.
Основную роль в функционировании N-CAM играют гомофильные белок-белковые взаимодействия между иммуноглобулиноподобными доменами. Однако N-CAM связывается также с гепарином с помощью домена, расположенного вблизи N конца, и это взаимодействие может играть роль в межклеточных контактах. Таким образом, N-CAM полифункционален. На рис. 9.4 схематически представлена структура N-CAM, построенная по результатам исследований с использованием моноклональных антител.
Идентифицированы и другие виды САМ, отличные от N-CAM.
Один из них, нейроглиальный, или Ng-CAM, выделен из эмбриона цыпленка. N-CAM участвует в адгезии нервных клеток, a Ng-CAM – нервных клеток и клеток глин. Время появления и клеточная локализация Ng-CAM отличны от таковых у N-CAM. Возможно, запрограммированное появление Ng-CAM вместе с N-CAM помогает в регуляции образования нервной сети. Взаимодействия, в которых участвуют эти САМ, не зависят от ионов кальция.
Обнаружен отдельный класс белков САМ, которые опосредуют Са2 +-зависимые межклеточные взаимодействия. Эти белки были названы кадхеринами и включают в себя эпителиальный кадхерии, плацентарный кадхерин н увоморулин мышей. Гомолог Е-кадхерина цыпленка называется L^CAM; оба этих гликопротеина опосредуют взаимодействия между эпителиальными клетками. Сходство аминокислотных последовательностей Са2 +-зависимых белков САМ свидетельствует о том, что они образуют отдельное суперсемейство молекул адгезии. Например, результаты определения полной аминокислотной последовательности L-CAM по данным секвенирования кДНК показывают, что его мол. масса составляет 79,7 кДа, однако гомология с белком N-CAM отсутствует и L-CAM не принадлежит к суперсемейству иммуноглобулинов. Тем не менее, в молекуле САМ имеются три соседних гомологичных сегмента длиной по 113 аминокислотных остатков, а в молекуле N-CAM – пять таких сегментов, что указывает на сходство структурной организации упомянутых белков.
Дальнейшие исследования белков САМ прольют свет на механизмы межклеточного узнавания и адгезии во время эмбриогенеза и множества других клеточных процессов.
2.4 Рецепторы, участвующие в межклеточных взаимодействиях при иммунном ответе
При исследовании САМ выявился один неожиданный факт: в межклеточных взаимодействиях при эмбриогенезе участвует относительно небольшое число структурно различающихся САМ, а для взаимодействий между лимфоцитами, опосредующими иммунный ответ, наблюдается обратная картина. В индукции антител, направленных против специфического антигена, участвуют по крайней мере три разных типа клеток: 1) В-клетки, которые продуцируют антитела; 2) Т-клетки, которые секретируют факторы роста; 3) макрофаги, или дополнительные клетки. У каждой из этих клеток имеются поверхностные рецепторы, которые участвуют в специфических межклеточных взаимодействиях и в активации В-клеток с целью их дальнейшей пролиферации и секреции антител против специфического антигена. Известны два основных рецептора, участвующих в этом процессе: 1) Т-клеточный рецептор; 2) гликопротеины МНС класса II. Оба они входят в иммуноглобулиновое суперсемейство. Специфические межклеточные взаимодействия, участвующие в иммунном ответе, определяются в первую очередь белок-белковыми взаимодействиями между этими рецепторами клеточной поверхности. Приведем упрощенную последовательность событий.
Антиген захватывается А-клетками, подвергается процессингу и образует на клеточной поверхности комплекс с гликопротеинами МНС класса II.
Т-клетка взаимодействует с А-клеткой при участии Т-клеточного рецептора. Подразумевается, что Т-клеточный рецептор одновременно узнает глнкопротеины МНС класса II и антиген. При этом с А-клеткой будут взаимодействовать только Т-клетки с подходящими антигенспецифичными рецепторами. В популяции Т-клеток существует много разнообразных структур Т-клеточных рецепторов, однако каждая отдельная клетка продуцирует только один из них. Результатом такого взаимодействия между А- и Т-клетками является, в частности, образование факторов роста, которые стимулируют пролиферацию субпопуляции Т-клеток, а также других лимфоидных клеток.
В-клетки могут экспрессировать большое число разных мембраносвязанных иммуноглобулинов, но, как и в случае Т-клеток, индивидуальная В-клетка экспрессирует лишь один тип иммуноглобулина. В-клетки данной субпопуляции будут нести поверхностные иммуноглобулины, связывающиеся со специфическим антигеном, представленным системе. Активность и пролиферация В-клеток усиливаются при их взаимодействии с активированными Т-клетками и факторами, которые этими клетками высвобождаются. По-видимому, взаимодействие включает узнавание Т-клеткой антигена, который связывается с гликопротеинами МНС класса II на поверхности В-клетки. Это явление известно как МНС-ограниченная иммунная реакция. Пролиферация активированных В-клеток приводит к образованию популяции клеток, секретирующих антигенспецифичное антитело.
Глнкопротеины МНС класса II являются гетеродимерами, в которых каждая полипептидная цепь имеет единственный трансмембранный сегмент. Обе цепи гликозилированы. Методом рентгеноструктурного анализа была установлена структура главной части гликопротеинов МНС класса II и локализован участок связывания с пептидными антигенами. В работе приводится информация о взаимодействии пептидных антигенов с гликопротеинами МНС класса II. Данные по передаче энергии электронного возбуждения свидетельствуют о том, что очищенные гликопротеины МНС класса II, встроенные в плоскую мембрану, образуют тройной комплекс с Т-клеткой и антигеном, что напоминает антигенспецифичное взаимодействие между В- и Т-клетками. Новые данные о взаимодействии между компонентами, участвующими в адгезии клеточных мембран, вероятно, позволят получить опыты с использованием искусственных мембран.
Т-клеточный рецептор состоит из двух частей. Антигенспецифичная часть является а/З-гетеродимером, который имеет моноклональную специфичность и принадлежит к иммуноглобулиновому суперсемейству. Этот а/З-димер образует в мембране комплекс со структурно инвариантным компонентом. Данный комплекс охарактеризован для мышиных и человеческих Т-клеток; он состоит из четырех или пяти полипептидов. Вероятно, эта часть Т-клеточного рецептора участвует в передаче сигнала, приводящей к активации Т-клетки.
Гликопротеины МНС класса II, присутствующие на антиген-представляющих клетках, могут взаимодействовать и с другим гликопротеиновым рецептором, находящимся на поверхности Т-клеток. Это рецептор CD4; его взаимодействие с гликопротеинами МНС класса II, возможно, облегчает межклеточное взаимодействие.
Существует и вторая пара рецепторов, участвующих в адгезии между антигенпредставляющей клеткой и Т-хелпером. Т-лимфоциты содержат мембранный гликопротеин CD2, который специфически взаимодействует с другим белком адгезии, обозначаемым LFA 3, который присутствует в мембранах множества типов клеток. Интересно, что как CD2, так и LFA 3 являются членами иммуноглобулинового суперсемейства и структурно родственны N-CAM. Как и N-CAM, рецептор LFA 3 существует в разных формах и может фиксироваться на мембране с помощью трансмембранной спирали или фосфатидилинозитольного якоря. Взаимодействие между рецепторами LFA 3 и CD2, по-видимому, существенно для активации Т-хелперов.
После активации Т-клеток происходит экспрессия рецептора для фактора роста Т-клеток – интерлейкина 2. Клонирован и секвенирован ген, кодирующий одну субъединицу этого рецептора; по-видимому, рецептор имеет единственный трансмембранный сегмент и лишь очень небольшой С-концевой цитоплазматический домен. Это весьма необычно для митогенных рецепторов, которые, как правило, имеют протяженный цитоплазматический домен, обладающий тирозинспецифичной протеинкиназной активностью.
2.5 Интегрины – семейство рецепторов, которые связываются с компонентами внеклеточного матрикса и белками адгезии
Помимо суперсемейства иммуноглобулиновых рецепторов клеточной поверхности идентифицировано и другое многочисленное семейство рецепторов клеточной адгезии, называемых интегринами. Интегрины участвуют в связывании с белками внеклеточного матрикса и другими белками адгезии. Во многих случаях интегрины узнают трипептид Arg-Gly-Asp и связываются с белками, содержащими его. Интегрины являются гетеродимерами, в которых каждая субъединнца предположительно содержит один трансмембранный сегмент вблизи С-конца. В каждой субъединице имеются короткий цитоплазматический домен и большой внеклеточный домен. Более крупная а-субъединица во многих случаях подвергается протеолитическому расщеплению с образованием двух полипептидных цепей, соединенных дисульфидной связью. в-субъединица содержит четыре повтора длиной 40 аминокислотных остатков каждый, богатых цистеином, которые содержат многочисленные внутрицепочечные дисульфидные связи. Обе субъединицы гликозилированы. Идентифицировано примерно 20 разных членов этого семейства рецепторов в разных типах клеток. О сходстве членов этого семейства свидетельствуют результаты перекрестного иммунохимического анализа и/или данные о гомологии аминокислотной последовательности. Примеры интегринов приведены в табл. 9.1. Показано, что эти белки связываются с множеством матриксных белков или белков адгезии, однако индивидуальные интегрины строго специфичны. Решающее значение для взаимодействия имеют трипептиды RGD, но для полного объяснения специфичности нужно привлекать и другие детерминанты.
Одна из важных функций интегринов состоит в передаче информации в клетку, поскольку связывание с белками внеклеточного матрикса часто играет большую роль в определении формы клетки и ее миграции и оказывается решающим для морфогенеза и дифференцировки. Показано, что интегрин из фибробластов цыпленка связывается с компонентом цитоскелета талином. Это связывание конкурентно ингибируется пептидом, который соответствует сайту фосфорилирования тирозинкииазы, находящемуся в цитоплазматическом домене в субъединнцы интегрина. Этот пептид, однако, не влияет на связывание белков внеклеточного матрикса через сайт RGD, что свидетельствует о кв аз независимости внутриклеточного и внеклеточного доменов. Интегрин – это наиболее полно охарактеризованный трансмембранный белок, который одновременно взаимодействует с внеклеточными компонентами и цитоскелетом.
Одной интересной особенностью интегринов является наличие их разновидностей, содержащих одинаковые в субъединицы, которые представлены по меньшей мере тремя типами. Однако четко разграничить функции а- и б-субъединиц, считая, что одни из них ответственны за связывание с внеклеточными элементами, а другие – с внутриклеточными, не удается. Так, было показано, что способность интегрина цыпленка к связыванию полностью утрачивается при диссоциации субъединиц и восстанавливается при реконструкции гетеродимера.
Примеры некоторых интегринов
1. Рецепторы для белков внеклеточного матрикса птиц и млекопитающих. Они связываются с гликопротеиновыми компонентами внеклеточного матрикса, в частности с фибронектином, ламинином и витронектином. Связывание с рецепторами в большинстве случаев конкуретно блокируется пептидами, содержащими трипептид RGD. Было показано, что фибронектин опосредует клеточное движение, и ясно, что рецептор фибронектина и его внутриклеточные контакты имеют решающее значение для клеточного морфогенеза.
Гликопротеины тромбоцитов. По и Ша являются гликопротеинами мембран тромбоцитов, гомологичными а- и /3 субъединицам других интегринов. Этот поверхностный рецептор участвует в агрегации тромбоцитов, происходящей при свертывании крови. Тромбоциты не агрегируют до тех пор, пока не произойдет «активация» одним из агонистов – тромбином, коллагеном или адреналином. Процесс активации детально не изучен, но одним из ее результатов является увеличение доступности комплекса на поверхности тромбоцитов, в результате чего он может взаимодействовать с циркулирующими макромолекулярными «адгезивными» белками, в том числе с фибриногеном, фибронектином и фактором фон Виллебранда. Это связывание зависит от кальция. Фибриноген двухвалентен и, вероятно, более важен для связывания тромбоцитов в каскаде агрегации. Плазматический фактор фон Виллебранда является многофункциональным гликопротеином, который обладает сродством не только к активированному интегрину, но и к коллагену. Следовательно, этот белок адгезии способствует прилипанию активированных тромбоцитов к сосудистому субэндотелию, который становится доступным для них при нарушении целостности эндотелиальных клеток после ранения. Фактор фон Виллебранда связывается также с другим рецепторным белком тромбоцитов, глнкопротеином lb.
Лейкоцитарные белки адгезии. Для того чтобы мигрировать к месту инфекции и воспаления, лейкоциты должны вступить во взаимодействие с эндотелиальными клетками сосудов. Идентифицированы три гетеродимерных рецептора, участвующие в адгезии лейкоцитов; все они относятся к семейству интегринов. По-видимому, все три белка имеют одинаковые /3 субъедини-цы. Один из них, LFA 1, связывается со специфическим глнкопротеином клеточной поверхности ICAM4, присутствующим на фибробластах. Это взаимодействие может опосредовать связывание Т-лимфоцитов с фибробластами при воспалении.
Позиционно специфические антигены дрозофилы. По-видимому, семейство рецепторов, необходимых для нормального эмбрионального морфогенеза дрозофилы, также принадлежит к семейству интегринов. В присутствии пептидов, содержащих последовательность RGD, происходит нарушение эмбриогенеза и блокируется гаструляция у Drosophila.
2.6 Другие способы связывания с матриксом и белками адгезии
Интегрины не уникальны в своих свойствах, касающихся связывания с внеклеточным матриксом и белками адгезии. Показано, что ламинин, тромбоспондин и фактор фон Виллебранда специфически связываются с гликолнпидами, содержащими сульфогруппы. Физиологическое значение этого взаимодействия неясно. Фермент 5' – нуклеотидаза также участвует во взаимодействии как с внеклеточными, так и с внутриклеточными компонентами, хотя роль этого взаимодействия in vivo не доказана. Существуют также рецепторы ламинина, которые не относятся к семейству интегринов.
Всесторонне изучена агрегация диссоциированных клеток губки. Для инициации этого процесса должно произойти связывание некоего высокомолекулярного фактора с внеклеточным доменом рецептора агрегации, находящимся в плазматической мембране. Это, по-видимому, служит сигналом к запуску быстрого распада фосфатидилинозитола и образованию внутриклеточных вторых посредников, которые инициируют агрегацию, опосредованную фактором сборки коллагена. Коллагеновые тяжи служат матриксом, на котором сорбируются клетки губки.
3. Повторное использование мембран и эндоцитоз с участием рецепторов
До сих пор мы считали мембрану животной клетки статичной структурой, состав которой изменяется только во время роста клетки или при дифференцировке. На самом деле клеточная поверхность чрезвычайно динамична и составляет вместе с клеточными мембранными органеллами часть сложной сети мембранного транспорта. Мембранный транспорт можно разделить на две составляющие: эндоцитоз и экзоцитоз. Эндоцитоз – это поглощение внеклеточной жидкости и частиц в составе мембранных пузырьков, а экзоцитоз включает процессинг новосинтезированных белков и липидов и их доставку к месту секреции или включения в плазматическую мембрану, лизосомы или вакуоли. В обеих системах происходит селективный перенос специфических мембранных компонентов между мембранами внутри клетки с помощью везикул, которые отшнуровываются от одной мембраны и сливаются с другой. Важнейшей особенностью регуляции этих процессов является закисление везикул и вакуолей с помощью Н + – АТРаз.
3.1 Общие свойства эндоцитозного пути
Разграничим процессы поглощения клеткой крупных частиц, растворенных веществ и жидкости. Поглощение крупных частиц называется фагоцитозом и характерно только для клеток некоторых типов. Процесс активируется частицами и чувствителен к цитохалазину. После образования промежуточной фагосомы везикула закисляется и затем сливается с лизосомой, содержащей ферменты деградации.
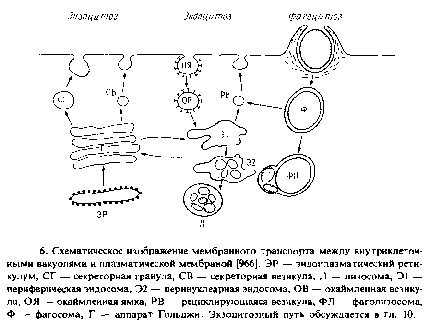
В основе поглощения жидкости и опосредованного рецепторами поглощения растворенных веществ лежит образование окаймленных ямок и окаймленных везикул. Термин «окаймленные» относится к морфологии этих структур, выявляемой с помощью электронной микроскопии. Отличительной их особенностью является наличие решетчатой структуры из молекул белка клатрина, который связывается с углублениями на поверхности плазматической мембраны и везикулами, образующимися из таких ямок. Возможно, существуют и другие эндоцитозные пути без участия окаймленных везикул, однако о них известно немного. Окаймленные везикулы участвуют и в экзоцитозе.
На долю окаймленных ямок обычно приходится всего 1 – 2% общей площади поверхности плазматической мембраны, и большинство белков плазматической мембраны не обнаруживаются на этих участках. Однако концентрация некоторых белков в этих ямках очень высока. Например, в них сосредоточено около 70% белка – рецептора липопротеина низкой плотности. В некоторых случаях сродство рецептора к окаймленным ямкам постоянно, в других рецептор концентрируется в них только при связывании лиганда. В табл. 9.2 перечислены некоторые рецепторы плазматической мембраны, участвующие в поглощении специфических лигандов с помощью окаймленных ямок и везикул.
Таблица 9.2
Некоторые рецепторы, интернализуемые при эндоцитозе
По-видимому, после образования эндоцитозных везикул оболочка из клатрина удаляется специфическим белком в ходе АТР-зависимой реакции. Эти данные получены в экспериментах in vitro; роль указанного белка in vivo пока не выявлена. Везикулы без клатрина становятся частью сложной системы трубочек и везикул, называемых периферическими эндосомами; они локализованы вблизи плазматической мембраны. На основе функциональных и морфологических различий субпопуляциям эндосом были присвоены различные названия. Мы будем называть их просто эндосомами. Существует также система эндосом, локализованных вблизи центриолей и комплекса Гольджи; они называются перинуклеарными эндосомами. Эти структуры почти наверняка также участвуют в эндоцнтозном мембранном транспорте. Конечный пункт эндоцитозного пути находится во вторичных лизосомах, где происходит деградация отдельных растворенных веществ.
Скорость, с которой происходит рециклирование мембран, поистине удивительна. Ее можно определить с помощью водорастворимых, не проникающих в мембрану меток, оценивая скорость поглощения клеткой внеклеточной жидкости. К таким меткам относятся, например, радиоактивный инулин, декстран, краситель люцифер желтый. Измерения, проведенные на гепатоцитах с использованием инулина, показали, что эти клетки поглощают путем эндоцитоза за 1 ч количество жидкости, составляющее не менее 20% их объема, и количество мембранного материала, по площади превышающее в пять раз площадь их базолатериальной плазматической мембраны! Скорость эндоцитоза у других типов клеток не столь велика, но также впечатляет; например, макрофаги поглощают за 1 ч мембранный материал, площадь которого вдвое превышает площадь их поверхности, а адипоциты – материал, по площади составляющий 0,2 площади их поверхности. Большая часть жидкости, поглощаемой клетками, быстро выводится из них зa характерное время от 1 мин до 20 мин. Возможно, между плазматической мембраной и периферическими эндосомами устанавливается динамическое равновесие, причем на долю эндосом приходится лишь около 3% общего объема клетки. Кроме того, некоторая часть инулина, поглощаемого i епатоцитами, поступает в гораздо медленнее обменивающийся внутренний пул, что, возможно, отражает попадание его в другие внутренние вакуоли, например в лизосомы.
Эти данные свидетельствуют об исключительной динамичности поверхности мембран. Бретчер обратил внимание на то, что если бы какой-то участок плазматической мембраны включался в одном месте клеточной поверхности и появлялся в другом, то это означало бы, что существует однонаправленный мембранный по-
ток. Это представление было положено в основу модели, объясняющей механизм амебоидного движения клетки таким же образом, как и «кэпииг» поверхностного антигена. Кэпинг наблюдается как у лимфоцитов, так и у других типов клеток; он инициируется агрегацией белков плазматической мембраны, обычно путем связывания мультивалентного лнганда с каким-то компонентом клеточной поверхности. Связанный компонент агрегирует с образованием «очажков», которые затем объединяются в один крупный агрегат – кэп. Далее происходит поглощение белковых агрегатов. Было высказано предположение, что первые белковые агрегаты пассивно увлекаются предполагаемым массовым мембранным потоком, при этом они концентрируются около места интернализацин. Альтернативная точка зрения, гораздо более распространенная, заключается в том, что кэпинг – это активный процесс, протекающий при прямом участии элементов цитоскелета. Интересно отметить, что ганглиозиды также можно индуцировать для образования кэпа на лимфоцитах.
3.2 Сортировка компонентов комплекса рецептор-лиганд
В результате эндоцитоза и быстрого рециклирования плазматической мембраны происходит поглощение не только жидкостей. Одна из основных функций этого процесса состоит в облегчении поглощения внеклеточных белков. Большинство рецепторов, перечисленных в табл. 9.2, которые концентрируются в окаймленных ямках, связываются с такими макромолекулярными лигандами, как гликопротеины, липопротеины низкой плотности или иммуноглобулины. Кроме того, имеются рецепторы для факторов роста и таких гормонов, как ФРЭ или инсулин, когда в результате рециклирования плазматическая мембрана быстро освобождается от комплексов гормон–рецептор, заменяемых ново синтезированными рецепторами. Структурные детерминанты, которые опосредуют связывание этих рецепторов с окаймленными ямками, неизвестны. Установлена первичная структура нескольких таких рецепторов, при этом никакого сходства между ними не выявлено. Все они имеют единственный трансмембранный сегмент, но у одних N конец обращен в цитоплазму, а у других ориентирован в противоположном направлении. В нескольких случаях было показано, что цитоплазматический домен рецептора необходим для того, чтобы рецептор оставался в незамкнутых ямках, но об этом известно очень мало.
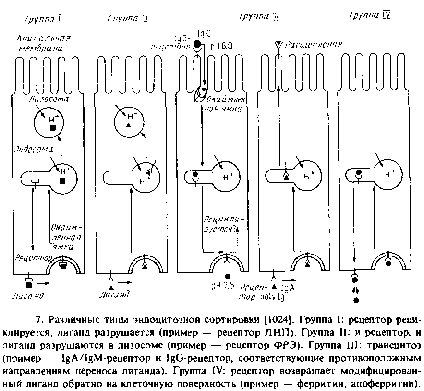
Судьбы рецептора и лнганда после их поглощения клеткой различаются. Исходя из этого можно выделить четыре основные группы систем лиганд–рецептор.
Группа I. Рецептор возвращается к поверхности клетки, лиганд направляется в лизосомы. Примерами служат ЛНП- и асиалоглико-протеиновый рецепторы.
Группа II. Как рецептор, так и лиганд направляются в лизосомы. Примерами являются ФРЭ- и инсулиновый рецепторы.
Группа III. Рецептор остается связанным с лигандом, а лиганд направляется в другой домен плазматической мембраны. Это явление называется трансцитозом и характерно для рецепторов иммуноглобулинов в поляризованных эпителиальных клетках. После такого клеточного «транзита» рецепторы для IgA и IgM подвергаются протеолитическому расщеплению, тогда как рецептор для IgG при некоторых условиях может использоваться вновь.
Группа IV. И рецептор, и лиганд возвращаются к одному и тому же домену плазматической мембраны. Наиболее полно охарактеризованным примером такого рода служит трансферриновая система, в которой после поглощения комплекса трансферрин–железо и удаления железа комплекс апотрансферрин–рецептор возвращается к клеточной поверхности.
Скорости всех этих процессов достаточно велики. Обычно время жизни рецепторов, возвращающихся к клеточной поверхности, составляет всего 3 – 6 мнн, а время полного оборота рецептора – около 15 – 25 мин. В равновесном состоянии на клеточной поверхности обнаруживается около 65 – 75% рецепторов, а остальная их часть находится на разных внутриклеточных мембранах. Полный анализ равновесной кинетики поглощения и процессинга может быть проделан с привлечением констант скоростей для каждого элементарного шага,
Одной из характерных особенностей механизма сортировки является его удивительная точность. Например, трансферриновый рецептор почти всегда находится в базолатеральной, но не в апикальной мембране поляризованных эпителиальных клеток. Вероятность его ошибочного включения в апикальную мембрану составляет лишь -0,1%, т. е. достаточно мала для сохранения полярности мембран этих клеток. В других системах, где по экспериментальным данным вероятность ошибки достигала 4%, для корректировки локализации рецепторов был необходим дополнительный этап сортировки.
Механизм сортировки должен быть весьма изощренным. По-видимому, различные комплексы рецептор–лиганд поглощаются вместе в одних и тех же частях окаймленных везикул, а сортировка внутри везикул происходит за несколько минут. Например, рецептор для асналогликопротеинов перемещается в латеральном направлении внутри эндосомной системы и концентрируется в трубочках и маленьких везикулярных компонентах, но не в крупных везикулах. Возможно, крупные эндосомные везикулы, практически лишенные этого рецептора, но содержащие гликопротеино-вый лиганд, сливаются затем с лизосомами. Однако трубочки, содержащие рецептор, возвращают его к клеточной поверхности. В этом случае сортировка несомненно происходит внутри эндосомного комплекса органелл.
Какой механизм лежит в основе быстрой сортировки макромолекул? Конечно, должны существовать особые структурные «сигналы», приводящие к компартмеитализации специфических рецепторов и лигандов. Единственным известным сигналом является ман-нозо 6 фосфат, который присутствует на ферментах, направляющихся в лизосомы. Маннозо 6 фосфатспецифичные рецепторы находятся в комплексе Гольджи, где они направляют новосинтезированные белки в лизосому, а также на плазматической мембране, где они вызывают секрецию таких ферментов во внешнюю среду.
Помимо специфических структурных сигналов сортировки большую роль играет закисление внутриклеточных везикулярных компартментов. Значение рН в эндоцитозных пузырьках составляет 5,0 – 6.2. При столь низких рН происходит диссоциация комплексов рецептор–лиганд, включающих липопротеины низкой плотности, лизосомные ферменты, асиалогликопротеины, фактор роста эпидермиса и инсулин. В таких условиях от комплекса трансферрин–рецептор отсоединяются и два атома железа, хотя в этом случае апотрансферрин остается связанным со своим рецептором.
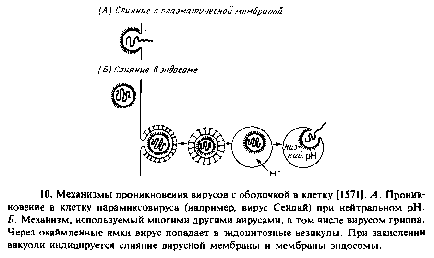
У некоторых оппортунистических вирусов и токсинов выработались механизмы проникновения в клетку, основанные на закислении везикул. Например, дифтерийный токсин связывается с каким-то неидентифицированным рецептором на клеточной поверхности и затем поглощается эндоцитозным путем. Понижение рН эндоцитозных везикул индуцирует в молекулах токсина конформационное изменение, что приводит к его проникновению через везикулярную мембрану и позволяет ферментативно активной части токсина достичь цитоплазмы. рН-индуцируемое конформационное изменение может вызвать образование трансмембранной поры. Многие вирусы животных, имеющие оболочку, тоже попадают в цитоплазму путем эндоцитоза. Низкое значение рН, отмечаемое в эндоцитозных везикулах, индуцирует конформационное изменение в гликопротеинах, входящих в состав шиловидных структур вирусных мембран, что облегчает как слияние мембраны вируса с мембраной эндоцитозной везикулы, так и доставку вирусного генома в цитоплазму. Примерами могут служить вирус леса Семлики и вирус гриппа.
рН во внутриклеточных компартментах может повышаться при добавлении слабых оснований или ионофоров. Слабые основания могут проходить через липидный бислой в незаряженной форме и протонироваться в кислом содержимом компартмента. В результате рН в компартменте может повышаться на 1–2 единицы и блокировать многие рН-зависимые процессы. Такие слабые основания часто называют «лизосомотропны-ми» или «ацидотропными» агентами. Моненсин уравновешивает протонный и К+-градиенты, что также увеличивает рН в вакуолях.
Добавление этих агентов часто предотвращает рециклирование рецепторов клеточной поверхности. Комплексы рецептор–лиганд при этом не диссоциируют, и рецепторы накапливаются во внутренних мембранных везикулах, не достигая клеточной поверхности. Такая картина наблюдается, например, для ЛНП- и асиалоглико-протеинового рецепторов. По-видимому, обмен между периферическими эндосомами и плазматической мембраной при этом не ослабевает, однако миграция к лизосомам может блокироваться.
Большие успехи в изучении этой сложной системы сортировки были достигнуты благодаря применению электронной микроскопии при искусном использовании таких клеток, как пероксидаза хрена, а также рН-контролирующих меток. Весьма полезными оказались и генетические подходы, основанные на резистентности к определенным токсинам и вирусам при неполном закислении эндоцитозных везикул. Источником соответствующих мутантов могут быть дрожжи. Биохимические исследования основываются на выделении и характеристике хорошо известных субпопуляций эндоцитозных везикул. Для разделения эндоцитозных и экзоцитозных везикул используются специально разработанные электрофоретические методы, подходы, основанные на иммунологическом сродстве, а также процедуры со смещением плотности при использовании холинэстеразы. В некоторых лабораториях удалось провести слияние изолированных эндоцитозных пузырьков in vitro и показать, что для этого необходим АТР; слияние происходило только в случае эндоцитозных пузырьков, полученных в течение 5 – 15 мин после интерналнзации.
3.3 Клатрин
При эндоцитозе наблюдаются в первую очередь такие структуры, как окаймленные ямки и окаймленные везикулы. Их характерной особенностью является наличие на цитоплазматической поверхности полигональной решетки, образуемой клатрином. Свойства клатрина и ассоциированных с ним белков определяют, какие именно рецепторы скапливаются в окаймленных ямках; эти свойства каким-то образом опосредуют и изменение мембраны, приводящее к отшнуровыванию окаймленных везикул. Молекула клатрина содержит три тяжелые цепи и три легкие и имеет сложную структуру с тремя ветвями; каждая из ветвей образована одной тяжелой цепью и одной легкой. Выделенный клатрин спонтанно ассоциирует с образованием полигональной решетки как в присутствии, так и в отсутствие мембран. Работы по реконструкции с очищенными плазматическими мембранами показали, что в местах образования окаймленных ямок имеется ограниченное число участков связывания с высоким сродством к клатрину. С клатриновой решеткой связаны и вспомогательные белки с мол. массами 100 и 50 кДа.
Каждая клетка продуцирует два основных класса легких цепей клатрина. Они кодируются двумя разными генами, мРНК которых подвергается дифференциальному сплайсингу, что приводит к появлению по меньшей мере четырех разновидностей белков. Тяжелые цепи играют структурную роль, а легкие, вероятно, выполняют регуляторную функцию и содержат места связывания кальмодулина, а также АТР-зависимого раздевающего белка. В клетке половина клатрина находится в растворе, и между этой формой и мембранными структурами поддерживается динамическое равновесие. До слияния окаймленных везикул с эндоцитозной системой из них должен высвободиться клатрин; эта реакция катализируется раздевающим белком, который выполняет чисто каталитическую функцию, однако остается прочно связанным с молекулами клатрина даже в отсутствие клатриновой решетки. В клетке этот белок находится в избытке по отношению к клатрину.
Чтобы понять природу рецепторзависимого эндоцитоза и его регуляции, необходимо выяснить механизм перехода клатрина из мономерной формы в мембраносвязанную структуру и обратно, а также механизм образования таких структур на мембране.
3.4 Некоторые примеры интернализуемых рецепторов
Рассмотрим вкратце свойства некоторых рецепторов. Все они имеют единственный трансмембранный домен, но этим сходство и ограничивается. Мы остановимся на рецепторах групп I, III и IV.
ЛНП-рецептор человека
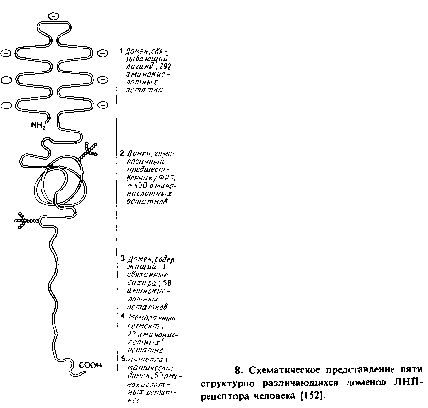
Это типичный рецептор группы I, который возвращается к плазматической мембране, в то время как его лиганд, сывороточный липопротеин низкой плотности, попадает в лизосому. Особенно богаты этим рецептором клетки печени и надпочечников, куда ЛНП поставляют холестерол для синтеза желчных кислот и стероидных гормонов соответственно. По данным об аминокислотной последовательности рецептора, определенной с помощью кДНК, он состоит из пяти доменов. Выраженная гомология с другими мембранными рецепторами отсутствует, хотя два самых крупных наружных домена содержат повторы, богатые цистеином и гомологичные соответственно фактору С9 комплемента и предшественнику ФРЭ. Рецептор имеет единственный трансмембранный домен и непротяженный цитоплазматический С-концевой домен. Показано, что у лиц с таким генетическим заболеванием, как семейная гиперхолестеролемия, ЛНП-рецепторы не функционируют. Установить функции структурных доменов рецепторов помог мутационный анализ. Так, было показано, что модификации в цитоплазматическом домене ЛНП-рецептора препятствуют связыванию рецептора с окаймленными ямками, даже если связывание ЛНП с рецептором не изменяется. Помимо выявления мутаций, происходящих in vivo, проводились опыты in vitro для получения необходимых мутаций и определения свойств экспрессированного продукта гена. Для этого применялась рекомбинантная ДНК, в которой отсутствовал ген, который кодирует домен, гомологичный предшественнику ФРЭ. Такой рецептор связывает ЛНП, но не высвобождает его при закислении. Это блокирует рециклирование рецептора и ведет к его деградации после связывания лиганда.
Асиалогликопротеиновый рецептор
Этот рецептор группы I, называемый также печеночным лектином, связывается с десиалированными гликопротеинами сыворотки и узнает гликопротеины с галактозой или N ацетилгалактозой на конце. Следует отметить две интересные особенности: 1) рецептор имеет единственный трансмембранный сегмент и является одним из нескольких рецепторов, у которых N конец обращен в цитоплазму; 2) в растворе детергента этот рецептор находится в виде гексамера, причем множество таких гексамеров встречается и в мембране. Асиалогликопротеиновый рецептор гомологичен рецептору с низким сродством к IgE, который находится на лимфоцитах человека и функция которого неизвестна.
Рецептор для полимерного иммуноглобулина
Этот рецептор связывает иммуноглобулины IgA или IgM из сыворотки и транспортирует их от базолатеральной мембраны к апикальной поверхности гепатоцитов. Во время этого процесса рецептор расщепляется и часть его, связанная с молекулой Ig, высвобождается в желчь гепатоцитов. Таким образом, рецептор используется только один раз и не восстанавливается. Как видно из рис. 9.3, данный рецептор относится к суперсемейству иммуноглобулинов и имеет пять внеклеточных иммуноглобулиноподобных доменов. Показано, что его цитоплазматический домен существен для эндоцитоза.
Трансферриновый рецептор
Этот рецептор участвует в поглощении железа из сыворотки. Рецептор связывается с трансферрином, содержащим два атома железа, интернализуется и остается связанным с апотрансферрином после отсоединения атомов железа в кислых эндоцитозных везикулах. Как и в случае ЛНП-рецептора, концентрирование этого рецептора в окаймленных ямках и его интернализация продолжаются и в отсутствие лиганда. Рецептор представляет собой димер с дисульфидными связями, гликозилированный и ацилированный по меньшей мере по одному остатку цистеина, который был идентифицирован с помощью сайт-специфического мутагенеза. Одна субъединица состоит из 760 остатков, и ее N конец обращен в цитоплазму. Для интернализации трансферринового рецептора, как и рецепторов ЛНП, IgA и ФРЭ, необходимо наличие цитоплазматического домена. Этот домен содержит несколько сериновых остатков, которые могут быть фосфорилирова-ны» но, как было показано, эти остатки несущественны для интернализации. Тем не менее было установлено, что форболовые эфиры, активирующие протеинкиназу С, уменьшают число трансферриновых рецепторов на поверхности клетки и попутно вызывают их фосфорилирование. Напротив, инсулин и другие митогены способствуют концентрированию рецептора на клеточной поверхности, по-видимому, путем увеличения скорости его экстернализации. Механизм этого явления неизвестен, но полагают, что распределение этого и других рецепторов между плазматической мембраной и внутренними везикулами является важным регуляторным фактором.
4. Слияние мембран
Анализ процессов перемещения мембранных компонентов показывает, что слияние отдельных мембранных структур внутри клетки является весьма распространенным и очень существенным клеточным процессом. Такое слияние должно происходить очень быстро и с высокой избирательностью, без утечки вакуолярного содержимого в цитоплазму. Регуляция процесса должна быть очень тонкой. Например, плазматическая мембрана быстро сливается с периферическими эндоцитозными пузырьками, но не с плазматическими мембранами соседних клеток; с ними она слипается. Каков механизм слияния мембран и как он регулируется? Ответы на эти вопросы пока не получены, но из экспериментов на модельных мембранах установлены минимальные требования к слиянию мембран и показано, что в быстром и избирательном слиянии могут участвовать белки; об этом свидетельствуют результаты работ с использованием белков шиловидных выростов оболочки вирусов животных. Эти исследования показали, что слияние может происходить по крайней мере в два этапа. Во-первых, сливающиеся мембраны должны вступить в тесный контакт. Для этого необходимо преодолеть электростатическое отталкивание и, что наиболее важно, должна произойти дегидратация полярных групп липидных молекул. Во-вторых, в плотно прилегающих друг к другу бислоях должен существовать некий локальный дефект упаковки, чтобы могли реализоваться межмембранные гидрофобные взаимодействия. На каждом из этих этапов могут принимать участие белки, что, вероятно, и происходит in vivo.
4.1 Работы с липидными везикулами
Для опытов использовали две модельные системы: слияние липидных везикул и слияние плоской модельной мембраны с липидными везикулами. За процессом слияния можно следить с помощью светового или электронного микроскопа, но чаще проводят прямой количественный анализ слияния внутренних компартментов или смешивания липидов, образующих везикулы
Пусть одна группа везикул содержит дипиколиновую кислоту, а другая – Tb3 +. При слиянии везикул и смешивании их содержимого эти два реагента быстро образуют сильно флуоресцирующий ТЬ3 + – дипиколинатный комплекс, что и позволяет проводить количественные измерения. За процессом смешивания липидов можно следить, измеряя эффективность переноса энергии электронного возбуждения между флуоресцирующими липидными молекулами, принадлежащими до смешивания разным везикулам. Эти методы позволяют различать агрегацию везикул и их истинное слияние.
Замечательной особенностью однослойных фосфолипидных везикул является то, что самопроизвольно они сливаются с большим трудом. Хотя между противоположными фосфолипидными бислоями существует вандерваальсово взаимодействие, между ними имеется также сильное электростатическое отталкивание, особенно в том случае, когда везикулы содержат отрицательно заряженные фосфолипиды. Например, везикулы, содержащие фосфатидилсерин, не будут агрегировать, поскольку существует значительный энергетический барьер, препятствующий образованию плотного контакта между мембранами, необходимого для образования комплекса. Все фосфолипиды, включая цвиттерионные липиды, связываются с водой, и для того, чтобы два близлежащих бислоя могли вступить в прямой контакт, этот поляризованный водный слой на поверхности липидного бислоя должен быть удален. Дегидратация фосфолипидов требует больших энергетических затрат, и роль агентов, облегчающих слияние мембран, состоит, в частности, в снижении этого энергетического барьера. Некоторые фосфолипиды ги-дратированы в меньшей степени, чем другие, и образуют везикулы, которые сливаются гораздо легче. Например, везикулы, состоящие из фосфатидилэтаноламина / фосфатидилсерина, сливаются эффективнее, чем везикулы из фосфатидилхолина / фосфатидилсерина. Векзикулы, состоящие из фосфатидилэтаноламина, слипаются друг с другом сильнее, чем везикулы из фосфатидилхолина, из-за различий в степени гидратации.
Агенты, облегчающие слияние мембран
1. Кальций. При добавлении Са2+ к везикулам, содержащим анионные липиды, часто происходит их слияние. Если везикулы состоят только из анионных липидов, добавление Са2+ приводит к разрушению везикул; если же анионные липиды смешаны с нейтральными, такими, как фосфатидилэтанола-мин, то происходит слияние. Для этого необходимы высокие концентрации Са2+, который не может быть заменен Mg2+. Са2+ нейтрализует отрицательный поверхностный заряд, создаваемый анионными липидами, и облегчает агрегацию везикул. Кроме того, Са2+ особенно эффективен при образовании мостика между анионными фосфолипидами в близлежащих бислоях благодаря формированию прочного комплекса Саг. Это приводит к дегидратации липидов, т. е. выталкиванию воды из пространства между противоположными бислоями. Mg2 + стабилизирует агрегацию везикул, но обычно не стабилизирует тесный контакт дегидратированных противоположных бислоев, причем эффективность его действия зависит от липидного содержания везикул.
Деформация, происходящая при адгезии везикул, приводит к напряжению в мембранах, которое снимается при слиянии. Слияние облегчается при наличии дефектов упаковки липидного бислоя, возникающих из-за каких-то локальных флуктуации или образующихся на границе раздела фаз в присутствии Са2+. Как правило, четкой корреляции между условиями, приводящими к слиянию везикул, и условиями, облегчающими крупномасштабное разделение фаз липидов, не обнаруживается. Са2 + – индуцируемое слияние часто сопровождается лизисом.
Са2+ способствует также слиянию везикул из анионных липидов с плоскими мембранами. Однако в этом случае необходимым условием является наличие осмотического градиента или на везикуле, или на плоской мембране. По-видимому, слияние стимулируется благодаря дополнительным механическим напряжениям. Высказывалось предположение, что осмотическое набухание является движущей силой слияния мембран in vivo, но пока это не подтверждено экспериментально.
Имеет ли Са +-индуцированное слияние какое-либо физиологическое значение? Часто замечали, что во многих случаях слиянию in vivo предшествует изменение концентрации Са2+ в цитоплазме. Но концентрации Са2 +, требуемые для этого in vitro, гораздо выше физиологических. С другой стороны, отмечалось, что если два липидных бислоя уже тесно контактируют друг с другом, то их сродство к Са2+ очень высоко и образование Са2 +-мостиков между противоположными мембранами может индуцироваться при изменениях концентрации Са2 +, не выходящих за пределы физиологического диапазона.
Образуются ли при слиянии липидных бислоев какие-то промежуточные формы? Этот вопрос широко обсуждался. Рассматривалась возможность существования липидных частиц и небислойных форм. Однако об образовании редко встречающихся короткоживущих промежуточных структур, возникающих при слиянии липидных бислоев, мало что известно.
Полиэтиленгликоль и декстран. Эти агенты используются довольно часто, но охарактеризованы они хуже, чем Са2 +. Обычно считают, что они вызывают дегидратацию везикул, приводящую к их агрегации и слиянию.
Слияние под действием электрических сил. Слияние фосфолипидных везикул, как и клеток, можно индуцировать с помощью коротких электрических импульсов. Под действием высокого напряжения в мембранах образуются поры, что может привести к образованию тесного контакта между липидными бислоями. При наложении сильного электрического поля в мембранах могут также возникнуть долговременные дефекты, которые, по-видимому, облегчают образование гидрофобных контактов между близлежащими липидными бислоями.
Белки и пептиды. Показано, что слиянию везикул способствуют многие растворимые белки и амфифильные пептиды. Во многих случаях этот процесс зависит от рН и протекает только при протонировании соответствующих групп белковой молекулы. Например, в кислых условиях а-лактальбумин подвергается конформационному изменению, приводящему к экспонированию гидрофобной петли, что облегчает связывание с фосфо-липидными везикулами. Это каким-то образом облегчает слияние везикул. Слиянию фосфатидилхолиновых везикул способствуют два амфифильных пептида – мелиттин и 5 гемолизин из S. aureus. Оба они имеют гидрофобный участок, который может связываться с мембранами. Вероятно, благодаря локальному раазрушению бислоя преодолеваются электростатический и гидратационнный барьеры, затрудняющие агрегацию и слияние везикул. Высказывалось предположение, что при необходимости подобные гидрофобные пептиды могут образовываться и in vivo, однако убедительные данные на этот счет отсутствуют. Кроме того, известно, что отдельные участки белковых молекул могут вызывать такой же эффект без расщепления с последующим образованием пептидов.
4.2 Изучение белков, входящих в состав шиловидных структур оболочки вирусов
Конечно, описанная выше способность таких белков, как а-лак-тальбумин, облегчать слияние никак не связана с их физиологической ролью. Однако имеются белки, функция которых состоит именно в ускорении слияния мембран. Это гликопротеины шиловидных структур оболочки вирусов животных. Вирионы этих вирусов имеют бислойную липидную оболочку, с которой связаны вирус-специфические белки, опосредующие слияние вирусов с клеткой. Некоторые вирусы сливаются с плазматической мембраной, другие связываются с рецепторами на плазматической мембране и проникают в клетку путем эндоцитоза. Эти вирусы сливаются с мембраной эндоцитозных пузырьков только после закисления их содержимого.
Белки шипов выполняют две функции: 1) с их помощью вирусная частица прикрепляется к мембране животной клетки, обычно к гликопротеину или гликолипиду: 2) вероятно, они взаимодействуют непосредственно с мембраной клетки-мишени, так что мембраны вируса и клетки-хозяина приходят в тесный контакт и их слияние ускоряется. У некоторых вирусов функции прикрепления и ускорения слияния выполняют разные белки, а у других – один и тот же белок. В качестве примера можно привести В-белок вируса везикулярного стоматита и гемагглютинин вируса гриппа, участвующие в обоих процессах. Каждый из этих белков представляет собой гомотример, состоящий из трех идентичных субъединиц. Белки были очищены и встроены в липосомы, которые приобрели способность как к прикреплению, так и к слиянию. Способность к слиянию в обоих случаях проявлялась только при слабокислых условиях, которые соответствовали значению рН внутри эндоцитозных пузырьков. Эта способность, по-видимому, определялась небольшими сегментами белков, находящимися вблизи N конца. Синтетический пептид из 25 аминокислотных остатков, соответствующий N концевой последовательности В-белка вируса везикулярного стоматита, проявляет рН-зависимую гемолитическую активность, сходную с таковой самого вируса. Как соотносится это наблюдение со свойствами G белка, пока неясно.
Гемагглютинин вируса гриппа – наиболее полно охарактеризован ная гликопротеиновая структура
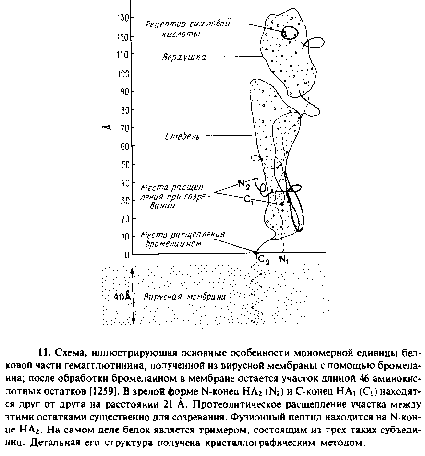
Этот белок связан с вирусной мембраной с помощью короткого трансмембранного домена на С-конце. Он синтезируется как единая полипептидная цепь, но при созревании претерпевает протеолитическое расщепление с образованием двух полипептидов, HAi и НА2, связанных дисульфидной связью. Участок, отвечающий за слияние, локализован на N конце НА2. Он соответствует N концу G белка вируса везикулярного стоматита.
С помощью рентгеновской кристаллографии была определена трехмерная структура водорастворимого домена гемагглютинина. Этот домен получают с помощью расщепления бромелаином. Он представляет собой трнмер из – субъединиц, напоминает по форме стержень и выступает из мембраны на 135 А. Каждая субъединица имеет а-спиральный «стебель» с глобулярной «верхушкой», которая содержит рецепторыый участок для сиалогликосоединений.
Гидрофобный фузионный пептид спрятан между субъединицами тримера и находится на расстоянии 30 А от поверхности мембраны. Как известно, при низких рН третичная и четвертичная структуры белка необратимо изменяются. При рН 5,0 белок приобретает способность связывать липиды и детергенты и самоагретируется, что позволяет думать об экспонировании гидрофобного домена. По-видимому, это коррелирует с экспонированием фузионного пептида, который теперь может связаться с мембраной-мишенью, способствуя сближению обеих мембран и облегчая их слияние. Были выделены и получены in vitro мутанты с другими рН-оптнмумом и фузноинымн свойствами. Это подтверждает важность контактирования субъединиц при рН-зависимом конформационном изменении структуры белка и роль фузионного пептида. Гемагглютинин ацилирован жирными кислотами, которые, по-видимому, усиливают фузионную активность.
Суммируя все сказанное выше, можно сделать вывод, что, хотя физико-химические механизмы слияния мембран до конца не установлены, очевидно, что специфическое слияние мембран внутри клетки может осуществляться с помощью некоего белокзависимого процесса. Для этого должно произойти специфическое межмембранное взаимодействие, обеспечивающее прикрепление мембран друг к другу, и должен присутствовать мембранный белок, который при необходимости обеспечивает слияние. Для изучения свойств таких белков можно использовать белки, образующие шиловидные структуры вирусных частиц. Но могут применяться и другие модельные системы. Вероятно, семейство таких белков участвует в слиянии мембран как при экзоцитозе, так и при эндоцитозе.
5. Рецепторные системы бактерий обладают некоторыми свойствами, присущими и высшим организмам
Во всех клеточных ответах участвуют системы передачи сигнала, которые преобразуют событие, происходящее вне клетки, – связывание лиганда с рецептором, – в сложный внутриклеточный ответ. Мы рассмотрим системы передачи сигналов у бактерий, а далее суммируем данные по таким системам у животных клеток.
Бактерии реагируют на изменение концентрации различных растворимых веществ в окружающей среде. Свободноплавающие бактерии, например Е. coli, обладают способностью к хемотаксису и при увеличении содержания в среде специфических питательных веществ перемещаются вверх по градиенту их концентрации, к источнику питания. В этом процессе участвуют рецепторы цитоплазматической мембраны, которые связываются с «привлекательным» для бактерии растворенным веществом и индуцируют серию событий в цитоплазме, приводящих к вращению жгутиков. Сходным образом клетки Е. coli реагируют на уменьшение концентрации фосфата или азота, синтезируя белки, которые придают клеткам способность «улавливать» эти компоненты из окружающей среды. В этом процессе также участвуют специфические рецепторы цитоплазматической мембраны.
Такие системы ответа активно изучались в первую очередь с помощью генетических и молекулярно-биологическнх методов. Данные по гомологии аминокислотных последовательностей позволили идентифицировать два семейства белковых рецепторов прокариот.
Рецепторы, участвующие в хемотаксисе и влияющие на вращение жгутиков.
Рецепторы, опосредующие ответы, которые влияют на аппарат транскрипции и активность генов.
Изученные типы рецепторов поражают своим сходством с рецепторами, характерными для клеток высших организмов.
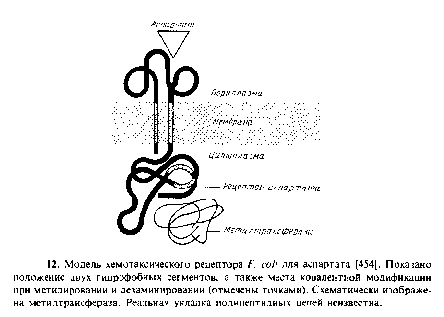
5.1 Рецепторы, ответственные за хемотаксис Е. coli
К этому семейству белков относятся четыре рецептора. Их часто считают продуктами четырех генов – tsr, tar, tap и trg. Например, Wr белок связывается с аттрактантом серином, а также опосредует хемотаксис в ответ на репеллент лейцин. Наиболее полно изучен рецептор для аспартата, который связывается с аттрактантом аспартатом, а также с мальтозосвяззывающим белком. Все четыре рецептора содержат единственную полипептидную цепь. Данные об их первичной структуре позволяют предположить, что это трансмембранные белки, которые имеют по две пронизывающие мембрану а-спирали. Характер укладки рецептора для аспартата, представленный на рис. 9.12, согласуется с результатами экспериментов по слиянию генов, а также с генетическими и биохимическими данными. Биохимические свойства рецептора для аспартата свидетельствуют о том, что он, по-видимому, представляет собой тетрамер. Все четыре хемотаксических белковых рецептора имеют высококонсервативные С-концевые половины, составляющие цитоплазматические домены; N концевые части, составляющие периплазматические домены, гораздо менее консервативны.
Рецептор для аспартата выполняет три разные функции.
1. Связывание аспартата, за которое ответствен N концевой домен, обращенный в периплазму. Белки с укороченным цитоплазматическим доменом тем не менее связываются с аспартатом нормально.
2. Передача сигнала, в которой участвуют аминокислотные остатки трансмембранных спиралей; об этом свидетельствуют результаты замещения лизина в положении 19 на аланин в первой трансмембранной спирали. Полученный мутантный рецептор связывает аспартат, но не индуцирует ответной реакции, что, вероятно, обусловлено изменением конформации белковой молекулы. Показано также, что рецептор может связываться с аспар-татом и с мальтозосвязывающим белком одновременно, при этом ответы усиливают друг друга. Природа конформацнонного изменения в рецепторе, индуцируемого связыванием лиганда, неизвестна, но, по-видимому, это изменение затрагивает значительную часть полипептида. Механизм, с помощью которого рецептор влияет на «мотор», приводящий в движение жгутики, также неизвестен; установлено только, что в нем участвует С-концевой домен рецептора и он может быть связан с фосфорилнрованием одного из других белковых компонентов системы.
3. Адаптация, которая заключается в том, что система способна реагировать на увеличение концентрации лишь непродолжительное время; через несколько минут рецептор десенсибилизуется, т. е. адаптируется к новой концентрации аттрактанта. Но затем рецептор вновь приобретает способность реагировать на дальнейшие изменения концентрации аттрактанта. Частично это связано с метилированием и деметилированием рецептора по нескольким глутаминовым остаткам, расположенным в цитоплазматическом домене. Адаптация отсутствует у рецепторов с укороченным С-концом; эта мутантная форма реагирует на аспартат в течение всего времени, пока последний находится в среде.
В ходе многочисленных экспериментов была продемонстрирована кажущаяся независимость функциональных доменов, расположенных на N- и С-концах белка. Такие белки обладали хемотаксической активностью по отношению к серину. Подобные конструкции наблюдались также у семейства рецепторов пептидных гормонов животных клеток.
Из всего сказанного можно сделать следующие выводы.
Существует семейство трансмембранных рецепторов с родственными последовательностями.
Наличие у рецепторов разных функций предполагает, что у них имеются разные структурные и функциональные домены.
И высшие, и низшие организмы обладают системой передачи сигнала, в которую вовлечены другие цитоплазматические белки, вероятно каким-то образом модифицирующиеся благодаря конформационному изменению, которое претерпевает рецептор при связывании лиганда.
Система адаптируется к сигналу, т. е. может отвечать на него лишь непродолжительное время. Это свойство присуще многим системам клеточного ответа; его называют также десенсибилизацией.
5.2 Рецепторы, участвующие в активации транскрипции
Это второе семейство рецепторов обнаружено у множества бактерий, которые отвечают на сигнал активацией транскрипции отдельных генов. Во всех случаях система имеет два белковых компонента: 1) сенсор, или рецептор, и 2) регулятор. Все рецепторы, по-видимому, имеют сходную структуру. Они содержат две трансмембранные спирали в N концевой половине молекулы. С-концевые последовательности представителей этого семейства, находящиеся на цитоплазматической стороне мембраны, в значительной степени гомологичны. Регуляторные белки, по-видимому, находятся в цитоплазме в растворимой форме. Вероятно, рецепторы каким-то образом модифицируют эти белки, и затем они прямо или косвенно активируют транскрипцию. Возможно, модификация состоит в фос-форилировании; об этом свидетельствуют данные, полученные при исследовании системы ответа на ограничение концентрации азота.
Рассмотрение семейства бактериальных рецепторов показывает, что на основе одной структурной идеи может быть получено соответствие между самыми разными лигандами и ответами на них. Об этом же свидетельствует и изучение некоторых рецепторов животных клеток. Система передачи сигнала в животных клетках в отличие от бактерий изучена весьма детально.
6. Передача сигналов в животных клетках
Животные клетки реагируют на самые разные вещества, содержащиеся во внешней среде. Первым шагом при этом всегда является связывание лиганда со специфическим рецептором на наружной поверхности плазматической мембраны. Связывание с лигандом инициирует каскад специфических для данных клетки и рецептора событий, которые весьма интенсивно и плодотворно изучаются. Быстрое накопление новых данных в этой области вскоре потребует привлечения новых подходов для их систематизации. Однако наиболее общие проблемы здесь уже вполне ясны, даже при том, что многие детали малоизучены или неизвестны. Мы ознакомимся с этими центральными вопросами и теми связанными с мембранами биохимическими явлениями, которые уже хорошо охарактеризованы.
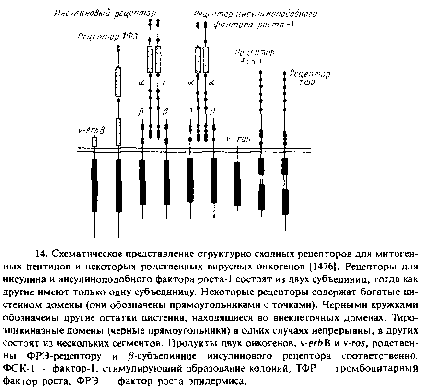
В табл. 1 перечислены рецепторы животных клеток, которые участвуют в передаче сигнала; многие из них были клонированы и была определена их первичная структура. Таблица составлена таким образом, чтобы подчеркнуть их структурное сходство. Большинство рецепторов, опосредующих передачу сигнала, связывают либо митогенные агенты, либо нейромедиаторы. К митогенным агентам относятся такие вещества, как ФРЭ, пептидные гормоны и регуляторные пептиды. Эти соединения регулируют рост клеток при различных условиях, в частности при эмбриогенезе, созревании клеток или их пролиферации, которая является частью иммунного ответа. К нейромедиаторам относятся адреналин, норадреналин, ацетилхолин, глицин и множество других малых молекул, участвующих в клеточном ответе.
Было бы полезно сказать еще несколько слов о классификации рецепторов, особенно рецепторов нейромедиаторов. В основе названий и классификаций этих рецепторов лежит их способность отвечать на различные агонисты и антагонисты, а также их физиологические функции и локализация. Однако тот факт, что имеются рецепторы, отвечающие на один и тот же агонист, означает, что классификация, основанная на свойствах и локализации, не может использоваться для разграничения рецепторных белков. Например, адренергические рецепторы, специфически связывающие катехоламиновые агонисты, такие, как норадреналин и адреналин, были сначала подразделены на типы а и 13 и далее на подтипы а, аг, 0\ и ft – Были выделены соответствующие рецепторные белки, правда, не все они строго вписывались в рамки классификации по фармакологическим признакам. Аналогичным образом по фармакологическим признакам были выделены два класса мускариновых холинергических рецепторов и идентифицированы по крайней мере четыре клонированных гена. Они отличались от никотинового ацетилхолинового рецептора по специфическому ответу на лекарственные препараты. Существуют также многочисленные классы рецепторов для гистамнна, дофамина, опиатов и других агонистов. Можно ожидать, что в будущем благодаря применению биохимических методов и методов молекулярного клонирования удастся идентифицировать разные рецепторные белки и установить механизмы клеточного ответа. Это позволит по-новому подойти к классификации рецепторов, основанной на их фармакологических свойствах.
6.1 Первичный ответ и семейства рецепторов
Лиганд, связываясь с рецептором, должен индуцировать в нем конформационный переход, приводящий к функциональным изменениям в других частях молекулы. Природа такого перехода абсолютно неизвестна. Установлено лишь, что по крайней мере в IgE рецепторе с высоким сродством связывание лиганда индуцирует агрегацию рецептора в плоскости мембраны, однако нет никаких указаний на то, что это характерно для всех передающих сигнал рецепторов. Хотя структурные детали гормонов или нейромедиаторов остаются неизвестными, их важные функциональные особенности сейчас более или менее ясны. При связывании агониста происходят следующие три события.
Связывание агониста индуцирует открывание канала, образуемого рецептором. Примерами могут служить никотиновый ацетил-холииовый рецептор, рецептор 7 амнномасляной кислоты и глициновый рецептор. Все это рецепторы нейромедиаторов, которые структурно объединены в малое суперсемейство. На основании данных о первичной структуре этих рецепторов / ионных каналов для каждого полипептида была построена модель с четырьмя трансмембранными сегментами, однако экспериментальные исследования топологии nAChR еще не закончены.
При связывании лиганда активируется тирозиновая протеин-киназа, представляющая собой цитоплазматический домен рецептора. Обычно сам рецептор и является мишенью, но данные о том, какие именно белки фосфорилируются и как они влияют на клетку, практически отсутствуют. Этот механизм используют рецепторы митогенных пептидных гормонов и факторов роста, причем многие из этих рецепторов структурно родственны между собой. Каждый из этих рецепторных полипептидов имеет по одному трансмембранному сегменту.
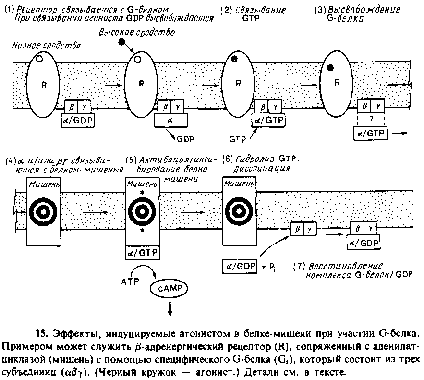
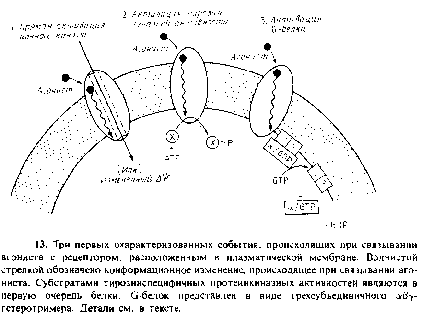
3. Рецептор образует комплекс с одной из групп мембраносвязанных GTP связывающих белков, называемых G белками. При связывании лиганда с рецептором в комплексе peuenTop/G белок происходит конформационное изменение, в результате чего облегчается обмен связанного GDP и GTP на G белке.
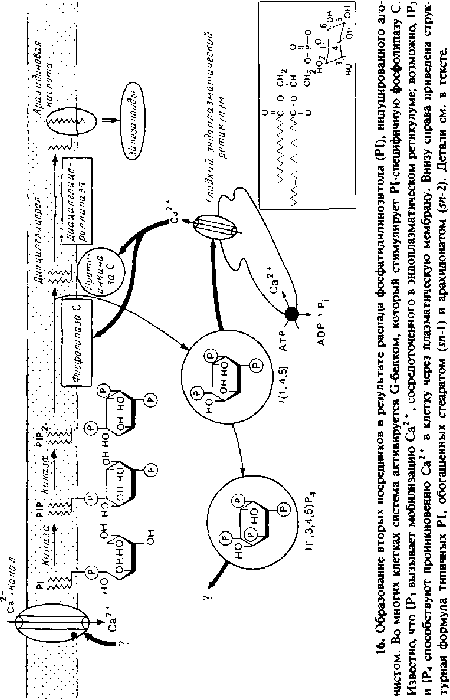
Последовательность происходящих событий изображена на рис. 9.15. G белок активируется на короткое время, будучи связанным с GTP, и в этом состоянии может отделиться от рецептора, причем одна или больше субъединиц G белка могут связаться с другими мембранными белками, обозначенными на рис. 9.15 словом «мишень», оказывая на них определенное воздействие. К этим мишеням относятся ионные каналы, аденилатциклаза, cGMP/фосфодиэстераза и фосфолипаза С.
Принадлежат также /З-адренергические рецепторы, мускариновые ацетилхолиновые рецепторы и опсины. Каждый из этих рецепторов имеет семь трансмембранных сегментов. На рис. 4.1 показана предполагаемая структура родопсина – наиболее полно охарактеризованного представителя этой группы.
6.2 G белки
Гуаниннуклеотидсвязывающие регуляторные белки, или G белки, ответственны за передачу сигналов множества гормонов или нейромедиаторов к разнообразным мишеням клетки. Соответствующие примеры приведены в табл. 9.3. Четыре G белка были очищены до гомогенного состояния и биохимически охарактеризованы: d, Gs, Gi и G0. Оказалось, что каждый из них имеет уникальные мишени или эффекторные белки. Gt активирует cGMP специфичную фосфодиэстеразу в наружных сегментах палочек сетчатки; Gs и Gi соответственно стимулируют и ингибируют аденилатциклазу и присутствуют во всех клетках; G0 представлен в большом количестве в клетках мозга и, по-видимому, ингибирует электрочувствительный Са2 +-канал в нейронах. Кроме того, почти несомненно имеются и другие, пока не выделенные G клетки. G белок Gp, вероятно, использует в качестве мишени фосфатидилинозитолспецифичную фосфолипазу С, которая инициирует быстрый распад фосфатидилинозитола в плазматической мембране и образование нескольких вторых посредников. Существует также G белок, обозначаемый Gp, выделенный из мембран плаценты человека, однако его функция неизвестна. Другой G белок, GK, по-видимому, открывает К+-специфичные каналы в сердечной мышце и других клетках; G белки участвуют также в регуляции экзоцитоза. В некоторых случаях какой-то один G белок внутри клетки может отвечать на связывание лиганда с одним из нескольких разных рецепторов. Такая ситуация скорее всего имеет место, например, для белка Gk из клеток ганглия Aplysia. Кроме того, G белки могут иметь больше одной мишени. В качестве примера можно привести белок Gt, который активирует как cGMP фосфоднэстеразу, так и фосфолипазу А2 в наружных сегментах палочек сетчатки быка. По-видимому, в этих процессах активации участвуют различные субъединицы Gt.
Все четыре выделенных белка являются а-гетеротримерами. Биохимический анализ и анализ последовательности кДНК указывают на значительное различие между субъединицами, на существование по меньшей мере двух разных /З-субъединиц, а также на различия между 7 субъединицами. а-Субъединицы связывают GDP и обладают ОТРазной активностью при отсоединении от /37 субъединич-ной пары. а-Субъединица также содержит сайт, по которому может происходить ADP рибозилирование бактериальными экзотоксинами. Gi, G0 и Gt модифицируются коклюшным токсином, a Gs и Gt – холерным токсином. Эта ковалентная модификация блокирует фосфорилирование G белка и служит одним из тестов на участие G белков в качестве интермедиатов в клеточных ответах. Заметим, что модификации холерным и коклюшным токсинами оказывают существенно разные эффекты. Модификация холерным токсином приводит к непрерывной активации Gs в присутствии АТР, а коклюшный разъединяет Gi, G0, Gt и рецептор, необходимый для их активации.
G белки могут стимулироваться в отсутствие гормона при добавлении в цитозоль негидролизуемого аналога GTP – GTP7S, который связывается а-субъединицей. Это служит вторым тестом на участие G белков в физиологическом ответе. Стимулировать G белок может и добавление фторида; по-видимому, при этом образуется фторалюминатный комплекс со следовыми количествами алюминия. Этот ион, A14, связывается с комплексом G белок/ GDP и активирует его, по-видимому, так же, как аналог 7 фосфата GTP.
Все G белки прочно связаны с плазматической мембраной, за исключением трансдуцина, который in vitro может легко отсоединяться от мембраны. По крайней мере в двух случаях – для Gi и Go – было показано, что для прочного прикрепления а-субъединиц к мембране необходимо присутствие 07 пары. Ни одна из субъединиц не является трансмембранным белком. Однако по меньшей мере в некоторых случаях а-субъединица ацилирована и может присоединяться к мембране с помощью ковалентно связанной жирной кислоты. Присоединение к рецептору гормона или нейромедиатора ускоряет быстрый обмен GDP, связанного с а-субъединицей, с GTP. G белок отсоединяется от рецептора, и в конечном счете а-субъединица отсоединяется от /37 пары. G белок или отсоединившиеся а-либо /37 субъединицы диффундируют в плоскости мембраны или через цитоплазму к мишени. Способы связывания субъединиц G белка с мембраной и с их партнерами-мишенями или рецептором точно не известны. Однако установлено, что после отсоединения а- и 07 субъединицы могут обладать разными функциями; так, в случае трансдуцина-а был выделен из родопсинсвязан-ной системы, где он присутствует в относительном избытке. Установлено, что G белки повсеместно используются для передачи информации о том, что рецептор занят, на специфическую внутриклеточную систему амплификации сигнала. По-видимому, в будущем будут обнаружены другие G белки и достигнуты новые успехи в определении их специфичности, особенно в случае, когда одна клетка содержит разные G белки.
6.3 Обновление фосфатидилинозитола и вторые посредники
Наиболее широкораспространенными мишенями G белков являются аденилатциклаза и фосфолипаза С, ответственная за гидролиз фосфатидилинозитола. Модуляция адени-латциклазы приводит к изменению внутриклеточной концентрации сАМР, который, как известно, служит вторым посредником, влияя на множество внутриклеточных процессов. Одним нз последствий увеличения содержания сАМР является, например, стимуляция сАМР-зависимой протеинкиназы, которая в свою очередь фосфорилирует специфические белковые субстраты. Клетки содержат также два типа Са2 + – зависимых протеннки-наз, активируемых соответственно Са2 +-кальмодулином и Са2 + вместе с диацилглицеролом и фосфатидилсерином. Активность обеих этих кии аз регулируется вторыми посредниками, образующимися при деградации фосфатидилинозитола, которая во многих клетках инициируется путем G белокзависимой активации специфической фосфолипазы С. Установление механизма обновления фосфатидилинозитола и физиологической роли продуктов его деградации явилось главным достижением в выяснении роли гормонов и нейромедиаторов в осуществлении клетками их функций.
На долю фосфатидилинозитола приходится лишь 2–8% всех фосфолипидов, содержащихся в клеточных мембранах эукариот. Структура его полярной головки представлена на рис. 9.16. Этот стереоизомер называют миоинозитолом, поскольку впервые он был выделен из мышц. Небольшая часть фосфатидилинозитола фосфорилирована по положению 4 или по положениям 4 и 5. От 1 до 10% фосфатидилинозитола, присутствующего в мембране, приходится на долю фосфатидилинози-толбисфосфата, обозначаемого как PIP2 или Р1Р2. Этот компонент является, вероятно, первой мишенью для фосфатидили-нозитолспецифичной фосфолипазы С, которая активируется во многих клетках G белком. Последующий гидролиз приводит к быстрому распаду фосфатидилинозитола в плазматической мембране и кратковременному возрастанию количества продуктов распада. Например, во время активации тромбоцитов за 90 с деградирует половина общего пула фосфатидилинозитола. Продукты распада действуют как вторые посредники и участвуют во многих клеточных процессах. Исследование этой системы еще не закончено, но общая ее схема уже построена и представлена на рис. 9.16. Последовательность событий такова.
Начальными продуктами гидролиза PIP2 являются диацил-глицерол и ииозитолтрисфосфат. Диацилглицерол связан с мембраной, а 1Рз является растворимым компонентом. Обычно жирные кислоты фосфатидилинозитола представлены стеариновой кислотой в положении 1 и арахидоновой кислотой в положении 2 глицерола. Из мозга быка были выделены две разные фосфатидилииозитолспецифичные фосфолипазы С, но данные об их активации G белком in vitro отсутствуют.
1Рз служит вторым посредником, и его основной функцией, по-видимому, является мобилизация Са2 +, аккумулированного в эидоплазматическом ретикулуме. Возможно, этот компонент путем прямого связывания открывает Са2 + – специфичные каналы в эидоплазматическом ретикулуме, что приводит к увеличению концентрации Са2 + в цитоплазме в несколько раз. Обычно концентрация свободного Са2+ в цитоплазме составляет 0,1 мкМ.
3. Специфическая кии аза превращает некоторое количество 1Рз в тетрафосфорилированный продукт 1Р4. Образуются также другие, в том числе циклические, фосфоинозитиды, и некоторые из них тоже имеют физиологическое значение.
4. Одним из ферментов, регулируемых Са2 +, является фосфолипаза С, которая при низкой концентрации Са2+ использует в качестве субстрата преимущественно PIP2, но при более высокой концентрации Са 2 +, по крайней мере in vitro, использует нефосфорилированиый фосфатидилинозитол. Возможно, это облегчает непосредственный быстрый гидролиз основной части фосфатидилинозитола, но так ли это – неясно.
Наиболее важным ферментом, активируемым Са2 +, является протеинкиназа С. Этот фермент локализован преимущественно в цитозоле до момента появления там диацилглице-рола и Са2 +. Затем в зависимости от присутствия фосфатидилсери-на он связывается с плазматической мембраной и активируется. Эффекты, сходные с действием диацилглицерола, оказывают форболовые эфиры, и протеинкиназу С часто рассматривают как рецептор этих соединений. Одним из признаков участия протеинкиназы С и фосфоинозитидной системы в клеточном ответе на присутствие агониста является дублирование эффектов агониста путем добавления форболовых эфиров, которые непосредственно активируют протеинкиназу С.
В активированном состоянии протеинкиназа С является серини треонинспецнфичной протеинкиназой, которая фосфорилирует как специфические мишени, так и саму себя. Природа такой субстратной специфичности и физиологические последствия фосфори-лирования белков точно не известны. Однако с помощью молекулярного клонирования удалось установить, что существует семейство протиеинкиназ С. Возможно, оии обладают разной специфичностью, как и семейство G белков.
Механизм регуляции работы протеинкиназы С неизвестен; установлено лишь, что ганглиозиды и лизосфннголипиды ин-гибируют этот фермент, а кроме того, выделен его ингибитор белковой природы.
Диацилглицерол может подвергаться дальнейшей деградации под действием диацилглицероллипазы до арахидоновой кислоты, которая окисляется до множества биологически активных метаболитов, называемых эйкозаноидами и включающих простагландины. Хотя арахидоновая кислота сама является вторым посредником, неясно, насколько существен для ее образования фосфатидилинозитолспецифичный, зависимый от фосфолипазы С путь. С другой стороны, арахидоновая кислота может образовываться из множества фосфолипидов при действии фосфолипазы А2. В нескольких типах клеток путь биосинтеза с участием фосфолипазы Аг более важен.
Итак, суммируя сказанное выше, можно утверждать, что при функционировании рассмотренной сложной системы образуются по меньшей мере три известных вторых посредника: диацилглицерол, 1Рз и арахидоновая кислота. Каждый из них выполняет специфические функции, включая увеличение содержания внутриклеточного Са2 + н активацию Са2 + – зависимых протеинкинаэ. Эта система распространена весьма широко, но детали механизма воздействия с ее помощью на специфические клеточные функции пока неясны.
6.4 Фосфорилирование рецепторов и десенсибилизация
Физиологический ответ на действие гормона или нейромедиатора обычно является кратковременным даже при постоянном присутствии агониста. Это явление называется десенсибилизацией и характерно для многих систем ответа как у эукариот, так и у прокариот. Десенсибилизация системы хемотаксиса Е. coli частично обусловлена ковалентной модификацией рецепторов путем метилирования. В животных клетках решающую роль в десенсибилизации играет фосфорилирование рецепторов.
Индуцируемая лигандом десенсибилизация может рассматриваться в двух вариантах. Гомологичная десенсибилизация происходит тогда, когда ослабляется ответ на специфический агонист, но ответ на другие агоиисты, действующие через разные рецепторы, остается без изменения. Гетерологичная десенсибилизация наблюдается в случае, когда применение одного агониста ослабляет ответ клетки на многочисленные агонисты, действующие через различные рецепторы. В обоих случаях происходит фосфорилирование в основном рецепторных белков. В этих реакциях участвуют две киназы – протеинкиназа С и сАМР-зависимая протеинкинаэа, называемая также протеинкиназой А. Кроме того, рецепторы могут модифицироваться под действием рецепторспецифичных киназ; протекают также реакции аутофосфорилирования, катализируемые теми рецепторами, которые представляют собой тирозиновые протеинкиназы.
В основе гетерологичной десенсибилизации лежит классическая регуляция по типу обратной связи. Агонисты, стимулирующие аденилатциклазы, активируют протеинкиназу А, которая в свою очередь фосфорилирует рецептор и вызывает его десенсибилизацию. Например, фосфорилированный /3 адренергический рецептор обладает меньшей способностью активировать Gs белок. Аналогичным образом агонисты, стимулирующие фосфатидилинозитольную систему, активируют протеинкиназу С, которая фосфорилирует рецептор и ослабляет ответ. В качестве примера можно привести а 1 – адренергический рецептор. Не исключено также, что рецепторы, связанные с фосфатидилинозитольной системой, модулируются протеинкиназой А, стимулированной сАМР. Примером такого рода является мускариновый ацетилхолиновый рецептор.
Гомологичная десенсибилизация была описана для /3 адренергических рецепторов и включает фосфорилирование рецепторов с помощью рецепторспецифичной киназы. Эта киназа фосфорилирует только комплекс рецептор / агонист, в результате чего происходит интерн ал изация фосфорил ированного рецептора путем эндоцитоза. В эндоцитозных везикулах находится фосфатаза, которая отщепляет фосфатную группу и регенерирует активную форму рецептора, возвращающегося к плазматической мембране. Аналогичная киназа была описана для «светового» рецептора родопсина, где субстратом является его обесцвеченная форма.
Одним из сигналов для интериализации рецепторов может быть фосфорилирование по специфичным сайтам. Например, фосфорилирование рецептора ФРЭ протеинкиназой С приводит к его интериализации. Этот процесс блокируется замещением остатка специфичного треонина на остаток аланина с помощью сайт-специфического мутагенеза. Однако ФРЭ-стимулируемая интерна-лизация рецептора не прекращается, что указывает на множественность сигналов интериализации. Как мы уже говорили, форболо-вые эфиры вызывают фосфорилирование н интернализацию транс-ферринового рецептора.
Интернализация не является единственным механизмом, с помощью которого фосфорилирование ослабляет рецепториый ответ. Активность рецептора, локализованного в плазматической мембране, тоже может регулироваться. Например, фосфорилированный рецептор ФРЭ обладает меньшей тирозинкиназной активностью, а также меньшим сродством к агонисту ФРЭ. Фосфорилированный мускариновый ацетилхолиновый рецептор также дезактивируется в плазматической мембране.
Реакции аутофосфорилирования рецепторов, обладающих тирозинкииазиой активностью, как правило, являются стимуляторными.
Это было показано для инсулинового рецептора, при аутофосфорилировании которого увеличивалась его способность фосфорилировать другие белки, а рецепторная активность становилась независимой от инсулина. С помощью мутагенеза было показано участие в регуляции этих эффектов специфических остатков тирозина, локализованных в цитоплазматическом домене /З-субъединицы.
6.5 Некоторые рецепторы, принимающие участие в передаче сигналов в животных клетках
Мы остановимся на некоторых наиболее важных особенностях трех типичных систем передачи сигнала в животных клетках. Эти системы относительно хорошо изучены и иллюстрируют интересные особенности механизма ответа животных клеток на внешние раздражители. Основной особенностью является то, что центральную роль в изменении ионных токов играют протеин-киназы.
Рецептор фактора роста эпидермиса
Фактор роста эпидермиса является сильнодействующим митогенным белком, который связывается со специфическим рецептором, находящимся на поверхности различных эпителиальных, эпидермальных и фибробластных клеток. Рецептор представляет собой один гликозилированный полипептид с мол. массой около 170 кДа и относится к семейству митогенных рецепторов. Его N концевая часть расположена вне клетки и является ФРЭ-связывающим доменом. Рецептор имеет единственный мембранный сегмент и большой внутриклеточный домен, обладающий тирозинкиназной активностью. ФРЭ-рецептор, как и другие рецепторные белки, содержит внеклеточные домены, богатые цистеином, но их функция неизвестна.
ФРЭ-рецептор находится на плазматической мембране в высокоаффинной и низкоаффинной формах. Возможно, это связано с существованием в мембране различных состояний ассоциации этого белка. Показано, что связывание с ФРЭ стабилизирует димерную форму очищенного рецептора в детергенте; это указывает на важность агрегации рецептора для передачи сигнала. Биохимические исследования показывают, что связывание с ФРЭ индуцирует тирозинкиназную активность, в частности аутофосфорилирование рецептора, по нескольким остаткам тирозина в цитоплазматическом домене. Как связаны между собой киназная активность и клеточный ответ, неясно. В некоторых типах клеток существует какой-то независимый механизм, с помощью которого ФРЭ влияет на фосфатидилинозитольную систему, возможно, путем стимулирования фермента, фосфорилирующего фосфатндилинозитол с образованием монофосфорилированного производного.
Рецептор ФРЭ фос-форилируется протеинкиназой С, которая десенсибилизирует рецептор и индуцирует его поглощение путем эндоцитоза. Одним из ранних событий, связанных с ФРЭ-стимуляцией клеток, является активация Na + /H +-антипортера в плазматической мембране. Это приводит к замене внутриклеточного Н+ на внеклеточный Na+ и к незначительному повышению рН. Это ранний ответ на многие митогенные агенты, и изменения рН может быть достаточно для индукции активности других клеточных ферментов. Митогенный ответ, т. е. индукция синтеза ДНК, является длительным ответом, требующим присутствия ФРЭ во внешней среде в течение нескольких часов. Механизм этого явления остается непонятным.
ФРЭ-рецептор поглощается путем рецепторзависимого эндоцитоза. Исходно рецепторы распределены в плазматической мембране случайным образом, но при связывании ФРЭ комплекс рецептор/ФРЭ концентрируется в окаймленных ямках, поглощается и попадает в лизосому, где происходит его деградация. Это очищает поверхность с эффективностью примерно 80% рецепторов за 20 мин. Латеральная подвижность рецептора, измеренная с помощью метода FRAP, составила 1,5–10~ 10 см2-с * ', что указывает на существование каких-то препятствий при его латеральном движении. Мутанты, у которых отсутствует большая часть цитоплазматического домена, тоже диффундируют медленно, из чего следует, что этот домен не связан с с уменьшением латеральной подвижности. Возможно, для этого важны взаимодействия с компонентами внеклеточного матрикса. Однако цитоплазматический домен необходим для эндоцитоза, как и у других рецепторов. Делеция 63 аминокислотных остатков с С-конца приводит к потере рецептором сайта аутофос-форилирования и высокого сродства к ФРЭ. Тем не менее, этот рецептор остается способным к эндоцитозу и обладает митогенными свойствами.
Мутагенез очень полезен для выяснения механизма функционирования рецепторов, но важным фактором, который пока не удалось выяснить, является степень ассоциации рецептора в мембране. Это особенно интересно для тех рецепторов, которые имеют единственный спиральный трансмембранный сегмент, с точки зрения передачи конформационного изменения во внеклеточном агонист-связывающем домене к внутриклеточному тирозинкнназному домену через единственную спираль. Вряд ли связывание ФРЭ изменяет геометрию спирали; спираль не может также «скользить» вдоль другой спирали внутри трансмембранного домена, если рецептор имеет один трансмембранный сегмент. Возможно, связывание ФРЭ изменяет белково-липидные взаимодействия, благодаря которым спираль может проталкиваться через бислой. Другая возможность – изменение степени агрегации рецепторов при связывании с ФРЭ; об этом свидетельствует изучение выделенных белков.
d Адренвргический рецептор
Многие важные особенности /9 адренергических рецепторов мы уже обсуждали. Несколько таких рецепторов было клонировано; при этом было показано, что они структурно сходны с семейством опсинов, в том числе родопсином, и с мускарииовыми холинергическими рецепторами. По-видимому, все эти белки имеют по семь трансмембранных спиралей; экспериментальное подтверждение этому было получено для родопсина. Консервативные остатки этих рецепторов локализованы главным образом в гидрофобных областях, а не в гидрофильных петлях, соединяющих трансмембранные сегменты. Среди этих консервативных остатков в трансмембранных сегментах находится несколько полярных остатков. Заметим, что эти белки негомологичны бактериоро-сопсину.
Ретинальсвязывающий сайт родопсина находится в гидрофобном ядре, образуя шнффово основание с остатком лизина в спирали VII. Было бы заманчиво предположить, что агонистсвязывающий сайт в /3 адренергическом рецепторе также локализован в гидрофобном ядре. Для проверки этого предположения был проведен сайт-специфический мутагенез /3 адренергического рецептора хомяка. Полученные результаты свидетельствуют о том, что гидрофильные петли несущественны для связывания агониста или антагониста, а также показывают, что для связывания агониста необходим остаток аспартата в положении 113, находящийся в спирали III. Не являются неожиданностью полученные в этих работах данные о том, что, вероятно, гидрофильная петля участвует во взаимодействии с G белком.
lgE рвцептор мастоцитов и базофилов
Мастоциты и базофилы содержат секреторные гранулы, наполненные гистамином. При соответствующей стимуляции эти экзоци-озные везикулы сливаются с плазматической мембраной и высвобождают запасенный гистамин. Показано, что этот процесс запускается агрегацией IgE рецепторов клеточной поверхности, которая индуцируется связыванием либо с IgE, либо с другими лиган-дами, сшивающими рецепторы. IgE система представляет особенный интерес, поскольку для нее действительно показана роль агрегации рецепторов в передаче сигнала, а кроме того, она является примером системы, связанной с деградацией фосфатидилинозитола, которая инициируется G белком.
IgE рецептор представляет собой а/372 тетрамер; он был очищен, а ген а-субъединицы – клонирован и секвенирован. Эта субъединица гомологична Fc рецептору IgG, который относится к иммуноглобулиновому суперсемейству. В отсутствие сшивающего лиганда IgE рецепторы распределены в мембране равномерно и обладают ограниченной подвижностью. Каждый рецептор может связать одну молекулу IgE, и ответ возникает только под действием мультимерных форм IgE, которые способны связывать несколько рецепторов одновременно. Олигомеры, содержащие лишь несколько молекул IgE, вызывают быструю иммобилизацию рецепторных кластеров, которая, по-видимому, осуществляется благодаря последовательным взаимодействиям с элементами цитоскелета и не может определяться простой гидродинамикой. В результате всех этих событий запускается клеточный ответ, при котором образуются фосфоинози-тиды и арахидоновая кислота, мобилизация Са2+ и секреция гистамина. Этот ответ ингибируется коклюшным токсином, по-видимому, при участии G белка.
7. Онкогены и передача сигнала
Рецепторы и механизм передачи сигнала играют существенную роль в регуляции клеточного роста и дифференцировки. Те же факторы, как показывают молекулярно-генетические исследования, участвуют в процессах перерождения опухолей. Наилучшими экспериментальными моделями явились онкогены ретровирусов. Было показано, что за опухолевую трансформацию инфицированных клеток отвечают 20 разных ретровирусных генов, называемых онкогенами. Эти онкогены в большинстве случаев имеют клеточные аналоги. Например, белок, кодируемый вирусным онкогеном v-erbB, является укороченным вариантом ФРЭ-рецептора. В этом случае вирусный онкоген родствен клеточному гену, кодирующему ФРЭ-рецептор. Такие клеточные гены называются протоонкогенами. Используя способность онкогенов трансформировать клетки в культуре, удалось выделить их также из ДНК опухолевых клеток. Онкогены появляются в результате генетических повреждений в протоонкогенах. Около половины протоонкогенов, идентифицированных по гомологии с вирусными онкогенами, тоже были выявлены при изучении опухолей. Однозначной корреляции между видом онкогена и возникающей опухолью или характером нарушения функционирования клетки не обнаружено. Существует гипотеза, что протоонкогены кодируют белки, которые участвуют в передаче сигнала, опосредуемой мембранами, или являются мишенями для вторых посредников.
Продукты некоторых идентифицированных онкогенов обладают тирозинспецифичной протеинкиназной активностью и являются аналогами мембранных рецепторов для митогенных пептидов и гормонов роста. Сверхэкспрессия онкогена, изменение специфичности для белковых субстратов или изменение регуляции активности могут приводить к патологии. Протоонкоген может превратиться в онкоген в результате простых точечных мутаций. Продукты не всех онкогенов, обладающие тирозинкиназной активностью, являются трансмембранными белками, некоторые из них представляют собой периферические мембранные белки.
Онкогенные белки типа v-res гомологичны а-субъединице G белков. Соответствующие гены представляют собой модификации гена, кодирующего G белок, который стимулирует фосфатидилинозитольную систему. Показано, что введение этих онкогенов в геном приводит к повышению уровня диацилглицерола, хотя содержание растворимых фосфоинозитидов при этом не увеличивается. Как это связано с трансформацией – неизвестно. Отметим, что форболовые эфиры ускоряют образование опухолей, и эта функция, вероятно, связана с активацией протеинкиназы С.
Наиболее существенно то, что нарушение аппарата передачи сигнала может индуцировать рак. Изучение этой закономерности может оказаться полезным не только для установления механизмов возникновения опухолей, но и для выявления сложной сети взаимодействий в системе передачи сигнала, ответственной за нормальную клеточную пролиферацию и дифференцировку.
Резюме
Взаимодействия клетки с ее окружением осуществляются при участии рецепторов, расположенных на ее поверхности. Функции этих рецепторов существенно различаются. Одни из них определяют адгезивные свойства клеток по отношению к другим клеткам или компонентам внеклеточного матрикса. Другие участвуют в системах сигнал / ответ или в импорте макромолекул в цитоплазму.
Сравнение аминокислотной последовательности рецепторов показывает, что многие из них могут быть сгруппированы в суперсемейства структурно родственных, но функционально различающихся белков. Например, многие рецепторы, участвующие в межклеточной адгезии, принадлежат к суперсемейству иммуноглобулинов IgG. Интегрины составляют другое суперсемейство, включающее в себя множество рецепторов для внеклеточных компонентов матрикса.
Рецептор, который связывается с таким внеклеточным лигандом, как гормон или нейромеднатор, и опосредует клеточный ответ, осуществляет это одним из нескольких способов. В одних случаях рецептор сам является протеинкиназой, а в других он образует ионный канал. Связывание лиганда с внеклеточным участком рецептора изменяет эти функции, инициируя каскад событий в цитоплазме. В других случаях рецептор связывается с гуанидиннуклео-тидсвязывающим белком и активирует его в цитоплазме в ответ на внешний сигнал. G белок влияет на другие клеточные процессы, такие, как деградация фосфатидилинозитола в клеточной плазматической мембране. Рецепторы, которые взаимодействуют с G белками, образуют одно из нескольких суперсемейств рецепторов, участвующих в системах сигнал / ответ.
Важно помнить, что поверхность животной клетки очень динамична и плазматическая мембрана участвует в удивительном явлении, называемом рециклированием мембран. Внутриклеточные везикулы постоянно сливаются с плазматической мембраной, а участки плазматической мембраны в свою очередь отшнуровываются с образованием внутриклеточных везикул. Эти процессы составляют часть эндоцитозного и экзоцитозного путей.

Нравится материал? Поддержи автора!
Ещё документы из категории биология:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ