Мукозный иммунитет
 Оглавление
Оглавление
1. Лимфоидная ткань слизистых оболочек
1.1 Групповые лимфоидные фолликулы
1.2 Червеподобный отросток
1.3 Небные миндалины
1.4 Лимфоидные клетки слизистых оболочек
2. Механизмы, регулирующие образование в слизистых оболочках плазматических клеток, которые продуцируют IgA
2.1 Регуляция процесса переключения классов
2.2 Регуляция пролиферации и дифференциации В-лимфоцитов
3. Иммунный ответ в слизистых оболочках
4. Мукозные вакцины
Выводы
Литература
Введение
Человеческий организм обладает множеством неспецифических и специфических механизмов, которые защищают слизистую внешне. Доминирующую роль в этом выполняет система иммунитета, связанная со слизистыми оболочками. Концепция общего иммунитета слизистых оболочек была сформулирована в конце семидесятых годов Bienenstock и сотрудниками.
Морфологической составной этой системы являются разбросанные в слизистой и подслизистой оболочках совокупность лимфатических фолликулов и одиночные лимфатические фолликулы, совокупность которых называют лимфатической тканью, связанной со слизистыми оболочками (mucosal-associated lymphoid tissue - MALT), а также одиночные лимфоциты. MALT охватывает лимфатическую ткань слизистой и подслизистой оболочек желудочно-кишечного тракта, особенно хорошо развита в кишечнике (gut-associated lymphoid tissue - GALT), конгломераты лимфатической ткани в дыхательных путях на уровне бронхов (bronchus - associated lymphoid tissue - BALT), а также лимфатическую ткань молочных, слезных, слюнных желез и, желез связанных с мочеполовой системой. К MALT относится также лимфатическая ткань носа и горла, которая хорошо развита у человека, но неодинаково у разных видов животных [5].
Многочисленные исследования показали, что индукция системного иммунного ответа в результате инъекционной иммунизации может эффективно предотвращать системные инфекции, но при этом не защищает слизистые. Таким образом, для эффективной их защиты необходимо осуществлять их местную иммунизацию. Существует несколько способов мукозной иммунизации вместо парентеральной доставки вакцины. Наиболее важными и признанными являются методы без инъекций, например оральная и аэрозольная иммунизация.
Существует несколько факторов, которые следует принимать во внимание для достижения успешной мукозной иммунизации:
эффективная доставка антигена в индуктивный сайт мукозной иммунной системы;
усиление иммунного ответа с помощью адъювантов;
выбор схемы и способа иммунизации, которые обеспечат индукцию защитного местного и системного ответов;
выбор подходящею состава для вакцины при оптимизации схемы иммунизации
Самые различные системы доставки, содержащие микрочастицы, липидные структуры, ослабленные бактерии или вирусы, в настоящее время используются для разработки вакцин [1].
1. Лимфоидная ткань слизистых оболочек
Лимфоидная ткань слизистых оболочек состоит из двух компонентов: отдельных лимфоидных клеток, которые диффузно инфильтруют стенки пищеварительного канала, бронхолегочного и мочеполового путей и локализованных в них структурных лимфоидных образований. Последние обычно и определяют как ассоциированную со слизистыми оболочками лимфоидную ткань - MALT (mucosal associated lymphoid tissue).
Структурированные лимфоидные образования бывают конституционными, как, например, в кишках, или же образуются в постнатальном периоде в очагах активации клеток под влиянием цитокинов в случае микробной агрессии или чрезмерной (аллергической) реакции, как это наблюдается в дыхательных и мочеполовых путях. Интересно, что частота постнатального формирования фоликулоподобных лимфоидных структур существенно отличается от разных видов. Так, в бронхах они определяются в 100% случаев у кроликов и крыс, а у здоровых котов полностью отсутствует. У здоровых людей такие структуры выявляются с разной частотой в зависимости от возраста: в бронхах особей в возрасте до 20 лет - в 40% случаев, а после 20 лет - только в определенных случаях; в верхних дыхательных путях эти показатели выше и составляют соответственно 80 и 56%.
Лимфоидная ткань слизистых оболочек, функционально связана с локализованными в них антиген презентующими (преимущественно дендритными) и эпителиальными клетками, огромный по объему отдел иммунной системы, который занимает площадь 400 м2 и составляет больше половины лимфоидной ткани всего организма. Эта ткань формирует достаточно мощный барьер, который защищает организм от чужеродных агентов, которые попадают через слизистые оболочки.
В каждом отделе лимфоидной ткани слизистых оболочек условно выделяют индуктивные и эффекторные участки в зависимости от участия их в процессе реализации иммунного ответа. К индуктивным участкам относят структурированные лимфоидные образования, к эффекторным - собственную пластинку и эпителиальный слой с локализованными в них лимфоцитами. В индуктивных участках происходят процессы преобразования, презентации и распознавания антигена и праймирование антигенспецифичных Т - и В-лимфоцитов, в эффекторных участках - происходят эффекторные функции: синтез антител В-лимфоцитами, природными киллерами и макрофагами.
Поскольку инициирование иммунного ответа, развитие эффекторных механизмов и реализация производящего иммунитета происходят непосредственно в слизистых оболочках, лимфоидная ткань слизистых вместе с локализованными в них иммунологически значимыми клетками разных типов является относительно самостоятельным отделом иммунной системы. Она обеспечивает защиту собственно слизистых оболочек, т.е. образование местного иммунитета. Главным иммунным механизмом для защиты слизистых оболочек является продуцирование В-лимфоцитами антигенспецифичных секреторных IgA (sIgA). sIgA-Антитела в норме определяются в довольно высоких концентрациях только в секретах слизистых оболочек. Локализуясь на поверхности слизистых оболочек, sIgA реализуют защитное действие блокированием первого этапа взаимодействия патогенна с клетками макроорганизма (эпителиальными клетками) - адгезию их к эпителию. При этом протективный эффект sIgA не связанный с развитием воспалительных реакций, которые в значительной степени обусловлено отсутствием в антителах этого изотипа способности активизировать систему комплемента. Способность синтезировать sIgA является основным характерным признаком всех структурированных образований лимфоидной ткани слизистых оболочек, в связи с чем ее еще называют секреторной иммунной системой [4].
Среди всех отделов лимфоидной ткани слизистых оболочек наиболее изучен и развит желудочно-кишечный.
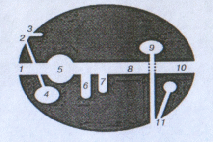
Рис.1. Схема ЛТС и граничащих с ними органов [1].
1-ротовая полость, 2-носовая полость, 3-потовые железы, 4-легкие, 5-желудок, 6-печень, 7-поджелудочная железа, 8-кишечник, 9-почки, 10-анальное отверстие, 11-репродуктивный тракт.
В слизистой пищеварительного канала к структурированным лимфоидным образованиям, которые выполняют функцию индуктивных участков в процессе развития иммунного ответа, относятся такие организованные формирования лимфоидной ткани, как пееровы бляшки (групповые лимфоидные фолликулы), миндалины, конгломераты фолликулов в червеподобном отростке (аппендиксе), а также отдельные фолликулы, локализованные непосредственно в слизистой оболочке.
1.1 Групповые лимфоидные фолликулы
Под эпителием слизистых оболочек кишок, а также гортани, бронхов, мочеполовых органов содержатся образования лимфоидной ткани в виде одиночных фолликулов или их собраний. Наибольшее количество скоплений фолликулов находится в тонкой кишке. Их называют групповыми лимфоидными фолликулами или перовыми бляшками.
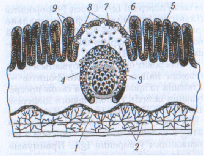
В участке локализации "бляшки" слизистая оболочка образует куполоподобный выступ. Групповые лимфоидные фолликулы, как и другие лимфоидные образования, имеют В - и Т-клеточную зоны (Рис.2). В-Зона представлена скоплением фолликулов, которые заселенные В-лимфоцитами и размещены в глубине слизистой оболочки. Т-Зона занимает межфолликулярное пространство, где расположены венулы с высоким эндотелием, и распространяется глубже под фолликулы, где проходит артерия. Кроме Т-лимфоцитов, которые доминируют в этой зоне, тут расположены ИДК. В зоне купола между эпителием и фолликулами в непосредственном контакте с эпителиальными клетками содержатся Т - и В-лимфоциты со значительным преобладанием последних. Большинство В-лимфоцитов составляют клетки памяти. Изредка тут встречаются плазматические клетки.
Рис. 2. Строение перовой бляшки: 1-мышечный слой слизистой оболочки; 2-лимфатические сосуды; 3-центр размножения; 4-фолликул; 5-кишечная ворсинка; 6-эпителий, ассоциированный с фолликулом; 7-купол; 8-М-клетка; 9-крипты Либеркюна.
Среди В-лимфоцитов, которые заселяют групповые лимфоидные фолликулы, большинство несет на своей поверхности IgA. Среди Т-лимфоцитов количественно преобладают функционально зрелые αβТ-клетки (95%), большая часть которых экспресирует маркер СD4 и вдвое меньшая часть - маркер СD8.
В перовых бляшках происходит праймирование наивных Т - и В-лимфоцитов - активация и пролиферация, а также программирование путей их дальнейшей дифференцировки для обеспечения развития в слизистой оболочке ответа с преобладанием образования IgA. Праймирование лимфоцитов обеспечивается эпителием, который выстилает слизистую оболочку в участке купола, непосредственно над самим фолликулом, и содержит уникальные микроскладчатые клетки - М-клетки, которые называют фолликулоассоциирующими клетвами (Рис.2,3). От поверхности М-клеток в просвет кишки выходят небольшие отростки, которые формируют многочисленные микроскладки. В противоположном к просвету участке М-клеток имеются карманы, образованные глубокими инвагинациями плазматической мембраны. В них содержатся Т - и В-лимфоциты, дендритные клетки и макрофаги [4].
М-клетки выполняют специализированную функцию - транспортирование растворенных и корпускулярных агентов из просвета кишки в середину лимфоидного фолликула. Захваченный М-клеткой вследствие эндоцитоза или фагоцитоза антиген транспортируется с помощью везикулы в карман, где он представляется Т-клеткам, оттуда - в субэпителиальную лимфоидную ткань, где индуцирует местный иммунный ответ с образованием антител изотипа А.
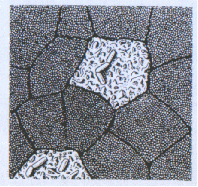
Рис.3. М-клетки кишечного эпителия. Видно две М-клетки, окруженные резорбционными клетками, к поверхности М-клеток прилегают бактерии.
Известно, что М-клетки могут сами представлять агенты. Кроме того, они секретируют цитокины, с помощью которых приходят в действие Т - и В-лимфоциты, ДК, а в условиях патологии еще и воспалительные клетки (нейтрофилы, эозинофилы). Способность выполнять эти иммунные функции свойственна также М-клеткам, которые локализованы в слизистой оболочке дыхательной, мочеполовой систем, глаз. М-клетки разной локализации несут рецептор типа I для лектина моллюска европейского (Ulex europeus) - UEAI, что является их общим фенотипическим признаком. Следует обратить внимание, что некоторые инфекционные агенты могут длительно приживаться и размножаться в М-клетках, вызывая их гибель, что приводит к образованию некротических язв в эпителие.
1.2 Червеподобный отросток
У человека аппендикс (5-7 см длинной и приблизительно 1см в толщину) придаток слепой кишки (Рис.4). В слизистой оболочке отростка содержится значительное количество лимфоцитов. У особей молодого возраста лимфоциты образуют большие фолликулы, которые в виде почти плотного конгломерата окружают просвет отростка. Из слизистой оболочки они часто погружаются в подслизистую основу. В эпителиальном слое слизистой оболочки отростка в участке локализации фолликулов содержаться М-клетки, которые поглощают антигены. С возрастом в отростке. Как и в других лимфатических органах, происходит атрофия лимфоидной ткани с практически полным исчезновением фолликулов.
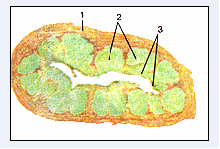
Рис.4. Лимфоидные узелки в стенке аппендикса [8].
Поперечный срез. 1-стенка аппендикса; 2-лимфоидные узелки; 3-эпителиальный покров.
Показано, что у нормальных кроликов между лимфоидными клетками и в ретикулярных клетках червеподобного отростка постоянно выявляются бактерии. При этом воспалительная реакция не развивается. После радиоактивного облучения отростка в его ткани не выявляют лимфоциты и исчезают бактерии. Последние появляются снова после восстановления лимфопоэза. Вероятно, микробы, которые содержатся в ткани червеподобного отростка, способствуют созданию толерантности к микрофлоре кишечника и формированию клонов антигенспецифичных лимфоцитов относительно условно-патогенных видов, которые входят в ее состав.
1.3 Небные миндалины
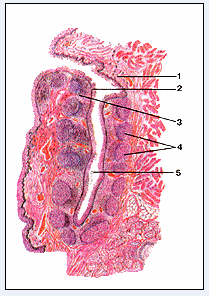
У человека небные миндалины размещены между поднебными дужками возле входа в полость глотки и вместе с глотковыми и языковыми миндалинами образуют кольцо Пирогова - Вальдеера. Внешне они покрыты капсулой, а их оральная поверхность - слизистой оболочкой. Кровеносные сосуды проникают в толщу миндалин сполучнотканевыми перепонками, которые начинаются от капсулы и являются "остовом" миндалин. Слизистая оболочка формирует в паренхиме миндалин крипты (от 1 до 20) - сложные древоподобные разветвления площадью приблизительно 300 см2 (с третичными и четвертичными криптами) (Рис.5) [4].
Рис.5. Небная миндалина [8]
Поперечный разрез: 1-слизистая оболочка; 2-многослойный плоский эпителий; 3-околоузелковая лимфоидная ткань; 4-лимфоидные узелки; 5-просвет крипты.
Лимфоидная ткань в небных миндалинах размещена между слизистой оболочкой и соединительнотканным слоем и содержит первичные и вторичные фолликулы.
Фолликулы размещены преимущественно вдоль крипт по ходу соединительной ретикулярной ткани. Они построены по такому же принципу как и в других лимфоидных органах, и содержат преимущественно В-лимфоциты. Между фолликулами размещены Т-клеточные зоны, через которые проходят венулы с высоким эндотелием. В миндалинах В-лимфоциты количественно преобладают над Т-лимфоцитами, а часть В-клеток с мембранным IgA-рецептором у них выше, чем в селезенке.
Анатомическая единица миндалин криптолимфон, который состоит из: просвета крипты, участка эпителия над вторичным фолликулом, где лимфоциты ассоциированы с эпителиальными клетками лимфоретикулярной ткани, размещенной между криптой и вторичным фолликулом, собственно вторичного фолликула, кровеносных и лимфатических сосудов и нервных элементов в этом участке. Криптолимфон содержит значительно больше кровеносных капилляров, чем другие участки небных миндалин, что, очевидно, связано со спецификой его физиологической роли. Небные миндалины не имеют афферентных лимфатических сосудов.
Миграция лимфоцитов небных миндалин под эпителий крипт в дистальных участках наблюдается уже у 4-5-месячного плода человека. Это явление, которое называют ретикуляцией эпителия, более выражено в глубине крипт и на участках, размещенных над поверхностью вторичных фолликулов. Причина и биологическая уместность этого процесса до сих пор не установлена. Очевидно, это явление не связано с инфекцией. В подэпителиальных участках находится значительное количество посткапиллярных венул, из которых лимфоциты мигрируют в ткани, где после контакта с микробными антигенами они активизируются.
Участки ретикулярного эпителия небных миндалин - специальные структуры, которые имеют в своем составе внутриэпителиальные ходы, высланные в средине эпителиальными клетками и макрофагами с поглощенными микробными клетками. Хода покрыты с боку крипт подушечкоподобными клетками, ассоциированными с эпителием. Эти клетки могут смешиваться открывая вход, через который микробы и разные частички могут проникать с крипт в ходы. Противоположные концы ходов открываются в подэпителиальную паренхиму.
После достижения половой зрелости происходит постепенная эволюция миндалин. У лиц в возрасте более 60 лет в миндалинах уменьшается глубина, количество крипт и вторичных фолликулов, а также количество и миграция лимфоцитов в просвет крипт. Однако существует мысль, что небные миндалины сохраняют свою функциональную активность в течении всей жизни. Считают, что они защищают верхние дыхательные пути от инфекций, принимают участие в формировании микробного ценоза полости рта и носовой части глотки [4,5].
1.4 Лимфоидные клетки слизистых оболочек
В слизистых оболочках разных органов содержится значительное количество лимфоидных клеток, которые локализуются в соединительной ткани собственной пластинки (Lamina propria) и в эпителиальном слое.
В собственной пластинке кишечника находятся Т - и В-лимфоциты, НК-клетки, ДК, макрофаги, эозинофилы. Встречаются также тканевые базофилы, которых особенно много в подслизистом слое. Доминируют в клеточном составе лимфоидные клетки, среди которых Т-лимфоциты численно преобладают над В-лимфоцитами. Т-Клетки (40 - 60% клеточного состава) по фенотипическим признакам (частотой экспрессии рецепторов αβ и γδ-типа и маркеров CD4 i CD8) почти не отличаются от Т-лимфоцитов периферической крови и составляют часть рециркулирующего пула. Большинство Т-клеток экспрессируют рецептор αβ-типа (более 90%) и только незначительная часть (<10%) - рецептор γδ-типа. Количество CD4Т-клеток (60%) значительно превышает количество CD8Т-клеток (25-30%). Доля В-лимфоцитов также значительна: может достигать 20-40% клеточного состава. Характерно, что, начиная с двухлетнего возраста, у человека в собственной пластинке концентрируются В-лимфоциты и плазматические клетки, которые экспрессируют преимущественно IgA (около 80% общего количества антителпродуцентов). Возможно, это связано со стимулирующим влиянием микрофлоры, которая заселяет слизистые оболочки, поскольку у безмикробных животных такая избирательность не наблюдается. Характерная особенность популяции В-лимфоцитов Lamina propria количественное преобладание в ее составе CD5+В1-клеток над CD5-В-клетками. В1-клетки синтезируют преимущественно низкоафинные антитела IgМ и IgА.
В пределах эпителиального слоя лимфоциты локализуются между эпителиальными клетками (ближе к базальной мембране), их называют внутриэпителиальными лимфоцитами (ВЭЛ). ВЭЛ представлены почти исключительно Т-лимфоцитами (ВЭЛ-Т), 80-90% ВЭЛ экспрессируют маркер CD3. большинство ВЭЛ-Т несут на поверхности полипептид НМL-1, который является представителем семейства α-цепей интегринов. Соединяясь с β7-цепью, он образует интегрин α НМL-1 - β7. экспрессия этого антигена свидетельствует о том, что ВЭЛ-Т в активированном состоянии. Известно, что Т-клетки периферической крови в состоянии покоя не имеют этого антигена, однако экспрессия его индуцируется после их активации ФГА.
ВЭЛ-Т отличаются от Т-клеток собственной пластинки (и периферической крови) преобладанием CD8-клеток (75%) над CD4-клетками (7%) и большей частью Тγδ.
У человека Тγδ составляют 10-40% ВЭЛ-Т. У мышей на момент рождения часть Тγδ достигает 80%, а у взрослых 30% ВЭЛ-Т, т.е. количество их неодинаково для разных отделов кишечника и зависит от возраста, линий мышей, условий. Большинство Тγδ в отличии от Тαβ не несут субпопуляционных маркеров, часть (около 30%) экспрессируют молекулу CD8, но в виде αα-димера, а не αβ-димера, как CD8Т αβ. Считают, что часть Тγδ дифференцируется в кишечнике, при этом большая их часть экспрессирует рецептор Vγ5δ4, другие - рецептор Vγ5δ1 [4,5].
Большинство Т-лимфоцитов, которые локализуются в эпителиальном слое и собственной пластинке слизистых оболочек, несут молекулу CD45R0 - маркер клеток памяти, что является признаком того, что они уже встречались с антигеном и, значит, не являются наивными.
Кроме лимфоидных клеток в слизистых оболочках содержатся также клетки нелимфоидной природы, которые принимают участие в иммунных реакциях - выполняют роль АПК. Это дендритные и собственно эпителиальные клетки. Способность презентовать антиген для Т-лимфоцитов они приобретают после активизации в очаге воспаления под влиянием цитокинов.
Эти два типа клеток отличаются по особенностям презентации антигена Т-лимфоцитам и их стимуляции. ДК представляют антиген в комплексе с классическими молекулами МНС, эпителиальные клетки - с классическими МНС, так и неклассическими молекулами - CD1d. У ДК роль костимулятора во время активизации Т-клеток выполняет молекула CD80, в эпителиальных клетках, которые не экспрессируют CD80, - вероятно ассоциированный с CD1d гликопротеин qp180, который распознает на Т-клетке молекулу CD8. Важность этого пути презентации антигена и активации Т-клетки состоит в том, что молекулы CD1d могут представлять не только белковые, но и липидные и гликолипидные антигены. Последние, как известно. Входят в большом количестве в состав клеточной стенки бактерий, роль которых, как причинных факторов кишечных инфекций довольно значительна.
Лимфоидные клетки слизистых оболочек, как розсеяные, так и локализованные в лимфоидных образованиях, обеспечивают создание местного иммунитета. Внутриэпителиальные лимфоциты, большинство которых несет субпопуляционный маркер Т-лимфоцитов - молекулуCD8, выполняют функцию иммунного надсмотра за эпителием, который быстро пролиферирует, элиминируя мутантные, инфицированные вирусами и некоторыми бактериями, а также измененные под влиянием токсических или других факторов клетки. Цитотоксическую активность определяют как Тαβ-, так и Тγδ-клетки с маркером CD8. CD8-клетки обоих типов содержат на поверхности особый белок BV55, который характерен для всех лимфоцитов с цитотоксическими функциями, включая НК-клетки. При этом первыми на инвазию инфекционных агентов реагируют Тγδ, которые рассматриваются как "часовые" эпителиальных тканей. Распознавая определенные консервативные структуры микробных клеток (в комплексе с белками теплового шока, которые продуцируются клетками под влиянием стрессовых факторов), Тγδ активизируются, продуцируют цитокинины (ИНФ-γ, ФНП-α) и приобретают способность разрушать как собственно патогенны, так и инфицированные ними, а также те, которые подверглись стрессу (и как результат этого - функционально неполноценные), эпителиальные клетки. Объектом распознавания Тγδ также могут быть МНС I-подобные белки MICA и MICB, которые экспрессируются энтероцитами кишечника во время стресса и эпителиальными опухолевыми клетками (у людей и разных видов животных, но не мышей). Получено интересные данные, что Тγδ способны также стимулировать рост эпителиальных клеток (путем продуцирования цитокинов) и способствовать восстановлению однородного пласта "продырявленной" ими самими эпителиальной выстилки [2].
Активированные Тγδ вместе с другими клетками природного иммунитета - гранулоцитами. Моноцитами (которые задействуются при помощи цитокинов) первыми вступают в борьбу с патогенами, которые проникают сквозь слизистые оболочки. Спустя некоторое время к защите присоединяются антигенспецифические Тαβ с цитотоксической и хелперной функциями и В-лимфоциты, которые развивают гуморальный иммунный ответ - продуцируют антитела IgA (Рис.6). Слизистые оболочки основное место синтеза антител этого класса.
Рис.6. Димер IgA [1]
1-J-цепь, 2-секреторный компонент
Развитию IgA-ответа в слизистых оболочках способствуют условия микроокружения. Секретированные локализованными в Lamina propria плазматическими клетками IgA транспортируется на поверхность слизистых оболочек, где реализует защитные функции.
Секреторные sIgA защищают слизистые оболочки от патогенов, блокируя сайты связывания их с эпителиальными клетками. Таким образом sIgA выполняют роль первой линии специфической защиты на пути проникновения патогенных микроорганизмов и имеют большое значение для обеспечения невосприимчивости организма к инфекциям, которые ассоциированы со слизистыми оболочками. Дефицит антител этого класса - самая распространенная форма иммунодефицита у европеоидов (1: 700 человек) - обуславливает понижение резистентности к инфекционным агентам, в частности гноеобразующих микроорганизмов, особенно в тех случаях, когда он присоединяется к дефициту определенных субклассов IgG. В защите слизистых, вероятно, могут принимать участия и антитела класса М, поскольку соединенная I-цепью пентамерная молекула IgМ также может выноситься на поверхность эпителия.
Локализованные в слизистых оболочках, в том числе и в перовых бляшках, дендритные и Т-хелперные клетки также принимают участие в индуцировании иммунной толерантности к антигенам, которые попадают per os [2,5].
2. Механизмы, регулирующие образование в слизистых оболочках плазматических клеток, которые продуцируют IgA
Преобразование В-лимфоцитов в плазматические клетки, которые выделяют IgA, сложный многоэтапный процесс, зависимый от участия Т-лимфоцитов и других клеток, а также от продуцированных ними цитокинов. Эта регуляция касается прежде всего двух этапов на пути преобразования В-лимфоцитов: процесса переключения классов (switching) IgM → IgA, а также процесса остаточной дифференциации В-лимфоцитов в клетке, продуцирующей антитела.
2.1 Регуляция процесса переключения классов
Процесс переключения классов происходит в перовых бляшках, главным образом в куполах, при участии дендритных клеток и Тh-лимфоцитов. Кажется, что ключевую роль в этом процессе относительно синтеза IgA играет цитокинин TGF-β. Переключение классов Ig может быть одноэтапным (IgМ→ IgA), или - реже - двухэтапным (IgМ → IgG, IgG → IgA).
В лимфатических фолликулах перовых бляшек можно выделить две субпопуляции В-лимфоцитов IgA+: малые В-лимфоциты памяти в состоянии покоя со слабой экспрессией рецептора для агглютинина земляных орехов (peanut agglutinin - PNA) и с сильной экспрессией цепи к, а большие лимфобласты в состоянии деления с сильной экспрессией рецептора для PNA и слабой для цепи к. Первые являются непосредственными предшественниками плазматических клеток, которые находят в слизистых оболочках. Роль другого вида клеток изучается. Процесс активации и переключения классов (IgМ → IgA), вероятно, зависит также от вида антигена. Такое свойство имеет LPS.
2.2 Регуляция пролиферации и дифференциации В-лимфоцитов
Образованные в вышеупомянутых процессах лимфоциты В IgA+, "направленные" (commited) на продукцию антител IgA, подлежат регуляторным влияниям, что приводит к их окончательной дифференциации и продуцирования ними IgA. Из многих исследований выходит, что эти процессы зависимы от Тh цитокинов, прежде всего IL-5 и IL-6. отдельные данные наводят на мысль, что на дифференцировку позитивно влияет также IFN-γ. Посредственное влияние, которое усиливает выделение IgA, придает также IL-1. лимфоциты IgA+ в перовых бляшках преобладают над другими популяциями В-лимфоцитов - их процент в центрах размножения бляшек Пеера равняется 60-70%.
Регуляция дифференцирования лимфоцитов В IgA+, правдоподобно, является зависимой также от клеток, которые имеют рецепторы для фрагмента Fc IgA (FcaR), особенно Т-лимфоцитов. Часть этих клеток ответственны за суппресию продукции IgA на периферии, например Т-лимфоциты FcaR+СD8, изолированы с селезенки. Подтверждено. Что этот процесс происходит при участии освобожденного этими лимфоцитами так называемого фактора, который связывает IgA (IgA binding factor - IgA-BF). Другие по очереди лимфоциты ТссаR+ (фенотипаТh), изолированные в бляшках Пеера, преимущественно усиливали гуморальный ответ IgA. Принято, что местная концентрация IgA, как и отношение В-лимфоцитов к Т-лимфоцитам, может существенно моделировать освобождение факторов, которые тормозят или стимулируют IgA, что на основе обратной связи регулировало бы иммунный ответ в пределах этих антител. Определенную роль в регуляции образования IgA в слизистых оболочках играют контрсуппресивные лимфоциты [2,5].
3. Иммунный ответ в слизистых оболочках
Элиминация патогенных микроорганизмов, которые поступают в слизистые оболочки, обеспечивается преимущественно развитием гуморального иммунного ответа с продуцированием секреторных IgA. В перовых бляшках и других фолликулярных структурах, куда попадает антиген с поверхности эпителия, происходит праймирование нитивных Т - и В-лимфоцитов, активация, пролиферация и детерминация путей следующего их дифференцирования. Продуцированные клетками микроокружения цитокины направляют дифференциацию CD4 Т-клеток в Тх2 и Тх3 и переключение синтеза иммуноглобулинов В-лимфоцитами с IgМ-изотипа на IgA-изотип. Переключение изотипа антител, вероятно, индуцирует ТФР-β, которое продуцируется Тх3. Так иногда называют субпопуляцию Т-хелперов, которые локализуются в слизистых оболочках, продуцируют кроме ТФР-β также IL-4 b IL-10 и важные для стимуляции образования IgA-антител В-лимфоцитами слизистых.
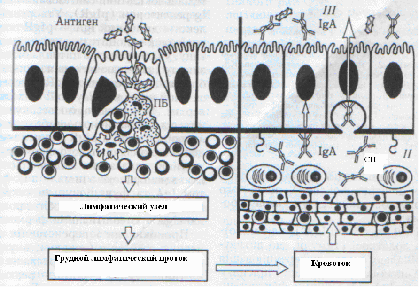
Праймированные Т - и В-лимфоциты выходят с перовой бляшки, входят через афферентный лимфатический сосуд в региональный мезентериальный лимфоузел, откуда через грудной проток попадают в кровяное русло, а с кровью в селезенку, где задерживаются на несколько суток (на протяжении которых происходит их дифференцирование), после чего они опять возвращаются в слизистую оболочку (Рис.7) [4].
Рис.7. Развитие иммунного ответа в слизистых оболочках:
ПБ - пеерова бляшка; СП - собственная пластинка слизистой оболочки; I - индуктивная, II - продуктивная, III - эффекторная фаза иммунного ответа.
Кроме клеточного и гуморального иммунного ответов, слизистые оболочки способны к анти-HIV-активности благодаря выделяемым веществам, например некоторым белкам слюны, обладающим ингибиторной активностью в отношении ВИЧ (Табл.1) [1].
Таблица 1. Белки слюны, обладающие ингибиторной активностью по отношению к ВИЧ
Компоненты слюны
Тип фактора
Механизм ингибирования ВИЧ
SLP (secretory leukocyte protease inhibitor)
Ингибирование сериновой протеазы
Взаимодействует с хемокиновыми рецепторами клетки и (или) блокирует стадию раздевания вируса
Муцины
Гликопротеины
Способствует агрегации вируса, уменьшая его титр, нарушает взаимодействие gp120 и gp41
Пролинбогатые белки
Пролинбогатые белки
Предотвращается взаимодействие вируса с клеткой
Лактоферин
Fe-связывающие гликопротеины
Связывается с V3-петлей gp120
4. Мукозные вакцины
В слизистых оболочках функционируют механизмы удаления антигенов с поверхностей, ферментативной деградации антигенов, снижение эффективности их проникновения в антигенпоглощающие М-клетки. Эти факторы усложняют доставку антигена при иммунизации через слизистые оболочки. Для защиты иммунизирующих антигенов их упаковывают в биодеградируемые полимерные или липидные частицы, которые вводят чаще всего орально или назально (Рис.8) [1,7].
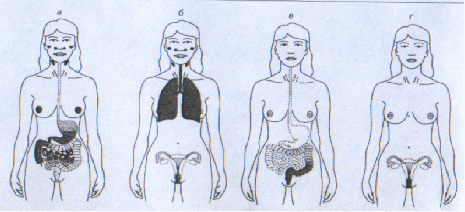
Рис.8. Экспрессия антител IgA в слизистых тканях после различных вариантов иммунизации.
а-оральная, б-интраназальная, в-ректальная, г-вагинальная иммунизация.
Новейший подход к созданию мукозных вакцин состоит в получении трансгенных растений, продуцирующих протекливные антигенные белки инфекционных агентов, и использовании их в качестве съедобных вакцин. Стенки клеток растений обеспечивают эффективную защиту находящегося в них антигена в ротовой полости и желудке, содержимое которого имеет кислую реакцию. Поэтому "упакованный" таким образом антиген эффективно достигает кишечника, где индуцирует иммунный ответ на уровне слизистых оболочек. Важной особенность съедобных вакцин является их потенциальная дешевизна, биологическая безопасность, простота хранения и применения. Более того в будущем можно будет создать растения, продуцирующие одновременно несколько протективных антигенов различных патогенов. Это будут мультивалентные съедобные вакцины.
Концепцию производства вакцин в трансгенных растениях впервые сформулировали X. Мэйсои с соавторами (1992 г). Они предприняли попытку получения съедобной вакцины против вируса гепатита В на основе грансгенного табака. Были созданы растения, экспрессирующие поверхностный антиген вируса гепатита В. Рекомбинантный HBsAg выделили из трансгенных растений с помощью иммуноаффинной хроматографии и исследовали под электроннмм микроскопом. Оказалось, что рекомбинантный HBsAg способен собираться в вирусоподобные частицы размером около 22 нм и взаимодейсвовать с антителами, выделенными из крови лиц, инфицированных HBV. Вакцинация мышеи инъекционным способом HBsAg антигеном, выделенным из трансгенных растений табака, стимулировала такой же специфичный иммунный ответ, как и коммерческая дрожжевая субъединичная вакцина Это исследование показало возможность создания трансгенных растений для получения рекомбинантных вирусных белков, обладающих нормальной биологической активностью [3].
На следующем этапе был создан траcгенный картофель, продуцирующий HВsAg, и при скармливании мышам клубней такого картофеля наблюдали развитие специфичного иммунного ответа против вируса гепатита В. В 1999 г. были начаты эксперименты на добровольцах, и у людей, поедавших сырые клубни картофеля, также наблюдали специфичный противовирусный иммунный ответ.
Другая группа исследователей в 1999 г. coздала съедобную вакцину против вируса гепатита В на основе люпина и салата. У мышей, которым скармливали люпин, наблюдалось появление антител к вирусу, а у добровольцев, получавших с пищей трансгенный салат, развивался специфический иммунный ответ на вирусный белок.
X. Мэисон с соавторами создали в 1996 г. трансгенные растения картофеля и табака, экспрессирующие белок нуклеокапсида вируса Норфолка, выбывающего у людей острый гастроэнтерит. Было показано, что чужеродный белок в растении формирует вирусоподобные частицы диаметром 38 нм, идентичные частицам, полученным в культуре клеток насекомых, инфицированных рекомбинантным бакуловирусом. При скармливании клубней трансгенного картофеля мышам у них стимулировалось образование специфического IgG, а при внутрижелудочном введении листьев трансгенного табака наблюдалось появление сывороточного IgG и секреторного IgA, специфичных к вирусоподобным частицам.
В 1995 г. были сконструированы трансгенные растения картофеля, синтезирующие олигомерный полипептид LT-B. LT - это термолабилиный токсин Е. coli, который состоит из
шести субъединиц: фермента LT-A и пяти рецепторсвязывающих полипептидов LT-B. Субъедин6ица LT-A проникает в эпителиальные клетки кишечника и вызывает изменения клеточного метаболизма, приводящие к потере воды клетками. LT-B формируют пентамер, который связывается с GM1-ганглиозидами мембраны эпителиоцитов и обеспечивает транспорт LT-А в клетки. Субьединица LT-В может быть отделена от LT-А и при оральном введении вызывает сильный иммунный ответ слизистой оболочки без каких-либо признаков болезни. Трансгенный картофель, продуцирующий LT-B, использовали в экспериментах на мышах. После четырех кормлений у животных начинал вырабатываться анти-LT-B IgG в сыворотке и IgA в слизистой кишечника. В опытах на добровольцах (1998 г) было обнаружено появление в крови клеток, секретирующих специфические антитела. Эти клетки появляются в крови примерно на 7-й лень после иммунизации (поедания трансгенного картофеля) и по прошествии 14 дней мигрируют в ткань слизистой. Присутствие их в крови с 7-го по 10-й день подтверждает важную роль иммунного ответа слизистой оболочки кишечника. Кроме того, у 91% добровольцев наблюдалось четырехкратное повышение концентрации анти-LT IgG, а у 55% - четырехкратное повышение концентрации анти-LT IgA. В более ранних исследованиях такой же эффект наблюдали при оральном введении определенного количества культуры вирулентной энтеротоксичной Е. coli.
Таблица 2. Свойства некоторых съедобных вакцин, созданных на основе трансгенных растений. СРБ-суммарный растворимый белок, СВ-сырой вес.
Источник иммуногена
Экспрессируемый белок или пептид
Растительная система экспрессии
Максимальный уровень экспрессии
Частота иммуногенность и протективная емкость вакцины
Год опубликования
Вакцины для человека
Энтеротоксигенная E. coli
В-субъединица термолабильного токсина
(LT-B)
То же
// -
Табак
Картофель
Кукуруза
<0,01% СРБ
<0,19% СРБ
Формирует мультимеры, экстрагированный из растения белок иммуногенен при оральном введ.
Формирует мультимеры, иммуногенен и протективен при оральном введении
(поедании сырых клубней)
Иммуногенен и протективен при оральном введении (поед. зерен)
1995
1995,
1998
2000
Холерный вибрион
В-субъединица холерного токсина
(СТБ)
Картофель
<0,30% СРБ
Формирует мультимеры, иммуногенен и протективен при оральном введении (поедании сырых клубней)
1997,
1998
Вирус гепатита В
Поверхностный белок оболочки (HBsAg)
То же
// -
Табак
Люпин
Салат
<0,01% СРБ
<0,01% СВ2
<0,01% СВ
Формирует вирусоподобные частицы, после экстракц. из раст. иммуногенен при инъекцион.
введении
Иммуногене при оралном введении (поед. листьев)
Иммуногене при оральном введении (поед. листьев)
1992,
1995
1999
Вирус Норфолк гастроэнтери-та человека
Белок капсида (NVCP)
То же
Табак
Картофель
<0,23% СРБ
<0,37% СРБ
Формирует вирусоподобные частицы, иммуногенен при оральном введ. экстракта листьев
Формирует вирусоподобные частицы, иммуноген. при оральном введении
1996
1996,
2000
Цитомегало-вирус человека
Гликопротеин В
Табак
<0,02% СРБ
Иммунохимически соответствует природному белку
1999
Вирус папилломы человека
Основной капсидный белок (L1)
Картофель
<0,01% СВ
Формирует вирусоподобные частицы, иммуногенен при оральном введ. (поед. сырых клубней)
2003
Вирус кори
Гемагглютинин (MV-H)
Салат
Нет данных
Иммуногенен и протективен при оральном введении (поед. листьев)
Вакцина для кроликов
Кроличный вирус геморрагического заболевания
Основной вирионный белок (VP60)
Картофель
<0,30% СРБ
Иммуногенен и протективен при оральном введении экстракта клубней
1999,
2003
Вакцины для сельскохозяйственных животных
Вирус ящура
Вирионный белок (VP1)
То же
Арабидопсис
Люцерна
Нет данных
Нет данных
Иммуногенен при инъекцион.
введении
Иммуногенен при инъекцион. или
оральном введении
1998
1999
В 2001 г. другая группа ученых сконструировала синтетический ген LT-B, оптимизированный для экспрессии в клубнях картофеля. Введение этого гена под контролем тканеспецифичного промотора в геном картофеля привело к продукции функциональных рекомбинантных пентамеров LT-B в клубнях. При подкожной инъекции экстракт этих клубней вызывал у мышей гуморальный иммунный ответ, сравнимый с ответом на бактериальный LT-B. Эффективным оказалось также скармливание клубней или их внутрижелудочное введение: значительное увеличение содержания анти-LT-антител обнаруживали в сыворотке крови и фекалиях
Группа С. Стретфилда (2001 г) достигла высокого уровня экспрессии LT-B в кукурузе. Скармливание зерна, содержащего чужеродный белок, вызывало у мышей иммунный ответ.
Похожую работу выполнили Т. Аракава с соавторами (1998 г), создав трансгенные растения картофеля, экспрессирующие В-субъединицу холерного токсина (СТ-В). У мышей, получавших с пищей клубни или листья, наблюдалось образование специфических антител в сыворотке крови и в слизистой кишечника, а цитотоксический эффект холерного токсина на культуру клеток почки зеленой мартышки Vero нейтрализовался сывороткой крови иммунизированных мышей. Объем жидкости, накапливаемой в тонком кишечнике, у иммунизированных животных по сравнению с мышами, больными холерой, уменьшился на 60%.
Из-за способности связываться с GМ1-ганглиозмдами эпителиальных клеток кишечника CТ-B может быть эффективной молекулой-носителем для различных полипептидов и индуцировать иммунитет слизистой оболочки. СТ-В облегчает доставку антигена в лимфоидную ткань кишечника и его презентацию.
В ряде экспериментов было показано, что оральное введение аутоантигенов предотвращает развитие аутоиммунных заболеваний, таких как диабет I типа, ревматоидный артрит или рассеянный склероз.Т. Аракава с соавторами (1998 г) показали, что экспрессируемый в картофеле химерным полипептид, состоящий из последовательности СТ-В и присоединенной к ее С-концу последовательности человеческого инсулина, сохранял пентамерную структуру и способность связываться с GМ1-ганглиозмдами, а также обладал иммуногенностью как инсулина, так и CТ-B. У мышей, принимавших с пищей трансгенный картофель, наблюдалось образование анти-CТ-B-антител и значительное замедление развития экспериментально индуцированного диабета.
Работы по созданию съедобных вакцин активно продолжаются. Результаты некоторых исследований приведены в таблице 2. Важным направлением развития данных исследований является создание съедобных вакцин на основе растений, которые могут широко использоваться в пишу без термообработки (томаты, бананы, салат и др.). По принятой в настоящее время концепции для увеличении эффективности съедобных вакцин необходимо решить проблему повышения уровня продукции целевых антигенов в трансгенных растениях, так как классическим подход обеспечивает довольно низкую продуктивность. Большие надежды на решение этой проблемы связывают с разрабатываемыми системами экспрессии на основе вирусов растений и генетической трансформации хлоропластов [6,7].
В течение последних лет был сделан значительный прогресс в понимании роли мукозной иммунной системы в патогенезе ВИЧ
Уменьшение численности CD4+ Т-клеток памяти в основном происходит в острой фазе инфекции и особенно сильно в слизистых оболочках. Степень иммунного дефицита после острой фазы, в частности способность контролировать проникновение патогенов через слизистую оболочку, задает темп иммунной активации и таким образом определяет степень прогрессии СПИДа.
Результаты многих исследований дают надежду на то, что в ближайшее время возможны предотвращение или элиминация на стадии проникновения ВИЧ. Эффективная вакцина должна быстро индуцировать сильный ответ при попадании вируса на слизистую оболочку.
Вакцины, разработанные для предотвращения передачи ВИЧ через слизистые оболочки, должны индуцировать множественный иммунный ответ, в том числе антитела, которые способны блокировать проникновение вируса через мукозные барьеры и начальную инфекцию в клетках-мишенях. Иммунологический анализ у ВИЧ-устойчивых людей и результаты вакцинирования приматов подтверждают, что и секреторные, и сывороточные антитела играют важную роль в защите от инфицирования через слизистые, тогда как цититоксические Т-клетки требуются для элиминации вируса и для предотвращения его системного распространения. Таким образом, можно сделать вывод, что дизайн мукозной вакцины - одна из главных стратегий против ВИЧ [1,7].
Выводы
Иммунная система слизистых поверхностей предохраняет эпителий и лежащие под ним ткани и органы от внешних повреждений. Эта первая линия защиты организма от ряда патогенов, проникающих через слизистую оболочку, включает врожденный иммунитет и (или) мукозный иммунитет.
Эффективный мукозный иммунитет может создавать барьер, который способен дополнять системный иммунитет и тем самым увеличивать вероятность защиты. При инфицировании вакцинированных животных наблюдаются низкий уровень высвобождения вируса из клеток или слабая инфекционность вируса и соответственно меньшая эффективность передачи инфекции [7].
На протяжении многих лет иммунитет слизистой оболочки и мукозные вакцины меньше привлекали внимание, чем они заслуживают, учитывая, что большинство инфекций и аллергий служили первичным местом проникновения, взаимодействия. Но в последние годы методологические достижения позволили более интенсивно изучать иммунные реакции слизистых оболочек, привели к росту интереса в попытке лучше понять особенности слизистой оболочки по сравнению с системным иммунитетом. Эти исследования дали толчок для разработки вакцин, предупреждающих инфицирование слизистой оболочки, и для лечения аллергических и аутоиммунных заболеваний.
Методика, которая облегчает наблюдение за слизистой иммунной реакцией у людей, включая младенцев и детей - главной целевой группы вакцинации против инфекционных заболеваний, была разработана в первую очередь для определения секреторных ответов антител. Однако практические исследования для оценки слизистой Т-клеточной реактивности в клинической и биологической сфере по-прежнему ограничены и методы прогнозирования эффективности иммунотерапии у людей недостаточны.
В серим последних исследовании акцентируется внимание на роли быстрого и необратимого уменьшении числа CD4+ССR5+ Т-клеток в слизистых тканях как на ключевом определяющем факторе прогрессии ВИЧ-инфекции. Следовательно, индукция мукозного иммунитета - главная задачи при разработке вакцин против таких патогенов. Правильный набор подходящей системы доставки антигена в организм является необходимым условием значительного мукозного иммунного ответа [1].
Литература
1. Карамов Э.В., Гарманова А.В., Хаитов. Мукозный иммунитет и его особенности // Иммунология. - 2008. - №6. - с.377-384.
2. Ройт А., Бростофф Дж., Мейл Д. Иммунология: Пер. с англ. - М., 2000
3. Щелкунов С.Н. Генетическая инженерия: Учеб. - справ. пособие. - 2-е изд., испр. И доп. - Новосибирск: Сиб. унив. изд-во, 2004. - с.471-475.
Вершигора А.Ю. Імунологія: підручник, за заг. ред. Є.У. Пастер. - К.: Вища шк. ., 2005. - с.44-50, 345-348.
5. Якобисяк М. Імунологія/Переклад з польської за ред. проф. .В. В. Чоп’як. - Вінниця: НОВА КНИГА, 2004, - с.328-345.
6. Jan Holmgren & Cecil Czerkinsky. Mucosal immunity and vaccines // Nature Medicine - 2005. - №11. - р.45 - 53.
7. Czerkinsky, Cecil; Anjuere, Fabienne; McGhee, Jerry R. Mucosal immunity and tolerance: relevance to vaccine development // Immunological Reviews.170: 197-222, August 1999.
8. Mowat, A. M. Anatomical basis of tolerance and immunity to intestinal antigens. Nat. Rev. Immunol.3, 331−341 (2003).

Нравится материал? Поддержи автора!
Ещё документы из категории биология:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ