Традиционные методы получения моноклональных антител
Главы из книги «Введение в молекулярную иммунологию и гибридомную технологию», автор: ведущий сотрудник лаборатории биотехнологии ВНЦМДЛ кандидат биологических наук Солопова Ольга Николаевна.
Традиционные методы получения моноклональных антител.
1.Общие свойства моноклональных антител.
Моноклональные антитела (монАТ), в отличие от поликлональных, являются продуктом секреции одной антитело- продуцирующей клетки, либо ее потомков (клона), образовавшихся в процессе деления этой клетки. Все монАТ, являющиеся продуктом одного клона, представлены идентичными молекулами, отсюда вытекают основные свойства моноклональных антител:
а) Все молекулы монАТ, являющиеся продуктом одного клона, имеют одинаковую специфичность, то есть, направлены против одинаковых мест связывания (антигенных детерминант) на каком-либо конкретном антигене, тогда как поликлональная сыворотка имеет в своем составе антитела к разным участкам связывания с антигенам и даже к разным антигенам.
б) Все молекулы монАТ, являющиеся продуктом одного клона, имеют одинаковое сродство к связываемому антигену (аффинность), то есть моноклональные антитела бывают высокоаффинными («прочно» связывающие антиген) и низкоаффинные (образующие легко диссоциирующий комплекс с антигеном). Поликлональная сыворотка всегда представлена антителами разной аффинности.
в) Все молекулы монАТ, являющиеся продуктом одного клона, имеют один изотип и субизотип иммуноглобулинов, чего нельзя сказать о поликлональной сыворотке.
2. Применение моноклональных антител.
Все вышеперечисленные свойства монАТ дают им преимущества перед поликлональными сыворотками в использовании их в диагностических целях, где монАТ нашли свое самое широкое применение.
2.1.Клиническая диагностика растворимых антигенов.
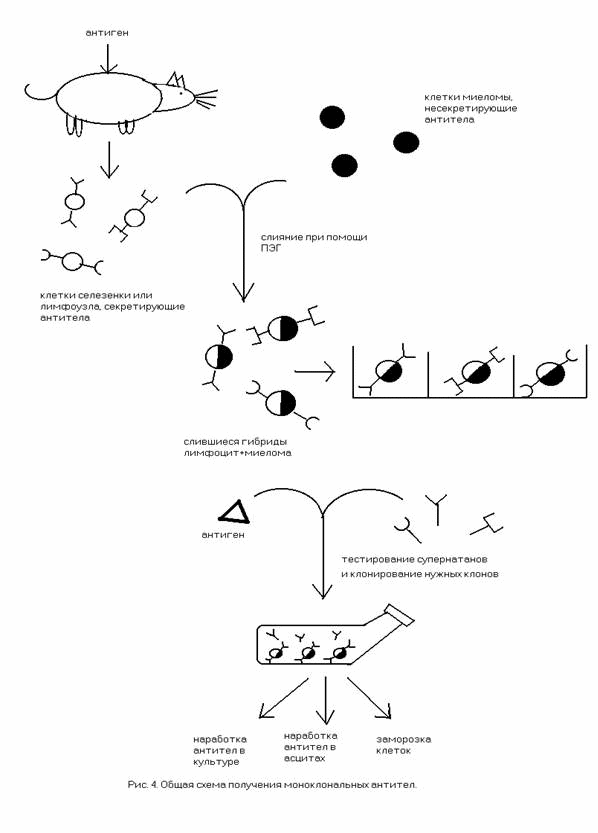
Почти все известные схемы анализа растворимых антигенов на основе монАТ можно отнести к двум типам: метод «двойного сэндвича» (рис.1.) и конкурентный анализ (рис.2.). В обоих случаях используют твердофазный носитель, на который прикрепляют (сорбируют) тем или иным способом монАТ. Далее, в случае «двойного сэндвича», этот носитель инкубируют с исследуемым раствором (чаще всего это биологические жидкости, которые хотят проверить на содержание в них какого-либо белка или низкомолекулярного соединения). Во время инкубации этот антиген (если он имеется в исследуемом растворе) связывается с монАТ, все несвязавшиеся компоненты образца удаляют, промывая твердый носитель буферными растворами или водой. Затем инкубируют со «вторыми» моноклональными антителами, которые, во-первых, должны быть направлены к другой части молекулы антигена, не экранированной первыми сорбированными монАТ, а, во-вторых, должны иметь на себе какую-либо метку, позволяющую регистрировать наличие или отсутствие присоединения «вторых» монАТ к твердому носителю и делать выводы о наличии и количественном содержании искомого антигена в растворе.
Недостатком этого метода является необходимость иметь два монАТ, направленных к разным участкам молекулы антигена и не мешающих друг другу связываться с антигеном. Существует ряд антигенов, как правило, низкомолекулярных, для которых невозможно получить такую пару монАТ по той причине, что антиген имеет только одну антигенную детерминанту, либо антигенные детерминанты расположены на недостаточном расстоянии друг от друга для того, чтобы две достаточно крупные молекулы антител могли независимо их связывать.
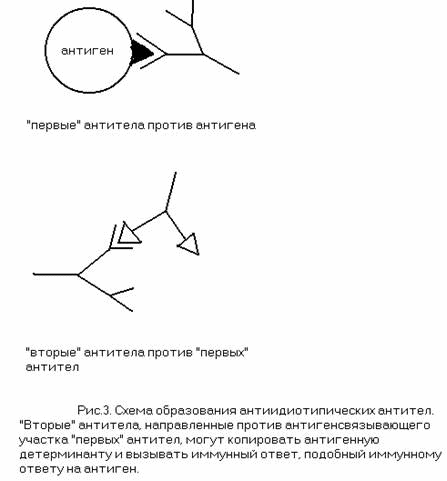
В таких случаях используют в среднем менее чувствительный конкурентный анализ. Для этого на твердофазный носитель прикрепляютмонАТ, затем инкубируют его с исследуемым образцом, куда предварительно добавили меченый антиген, который хотят обнаружить в образце. При наличии в образце искомого антигена (естественно, немеченого) последний препятствует связыванию меченого антигена ссорбированными монАТ (конкурирует с ним за связывание с монАТ). В результате самый сильный сигнал наблюдают при отсутствии в исследуемом растворе искомого антигена (отрицательный контроль), а о содержании антигена можно судить по уровню снижения сигнала по сравнению с отрицательным контролем.
2.2.Диагностика вирусов, бактерий и паразитов.
Для диагностики вирусов, бактерий и паразитов чаще применяют вышеописанный метод «двойного сэндвича». Все эти антигены относятся к крупным надмолекулярным образованиям, поэтому стерических проблем со связыванием антител не бывает, даже если и «первые», сорбированные, и «вторые» меченые монАТ направлены к одной и той же антигенной дереминанте, так как каждая антигенная детерминанта многократно повторена на целой клетке или вирусной частице.
Существуют некоторые особенности диагностики вирусов, бактерий и паразитов:
а) Многие из них могут представлять опасность для окружающей среды и людей, проводящих анализ, поэтому исследуемые образцы предварительно подвергают обработке, уменьшающую их возможную инфекционность.
б) Некоторые микроорганизмы представлены разными штаммами и линиями, среди которых могут быть и патогенные, и непатогенные (например, кишечная палочка Е.coli). Для диагностики конкретных патогенных штаммов необходимо использовать такие монАТ, которые избирательно связывают только искомые линии и штаммы. В этом случае применение моноклональных антител имеет особенную ценность, поскольку набор поверхностных антигенных детерминант у разных штаммов и линий микроорганизмов одного вида очень похож, и поликлональная сыворотка не в состоянии «отличать» патогенные штаммы одного вида от непатогенных.
в) Все грамотрицательные бактерии имеют на своей поверхности «шубу», состоящую из липополисахаридов (ЛПС) и предохраняющую бактериальную клетку от взаимодействия антител с бактериальными мембранными белками. Антитела против ЛПС являются не лучшими с точки зрения диагностики микроорганизмов, поскольку молекулы ЛПС очень похожи по структуре и даже часто идентичны не только у разных штаммов одного вида , но и у бактерий разных видов. В связи с этим для диагностики грамотрицательных бактерий необходимы монАТ со следующими свойствами: во-первых, они должны быть направлены против поверхностных бактериальных белков, а не ЛПС; во-вторых, избирательно связывать только искомые штаммы бактерий. Кроме того, иногда необходима предварительная обработка образца для того, чтобы удалить ЛПС и экспонировать белковые антигенные детерминанты.
2.3. Диагностика поверхностных антигенов эукариотических клеток, в частности CD антигенов.
В настоящее время только CD антигенов известно порядка сотни, кроме них на поверхности клеток имеются молекулы адгезии и разнообразные рецепторы. Качественный и количественный состав поверхностных антигенов может дать ценную информацию о функциях конкретной клетки, о ее принадлежности к опухолевым или вирус- инфицированным. Исследование поверхностных молекул клеток позволяет диагностировать ряд заболеваний человека или животного. И вновь моноклональные антитела оказываются незаменимыми в такой диагностике, так как направлены против конкретных поверхностных антигенов.
2.4. Персональные диагностические наборы.
Наиболее широко сейчас используются персональные наборы для определения беременности в домашних условиях. В их основе лежит цветная реакция взаимодействия хорионического гонадотропина мочи с соответствующими моноклональными антителами. Несомненно, большую перспективу могли бы иметь подобные наборы для ранней диагностики опухолевых и инфекционных заболеваний, для определения нежелательных примесей в воде, пищевых продуктах, лекарствах и парфюмерных товарах.
2.5. Использование моноклональных антител в препаративных целях.
С развитием методов генной инженерии особенно остро встал вопрос о необходимости наладить выделение генноинженерных продуктов из их источников (бактериальных и дрожжевых клеток и др.). Часто генноинженерные (или их еще называют рекомбинантные) белки используются в качестве компонентов фармакологических препаратов, производимых в промышленных масштабах, поэтому предъявляются особые требования к их чистоте и к стоимости их очистки . В этом случае выделение белков и пептидов с помощью моноклональных антител практически не имеет конкурентов, так как может производиться в один этап и с высокой степенью очистки.
Наиболее распространенным методом выделения белков с использованием моноклональных антител стала аффинная хроматография. Основной ее принцип заключается в следующем:
На полимерные гранулы (например, сефароза), называемые иначе сорбентом, химически пришивают молекулы моноклональных антител, и эти гранулы помещают в хроматографические колонки. Далее через эти колонки пропускают растворы (экстракты), из которых хотят выделить нужное вещество, при этом используют такие условия (величина ионной силы раствора, рН, температура и др.), когда с монАТ связываются только требуемые компоненты раствора, а все остальные вымываются. После тщательной промывки колонки от несвязавшихся веществ производят элюцию (смыв) тех веществ, которые специфически связались с монАТ на сорбенте, используя для этого предварительно подобранные условия элюции (изменяют рН раствора, ионную силу и др.). В результате относительно несложной процедуры получают практически чистый препарат белка или пептида. Примерно такой же подход применяют и в исследовательских целях, когда хотят обогатить образец конкретным веществом для последующего его использования в других методиках.
2.6. Применение моноклональных антител в терапии.
По сравнению с диагностикой и препаративным выделением, моноклональные антитела пока не очень широко используются для лечения заболеваний, и этому есть целый ряд причин:
а) бактериальные инфекции удобней лечить с помощью таких более доступных средств, как антибиотиков или солевых растворов (как, например, при лечении холеры);
б) вирусы, являясь внутриклеточными паразитами, плохо доступны для моноклональных антител.
Пожалуй, наиболее перспективным направлением для использования моноклональных антител в терапии- это нейтрализация токсинов и терапия опухолей, где антитела против опухоле-ассоциированных антигенов пытаются использовать в целенаправленной транспортировке лекарственных средств к раковым клеткам. В последнее время появились сообщения о получении человеческих монАТ, избирательно вызывающих апоптоз опухолевых клеток, и не действующих на здоровые.
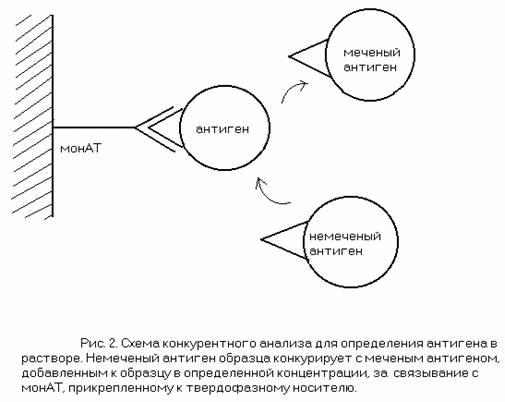
Помимо этого ведутся работы по разработке вакцин на основе моноклональных антител. Теоретическая основа существования таких вакцин основана на концепции антиидиотипических антител «внутреннего образа»: если моноклональные антитела направлены против антиген- связывающего участка других моноклональных антител, они иногда копируют участок антигена, то есть несут «внутренний образ» этого антигена и способны вызывать антиген-специфический иммунный ответ. (Рис. 3). Именно такие антитела или их Fv-фрагменты и предложено использовать в составе вакцин вместо антигена.
Еще одним возможным аспектом применения моноклональных антител в терапии является использование антител, обладающих самостоятельной ферментативной активностью, либо способных влиять на активность различных ферментов. Механизм действия таких антител (иначе их называют абзимы) заключается в том, что а) антитело может быть направлено к активному участку фермента и мешать (помогать) осуществлению ферментом своей функции; б) антитело может быть направлено против молекулы субстрата или к переходному от субстрата к продукту соединению и таким образом может понижать (или повышать) энергетический барьер превращения субстрата в продукт (то есть фактически самостоятельно выполнять функции фермента).
Основные проблемы, возникающие при использовании монАТ в терапии:
а) Подавляющее большинство получаемых монАТ имеет животное происхождение (мышиные или крысиные), в результате чего иммунная система человека воспринимает их как чужеродный белок и быстро разрушает. МонАТ при этом не успевают проявить свое лекарственное действие.
б) Некоторые монАТ нечеловеческого происхождения могут связывать и выводить из строя жизненно важные молекулы в организме человека, иногда это может привести к летальному исходу (например, агглютинация (склеивание) клеток крови под воздействием антител против поверхностных антигенов).
в) Мышиные и крысиные монАТ являются для человека сильным иммуногеном, и введение их в терапевтических дозах может вызывать аллергические реакции вплоть до анафилактического шока.
Во избежание всех этих неприятностей необходимо использовать для лечения антитела не животного, а человеческого происхождения.
Масштаб использования моноклональных антител в современном мире таков, что, если бы создатели технологии по получению монАТ запатентовали свое открытие, то суммарный патентный сбор превысил бы годовой бюджет всей Великобритании.
3.Основные этапы получения моноклональных антител методом гибридомной технологии.
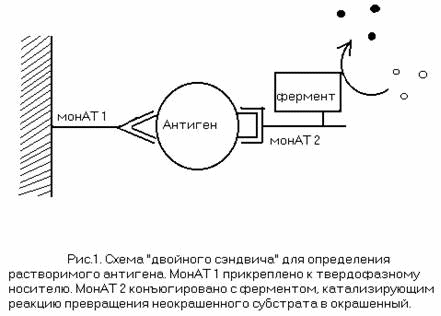
Долгое время единственным источником монАТ были опухолевые линии антитело- продуцирующих клеток миеломы и плазмацитомы, выделенные из больных людей и животных. Такие клетки могли быть адаптированы к росту в культуральных средах и секретировать моноклональные антитела, но было очень трудно и зачастую даже невозможно определить антиген, к которому эти антитела были направлены. Понятно, что использование таких монАТ было очень ограничено. Ситуация кардинально изменилась в 1975 году, когда ученые Kohler иMilshtein предложили метод получения моноклональных антител предопределенной специфичности, за что позднее были удостоены Нобелевской премии.
Смысл гибридомной технологии заключается в создании гибридной клетки (получившей название «гибридома»), получаемой путем слияния антитело- продуцирующего В-лимфоцита и опухолевой клетки миеломного или плазмацитомного ряда. (Рис.4). Такая гибридома обладает свойством секретировать антитела, взятой у В-лимфоцита, и способностью к бесконечному делению, взятой у опухолевой клетки.
Источником В-лимфоцитов для получения гибридомы служат лимфоидные органы животного, гипериммунизированного тем антигеном, против которого хотят получить монАТ. Гипериммунизация сильно повышает процентное содержание В-лимфоцитов, продуцирующих антитела желаемой специфичности, в общей популяции клеток лимфоидного органа. Лимфоциты, выделенные из тканей селезенки,лимфоузлов, периферической крови, не способны к самостоятельному делению и живут в культуре всего 10-14 дней. Миеломные клетки, напротив, могут жить и делиться в культуре сколь угодно долго, но не продуцируют антитела нужной специфичности (чаще используют линии миелом или плазмацитом, вообще не продуцирующие никаких антител).
В результате процедуры гибридизации (слияния) образуется гетерогенная популяция клеток, состоящая, во-первых, из неслившихсяклеток лимфоидного органа; во-вторых, из неслившихся клеток миеломы; в-третьих, из гибридов лимфоцит+лимфоцит и миелома+миелома; в четвертых, из гибридов лимфоцит+миелома, из которых лишь часть (часто весьма небольшая) стабильно продуцирует антитела нужной специфичности. Понятно, что необходимо отделить интересующие клетки от всех остальных. От неслившихся лимфоцитов и гибридовлимфоцит+лимфоцит избавляться не нужно: через несколько дней они умрут сами; от неслившихся опухолевых клеток и гибридов миелома+миелома избавляются с помощью селективных сред (подробности ниже); среди оставшихся клеток (гибридов лимфоцит+миелома) отбирают нужные путем клонирования, когда из одной клетки выращивают популяцию клеток (клеточный клон) и отбирают среди таких клонов лишь те, которые стабильно продуцируют антитела требуемой специфичности.
Секрецию антител определяют различными методами скрининга супернатантов гибридом, другими словами, проводят анализ тойкультуральной среды, в которой рос конкретный клон. При наличии в супернатанте желаемых антител проводят еще одно или несколькоклонирований, затем клетки нарабатывают для получения большего количества антител либо в культуре, либо в перитонеальной полости мышей (крыс). Далее антитела выделяют из культуральной или асцитной жидкости и проводят более детальные исследования на предмет их пригодности для использования в тех целях, для которых монАТ были получены. Клетки–продуценты можно заморозить и хранить в жидком азоте долгое время.
Рассмотрим теперь подробнее каждый из этапов получения монАТ:
4. Иммунизация.
Иммунизация- самый «творческий» этап в процессе получения моноклональных антител, именно эффективностью иммунизации определяется в наибольшей степени конечный успех всего предприятия. Тут невозможно дать какой-то единый рецепт, поскольку выбор схемы иммунизации и использование различных приемов, повышающих эффективность иммунизации, целиком зависят от свойств конкретного антигена.
3.1.1.Выбор объекта иммунизации.
В первую очередь необходимо выбрать объект иммунизации. На сегодняшний день известны три вида гибридомных систем: мышиная, крысиная и человеческая. Самой распространенной сегодня является мышиная гибридома, а самая редкая- человеческая, чему имеется ряд причин:
а) Мыши- наиболее хорошо изученный и доступный объект для работы в лаборатории, то же относится и к линиям мышиных миелом, используемых для слияния.
б) Все линии крысиных миелом, адаптированные для гибридомных работ, запатентованы, поэтому коммерческое использование крысиных гибридом регламентируется соответствующими патентами. Все мышиные линии миелом свободны от патентных ограничений.
в) Гипериммунизацию грызунов провести проще, чем иммунизацию человека. В большинстве случаев гипериммунизация человека вообще невозможна по этическим соображениям.
г) Источником иммунных В-лимфоцитов грызунов могут служить ткани любых лимфоидных органов, тогда как у человека возможно лишь взять периферическую кровь, где общее содержание В-лимфоцитов не превышает 20% от всех клеток. В редких случаях можно использовать удаленные миндалины пациентов, где содержание В-лимфоцитов может достигать 60%, но они, как правило, инфицированы и секретируют антитела именно против этого инфекционного агента.
д) При получении человеческой гибридомы существует проблема гистосовместимости клеток миеломы и В-лимфоцитов: у грызунов для слияния берутся В-лимфоциты и клетки миеломы, полученные от одной линии животных, и поэтому имеющих сходный репертуар антигенов гистосовместимости на клеточных поверхностях. Для человека это условие недостижимо, что в конечном итоге выражается очень низкой эффективностью слияния и крайне нестабильной антителопродукцией человеческих гибридом.
е) Мышиные и крысиные антитела достаточно просто нарабатывать в асцитных жидкостях; для человеческих гибридом возможна наработка лишь в культуре, либо с применением генноинженерных методов.
Для иммунизации мышей чаще всего используют линию BALB/c, все линии мышиных миелом происходят от этой линии. В случае низкоиммуногенных антигенов можно попытаться иммунизировать мышей другой линии, к некоторым антигенам они дают более сильный иммунный ответ по сравнению с BALB/c. Наработку таких гибридом в асцитных жидкостях производят на потомках первого поколения, полученных от скрещивания BALB/c и линии, использованной для иммунизации.
Для иммунизации крыс литература настойчиво рекомендует линию LOU/C, но вполне удовлетворительные результаты получаются с более доступными в нашей стране крысами линии WISTAR.
4.1.Схемы иммунизации мышей.
4.1.1.Короткая схема иммунизации.
Наиболее любима нашей лабораторией короткая схема иммунизации, когда антиген вводят дважды с двухнедельным интервалом в подушечки задних лап. Количество вводимого антигена берут в пределах от 5 до 200мкг на мышь в зависимости от его доступности и иммуногенности, для токсичных антигенов доза может быть понижена до 0,1мкг. Для первого введения антигена (раунда иммунизации) раствор антигена объемом 50-200 мкл смешивают с полным адъювантом Фрейнда (ПАФ), представляющего собой минеральное масло совзвесью убитых микобактерий. При активном перемешивании раствора антигена с ПАФ получается мелкодисперсная эмульсия, призванная замедлить и пролонгировать поступление антигена в ткани. Считается, что убитые микобактерии усиливают иммунный ответ, что, однако, у многих исследователей вызывает сомнение. Второй раунд иммунизации проводят так же, как и первый, но с использованием неполного адъюванта Фрейнда (НАФ), в котором отсутствуют микобактерии.
В случае проблемных антигенов полезно иммунизировать группу животных разными дозами антигена и с использованием разных схем иммунизации. На третий или четвертый день после второго раунда иммунизации нужно взять пробы крови и проанализировать их на содержание антител против требуемого антигена. Для дальнейшей работы выбирают животное с максимальным титром, исключение составляют антигены- белковые токсины, где иногда высокий титр специфических антител сочетается с большим процентом убитых токсином В-лимфоцитов. В таких случаях нужно брать животное, имеющее не самый высокий титр и/или обращать внимание на жизнеспособность клеток, берущихся для слияния.
На четвертый день после второго раунда иммунизации животное забивают, и клетки подколенных лимфоузлов сливают с клетками миеломы.
4.1.2. Длинные схемы иммунизации.
В случае неэффективности короткой схемы иммунизации пробуют различные виды длинных схем. При этом обычно животных иммунизируют с интервалом 2-4 недели либо внутрибрюшинно, либо подкожно (реже внутривенно или орально), используя для первого раунда иммунизации ПАФ, а для последующих- НАФ.
На 10-14 день после каждого раунда иммунизации (начиная со второго) кровь иммунизируемых животных проверяют на содержание специфических антител. Если титр антител достиг желаемого уровня, проводят последний раунд иммунизации (называемый бустированием), вводя раствор антигена внутривенно без адъювантов, в количестве 1/10 от предыдущих доз. В результате бустирования избирательно стимулируются клоны, продуцирующие антитела высокой аффинности к антигену.
4.2. Некоторые приемы, позволяющие усилить иммунный ответ.
4.2.1. Конъюгация (химическая сшивка) низкомолекулярного антигена (гаптена) с белком- носителем.
Существует целый ряд низкомолекулярных соединений, не способных самостоятельно вызвать иммунный ответ по причине малого размера молекулы. В таких случаях гаптен конъюгируют с белком- носителем (часто в качестве белка- носителя берут бычий сывороточный альбумин, яичный альбумин или гемоцианин улитки) и такой конъюгат используют для иммунизации. При этом возникает целый ряд проблем:
а) Основной иммунный ответ будет направлен на белок- носитель, а не на молекулу гаптена, и это нужно будет учитывать при тестировании сывороток иммунизируемых животных и супернатантов гибридом. Тестирование должно отражать содержание антител именно к гаптену, а не к конъюгату в целом.
б) Пространственное строение гаптена (конформация), как правило, существенно изменяется в процессе конъюгирования с носителем, иногда настолько, что все антитела против участков гаптена, находящегося в составе конъюгата, не способны узнавать свободную молекулу гаптена. В таких случаях пробуют разные варианты конъюгирования, которые затрагивают при сшивке разные функциональные группы молекулы гаптена, либо используют разные «линкеры»- органические соединения, связывающие функциональные группы гаптена и белка- носителя и увеличивающие экспонированность гаптена на поверхности носителя.
В целом метод конъюгирования хорошо зарекомендовал себя при получении антител против низкомолекулярных соединений.
4.2.2. Иммунизация иммунными комплексами (антиген- антитело).
Метод применяют, когда антигеном является консервативный низкоиммуногенный белок, либо, когда хотят получить антитела против минорных антигенных детерминант, на которые при иммунном ответе направлен очень низкий процент всех специфических антител. В первом случае антительным компонентом иммунного комплекса могут служить монАТ с неудовлетворительной аффинностью, полученные ранее после обычной иммунизации. Во втором случае берут монАТ против сильных антигенных детерминант, получение которых не представляет большой сложности.
Примером успешного использования такого подхода может служить получение антител против человеческого эритропоэтина, α и γ интерферонов, иммуноглобулинов близкородственных видов (крысиные монАТ против IgG мыши).
4.2.3. Конъюгация с адъювантным белком (hsp70).
Встречаются антигены, которые в силу своей сверх-консервативности не способны вызвать сколько-нибудь заметный иммунный ответ, несмотря на свою белковую природу и достаточный молекулярный вес (например, гемоглобин, некоторые ферменты). Выходом здесь может стать конъюгирование их с белком теплового шока (heat shock protein 70kDa, hsp70). Имеются данные, что hsp70 облегчает презентацию пептидных фрагментов, экспонируя их определенным образом, на практике же конъюгирование белков и пептидов с hsp70 приводит, как правило, к резкому усилению выработки антител против этих белков и пептидов.
Однако, случается полное подавление иммунного ответа в результате конъюгирования с hsp70, которое мы неоднократно наблюдали при иммунизации конъюгатом hsp70- интерферон γ.
4.3. Предварительная обработка антигенов перед иммунизацией.
а) Токсичные антигены часто подвергают денатурации нагреванием или добавлением денатурирующих агентов (мочевины, гуанидилхлорида и др.). Токсичность при этом снижается (не всегда), но утрачиваются многие антигенные детерминанты, присущие неденатурированному (нативному) антигену. В результате получаемые монАТ узнают лучше денатурированный антиген.
б) Иногда молекулы антигена сшивают друг с другом (полимеризуют) с целью увеличения молекулярного веса и/или уменьшения токсичности.
в) Вирусы и бактерии перед иммунизацией, как правило, инактивируют нагреванием, либо обработкой фенолом, формальдегидом, глутаральдегидом и др. для уменьшения их токсичности и эпидемиологической опасности. Грамотрицательные бактерии, кроме того, иногда обрабатывают лизоцимом, чтобы убрать ЛПС с их поверхности и обеспечить иммунный ответ против бактериальных белков.
5. Гибридизация В-лимфоцита с клеткой миеломы.
Отцы гибридомной технологии Келер и Мильштейн добивались слияния клеток при помощи вируса Сендай. Сейчас для этой цели все используют полиэтиленгликоль (ПЭГ), как более удобное, эффективное и безопасное средство. Формула ПЭГ:
HO(CH2CH2O)n CH2CH2OH , молекулярный вес ПЭГ, пригодного для слияния, от 20 до 20000, но чаще используют ПЭГ массой 600-6 000.
Полиэтиленгликоль токсичен для клеток, и его токсичность возрастает с уменьшением молекулярного веса. Слияние клеток происходит во время инкубации их в 35-50% ПЭГ, время инкубации зависит от концентрации ПЭГ и от его молекулярного веса (для 50% ПЭГ мол. веса 1 500 это приблизительно 1 минута). Недостаточное время инкубации приведут к очень низкому проценту слившихся клеток, а избыточное- к большому проценту погибших клеток вследствие токсичности ПЭГ. Хорошо работает такой компромиссный вариант, когда клетки сначала инкубируются при мягком перемешивании в 50% ПЭГ в течение 1 мин, затем процент ПЭГ снижается до 35% медленным добавлением бессывороточной среды, и клетки инкубируются еще 5-7 минут. Затем медленно, но с нарастающим темпом и при аккуратном перемешивании суспензия клеток далее разбавляется средой, потом центрифугируется и высевается на культуральные планшеты.
Точный механизм гибридизации клеток еще недостаточно изучен. Вначале, по-видимому, происходит агглютинация (склеивание) клеток, затем слияние клеточных мембран и, наконец, слияние ядер и перестройки хромосомного материала. Имеются данные, что сливаются, в основном, клетки, находящиеся в стадии интенсивного деления. По этой причине клетки миеломы за 12-24 часа до гибридизации переводят в условия, способствующие максимальной скорости роста клеток (повышение содержания фетальной сыворотки, витаминов и ростовых факторов в культуральной среде). Иммунизация в свою очередь стимулирует рост клонов В-лимфоцитов- продуцентов специфических к антигену антител.
6. Культивирование клеток.
Обычные условия культивирования миеломных и гибридомных клеток- 37°С и 5% СО2. Основа культуральной среды- это разные варианты предлагаемых на рынке сред DMEM или RPMI 1640, представляющих собой раствор солей, аминокислот, витаминов, углеводов и питательных добавок в разных концентрациях и цветового индикатора кислотности (как правило, феноловый красный). Кроме этого к среде добавляют эмбриональную телячью сыворотку или ее синтетические или полусинтетические заменители до концентрации 3-20% как источник белка и ростовых факторов. Качество сыворотки в наибольшей степени влияет на скорость роста клеток, особенно гибридомных, как более капризных по сравнению с миеломными. Помимо сыворотки в среду добавляют пируват натрия, антибиотики, глутамин (если он не содержался в исходной среде), реже- оксалоацетат, бета-меркаптоэтанол, инсулин и др.
Для культивирования клеток при низкой клеточной плотности (особенно при клонировании, когда из одной- единственной клетки в лунке необходимо вырастить целый клон) используют так называемый фидерный слой клеток (или просто фидер), облегчающий эту задачу. Клетки фидера не должны самостоятельно делиться, они призваны обеспечивать гибридомные клетки необходимыми для роста цитокинами и создавать клеточные контакты. В качестве фидера можно использовать клетки тимуса, селезенки, лимфоузлов, перитонеальной полости животных того вида, который использовался для получения иммунных В-лимфоцитов. Фидер от животных другого вида тоже может быть использован, но с меньшей эффективностью.
Культивирование клеток необходимо проводить в условиях, максимально приближенных к стерильным. Попавшие в культуру клеток бактерии и грибы, опережая гибридомы в скорости роста, очень быстро исчерпают питательные вещества ростовой среды и насытят ее своими токсинами. Это приведет к неизбежной гибели гибридомных клеток. Во избежание инфицирования пользуются стерильными ростовыми средами и стерильной культуральной посудой, применяют антибиотики, а все манипуляции с клетками проводят в условиях минимальной осемененности микробами (в ламинарном боксе с принудительной подачей стерильного воздуха).
Особую проблему представляет заражение клеток внутриклеточными паразитами- вирусами и микоплазмой. Детектировать их достаточно сложно, они, как правило, не убивают всю культуру гибридомных клеток и с легкостью переносятся от одной культуры к другой. Вирусы и микоплазма фильтруются сквозь бактериальные фильтры, поэтому фильтрование ростовых сред и воздуха в ламинарном боксе становятся неэффективными при борьбе с ними. Заражение клеток вирусами или микоплазмой приводит к резкому замедлению роста клеток, особенно в малой их плотности, а также к усиленной потере гибридомами их способности секретировать антитела. Против микоплазмы существуют специальные антибиотики, а против вирусов- интерфероны, но они помогают лишь снизить степень инфицированности клеток, не избавляя их от инфекции полностью. Более действенным является сочетание антибиотиков с неоднократным проведением зараженной культуры через организм животного, где клетки могут расти в виде асцитной жидкости и использовать иммунную систему животного против инфекции.
7. Методы селекции слившихся клеток.
7.1. Использование селективных сред.
Считается неплохим результатом гибридизации, когда сливается одна пара клеток из 10 000. Для удаления неслившихся миеломных клеток (неслившиеся В-лимфоциты отмирают сами через несколько дней) чаще всего используют негативную селекцию на селективных средах, смысл которой заключается в следующем: В клетках млекопитающих имеется два пути синтеза пуринов (предшественников нуклеотидов)- основной и запасной. Для осуществления запасного пути требуется фермент гипоксантинфосфорибозилтрансфераза (ГФРТ), который отсутствует у миеломных клеток. Линии миеломных клеток, пригодные для гибридомной технологии, имеют мутацию, в результате которой клетки не способны синтезировать ГФРТ и осуществлять запасной путь синтеза пуринов. Отбор мутантов и удаление спонтанно возникающих нормальных миеломных клеток производят с помощью 8-азагуанина или 6-тиогуанина. В-лимфоциты, как изначально нормальные, способны использовать оба пути синтеза пуринов.
После процедуры гибридизации клетки высевают в среде, содержащей аминоптерин, который блокирует основной путь синтеза пуринов. В результате неслившиеся клетки миеломы (и гибриды миелома+миелома) погибают, так как оказываются лишенными и основного (блокированного аминоптерином) и запасного (потерянного в результате мутации) путей синтеза пуринов. Способными к росту оказываются лишь гибриды миелома+лимфоцит, взявшие у исходных лимфоцитов способность к осуществлению запасного пути синтеза пуринов.
После отмирания основной массы неслившихся клеток ростовую среду постепенно заменяют на свежую, не содержащую аминоптерин, так как он мешает нормальному функционированию клеток.
7.2.Использование проточного цитофлуориметра.
Проточный цитофлуориметр позволяет отсортировывать клетки, которые несут на своей поверхности флуоресцентную метку.Использование проточного цитофлуориметра для отбора гибридных клеток состоит в следующем: Смесь иммунных лимфоцитов и клеток миеломы подвергают стандартной процедуре слияния; затем полученную суспензию клеток инкубируют с раствором антигена, против которого хотят получить монАТ, предварительно конъюгированного с флуоресцентной меткой (например, ФИТЦ- флуоресцеинизотиоцианат). В-лимфоциты и гибриды лимфоцит+миелома имеют на своей поверхности молекулы иммуноглобулинов. В том случае, когда эти иммуноглобулины направлены против требуемого антигена, происходит связывание несущих их клеток с антигеном, а через него с флуоресцентной меткой. Затем с помощью прибора отсортировывают меченые клетки от всех остальных и получают популяцию клеток, состоящую в основном из гибридом, секретирующих антитела против желаемого антигена, и неслившихся В-лимфоцитов, не способных к делению.
Достоинства этого метода селекции по сравнению с методом селективных сред состоят в следующем:
а) отбираются не все гибриды лимфоцит+миелома, а только те, которые секретируют антитела к нужному антигену;
б) партнеры для гибридизации могут не быть мутантами (ГФРТ негативными), поэтому этот метод селекции особенно полезен при получении биспецифических антител, когда для слияния берут две гибридомы, секретирующие антитела разной специфичности.
Недостатки метода:
а) далеко не все лаборатории имеют в своем распоряжении этот весьма дорогостоящий прибор, требующий к тому же квалифицированного оператора;
б) процедура гибридизации довольно травматична для клеток, а дополнительные манипуляции с ними после гибридизации неизбежно приведут к большей их гибели.
8. Скрининг супернатантов гибридом.
Через несколько дней после процедуры слияния заметен рост гибридомных клонов на фоне отмерших неслившихся миеломных клеток и меньших по размеру неделящихся В-лимфоцитов. На 6-14 после слияния день, когда размер клонов обычно достигает нескольких сотен клеток, необходимо протестировать супернатанты гибридом на содержание антител к требуемому антигену (иначе говоря, провести скрининг). Необходимость в раннем скрининге диктуется следующими причинами:
а) после отмирания неслившейся миеломы популяция делящихся клеток может содержать в себе гибридомы, секретирующие антитела к постороннему антигену либо антитела к требуемому антигену, но неудовлетворительной аффинности;
б) небольшая часть миеломных клеток может выжить на селективной среде вследствие обращения мутантного гена в нормальный, свободные от секреции такие ревертанты быстро перерастут гибридомы- продуценты антител;
в) после гибридизации клетки приобретают дополнительный хромосомный набор, что делает клетку генетически неустойчивой. Это приводит к активным геномным перестройкам и выбросу лишних хромосом в первые дни и недели после гибридизации. Клетка, лишившаяся таким образом обременительной для себя секреции антител, опередит в росте секретирующие клетки.
8.1.Иммуноферментный анализ.
Наиболее распространенным сегодня методом скрининга является твердофазный иммуноферментный анализ (ИФА). Общая схема имунноферментного анализа:
1) прикрепление молекул антигена на дне лунок 96-луночного планшета;
2) отмывка несвязавшегося антигена;
3) блокировка мест связывания на планшете, свободных от молекул антигена;
4) отмывка блокирующего раствора;
5) инкубация с исследуемыми образцами (например, супернатантами гибридом); в процессе инкубации должно происходить связывание молекул антигена с молекулами антител (если они имеются в исследуемом образце);
6) отмывка от несвязавшихся с антигеном компонентов исследуемых образцов;
7) инкубация с раствором конъюгированных с ферментом антител, направленных против предполагаемых антител образца;
8) отмывка от несвязавшихся конъюгированных с ферментом антител;
9) инкубация с раствором неокрашенного субстрата фермента до развития окраски вследствие ферментативной реакции;
10) остановка ферментативной реакции;
11) оценка интенсивности окраски.
Приведенная схема отражает лишь один, самый распространенный вариант иммуноферментного анализа. Рассмотрим подробнее вышеперечисленные этапы ИФА:
8.1.1. Прикрепление (сорбция) антигена.
Обычно антиген сорбируют на полистиреновых или поливиниловых 96- луночных планшетах, инкубируя раствор антигена в течение ночи при 4°С или 1-4часа при 37°С. Условия сорбции зависят от природы антигена, большинство растворимых белков хорошо сорбируется в фосфатно-солевом (рН 7,0-7,5) или бикарбонатном (рН 8,5-9,0) буфере в концентрации 1-10мкг/мл. Выбор концентрации антигена определяется его способностью неспецифически взаимодействовать с посторонними компонентами исследуемых образцов и мечеными антителами, а также доступностью антигена. Пептиды (особенно мелкие) и нуклеиновые кислоты сорбируются значительно хуже белков, а липиды возможно лишь сорбировать высушиванием их в лунках в смеси этанол/хлороформ.
Клеточные антигены и вирусные частицы можно сорбировать при обычных для белков условиях, если клетки или частицы хорошо очищены от примесей и инкубируются в достаточно высокой концентрации (108 клеток/мл). В ряде случаев приходится прибегать к таким уловкам, как высушивание образцов, фиксация глутаральдегидом, сорбирование на планшеты, предварительно покрытые поли-Л-лизином, и др. Однако, если в образце слишком маленькая концентрация клеток и большое количество посторонних включений, все эти приемы оказываются неэффективными.
Низкомолекулярные соединения чаще всего нереально сорбировать обычной инкубацией, поэтому их, как правило, сорбируют в составе конъюгата с белком- носителем.
При сорбции довольно часто происходит частичное или полное искажение антигенных детерминант, иногда антитела хорошо связывают свободный и практически не узнают сорбированный антиген, но чаще наблюдается обратная картина: антитело отлично связывает сорбированный антиген и почти или совсем не узнает антиген в растворе.
8.1.2. Отмывка несвязавшихся компонентов растворов.
Отмывку планшета от несвязавшихся компонентов инкубируемых растворов проводят после каждого этапа инкубации за исключением последнего, когда планшет инкубируют с ферментными субстратами до развития окраски. Несвязавшиеся вещества отмывают обычнофосфатно- солевым буфером (ФСБ) с добавлением детергента Tween 20 при концентрации последнего 0,05-0,1%. Tween 20 уменьшает уровень неспецифических взаимодействий и способствует забивке свободных мест связывания на планшете. Обычно процедура отмывки производится заполнением лунок планшета отмывающим раствором и последующим резким вытряхиванием этого раствора из перевернутого планшета, и повторяется 3-5 раз после каждой инкубации. Сейчас рынок предлагает целый ряд приборов, частично или полностью автоматизирующих рутинную процедуру отмывки планшетов для ИФА.
8.1.3. Блокировка (забивка) несвязавшихся участков планшета после сорбции антигена.
Применение Tween делает дополнительную забивку необязательной; в тех случаях, когда Tween не используют или его блокирующие свойства не достаточны, производят инкубацию планшета с блокирующим раствором. Таким раствором может быть 0,5-1% раствор бычьего сывороточного альбумина в ФСБ, раствор желатина, казеина, овальбумина, обезжиренное сухое молоко и др. Если антиген проявляет свойства лектина, т.е. связывает определенные углеводы, необходимо добавлять в блокирующий раствор и во все растворы при последующих инкубациях (за исключением последней инкубации с ферментными субстратами) избыток этого углевода, чтобы избежать неспецифического присоединения антигена к углеводному компоненту антител.
8.1.4. Инкубирование с исследуемыми образцами.
В качестве исследуемых образцов в ИФА могут выступать супернатанты гибридом, сыворотки иммунных животных, любые растворы, которые хотят проверить на содержание антител к конкретному антигену. Инкубацию обычно проводят в течение 1 часа при 37°С, но возможны варианты.
Супернатанты можно наносить в лунки без разведения, но предпочтительнее разбавлять их в соотношении 1:1 в 1%-ом растворе БСА (бычьего сывороточного альбумина) с Tween 20 для уменьшения неспецифического взаимодействия. Если в качестве сорбированного антигена использовался конъюгат с белком носителем, супернатанты полезно наносить в растворе, содержащем избыток белка- носителя, для того, чтобы антитела против носителя с ним связались, затем отмылись и не участвовали в дальнейшем анализе. В такой системе основной вклад в формирование конечного сигнала дают антитела, направленные против гаптена (или линкера), а не носителя.
Сыворотки почти всегда тестируют, делая их серийные разведения в ФСБ-БСА-Tween. Неразведенные сыворотки содержат слишком большое количество антител и других белков, что неизбежно приведет к слишком большому уровню неспецифического связывания. Полезно параллельно с иммунной сывороткой таким же образом титровать и преиммунную, чтобы оценить уровень неспецифического связывания при каждом разведении сыворотки.
При нанесении любых тестируемых образцов на планшете для каждого антигена должны быть оставлены лунки, лишенные тестируемой пробы (отрицательный контроль). При тестировании супернатантов таких отрицательных контролей должно быть несколько: во-первых, лунка, содержащая лишь тот буфер, в котором были разведены остальные супернатанты; во-вторых, лунка, содержащая ростовую среду, разведенную этим буфером; в-третьих, лунка, содержащая супернатант иммунных В-лимфоцитов, не подвергшихся процедуре гибридизации с миеломными клетками. Постановка всех этих контролей позволит судить о том, какой вклад в формирование сигнала вносят:
а) неспецифическое связывание с антигеном антител, меченых ферментом (сигнал в лунке с буфером),
б) неспецифическое связывание компонентов ростовой среды (сигнал в лунке с ростовой средой),
в) вклад специфических к антигену антител, секретируемых неслившимися В-лимфоцитами, присутствующими в каждой лунке культурального планшета, куда высевались клетки после слияния.
Делать выводы о секреции гибридомой антител против требуемого антигена можно лишь при всех удовлетворительно низких отрицательных контролях.
В тех случаях, когда сигнал в контрольных лунках (иначе говоря, фон) слишком высок, принимают меры, позволяющие его снизить. Если «фонят» меченые ферментом антитела, снижают их концентрацию и/или меняют буфер, в котором они наносились, и условия инкубации (инкубируют при комнатной температуре вместо 37°С, используют при инкубации шейкер, сокращают время инкубации и т.д.). Иногда помогает снижение концентрации сорбированного антигена. При неэффективности этих мер пробуют использовать меченые антитела из других источников, либо другого происхождения (например, кроличьи заменяют козьими или свиными), либо несущие другую ферментную метку. Проверку меченых антител и подбор условий инкубирования производят заблаговременно.
Компоненты ростовой среды редко влияют на уровень фона, основной вклад здесь вносят белки (особенно иммуноглобулины и комплемент), содержащиеся в эмбриональной телячьей сыворотке. В таком случае обычно помогает уменьшение концентрации сорбируемого антигена.
Довольно часто высокий фон наблюдается в лунке, куда нанесли супернатант от иммунных В-лимфоцитов, не гибридизованных с миеломой. Такой фон хорошо прогнозируется по уровню титра специфических антител в сыворотке животного, используемого как источника В-лимфоцитов. Выходом здесь является смена ростовой среды во всех лунках культурального планшета, производимая столько раз, сколько требуется для удаления большей части антител, секретируемых неслившимися В-лимфоцитами.
Условия инкубации исследуемых образцов можно варьировать, если хотят повысить чувствительность метода (отношение сигнал/фон). Для уменьшения фона можно понизить температуру и уменьшить время инкубации, использовать во время инкубации шейкер, для увеличения положительного сигнала время инкубации, напротив, увеличивают. При использовании светочувствительных антигенов все процедуры ИФА проводят, по возможности, в темноте или при красном свете. В случае антигенов, не устойчивых к действию протеолитических ферментов (протеазы могут содержаться в исследуемых сыворотках и супернатантах как компоненты ростовой среды), в инкубируемые образцы добавляют ингибиторы протеаз (PMSF, aprotinin и др.).
8.1.5. Инкубирование с мечеными ферментом антителами.
Обычные условия инкубации: 1час при 37°С в фосфатно-солевом буфере. В качестве антител, конъюгированных с ферментом, обычно используют очищенную поликлональную сыворотку животных (кролика, козы, овцы, свиньи, морской свинки и др.), гипериммунизированных мышиными антителами или их фрагментами. Если для гипериммунизации берут полную иммуноглобулиновую фракцию сыворотки мыши, то получаемая поликлональная сыворотка будет узнавать все изотипы мышиных антител, с большей чувствительностью IgG1, как доминантного в мышиной сыворотке.
В случае, когда хотят получить монАТ определенного класса (например, IgG), берут поликлональные антитела, направленные против иммуноглобулинов этого класса (или подкласса). При этом, однако, возможен отбор монАТ нежелаемых классов, так как такая поликлональная сыворотка будет содержать антитела, направленные против участков, общих для разных классов иммуноглобулинов. Во избежание этого используют сыворотку против Fc-фрагментов иммуноглобулинов желаемого класса.
Качество конъюгата зависит от способа очистки поликлональных антител. При высаливании сыворотки конъюгат будет содержать помимо антител примесь других белков, а среди выделенных антител будут не только те, что направлены против иммуноглобулинов мыши, но и «посторонние» антитела, что отразится в конечном итоге на степени чувствительности анализа. При очистке с помощью хроматографии на протеине А или протеине G содержание примесных белков будет ниже, но количество «посторонних» антител будет такое же, как при высаливании. Самой качественной считается очистка аффинной хроматографией на мышиных иммуноглобулинах того класса (подкласса), против которого хотят получить конъюгат.
Все упомянутые виды поликлональных антител против иммуноглобулинов мыши сегодня представлены на рынке, при их выборе учитывают цели, для которых предполагается их использовать, желаемый уровень чувствительности ИФА и цену. Ряд лабораторий использует самостоятельно получаемые конъюгаты.
В качестве фермента для ИФА чаще всего используют пероксидазу хрена (horseradish peroxidase или HRP), реже щелочную фосфатазу или бета-галактозидазу. Пероксидаза хрена имеет несколько субстратов, все они требуют добавления Н2О2. Для ИФА чаще используют растворимые субстраты ортофенилендиамин (ОФД) или тетраметилбензидин (ТМБ), причем ТМБ в последнее время вытесняет ОФД из употребления по причине канцерогенных свойств последнего. Пероксидаза хрена довольно легко конъюгируется с антителами, что, вероятно, и стало причиной ее популярности. Для конъюгирования используют, как правило, периодатный метод, при котором углеводные остатки пероксидазы соединяются с аминогруппами антител через формирование Шиффовых оснований.
При инкубации пероксидазного конъюгата нужно избегать присутствия в буфере азида натрия, ингибирующего ферментативную активность пероксидазы. Для уменьшения неспецифического связывания конъюгата с антигеном в буфер добавляют бычий сывороточный альбумин до концентрации 0,5-1% и Tween 20 (0,05%). Концентрацию конъюгата определяют экспериментальным путем:
а) в хорошо изученной системе берут оптимальное количество антигена для сорбции и насыщающее количество известных антител против антигена, параллельную дорожку оставляют без добавления антител;
б) титруют конъюгат параллельно на дорожке с антителами и на дорожке без антител;
в) считают отношение сигнала в лунке с антителами к сигналу в лунке без антител для каждого разведения конъюгата; выбирают разведение конъюгата, дающее максимальное отношение позитивный сигнал/фон и используют это разведение в дальнейшей работе. Время от времени нужно повторять процедуру определения оптимального рабочего разведения конъюгата, поскольку его активность со временем падает. О том, как нужно обращаться с фирменными конъюгатами, обычно подробно описывается в инструкциях.
8.1.6. Инкубирование с ферментными субстратами.
В настоящее время большинство лабораторий пользуется коммерческими наборами субстратов, имеющими подробные инструкции по их применению. Для пероксидазы хрена это, как правило, сухой ОФД или ТМБ, кислый буфер (цитратный для ОФД или ацетатный для ТМБ) и перекись водорода. Компоненты смешивают непосредственно перед использованием и инкубируют в лунках 10-20 минут до развития окраски (желтой в случае ОФД и голубой для ТМБ). Время инкубации может быть увеличено или уменьшено в зависимости от скорости окрашивания субстрата. Реакцию останавливают добавлением серной кислоты. Результат оценивают визуально или при помощи спектрофотометра, измеряя оптическую плотность при длине волны 492 нм (для ОФД) или 450 нм (для ТМБ).
8.1.7. Варианты иммуноферментного анализа.
Вышеописанный вариант ИФА часто хорошо работает при тестировании иммунных сывороток и супернатантов гибридом. Однако его существенным недостатком является необходимость сорбировать антиген в лунки планшета. При сорбировании антигена, как упоминалось выше, часто происходит изменение конформации антигенных детерминант, и происходит отбор монАТ, узнающих предпочтительно сорбированный антиген, а не свободный. Кроме того, для сорбции требуются значительные количества антигена, и при его дефиците имеются все основания попытаться использовать вариант ИФА с биотинилированным антигеном.
8.1.7.1. ИФА с использованием биотинилированного антигена.
Суть его заключается в следующем: На планшет сорбируют поликлональные антитела против иммуноглобулинов мыши (не конъюгированные с ферментом). Все описанные выше замечания для меченых «антимышиных» антител справедливы и в этом варианте ИФА для немеченых. После отмывки следует инкубация с супернатантами гибридом с соблюдением всех необходимых контролей. Во время этой инкубации мышиные антитела, содержащиеся в супернатантах, должны связаться с сорбированными антителами. Содержание гибридомных антител в супернатанте очень невелико по сравнению с содержанием в них других белков (особенно альбумина), поэтому напрямую сорбировать антитела на планшет в супернатантах не удается, и приходиться прибегать к помощи поликлональной гипериммунной сыворотки против мышиных антител.
После очередной отмывки в лунки планшета вносят раствор антигена, конъюгированного с биотином. При этом биотинилированного антигена требуется на порядок меньше, чем при сорбции на планшет. Во время этой инкубации гибридомные антитела должны связать антиген, а через него и биотин. При правильном конъюгировании биотина с антигеном часто (но не всегда) удается избежать изменения профиля антигенных детерминант, поэтому биотинилированный белок по своим антигенным свойствам часто ближе к нативному (природному), чем сорбированный.
Метод конъюгирования белкового антигена с биотином достаточно прост: белок должен находиться в буфере с нейтральным, а лучше сщелочным рН (скорость реакции биотинилирования возрастает с увеличением рН раствора) и в отсутствие активного азота (азид натрия или аммоний полностью блокируют реакцию). N-гидроксисукцинимидный эфир биотина растворяют в ДМСО (диметилсульфоксид) и инкубируют с раствором белка (1мг/мл) при комнатной температуре 4 часа или в холодильнике в течение ночи. Концентрацию биотина рассчитывают таким образом, чтобы на одну молекулу белка приходилось 1-20 молекул биотина (высокая степень биотинилирования увеличивает чувствительность анализа, но в то же время увеличивает риск изменения конформации антигенных детерминант белка). При использовании N-гидроксисукцинимидного эфира биотина последний присоединяется к свободным аминогруппам белка, использование других эфиров биотина позволяет присоединять его к другим группам. Реакцию останавливают добавлением азида или аммония.
Биотин имеет сродство порядка 1015М-1 к авидину (белку куриных яиц) и стрептавидину (бактериальному аналогу авидина), поэтому следующим после очередной отмывки этапом является инкубация с авидином или стрептавидином, конъюгированными с ферментом (чаще всего с HRP). В результате выстраивается цепочка: «антимышиные» антитела- монАт из супернатанта- биотинилированный антиген- стрептавидин- пероксидаза. Следующие затем инкубация с ферментными субстратами и оценка результатов идентичны вышеописанным. Пептидные антигены тоже могут быть использованы в этой системе, но риск изменения их антигенных свойств в процессе биотинилирования довольно высок.
Этот вариант ИФА плохо подходит для тестирования иммунных сывороток по той причине, что сыворотки содержат большое количество антител, не направленных против нужного антигена. Содержание таких «посторонних» антител в иммунных сыворотках превышает содержание специфичных к требуемому антигену антител в десятки и сотни раз, поэтому в основном с связываться сорбированной поликлональной сывороткой и участвовать в анализе будут такие «посторонние» антитела. Понятно, что чувствительность этого метода для сывороток будет неудовлетворительно низкой.
8.1.7.2. Конкурентный ИФА.
Описанные выше варианты ИФА не отвечают достоверно на вопрос о том, насколько способны антитела в сыворотке или супернатанте связывать именно свободный антиген (не сорбированный, не биотинилированный, не сшитый с белком- носителем). Конкурентный ИФА решает эту задачу, хотя он несколько сложнее в исполнении по сравнению с предыдущими. Выполняется он в два этапа. Первый этап похож на ИФА, описанный в разделах 8.1.1.- 8.1.6. Цель этого этапа состоит в том, чтобы, во первых, определить содержание в сыворотке или супернатанте антител, способных связываться с сорбированным антигеном или с конъюгатом гаптен- носитель; а во- вторых, подобрать такое разведение сыворотки или супернатанта, при котором практически все антитела против антигена (даже низкоаффинные) оказываются связанными с ним, то есть нет избытка антител, оптическая плотность при таком разведении будет находиться в пределах 0,3-0,5 оптических единиц.
Второй этап конкурентного ИФА выполняется по следующей схеме:
а) Сорбируется антиген (белок или конъюгированный с носителем гаптен) при тех же условиях, что и на первом этапе.
б) После отмывки в лунки наносят смесь, состоящую из супернатанта или сыворотки, взятых в тех разведениях, которые способны давать сигнал в пределах 0,3-0,5 оптические единицы, и серийных разведений свободного антигена (белка или гаптена без носителя). Обязательно должны быть лунки, где нет добавления свободного антигена.
в) Несвязавшиеся компоненты отмывают, и затем следует инкубация с мечеными ферментом антителами против иммуноглобулинов мыши. Инкубацию с ферментными субстратами, остановку реакции и оценку результатов проводят, как описано выше.
В процессе такой инкубации со смесью исследуемого образца и свободного антигена (гаптена) происходит следующее: Антитела, содержащиеся в исследуемом образце, оказываются поставлены перед выбором: реагировать с сорбированным на планшете антигеном (конъюгатом гаптен- носитель) или со свободным, находящимся в растворе, антигеном (гаптеном). В случае, когда антитела могут узнавать свободный антиген (гаптен), они связываются преимущественно с ним, а не с сорбированным. Это происходит потому, что скорость реакции взаимодействия двух веществ, находящихся в жидкой фазе, существенно выше, чем скорость взаимодействия в системе, когда одно из реагируемых веществ сорбировано на твердофазном носителе. Связавшиеся со свободным антигеном антитела оказываются не прикреплены к планшету и отмываются при последующих отмывках. Сигнал в таких лунках получается ниже, чем в тех, в которые не добавляли свободный антиген. При последовательном повышении содержания свободного антигена в лунках сигнал последовательно снижается вплоть до уровня фона, поскольку свободный антиген конкурирует с сорбированным за связывание с антителами в пробе и не позволяет им участвовать в дальнейшем анализе.
Если в пробе будет избыток антител к антигену, то их хватит и на связывание со свободным антигеном, и на связывание с сорбированным антигеном, и конкуренцию (понижение сигнала) фиксировать будет сложно или невозможно вовсе. Поэтому здесь важно избегать избытка антител и тщательно подбирать разведения сывороток и супернатантов.
В том случае, если антитела не узнают свободный антиген (белок или гаптен), добавление его к исследуемой пробе не окажет влияния на величину сигнала, поскольку не помешает антителам реагировать с сорбированным антигеном. Часто наблюдаются промежуточные варианты, когда антитела узнают свободный антиген, но с меньшей аффинностью, чем сорбированный или в составе конъюгата с носителем. В таких случаях конкуренция имеет место, но требуются большие концентрации свободного антигена, чтобы произошло понижение сигнала, и это понижение не достигает уровня фона.
Другие варианты конкурентного ИФА используются для того, чтобы определить, связываются ли два монАТ с одним и тем же участком антигена или с разными. Для этого одно из монАТ метят конъюгированием с ферментом (или чаще с более мелким биотином) и инкубируют смесь этих монАТ с сорбированным антигеном. При этом меченое антитело берут в одной концентрации (далекой от насыщения), а второе, немеченое, наносят в серийных разведениях. При наличии конкуренции между двумя монАТ за связывание с сорбированным антигеном наблюдается понижение сигнала с увеличением концентрации немеченого антитела.
8.1.7.3.Метод «двойного сэндвича», адаптированный для скрининга сывороток и супернатантов гибридом.
Выше упоминалось о том, как полезно для разработки тест- системы иметь монАТ к разным антигенным детерминантам тестируемого антигена. При этом два монАТ не должны мешать друг другу связываться с антигеном. В случае низкомолекулярных антигенов часто отсутствует возможность получения такой «пары» антител по причине их (антигенов) мелкого размера. В случае крупных белков, вирусных частиц или бактериальных клеток получить такие «пары» и даже «тройки» антител не представляет большой сложности, не прибегая к дополнительным ухищрениям. В промежуточном положении находятся антигены, к которым получить «пару» антител возможно, но довольно проблематично: у них антигенные детерминанты либо близко расположены, либо имеется доминантная антигенная детерминанта, вызывающая на себя основной иммунный ответ. В таких случаях помогает использование при первичном скрининге метода «двойного сэндвича», адаптированного для тестирования сывороток и супернатантов.
Метод предполагает, что уже имеется одно антитело против требуемого антигена, полученное обычным способом (например, монАТпротив сильной детерминанты). Для подбора монАТ, способного образовать «пару» с уже имеющимся монАТ, неплохо работает при первичном скрининге метод «двойного сэндвича». Напомним, что при использовании этого метода одно монАТ связывают с твердофазным носителем, а второе монАТ конъюгируют с какой либо меткой и проявляют им наличие связанного с первыми монАТ антигена.
Основная проблема состоит в том, что антитела из супернатанта нельзя ни конъюгировать с меткой, ни сорбировать на твердую фазу по причине их малого содержания в супернатанте и наличия там множества «посторонних» белков. Если супернатант конъюгировать с сорбированными «антимышиными» антителами, то последние будут успешно связывать и вторые монАТ, конъюгированные с меткой. Приблизительно то же произойдет, если сорбировать уже имеющиеся очищенные монАТ, а наличие «сэндвича» сорбированные монАТ-антиген- монАТ из супернатанта проявлять с помощью конъюгированных с ферментов антител против мышиных иммуноглобулинов. Последние будут связываться с сорбированными монАТ антителами даже в отсутствие антигена и монАТ в исследуемом образце.
Избежать такого нежелательного связывания можно в том случае, если сорбировать имеющееся монАТ не целиком, а предварительно расщепив молекулу монАТ на Fab`2 и Fc- фрагменты. Имеющиеся в нашей лаборатории моноклональные крысиные антитела против мышиныхIgG не связывают такую расщепленную молекулу монАТ, поэтому метод «двойного сэндвича» для первичного скрининга мы применяли по такой схеме: В лунки планшета сорбировали полученные ранее монАТ, предварительно расщепленные на Fab\2 и Fc- фрагменты. Fab\2 –фрагмент способен связывать антиген, раствор которого инкубировали в лунках планшета после отмывки. Затем планшет снова отмывали и инкубировали с супернатантами гибридом, в которых хотели обнаружить антитела, способные реагировать с антигеном в присутствии ранее полученных монАТ. После отмывки следовала инкубация с мечеными крысиными монАТ, связывающие антитела из супернатанта, но не реагирующие с сорбированными расщепленными на Fab\2 и Fc- фрагменты моноклональными антителами.
8.1.7.3. Дот-ИФА.
Дот- иммуноферментный анализ отличается от всех описанных выше тем, что твердой фазой здесь является не планшет, а нитроцеллюлоза или фильтровальная бумага. Антиген сорбируют, нанося каплю раствора антигена на лист нитроцеллюлозы или фильтровальной бумаги. После высыхания капли процедуру при необходимости повторяют столько раз, чтобы сорбировалось достаточное количество антигена. Затем лист помещают в блокирующий раствор (1% БСА в фосфатно-солевом буфере) на ночь при 4°С или на 1 час при 37°С. После блокировки лист отмывают в фосфатно- солевом буфере с Tween 20 и инкубируют в исследуемых образцах. Все дальнейшие процедуры такие же, как и для ИФА на планшетах, за исключением ферментных субстратов.
В дот-ИФА целесообразно использовать нерастворимые в воде субстраты, такие как 4-хлор-1-нафтол и диаминобензидин тетрагидрохлорид (ДАБ), если в качестве фермента берут пероксидазу. Для получения окрашенного пятна на нитроцеллюлозе или фильтровальной бумаге эти субстраты растворяют в холодном (-20°С) метаноле (оба или один из них), затем раствор смешивают с фосфатно-солевым буфером, содержащим перекись водорода, и инкубируют в этой смеси тестируемый лист нитроцеллюлозы или фильтровальной бумаги. После окрашивания пятна в сине-черный (для хлорнафтола) и/или коричневый (для ДАБ) цвет, реакцию останавливают промыванием листа в воде.
Метод является менее удобным и чувствительным по сравнению ИФА на планшетах и для скрининга супернатантов применяется редко. Достоинствами метода являются его низкая стоимость и возможность обходиться очень маленькими объемами исследуемых проб (супернатанты можно тестировать ежедневно, нанося на пятно сорбированного антигена всего 2-5мкл супернатанта).
8.2. Радиоиммунный анализ.
Почти все сказанное выше в отношении иммуноферментного анализа можно отнести и к радиоиммуному анализу. Принципиальным отличием здесь является то, что вместо ферментной метки используют метку радиоактивную, главным образом 125I. Наличие сигнала регистрируют, прикладывая к лункам планшета или нитроцеллюлозному листу пленку с чувствительным к излучению слоем, либо вырезают дно лунок планшета (используют специальные гибкие планшеты) или кусочки нитроцеллюлозы и фиксируют наличие излучения при помощи сцинтилляционного счетчика. Радиоиммунный анализ более чувствителен, чем иммуноферментный, однако сейчас он почти не используется по причине своей дороговизны и вредного воздействия изотопов на человека и окружающую среду.
8.3. Латекс-агглютинация и метод фиксации комплемента.
Эти методы целесообразно применять для скрининга в том случае, если получаемые монАТ предполагается использовать в подобных тест- системах. МонАТ, отобранные иммуноферментным анализом могут плохо работать в гомогенных системах, таких как латекс- агглютинация или метод фиксации комплемента.
При использовании метода латекс- агглютинации частицы латекса нагружают молекулами антигена, инкубируя их в растворе антигена 30 минут при 56°С. Латекс отмывают от несвязавшегося антигена неоднократным центрифугированием в фосфатно-солевом буфере. Тестируемые пробы смешивают со взвесью латексных частиц в лунках круглодонного 96-луночного планшета, затем центрифугируют или ждут самостоятельного осаждения латексных частиц. Наличие антител против требуемого антигена оценивают по степени агглютинации латекса: при отсутствии антител и, следовательно, агглютинации, латексные частицы собираются на дне лунки в одну точку. При наличии агглютинации частицы оказываются «размазанными» по дну лунки. Диаметр пятна зависит от степени агглютинации и, соответственно, отражает уровень содержания специфических к антигену антител в исследуемой пробе. Для облегчения визуальной оценки реакции используютярко-окрашенные латексные частицы.
Явным недостатком метода является необходимость нагревать антиген, что может привести к изменению его антигенных свойств. Другим недостатком метода является необходимость тщательного подбора условий реакции для каждого конкретного антигена во избежание ложно-положительных реакций. К таким условиям относятся: количество сорбируемого антигена и разведение супернатантов и сывороток, поскольку избыток сывороточных неспецифических антител (особенно класса IgM) может вызвать неспецифическую агглютинацию. Кроме того метод c большей чувствительностью определяет антитела класса IgM по сравнению с более желаемыми IgG. К несомненным достоинствам метода можно отнести быстроту его исполнения и низкую стоимость.
Метод фиксации комплемента имеет много общего с латекс-агглютинацией; разница состоит в том, что антигеном нагружают не латексные частицы, а живые клетки (как правило, эритроциты барана). Взвесь клеток с молекулами антигена на поверхности смешивают с исследуемой пробой и раствором белков системы комплемента. При наличии в пробе антител к антигену, происходит активация комплемента и, как следствие, лизис клеток, наблюдаемый визуально. Достоинства и недостатки метода фиксации комплемента те же, что и у латекс-агглютинации.
8.4. Дополнительные методы скрининга.
При получении монАТ полезно учитывать их предполагаемое использование и в связи с ним вводить дополнительные методы скрининга, позволяющие отобрать монАТ, максимально пригодные для их применения. Примером здесь может быть скрининг монАТ,влияющих на активность фермента, либо обладающих самостоятельной ферментативной активностью. В этих случаях используют метод, позволяющий оценивать активность фермента в присутствии или в отсутствие тестируемого образца.
9. Клонирование гибридом.
Сразу после обнаружения в лунке с растущим клоном (или несколькими клонами) желаемых антител, нужно возможно скорее провести клонирование. Причины, по которым нужно торопиться с клонированием, такие же, что и для раннего тестирования первичных клонов, и были перечислены выше.
9.1. Метод клонирования в мягком агаре.
Отцы гибридомной технологии Келер и Мильштейн в своей пионерской работе использовали метод клонирования в мягком агаре. Сегодня этот метод имеет скорее историческое, нежели практическое значение, но из уважения к патриархам гибридомной технологии кратко рассмотрим и его. Гибридомы после процедуры слияния высевали в чашке Петри на стерильном 1%-ом агаре, приготовленном на селективной ростовой среде с аминоптерином. Белые бляшки растущих клонов тестировали на наличие специфических антител, используя метод фиксации комплемента. Те бляшки, вокруг которых наблюдали лизис эритроцитов барана, вырезали скальпелем, клетки суспендировали в ростовой среде и затем вновь высевали на агар. Процедуру повторяли до тех пор, пока не отбирали клоны, стабильно продуцирующие нужные антитела. Такие антитела являются моноклональными, поскольку секретируются клоном, выращенным из одной клетки.
9.2. Клонирование методом предельных разведений.
Самым распространенным сегодня методом клонирования является метод предельных разведений. Смысл его состоит в том, чтобы суспензию клеток развести в ростовой среде до такой концентрации, чтобы при посеве клеток на планшет в каждой лунке оказалась бы одна гибридомная клетка. На практике такое недостижимо, даже при самом тщательном расчете в какие-то лунки попадет две или даже большее число клеток, в какие-то не попадет вовсе. Кроме того, не все клетки могут выжить в тяжелых для них условиях одиночества и дать начало жизнеспособному клону. Поэтому делают несколько разных разведений клеток (как правило, три), в первом из них концентрацию клеток берут приблизительно равной 10 клеток на лунку, во втором- одна клетка на лунку, и в третьем- 0,1 на лунку. Приведенные цифры в разных пособиях могут варьировать. Клетки высевают, используя фидерный слой клеток, поскольку у одинокой гибридомной клетки практически нет шансов выжить в лунке.
Через несколько дней просматривают под микроскопом все лунки и фиксируют количество растущих в них клонов. Лунки с одним растущим клоном осматривают особенно тщательно на предмет отсутствия в них вторых мелких и малозаметных клонов. Затем, когда клоны достигнут достаточного для тестирования размера, проводят скрининг их супернатантов, используя тот же метод, что и для тестирования первичных клонов. Среди клонов, давших при тестировании положительный результат, отбирают самые продуктивные и здоровые на вид и повторяют процедуру клонирования. Если после второго клонирования все протестированные клоны дали положительный результат, самые лучшие из них отбирают для дальнейшей работы (наработки, заморозки и т.д.). В случае обнаружения несекретирующих клонов, что говорит о неустойчивой секреции антител, необходимо повторить клонирование, либо отказаться от дальнейшего использования этого клона.
9.3. Клонирование с помощью приборов.
В последнее время все большую популярность приобретают микроманипуляторы- приборы, позволяющие под визуальным контролем стерильно перенести одну выбранную клетку из одного культурального планшета в другой. Этот метод особенно удобен, если в лунке с положительно протестированным супернатантом имеется несколько клонов. Прибор позволяет взять из всех, даже самых маленьких клонов по несколько клеток и рассадить их по одной в лунки. Налицо экономия культуральной посуды и ростовых сред.
Другим прибором, использующимся для клонирования, является упомянутый выше проточный цитофлуориметр. Он может предложенную ему суспензию клеток рассадить по одной клетке в лунки культурального планшета.
10. Наработка гибридомных клеток и секретируемых ими антител.
Наиболее широко используются сейчас два способа наработки гибридомных клеток и моноклональных антител: наработка на культуральных средах в СО2 инкубаторе и в асцитных жидкостях мышей (или крыс). Каждый из них имеет свои достоинства и недостатки.
10.1. Наработка на культуральных средах в СО2 инкубаторе.
После того, как отобраны стабильно продуцирующие клоны, переходят к наработке антител, чтобы получить достаточное их количество для более подробного изучения их свойств. Гибридомные клетки очень чувствительны к перемене условий их содержания, поэтому необходима плавность и постепенность при увеличении объема ростовой среды и культуральной посуды: из одной лунки 96-луночного планшета клетки рассевают на несколько лунок такого же планшета, затем, когда плотность клеток в них будет достаточно большой, клетки из нескольких лунок переносят в одну лунку большего размера и т.д. Когда количество клеток будет достаточным для производства требуемых количеств антител, содержание эмбриональной телячьей сыворотки (ЭТС) в ростовой среде постепенно или резко снижают (до концентрации <1%). Рост и деление клеток при этом сильно замедляется, клетки переключаются на секрецию антител. Супернатанты клеток стерильно отбирают, проверяют на содержание специфичных антител и собирают для дальнейшей очистки.
Для наработки антител в промышленных масштабах используют различные приспособления (цитокультиваторы, ферментеры и т.д.), в которых соблюдаются необходимые условия культивации клеток (температура, уровень СО2 и влажности), а также частично или полностью автоматизированы подача питательных сред и отбор супернатантов.
10.2. Наработка антител в асцитных жидкостях.
Наименее хлопотный способ наработать большое количество антител- это ввести гибридомные клетки в перитонеальную полость мыши (или крысы). Через 6-30 дней (чаще через 10-14) в зависимости от числа введенных клеток и скорости их деления в перитонеальной полости образуется асцитная жидкость, содержащая большое количество гибридомных клеток и монАТ (концентрация антител в асцитах может достигать 20мг/мл). Для лучшей приживаемости гибридомных клеток и во избежание развития солидных (твердых) опухолей мышам предварительно (за 7-20 дней до введения клеток) вводят минеральное масло- пристан. Если все-таки вместо асцитной жидкости образовалась солидная опухоль, ее извлекают, гомогенизируют, и в фосфатно- солевом буфере вводят другим мышам.
В процессе развития асцитной опухоли клетки гибридомы оздоравливаются, избавляются от бактериальной и вирусной инфекций.Скорость роста извлеченных из асцита клеток, как правило, значительно выше, чем до введения их в перитонеальную полость мышей.
Количество клеток, вводимых мышам, может быть любым: от нескольких десятков или сотен клеток до нескольких сотен миллионов. Однако следует учитывать, что при очень маленьком количестве вводимых клеток увеличивается время образования асцита, при очень большом- есть риск гибели мыши, если клетки заражены микоплазмой. В целом успех выращивания асцитной жидкости зависит, в основном, от качества мышей (их линейности - генетического соответствия требуемой линии).
Наработке антител в асцитных жидкостях во многих странах препятствует законодательство, считая эту процедуру негуманной по отношению к животным. В нашей стране пока такого запрета нет, но соответствующий законопроект уже обсуждается.
Наработка антител с использованием генноинженерных методов применяется только для наиболее ценных гибридом и будет подробно обсуждаться в следующей главе.
11. Хранение клеток.
Клетки годами можно хранить в жидком азоте без существенной потери их жизнеспособности. Заморозку клеток производят, когда они находятся в логарифмической фазе роста. Суспензию клеток, предназначенных для заморозки, помещают в раствор, содержащий 10-90% сыворотки, 5-10% ДМСО и в остальном- ростовую среду. Присутствие сыворотки смягчает процессы замораживания- оттаивания клеток, ДМСО препятствует при заморозке образованию крупных кристаллов воды, губительных для клеточной стенки.
Понижение температуры при заморозке производят постепенно, существуют даже специальные приборы, позволяющие снижать температуру с заданной скоростью. В основном же бывает достаточно предварительно поместить ампулу с клетками в морозильник на -70ºС, а затем перенести в специальный сосуд с жидким азотом (сосуд Дьюара). Неудобство хранения клеток жидком азоте состоит в необходимости регулярно доливать азот в эти сосуды. Для менее продолжительного хранения клеток можно использовать морозильники с температурой от -70ºС и ниже.
Наиболее ценные гибридомы можно хранить в виде векторов (плазмид или нитчатых фагов), куда вставлены гены, кодирующие иммуноглобулины этих гибридом. Этот метод хранения более надежен, но требует предварительной работы по изготовлению таких векторов.
12. Выделение монАТ из супернатантов гибридом и асцитных жидкостей.
При выборе методов выделения нужно учитывать следующее:
а) желаемая степень очистки в соответствии с дальнейшим использованием выделенных антител;
б) источник антител (супернатанты клеток или асцитная жидкость)
в) класс и субкласс выделяемых антител;
г) индивидуальные особенности конкретных монАТ.
Основным белком, подлежащим удалению при очистке, является альбумин (бычий в супернатантах и мышиный в асцитах). Его количество в десятки раз превосходит количество выделяемых антител.
12.1. Методы предварительной очистки антител: высаливание сульфатом аммония (натрия), преципитация каприловой кислотой, диализ против дистиллированной воды при выделении IgM.
Метод высаливания сульфатом аммония состоит в следующем: при смешивании образца антител с эквивалентным объемом насыщенного сульфата аммония происходит выпадение осадка, содержащего, главным образом, иммуноглобулины. Осадок растворяют в фосфатном буфере и диализуют. Процедуру повторяют при необходимости несколько раз. Степень очистки антител можно повысить, снижая концентрацию сульфата аммония, но при этом придется столкнуться с потерями антител. При повышении концентрации соли (до 60% от насыщения) выход антител увеличивается, но увеличивается и содержание загрязняющих компонентов, главным образом, альбумина. Недостатком метода является недостаточная степень очистки антител, поэтому часто его применяют в качестве предварительного метода, позволяющего увеличить концентрацию антител в образце.
Для очистки каприловой кислотой образец антител должен иметь рН 4, поэтому эго предварительно разбавляют 60 мМ ацетатом натрия. Каприловую кислоту добавляют по каплям при помешивании, получающийся при этом осадок содержит загрязняющие белки, IgG остается в растворе. После диализа раствор антител концентрируют и проверяют их активность.
При диализе образца против дистиллированной воды (или буфера с низкой ионной силой) большая часть IgM выпадает в осадок. Осадок растворяют в фосфатном буфере и проверяют активность антител.
12.2. Хроматографические методы выделения антител.
1) Ионнообменная хроматография.
В качестве ионнообменника для выделения антител чаще всего используют DEAE (DiEthylAminoEthyl), прикрепленного к целлюлозе, сефарозе или акриламидным гранулам. При кислых значениях рН (6,5) раствора молекулы IgG не связываются с DEAE, тогда как большинство других сывороточных (асцитных) белков (особенно, альбумин) связываются с DEAE достаточно прочно.
2) Гель-фильтрация антител производится на колонках с агарозой, сефарозой или сефадексом, если речь идет о гельфильтрации при атмосферном давлении, и акриловыми гранулами при высоко эффективной жидкостной хроматографии высокого давления (HLPC). Разделение идет по молекулярным массам белков, поэтому IgG массой 150кДа достаточно хорошо отделяется от основного загрязнителя- альбумина (65кДа).
3) Хроматография на протеинах А или G.
Протеин А (из Stafilococcus aureus) связывает Fc-фрагмент антител с разной эффективностью в зависимости от видовой и классовой (субклассовой) принадлежности антитела. Поэтому, в зависимости от силы связывания протеина А с конкретным монАТ, подбирают условия хроматографии (рН буфера для связывания, ионная сила). Антитела, плохо связывающиеся с протеином А (например, мышиные IgG1), можно выделять на протеине G.
4) Аффинная хроматография.
При помощи аффинной хроматографии, где к носителю прикреплены молекулы антигена, получаются самые чистые образцы монАТ. Однако, если монАТ имеют очень высокую аффинность, их элюция в неденатурирующих условиях может представлять серьезную проблему.
13. Заключение.
Гибридомная технология за 30 лет своего существования обросла многими дополнительными приемами, позволяющими получать моноклональные антитела к «сложным» антигенам. Некоторые из этих приемов запатентованы, некоторые используются лишь в тех лабораториях, которые их разработали, и недоступны всем желающим. Данное пособие отражает лишь небольшую часть всего накопленного опыта по получению гибридом, однако позволяет в общем понять смысл и значение гибридомной технологии. Для поиска путей, позволяющих получить монАТ к конкретному антигену, нужно изучать соответствующие публикации и патенты, либо самостоятельно, методом проб и ошибок, находить и отрабатывать нужные способы.
НОВЫЕ МЕТОДЫ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ИЛИ ИХ ФРАГМЕНТОВ.
1.Введение.
Большая часть современных исследований по получению монАТ направлена на разработку удобных и эффективных методов получения человеческих моноклональных антител или их фрагментов. В предыдущей главе подробно описывались причины, по которым предпочтительнее использовать в терапии человеческие антитела, нежели мышиные или крысиные. При получении человеческих антител первые сложности возникают уже на этапе иммунизации.
2. Получение иммунных В-лимфоцитов человека.
Для получения монАТ чаще всего используют В-лимфоциты периферической крови пациентов, несущих тот или иной инфекционный агент или раковую опухоль. Понятно, что специфичность антител, получаемых от таких больных, будет соответствовать их заболеванию. Для других антигенов возможна иммунизация вне человеческого организма. Более старый путь такой иммунизации- это инкубация выделенных из периферической крови лимфоцитов с антигеном, к которому хотят получить антитела (иммунизация in vitro). Во время такой инкубации часть лимфоцитов (или их предшественников) переключаются на секрецию антител против инкубируемого антигена.
Эффективность такой иммунизации очень низка, получить высокоаффинные антитела таким путем чрезвычайно сложно, поэтому позднее был разработан метод иммунизации в мышах, которым имплантировали человеческие лимфоидные ткани. Во избежание отторжения таких трансплантатов использовали мышей линии SCID, у которых отсутствует фермент, необходимый для репарации и рекомбинации ДНК. У таких мышей нарушен процесс перекомбинации иммуноглобулиновых генов, и выработка антител затруднена. Для развития полноценного иммунного ответа у таких мышей необходима трансплантация не только периферической крови, но и лимфоузлов и тимуса. Некоторые методы получения человеческих монАТ позволяют обходиться вовсе без иммунизации.
3. Получение бесконечно делящихся клеток-продуцентов человеческих антител (иммортализация).
Наиболее очевидный путь получения таких клеток- это гибридизация иммунных В-лимфоцитов с клетками опухолевых линий человеческой миеломы или плазмацитомы при помощи ПЭГ. Такая гибридизация используется и по сей день, но при этом эффективность слияния клеток очень низкая, а получающиеся гибридомы отличаются крайне нестабильной антителопродукцией. Объяснением этому, по-видимому, является факт несоответствия гаплотипов опухолевых клеток и гибридизируемых лимфоцитов.
Другим методом иммортализации В-лимфоцитов является их трансформация в опухолевые при помощи вирусов или онкогенов. Наиболее часто для этого используют вирус Эпштейна- Барр (ВЭБ). Мишенью ВЭБ являются В-лимфоциты человека, несущие на своей поверхности молекулы CD21. Эти молекулы присутствуют в основном на незрелых В-лимфоцитах, вовлеченных лишь в первичный иммунный ответ и не осуществивших еще переключение изотипа иммуноглобулинов. В результате трансформанты вирусом Эпштейна- Барр продуцируют, как правило, низкоаффинные антитела класса IgM. Стабильность иммуноглобулиновой секреции таких трансформантов тоже довольно низка.
Перед процедурой трансформации ВЭБ из клеточной популяции должны быть тщательно удалены все Т-лимфоциты, препятствующие трансформации ВЭБ. Несмотря на то, что более 90% всех людей являются носителями ВЭБ, при осуществлении трансформации соблюдают соответствующие предосторожности. Аналогичное воздействие на мышиные В-лимфоциты оказывает вирус мышиной лейкемии Абельсона, который и используют для трансформации мышиных клеток.
Еще одним методом иммортализации, недостаточно пока отработанным, является стимуляция роста и деления клеток добавлением в ростовую среду соответствующих лимфокинов. Для иммортализации Т-клеток таким лимфокином может служить интерлейкин 2. Для В-лимфоцитов такой лимфокин еще точно не определен, но иммортализации человеческих В-лимфоцитов можно добиться добавлением в среду клеток мышиной тимомы (линия EL4), человеческих Т-лимфоцитов, макрофагов и небольшого количества (3нг/мл) форбол миристил ацетата. Полученные таким образом долгоживущие В-лимфоциты могут секретировать антитела классов IgG, IgM и IgA.
4. Использование генно-инженерных методов для получения и наработки человеческих антител.
В результате применения описанных выше методов получаются, в основном, нестабильно секретирующие продуценты человеческих антител. Наработка таких клонов в культуральной среде сильно затруднена из-за быстрой потери их активности. Решением проблемы является изготовление векторов, содержащих гены иммуноглобулинов или их фрагментов, и вставка их в геном бактерий, дрожжей, растений, насекомых или млекопитающих. Для этого из клеток, секретирующих монАТ, выделяют гены, кодирующие легкие и/или тяжелые цепи иммуноглобулинов или фрагменты цепей, или соответствующую матричную РНК (мРНК). Затем с помощью полимеразной цепной реакции (ПЦР) получают необходимое количество копийной ДНК (кДНК), то есть амплифицируют (умножают) исходный генный материал. Теоретически для этого достаточно единственной клетки, но на практике берут популяцию клеток такого размера, которую удалось получить без потери активности. Полученную кДНК встраивают в плазмиды (кольцевые молекулы ДНК бактерий) или кольцевые бактериофаги и в таком виде вводят в бактериальные клетки для размножения (экспансии) полученных векторов. Готовые векторы можно хранить в холодильнике и использовать при необходимости наработать нужное количество соответствующих иммуноглобулинов или их фрагментов. Для такой наработки векторы вводят в клетки бактерий или эукариотов (иначе говоря, осуществляют экспрессию генов иммуноглобулинов).
4.1. Выбор генов, используемых для вставки в векторы.
Прежде чем приступить к изготовлению векторов, несущих иммуноглобулиновые гены, определяют, целые молекулы антител необходимо получить, или достаточно их фрагментов. Выбор в конечном итоге зависит от цели получения антител. Если антитела предполагается использовать в системах, требующих активности Fc-фрагмента, например, фиксация комплемента или антитело- зависимаяцитотоксичность, то необходимо клонировать и легкие и тяжелые цепи иммуноглобулинов, обеспечивая при этом правильноегликозилирование и правильную сборку цепей. Достигнуть этого можно лишь, используя клетки млекопитающих, чаще всего клетки миеломы, куда встраивают готовые векторы.
(Fab)2- фрагменты почти не уступают целым молекулам в способности связывать антиген, но не могут быть использованы в реакциях, требующих присутствия Fc-фрагмента. Эффективность (Fab)2- фрагментов для нейтрализации вирусов, опсонизации микробов ниже по сравнению с целыми молекулами, а также короче их время полужизни в организме. Наработка (Fab)2- фрагментов антител возможна тоже лишь в клетках млекопитающих.
Fab-фрагменты антител возможно нарабатывать (экспрессировать) не только в клетках млекопитающих, поскольку здесь не предполагается сборка цепей, но аффинность Fab-фрагментов и время полужизни значительно снижены по сравнению с целой молекулой антитела.
Наиболее доступна для экспрессии в бактериальных клетках вариабельная часть легкой цепи иммуноглобулина (Fv), но самостоятельное использование Fv-фрагмента сильно ограничено его функциональными возможностями. Чаще всего гены, кодирующие Fv-фрагмент мышиных антител, используют для конструкции векторов, в которых оставшаяся часть иммуноглобулиновых генов представлена генами человеческого происхождения. При экспрессии таких векторов в миеломных клетках получаются целые молекулы антител, Fv-фрагмент которых мышиного происхождения, а вся остальная часть- человеческого. Такие химерные монАТ не вызывают столь выраженного иммунного ответа на них при введении в человеческий организм, поэтому нашли свое применение в терапии. Исследования в этой области направлены на дальнейшую замену мышиной части антитела на человеческие вплоть до того, что лишь антиген- связывающий участок остается мышиным. Такие антитела называются «очеловеченными», но иммунный ответ на них в организме человека полностью исключить не удается.
4.2. Источники генного материала.
1) Получение кДНК.
Иммуноглобулиновые кДНК получают, например, таким образом: цитоплазму гибридомных клеток, содержащую мРНК с поли-А-концами инкубируют с твердым носителем, несущим поли-Т олигонуклеотиды, в присутствии обратной транскриптазы. Из популяции полученной таким образом кДНК выделяют молекулы, соответствующие по размеру кДНК легких и тяжелых цепей иммуноглобулинов. (кДНКтяжелой цепи иммуноглобулинов составляет 2-3тыс. пар оснований в зависимости от изотипа антител). Полученные популяции кДНКидентифицируют при помощи генных проб J и С регионов антител.
В дальнейшем кДНК можно амплифицировать при помощи ПЦР. Для этого полученную популяцию кДНК последовательно нагревают и охлаждают в присутствии термостабильной ДНК-полимеразы, мономерных нуклеотидов и затравок- праймеров, представляющих собой искусственно синтезированные олигонуклеотиды, идентичные концевым последовательностям амплифицируемых молекул кДНК. При нагревании происходит денатурация и расхождение нитей молекулы ДНК, при последующем охлаждении часть нитей снова соединяется между собой, а часть- с комплементарными затравками- праймерами. Далее на одноцепочечных ДНК с праймерами при помощи ДНК- полимеразы происходит сборка комплементарных молекул ДНК. Таким образом количество копий ДНК увеличивается. Процесс можно продолжать, чередуя нагревание и охлаждение, пока концентрация молекул кДНК не достигнет желаемого уровня.
Копийная ДНК не нуждается в посттранскрипционной модификации, так как все интроны уже были вырезаны в процессе созревания мРНК. Для последующей экспрессии в бактериальных клетках это является преимуществом, так как прокариоты не имеют необходимых механизмов для правильного процессинга мРНК. Кроме того, кДНК имеет значительно меньшие размеры по сравнению с геномной ДНК, и поэтому ее проще выделять. Для экспрессии в клетках миеломы больше подходит геномная ДНК, содержащая, во-первых, эукариотическийпромотор, а, во-вторых, энхансер, локализованный на интроне перед VDJ-регионом. Этот энхансер (нуклеотидная последовательность, усиливающая транскрипцию гена) является тканеспецифичным, поэтому оказывается полезным лишь при экспрессии в миеломных клетках.
2) Получение геномной ДНК.
Существует много методов выделение геномной ДНК, рынок сейчас предлагает готовые наборы для получения ДНК требуемой чистоты и качества. Наиболее распространенный метод выделения ДНК включает в себя инактивацию нуклеаз при помощи SDS и протеиназы К, экстракцию фенолом и преципитацию этанолом или изопропанолом. Затем выделенную ДНК расщепляют нуклеазами, а полученные последовательности разделяют по размеру и идентифицируют подходящие по размеру популяции молекул ДНК на предмет содержания в нихиммуноглобулиновых генов методом Southern блоттинга с использованием генных проб из J региона. Выделенная геномная ДНК тоже может быть амплифицирована при помощи ПЦР, однако ее размеры, в несколько раз превышающие размеры соответствующей кДНК, усложняют эту процедуру.
4.3. Манипуляции с иммуноглобулиновыми генами.
1) Чаще всего целью генных манипуляций является замена константных областей мышиных или крысиных антител на человеческие для того, чтобы минимизировать иммунный ответ на используемые в терапии антитела. К настоящему времени открыто довольно многоэндонуклеаз и соответствующих им участков (сайтов) рестрикции на интронах иммуноглобулиновых генов, позволяющих разрезать гены в требуемых участках, затем отделять ненужные фрагменты (например, константные области мышиных иммуноглобулинов) и при помощи ДНК-лигаз сшивать с нужными фрагментами (человеческими константными областями).
2) Для придания антителу функциональной активности, присущей лишь определенным изотипам антител, можно поменять изотип на требуемый, заменив гены, кодирующие Fc-фрагмент на соответствующие желаемому изотипу.
3) Можно существенно изменить аффинитет антитела, произведя точечные мутации в участках ДНК, соответствующих антиген-связывающему центру. Для осуществления такой мутации ДНК переводят в одноцепочечную форму, встраивая ее в одноцепочечныйбактериофаг, например, М13. Затем этот бактериофаг инкубируют в присутствии ДНК-полимеразы с олигонуклеотидом, несущим мутацию икомплементарным (за исключением этой мутации) соответствующему участку ДНК. Мутантный олигонуклеотид достраивается при этом до размера целой ДНК и полученный гетеродуплекс вводят в клетку- хозяина (E.coli в случае М13). При размножении вируса внутри клетки получаются как исходные, так и мутантные копии ДНК, поэтому необходимы отбор и клонирование клеток с мутантным геном.
Точечную мутацию ДНК можно осуществить на стадии амплификации, используя измененные в нужной точке праймеры.
Первое время лишь методом проб и ошибок устанавливали, какую именно аминокислоту нужно заменить в антиген- связывающем центре для того, чтобы повысить аффинность антител. Теперь имеются широко доступные базы данных по трехмерным структурам многих белков и низкомолекулярных соединений. Определив первичную последовательность аминокислот в антиген- связывающем центре антитела, можно смоделировать пространственную структуру этого участка и сопоставить ее со структурой антигенной детерминанты. Специальные компьютерные программы позволяют при этом определить, какая замена аминокислот в антиген- связывающем центре могла бы обеспечить более тесный контакт с антигеном.
4.4. Конструирование векторов.
Векторы могут быть плазмидные или вирусные. В любом случае они должны содержать следующие компоненты:
а) все гены, необходимые для репликации вектора внутри клетки (бактериальной и/или эукариотической);
б) гены-маркеры (как правило, гены устойчивости к антибиотикам), позволяющие проводить селекцию клеток. Для наработки белка вэукариотических клетках необходима соответствующая система селективных генов, подобных, например, тем, которые используются при отборе гибридов миелома+лимфоцит по традиционной схеме получения монАТ.
в) ген, который предполагается экспрессировать (в данном случае кДНК или геномная ДНК легких и тяжелых цепей иммуноглобулинов или их фрагментов).
Для сборки вышеперечисленных компонентов плазмиду или геном бактериофага разрезают рестриктазами на участке, не критичном для репликации плазмиды или жизненного цикла вируса. Далее конструкцию из необходимых генов соединяют с разрезанными концами при помощи ферментов ДНК-лигаз.
4.5. Введение вектора в бактериальную клетку (трансфекция).
Сконструированный вектор вводят в бактериальную клетку с целью получения большего количества векторных копий. Вектор вирусного происхождения имеет собственные механизмы проникновения в клетку- хозяина, плазмидные векторы нуждаются в дополнительном воздействии на клетку- реципиента. Таким воздействием может быть обработка клеток фосфатом или хлоридом кальция, либо приложение электрического тока. В любом случае лишь часть клеток оказывается трансформированной (несущей вектор). Отделение их из общей массы выполняют в процессе клонирования. Смысл и цели клонирования здесь те же, что и в предыдущей главе: из индивидуальных клеток выращивают клоны и отделяют среди них те, что несут в себе необходимый ген. Содержание этого гена определяют, например, при помощи гибридизации лизированного образца клона с радиоактивной пробой, полученной химическим синтезом.
Клоны, несущие необходимый ген (позитивные клоны) нарабатывают в агаре, выделяют векторные молекулы, которые затем вводят вэукариотические клетки с целью получения полноценных иммуноглобулинов.
4.6. Экспрессия генов иммуноглобулинов в бактериальных и эукариотических клетках.
Бактериальные клетки могут быть использованы только для наработки Fab или Fv- фрагментов антител, так как не имеют аппарата длягликозилирования и сборки иммуноглобулиновых молекул. Дрожжевые клетки могут секретировать целые молекулы антител, однако, с низким выходом и неправильным гликозилированием. Такие антитела не способны выполнять все присущие им функции, например, запускать систему комплемента.
Полноценные рекомбинантные человеческие антитела получаются в результате трансфекции миеломных клеток. Для этой цели можно использовать мышиную миелому sp2/0, а антитела нарабатывать в виде асцитов.
Имеются данные об экспрессии иммуноглобулиновых генов в клетках насекомых. Векторы для такой экспрессии изготавливают на основе бакуловирусов, а иммуноглобулиновые гены встраивают внутри гена polyhedron, не являющегося жизненно необходимым для вируса, но имеющего очень сильный промотор. Гены тяжелых и легких цепей иммуноглобулинов встраивают в противоположных направлениях по отношению друг к другу, поэтому каждый из них оказывается под контролем промотора polyhedron. В результате инфицированные насекомые производят иммуноглобулины в количестве 50-70% от всего синтезируемого ими белка. Есть данные, что, по крайней мере, часть синтезируемых насекомыми антител собираются и гликозилируются надлежащим образом.
Экспрессия иммуноглобулинов в растениях находится пока в стадии разработки. Для трансформации листьев табака использовали бактериальные векторы, в которые по отдельности встраивали гены тяжелых и легких цепей иммуноглобулинов. Растения, трансфицированныегенами тяжелых цепей, скрещивали с носителями легких цепей иммуноглобулинов для получения потомства, синтезирующего обе цепи. Были получены растения, продуцирующие обе цепи иммуноглобулинов в количестве 1,3% от суммарного белка листьев. Корректностьгликозилирования таких антител пока не ясна.
5. Использование фаговых библиотек (дисплеев) для производства монАТ.
В тех случаях, когда доступность иммунных В-лимфоцитов особенно ограничена (например, при получении человеческих монАТ к токсичным или низкоиммуногенным веществам), использование фаговых библиотек может быть наилучшим выходом в такой ситуации, так как не требует стадии иммунизации. Популяции В- лимфоцитов, выделенных из лимфоидных органов нескольких десятков неиммунизированныхлюдей, могут продуцировать антитела с очень большим спектром специфичностей. В таких популяциях присутствуют клетки- продуценты антител разной аффинности практически к любой возможной антигенной детерминанте, не являющейся аутоантигеном для всех людей, клетки которых были использованы для создания дисплея.
Полиаденилированную мРНК выделяют из В-лимфоцитов и при помощи ПЦР получают амплифицированную кДНК, кодирующую Fv-фрагменты легких и тяжелых цепей иммуноглобулинов. Затем на ее основе изготавливают векторы и вставляют их в геном однонитчатых фагов. В итоге каждая фаговая частица должна содержать ДНК, кодирующую одноцепочечный Fv-фрагмент определенной специфичности. Далее следует трансфекция этими фагами бактериальных клеток, в результате чего получают популяцию бактерий, экспрессирующих фрагменты человеческих антител самой разнообразной направленности. Такая популяция называется фаговой библиотекой или фаговым дисплеем. Объемфаговой библиотеки определяется разнообразием специфичностей продуцируемых антител и превышает сегодня величину 1010. Соматические мутации внутри встроенных иммуноглобулиновых генов дают дополнительное разнообразие Fv-фрагментов антител.
Для того, чтобы фрагменты антител экспрессировались на внешней мембране бактериальных клеток, ген Fv-фрагмента соединяют с геном поверхностного белка. Бактерии, экспрессирующие фрагменты антител нужной специфичности, отбирают, пропуская всю библиотеку через микротрубочки с сорбированным антигеном. В итоге внутри таких трубочек остаются в основном клетки, на поверхности которых имеются фрагменты антител против этого антигена. Затем эти клетки клонируют, отбирают среди них продуценты с наилучшими характеристиками (в первую очередь, аффинность антител, а также уровень антителопродукции, стабильность и пр.).
Несмотря на то, что аффинность Fv-фрагментов в целом на порядок ниже, чем аффинность соответствующих целых молекул антител, при помощи фаговых дисплеев удалось получить довольно аффинные Fv-фрагменты с Кd, меньшей 10-9М. Время, затрачиваемое на получение таких мини-антител, сократилось до двух недель.
К недостаткам метода можно отнести трудности в поддержании разнообразия библиотеки: изначально разные клоны в ней были представлены неодинаковым количеством копий, по мере культивирования библиотеки эта разница неизбежно увеличивается, и минорные специфичности довольно быстро утрачиваются. Другим моментом является высокая частота соматических мутаций, происходящих вне контроля человеческого организма. В результате таких мутаций полученные мини-антитела, хотя и являются изначально человеческими, приобретают иммуногенность, поэтому могут быть использованы в терапевтических целях с известной осторожностью.
6. Использование трансгенных мышей для получения человеческих монАТ.
В последние годы появились сообщения о создании линий мышей, способных продуцировать человеческие антитела.
6.1. Общие схемы получения мышей- продуцентов человеческих антител.
Перед создателями таких линий стояло две задачи: во-первых, инактивировать собственные мышиные Ig гены, а, во-вторых, вставить в мышиный геном клонированные гены человеческих иммуноглобулинов. Общий размер всех иммуноглобулиновых генов, которые предполагалось вставить, (тяжелые цепи, легкие цепи класса каппа и регуляторные элементы) превысил 1,5 миллиона пар оснований.
Клонирование таких больших фрагментов стало возможным с использованием технологии искусственной дрожжевой хромосомы, представляющей собой дрожжевую библиотеку человеческих иммуноглобулиновых генов размером в миллионы нуклеотидных пар. Такую дрожжевую хромосому вводили в эмбриональную стволовую клетку (ЭСК) мыши путем слияния сферопласта дрожжевой клетки и ЭСК.
В результате в составе этой дрожжевой хромосомы были введены иммуноглобулиновые гены, соответствующие интактной зародышевой клетке человека, а именно: 245 тыс. пар оснований (kb), кодирующие мю и дельта константные регионы тяжелых цепей, внутренний D-регион,интронный энхансер и пять V-генов от четырех VH семейств; 190kb- kde-элемент (kappa deleting element), энхансеры интрона и 3`-конца, константный регион легкой цепи класса каппа, все пять J-генов легкой цепи каппа и три V-гена легкой цепи каппа. При этом были получены мыши, имеющие в своем геноме все эти перечисленные человеческие иммуноглобулиновые гены. Затем следовало скрещивание этих мышей с линией мышей, дефицитных по продукции мышиных иммуноглобулинов.
Прекращение продукции мышиных иммуноглобулинов было достигнуто следующим путем: в ЭСК мыши направленно разрушали либоJH-регион тяжелой цепи Ig, необходимый для первого этапа генной перестройки, либо константный регион легкой цепи. Мыши с нарушениями в генах тяжелых цепей скрещивались с мышами с нарушенными генами легких цепей до появления особей, гомозиготных по обеим мутациям. Такие мыши не продуцировали иммуноглобулины, но были способны к генным перестройкам и к экспрессии человеческихиммуноглобулиновых генов.
Другим подходом, опробованным для получения человеческих антител в мышах, было использование человеческих Ig минигенов, которые были сконструированы соединением вместе геномных сегментов вариабельных и константных регионов человеческих Ig локусов.Трансгенные мыши, продуцирующие человеческие антитела, были получены путем микроинъекции в пронуклеус стволовой клетки конструкции, состоящей из сегментов тяжелых цепей (4 VH- сегмента, 15 D-сегментов, 6 J-сегментов, мю- и гамма 1- кодирующие экзоны и их соответствующие регионы переключения изотипов, Jмю-интронный энхансер и крысиный 3`-концевой энхансер) и легких цепей (4V-гена, 5 J-сегментов, константный каппа экзон, интронный и последующий энхансеры). Мыши, получившие такую конструкцию, подвергались затем инбредному скрещиванию с мышами, имеющими нарушенные собственные Ig гены.
6.2. Функционирование генов человеческих иммуноглобулинов в мышах.
Человеческие Ig гены оказались совместимыми с мышиной системой перестройки и экспрессии генов, и смогли служить заменой нарушенных мышиных генов. Человеческие иммуноглобулиновые гены из дрожжевой хромосомы оказались способными к перестройке и экспрессии независимо ни от участков их встраивания в мышиный геном, ни от количества встроенных копий. Более зависимы от расположения и количества копий оказались человеческие Ig минигены, потребовалось встраивание их множественных копий. Меньшая зависимость генов дрожжевой хромосомы от ближайшего окружения может быть следствием большого размера и структурной организованности встраиваемого генного материала, и/или следствием присутствия неидентифицированных, но важных регуляторных элементов, необходимых для оптимальной экспрессии Ig генов и их правильной регуляции.
У мышей с человеческими Ig-генами в различных лимфоидных органах (в костном мозге, селезенке, периферической крови, лимфоузлах иперитонеальной полости) были обнаружены зрелые В 220+ клетки. Все найденные В 220+ клетки экспрессировали человеческую тяжелую цепьIg, а большинство этих клеток еще и человеческую легкую цепь каппа, продуцируя при этом полные молекулы человеческих иммуноглобулинов. Меньшая часть В 220+ клеток продуцировала заменители мышиной легкой цепи класса лямбда (компоненты мышиных В-клеточныхрецепторов). Эти результаты показывают, что в процессе созревания функционально активных В-клеток тяжелые цепи человеческих иммуноглобулинов в мышах могут должным образом ассоциироваться и с заменителями мышиной легкой цепи, и с человеческими легкими цепями.
В трансгенных мышах, несущих человеческие Ig минигены, наблюдали неполное восстановление В-клеток, которое проявлялось в частичной блокировке переноса про- и пре- В-клеток из костного мозга и в низком уровне зрелых В-клеток в лимфоидных органах. Это могло быть отражением недостаточно эффективного созревания В-клеток в костном мозге на стадии перегруппировки VDJ генов из- за ограниченного репертуара введенных V-генов. Поэтому может иметь смысл вводить большее количество V-генов.
6.3. Репертуар человеческих антител в трансгенных мышах.
6.3. Репертуар человеческих антител в трансгенных мышах.
Природу репертуара человеческих антител у трансгенных мышей определяли анализом транскриптов тяжелых и каппа- легких цепей на предмет разнообразия VDJ—соединений и добавления незародышевых нуклеотидов (N-добавки). Оказалось, что в этих транскриптах все JH- иJ-каппа- сегменты были представлены с частотой, подобной той, что обнаруживается в В-клетках взрослого человека. Наблюдалось большое разнообразие использования V и D –сегментов независимо от их расположения, так же, как и в В-клетках взрослого человека. Частое добавление N- сегмента наблюдали в V-D и D-J соединениях, со средней длиной 6,1 нуклеотидов по сравнению с 7,7 нуклеотидами В-клеток взрослого человека. Длина человеческого CDR-3 (complementary determining region) тяжелой цепи варьировала от 10 до 18 аминокислот со средней длиной 12 аминокислот. CDR3 последовательность транскриптов каппа цепи была длиной в 9-10 аминокислот. Эти черты репертуара человеческих Ig, полученных от дрожжевой хромосомы, по-видимому, отражают разнообразие, наблюдающееся у взрослых людей.
В трансгенных мышах с Ig минигенами тоже наблюдали разнообразие в использовании JH- и Jкаппа- сегментов, подобное разнообразию в человеческих В-клетках. Кроме этого, наблюдали использование имеющихся VH- и вариабельных генов тяжелых и легких цепей, множественных константных регионов тяжелых цепей и добавочных регуляторных элементов. Большее разнообразие вариабельных генов может, по- видимому, повысить степень восстановления В-клеток и специфичную направленность против антигенных детерминант. Доступность различных лямбда- константных регионов позволит создать человеческие антитела с различными эффекторными функциями и поддерживать оптимальные условия созревания аффинности антител. Добавление контролирующих элементов, имеющихся в зародышевых клетках, может повысить уровень экспрессии и обеспечить оптимальное переключение изотипов, соматические гипермутации и аллельные исключения.
Линии мышей, содержащих Ig дрожжевую хромосому, могут стать бесценным источником получения терапевтических монАТ против очень широкого спектра человеческих антигенов и с разнообразной желаемой специфичностью. Кроме того, эти линии могут быть использованы для изучения молекулярных механизмов и регуляторных последовательностей, влияющих на программируемую сборку и экспрессию человеческих антител, как при нормальном иммунном ответе, так и при аутоиммунных и других заболеваниях.
7. Заключение.
Почти все новации в получении монАТ имели своей целью создание человеческих терапевтических антител. Впервые моноклональные антитела стали использоваться в терапии в 1986 году, но из-за своего мышиного происхождения их применение было очень ограничено. Спустя почти два десятка лет использование монАТ в терапии остается в зачаточном состоянии, несмотря на очевидные успехи в этом направлении. Большим сдерживающим фактором здесь является высокая стоимость производства терапевтических количеств моноклональных антител. Последние новости о работах по созданию трансгенных промышленных животных (коз, овец, коров), продуцирующих человеческие антитела в своем молоке, вселяют надежду на более широкое использование монАТ для лечения инфекционных, опухолевых и аутоиммунных заболеваний.

Нравится материал? Поддержи автора!
Ещё документы из категории биология:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ