Почвы как ионообменные сорбенты, особенности сорбции ионов свинца дерново-подзолистой супесчаной почвы
Почвы как ионообменные сорбенты, особенности сорбции ионов свинца дерново-подзолистой супесчаной почвы
СОДЕРЖАНИЕ
Введение
1 Стуктура почвы
1.1 Органическая часть
1.2 Неорганическая часть
2 Химический состав почвы
3 Кислотность почвы
4 Окислительно-востановительные режимы почвы
5 Механизм катионного обмена, особенность адсорбции
6 Пути поступления тяжелых металлов в почву
7 Сорбция тяжелых металлов почвой
8 Фракционный состав тяжелых металлов в почве
Заключение
Список использованных источников
ВВЕДЕНИЕ
Почва – особое природное образование, обладающие рядом свойств, присущих живой и неживой природе, сформировавшееся в результате длительного преобразования поверхностных слоев литосферы под совместным взаимообусловленным взаимодействием гидросферы, атмосферы, живых и мертвых организмов.Почвенный покров – важнейшее природное образование. Его роль в жизни общества определяется тем, что почва представляет собой источник продовольствия, обеспечивающий 95-97 % продовольственных ресурсов для населения планеты.
Особое свойство почвенного покрова – его плодородие, под которым понимается совокупность свойств почвы, обеспечивающих урожай сельскохозяйственных культур. Естественное плодородие почвы связано с запасом питательных веществ в ней и ее водным, воздушным и тепловым режимами. Почва обеспечивает потребность растений в водном и азотном питании, являясь важнейшим агентом их фотосинтезирующей деятельности. Плодородие почвы зависит также от величины аккумулированной в ней солнечной энергии. Растительность аккумулирует ежегодно большое количество солнечной энергии в ходе фотосинтеза и создания биомассы, трансформируясь в n*1010 т органического вещества. Большая часть синтезированного органического вещества вследствие его разложения возвращается в почву и воду. Потребление фитомассы человеком оценивается величиной порядка 3,6*1018 т[1].
Почвенный покров принадлежит к саморегулирующейся биологической системе, являющейся важнейшей частью биосферы в целом. Живые организмы, растения и животные, населяющие Землю, фиксируют солнечную энергию в форме фито- и зоомассы. Продуктивность наземных экосистем зависит от теплового и водного балансов земной поверхности, которые определяют многообразие форм обмена энергией и веществом в пределах географической оболочки планеты.
Площади земельных ресурсов мира составляет 129 млн. км2, или 86,5% площади суши. Под пашней и многолетними насаждениями в составе сельскохозяйственных угодий занято около 15 млн. км2 (10% суши), под сенокосами и пастбищами – 37,4 млн. км2 (25%). Общая площадь пахотнопригодных земель оценивается различными исследователями по-разному: от 25 до 32 млн. км2 [7].
Земельные ресурсы планеты позволяют обеспечивать продуктами питания больше населения, чем имеется в настоящее время. Вместе с тем, в связи с ростом населения, особенно в развивающихся странах, деградацией почвенного покрова, загрязнения, эрозии и т.д.; а также вследствие отвода земель под застройку городов, поселков и промышленных предприятий количество пашни на душу населения резко сокращается [2].
Воздействие человека на почву – составная часть общего влияния человеческого общества на земную кору и ее верхний слой, на природу в целом, особенно возросшее в век научно-технической революции. При этом не только усиливается взаимодействие человека с землей, но и меняются основные черты взаимодействия. Проблема «почва – человек» осложняется урбанизацией, все большим использованием земель, их ресурсов для индустриального и жилищного строительства, ростом потребностей в продуктах питания. По воле человека изменяется характер почвы, меняются факторы почвообразования – рельеф, микроклимат, появляются новые реки и т.д. Под влиянием промышленных и сельскохозяйственных загрязнений изменяются свойства почвы и почвообразовательные процессы, потенциальное плодородие, снижается технологическая и питательная ценность сельскохозяйственной продукции и так далее [3].
Процессы поглощения играют существенную роль в деференцации всех веществ по почвенному профилю. Адсорбции принадлежит важная роль в формировании почвенных коллоидов, а также физических и физико-механических свойств почвы.
Известно, что в результате сорбции органических веществ изменяется гидрофильность почвенных коллоидов. Изменение состава обменных катионов приводит к возрастанию пептизируемости коллоидов при увеличении в составе почвенно-поглощающий комплекс (ППК) доли ионов щелочных металлов или, наоборот, к их коагуляции при увеличении в составе ППК доли 2-и 3-валентных катионов. Состояние и свойства почвенных коллоидов влияют на агрегатообразование, позорность плотность почвы, а также ее физико-мехфнические свойства.
Процессы поглощения могут играть важную роль в формировании микроморфологических признаков почв, закреплении элементов питания в корнеобитаемом слое почвы. Благодаря сорбции эти элементы не вымываются из почвенных горизонтов, а аккумулируются в них и используются растениями. В условиях интенсивного земледелия роль сорбционных процессов и их регулирование возрастает, поскольку именно сорбционные процессы во многом определяют характер взаимодействия удобрений, химических меллиорантов, с почвой и эффективность использования средств химизации в сельском хозяйстве (С\Х) [14].
Изучая сорбционные процессы в почве, а особенно сорбцию тяжелых металлов, можно предсказать интенсивность поступления тяжелых металлов (ТМ) в почвенный покров, распределение их там.
1 Структура почвы
Механические элементы почвы могут находиться в раздельно-частичном состоянии или быть объединены в структурные отдельности (агрегаты, комки, комочки) разной формы и размера. Способность почвы распадаться на агрегаты называется структурностью, а совокупность агрегатов различной величины, формы и качественного состава называется почвенной структурой.
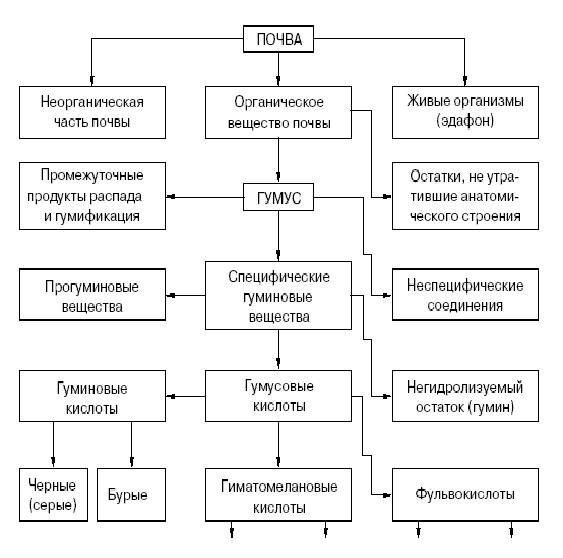
Рисунок 1- Перечень гуминовых веществ почвы [10]
В почве можно выделить две части: органическую и неорганическую.
1.1 Органическая часть
Первичными источниками органических веществ почвы являются первичные продуценты или автотрофы-организмы способные к самостоятельному синтезу органического вещества из минеральных соединений. В наземных экосистемах подавляющее большинство первичной продукции производят зеленые растения.
В почву поступают не только органические остатки отмерших растений (первичное органическое вещество) но и продукты их микробиологической трансформации. Практически все органическое вещество почвы перерабатывают микроорганизмы и представители почвенной фауны. Конечным продуктом этой переработки являются минеральные соединения [5]. В составе органического вещества почвы находится все соединения растений, бактерий и грибной плазмы, а также продукты их последующего взаимодействия. Таким образом, сложность и разнообразие органических веществ почвы уже заранее предопределены разнообразием поступающих в почву органических остатков и условиями их последующей трансформации микроорганизмами почвы [6].
Значения реакций взаимодействия между органической и неорганической частью почвы можно охарактеризовать:
под влиянием органических веществ образуются минералы почвообразующей породы.
органические вещества способствуют растворению многих минеральных соединений, переводя элементы в миграционно-способное и доступное растениям состояние.
органические вещества - образуют покрытые на поверхности почвенных частиц трудно растворимые соединения ингибируя, при этом процессы выветривания.
Участвуют в окислительно-востановительных реакциях, тем самым прямо или косвенно влияя на окислительное состоянии минеральных соединений.
Следствием органоминеральных взаимодействий является формирование почвенных агрегатов [7].
Многообразие органоминеральных соединений в почвах обусловлено тем, что в органической части почвы сосредоточен большой набор функциональных групп, среди которых наибольшее значение имеют карбоксильные, фенольные и аминогруппы. Углеродные скелеты фрагментов гуминовых и фульвокислот, идентифицированы по продуктам их окисления.
Основу органической части почвы представляют гумусовые и фульвокислоты. Сравнительный анализ молекулярной структуры препаратов гуминовых кислот (ГК) и фульвокислот (ФК) показал, что ФК обогащены кислородсодержащими фрагментами, что объясняет их лучшую растворимость в воде и миграционную способность. Высокое содержание карбоксильных групп (до 27.1%) обуславливает кислотную агрессивность ФК по отношению к почвенным минералам и способность образовывать комплексные соединения с катионами железа, алюминия и других металлов, переводя их в растворимые формы.
Рисунок 2 - Главные типы углеродных скелетов, идентифицированных в продуктах окисления гумусовых кислот [7]
Большое количество углеводных фрагментов (до 23.2 %) делает молекулы ФК более предпочтительным объектом питания почвенных микроорганизмов по сравнению с ГК, которые более чем наполовину состоят из алифатических цепочек и ароматических фрагментов и чье окисление энергетически менее выгодно [4]. Оценка содержания функциональных групп и молекулярных фрагментов ГК свидетельствует о существенном различии их молекулярного состава, при переходе от органогенного горизонта к минеральному, во всех исследованных почвах. Отмечена высокая степень ароматичности гумусовых веществ верхних горизонтов (А и А1) как в подзолистой, так и в торфянисто-подзолисто-глееватой почвах. При сравнении молекулярной структуры ГК почв разной степени гидроморфизма, следует отметить, что ГК, выделенные из подзолистой почвы, обогащены ароматическими фрагментами в отличие от ГК торфянисто-подзолисто-глееватой почвы. Кроме того, отмечено увеличение относительного содержания кислородсодержащих функциональных групп (–СООН, –С=О) в молекулах ГК при переходе от горизонта А к А1А2 в подзолистой почве. Содержание аналогичных групп в структуре ГК торфянисто-подзолисто-глееватой почвы уменьшается при переходе от горизонта А2 к А2 . Отмеченный факт объясняется тем, что в подзолистой почве формируются аэробные условия, способствующие протеканию процессов окисления, а для торфянисто-подзолисто-глееватых почв характерны анаэробные условия, в которых идут восстановительные процессы [9].
Изменение молекулярного состава ФК при переходе от автоморфных к гидроморфным почвам еще более наглядно. Здесь сохраняется тенденция к уменьшению степени ароматичности препаратов ФК при переходе от типичной подзолистой почвы к торфянисто-подзолисто-глееватой. Содержание кислородсодержащих групп возрастает на 14.5 % при переходе от горизонта А к А1А2 в подзолистой почве и уменьшается на 5.2 % в торфянисто-подзолистой глееватой при переходе от горизонта А2 к А2. Таким образом, процессы гумификации растительных остатков в подзолистой почве протекают более интенсивно, что способствует образованию агрессивных гумусовых кислот, обогащенных кислородсодержащими функциональными группами и с высоким содержанием ароматических фрагментов. Гумусовые вещества торфянисто-подзолисто-глееватой почвы имеют более низкую степень ароматичности и содержат в своей структуре, в основном, не окисленные алифатические фрагменты. Количественно или качественно установлено, что гумусовые вещества содержат следующие функциональные группы: Аминогруппы (–NH2), амидные (R-CO-NH2), спиртовые (R-CH2-OH), альдегидные (R-CHO). Карбоксильные (R-CO-OH), карбоксилатные, кетонные (R-CO-R), фенольные (–С6H4-OH), хинонные, гидрохинонные [9].
Важнейшими представителями гуминовых веществ являются гумусовые кислоты: гуминовые кислоты, фульвокислоты и гематомелановые кислоты. Эти группы кислот обуславливают основные свойства почвы.
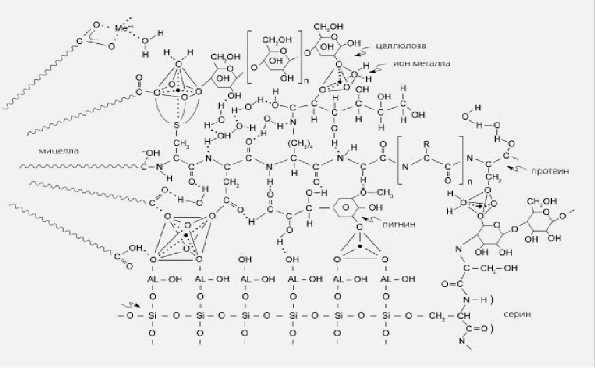
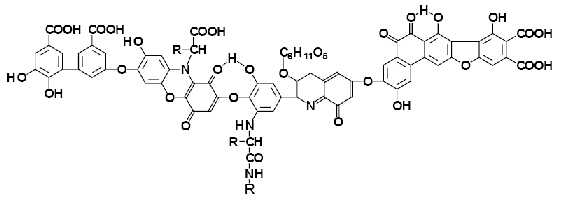
Рисунок 3 - Схема строения гуминовой кислоты: по Драгунову [7]
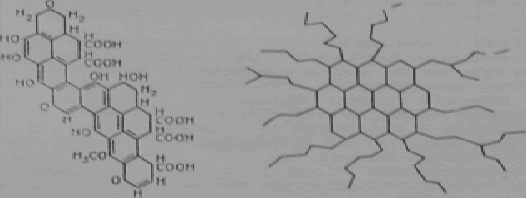
Рисунок 4 – Фрагмент гуминовой кислоты: по Stivenson
Установлено, что ГК содержат (мас. %) 52.6–58.8 % С; 5.02–8.24% Н; 2.01–3.83 % N и 30.3–39.3% О.Для ФК характерно более низкое содержание углерода – 40.2–45.6 %, азота – 0.82–2.42%, водорода – 3.56-4.89 % и повышенное кислорода – 47.7-54.5 %. Анализ элементного состава препаратов гумусовых кислот показал, что ГК и ФК типичной подзолистой почвы наиболее гумифицированы, это обусловливает их низкие значения атомных отношений (Н/С) и высокие О/С. Уменьшение отношения (Н/С) указывает на возрастание доли ароматических фрагментов в структуре ГК при переходе от органогенных горизонтов к минеральным во всех исследованных почвах. Расчет степени окисленности показал, что ГК подзолистых и торфянисто-подзолисто-глееватых почв слабо восстановлены ( от –0.91 до –0.09). ФК имеют степень окисленности от +0.40 до +0.76, т.е. представляют собой слабо окисленные соединения. С нарастанием степени гумификации гумусовых кислот в минеральных горизонтах повышается их степень окисленности. Отмечена пониженная степень окисленности ФК подзолистых почв и повышенная торфянисто-подзолисто-глееватых, в то время как для ГК характерна противоположная картина. Эту особенность можно объяснить, исходя из интенсивности микробиологической деятельности как определяющем факторе формирования гумусовых кислот. При повышенной биологической активности происходит быстрое разрушение неспецифических соединений и наиболее простых гумусовых веществ [7]. Поэтому более высокая биохимическая активность подзолистых почв по сравнению с торфянисто-подзолисто-глееватыми способствует окислению молекул ГК и накоплению наиболее устойчивых кислородсодержащих продуктов. ФК в подобных условиях являются одной из наиболее доступных для почвенных микроорганизмов и поэтому быстро ими используются и обновляются. В результате ФК представлены наиболее "молодыми" и менее окисленными. В литературе также имеются данные о повышении содержания кислорода в процессе "созревания" ГК [8].
Рисунок 4 - Блок-схема строения гуминовой кислоты (по Мистерски и Огинову)[7]
Кроме этих элементов гумусовые кислоты практически всегда содержат серу, фосфор и катионы различных металлов. Содержание серы составляет десятые доли процента иногда до 1,0-1.2%,фосфора - сотые и десятые доли процента. Серу можно считать обязательным компонентом гумусовых кислот.
А Б
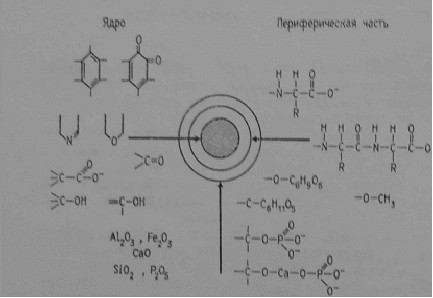
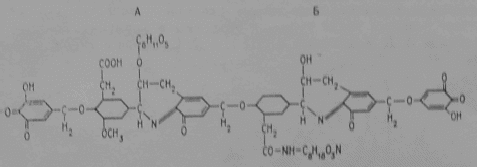
Рисунок 5- Схема строении гуминовой кислоты: по Фуксу (А), по Касаточкину (Б)
Рисунок 5- Один из вариантов нахождения тяжелых металлов (черные точки) в комплексе гуминовой кислоты с высокодисперсным глинистым минералом [5]
1.2 Неорганическая часть
Твердая фаза почв и почвообразующих пород состоит из частиц различной величины, которые называются – механическими элементами. По происхождению различают минеральные, органические и органо-мениральные частицы. Они представляют обломки горных пород, отдельные минералы, гумусовые вещества, продукты взаимодействия. Механические элементы находятся в почве или в породе в свободном состоянии и в агрегатном, когда они соединены в структурные отдельности – агрегаты различной формы, размеров и прочности. Выделяют следующие фракции [13].
КАМНИ (>3мм) представлены преимущественно обломками горных пород.
ГРАВИЙ (3-1 мм) состоит из обломков первичных минералов.
ПЕСЧАНАЯ ФРАКЦИЯ (1-0,05 мм) состоит из обломков первичных минералов, прежде всего кварца и полевых шпатов.
ПЫЛЬ КРУПНАЯ (0,05-0,005 мм) по своему минералогическому составу мало отлечима от песка.
ПЫЛЬ МЕЛКАЯ (0.005-0.001 мм характеризуется относительно высокой дисперсностью [12].
Строение почв характеризуют сочетанием генетических горизонтов. Генетическими называют те горизонты, которые образовались в результате общего почвообразовательного процесса, так что формирование каждого из присутствующих в почве горизонтов тесно связано (или даже обусловлено) формированием других горизонтов. Это проще всего проиллюстрировать на примере строения некоторых почв. Если заложить почвенный разрез (выкопать яму) с вертикальной передней стенкой, то на последней станет отчетливо видна последовательность генетических горизонтов. В профиле чернозема верхнюю часть занимает горизонт А — перегнойно-аккумулятивный; он имеет темно-серую окраску, содержит много гумуса, азота, фосфора. Аналогичные горизонты имеются во всех почвах, но обычно они значительно меньшей мощности, более светлые по окраске и содержат меньше гумуса. Такие качества позволили В.В. Докучаеву назвать чернозем царем русских почв.А1—гумусово-элювиальный- верхний горизонт профиля с морфологически или аналитически выраженными процессами разрушения или выщелачивания минеральных веществ. А2 –элювиальный горизонт образуются в процессе интенсивного разрушения минеральной части почвы и вымывания продуктов разрушения в нижележащие горизонты. Ниже горизонта А располагается переходный горизонт В. Он формируется под элювиальным или гумусовым и служит переходом к материнской породе, затем горизонт С - материнская порода. В подзолистых и дерново-подзолистых почвах горизонт А мал и обеднен элементами питания, под ним формируется горизонт Е, из которого нисходящими токами влаги вынесены Fe, A1, К, Mg и другие элементы, а накапливаются преимущественно оксиды кремния SiO2. Многие элементы, особенно Fe, скапливаются в следующем горизонте В. Если горизонт Е называют элювиальным (от латинского eluo — вымывать), то горизонт В — иллювиальным (от латинского illuo — вмывать). Еще ниже могут быть горизонты с интенсивным развитием восстановительных процессов, их называют глеевыми и обозначают буквой G. Для солонца очень характерен плотный, столбчатый горизонт В, который обычно содержит много натрия и легко набухает при увлажнении [12].
Количество генетических горизонтов велико, и этим обусловлено большое разнообразие почв. Первичными свойствами горизонтов являются химический состав и химические свойства: так, серая или темно-серая окраска вызвана присутствием гуминовых веществ, бурые, красноватые тона связаны с оксидами железа и т.п.Сочетания горизонтов, их свойства, выраженность зависят от небольшого числа факторов почвообразования, к которым относятся климат, растительность, почвообразующие породы, рельеф и возраст почв. Сочетание факторов приводит к различным водно-воздушным, окислительно-восстановительным, кислотно-основным режимам почв, а в целом образуется хорошо организованная система, называемая почвенным профилем. При сравнительно небольших дозах загрязняющих веществ почвы их перерабатывают, справляются с загрязнением, но если потоки загрязняющих веществ нарастают, то неизбежно наступает деградация почв, вплоть до полного разрушения и образования техногенных пустынь. Способность почв сопротивляться антропогенному изменению окружающей среды зависит от многих свойств и в первую очередь от их химического состава и многообразия слагающих почвы минеральных и органических веществ [10].
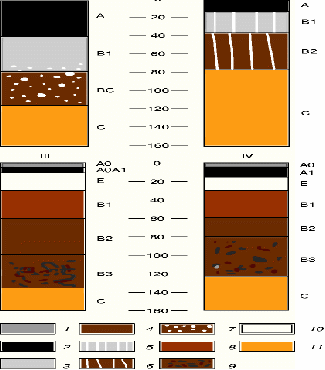
Рисунок 6 - Строение некоторых почв; (буквами обозначены генетические горизонты)
I - чернозем типичный, II - солонец, III - подзол, IV - дерново-подзолистая; 1 - АО - подстилка, 2 - А1 - перегнойно-аккумулятивный горизонт, 3 - В1- переходный горизонт в черноземах, 4,8, 9 - В2, В1, ВЗ - иллювиальные горизонты подзолистых почв, 5- В1 - иллювиальный солонцовый горизонт, 6 - В2 - переходный горизонт солонца, 7- ВС - переходный карбонат карбонатный горизонт чернозема, 10 - Е - элювиальный горизонт, 11 -С- материнская порода [2].
2 Химический состав почвы
Набор и количественное соотношение химических элементов в почве называют ее элементным составом. Любые почвы содержат все 92 элемента Периодической системы Д.И. Менделеева, а в случае химического загрязнения в почвах обнаруживаются и трансурановые элементы. Диапазон концентраций очень велик: от десятков и единиц массовых долей (в %), до 1010 — 1012% . Часть элементов участвует в формировании почвенной массы, то есть они играют конституционную роль, хотя они же необходимы и живым организмам, другая часть существенно не влияет на свойства почвенной массы, но зато играет важную физиологическую роль: некоторые элементы могут быть как стимуляторами физиологических и биохимических процессов, так и быть токсичными. Первая группа — это макроэлементы, вторая включает микро-, ультра, микро и наноэлементы [12].
Химические элементы представлены в почвах большим набором их химических соединений. Разнообразие соединений любого из элементов обеспечивает сравнительную устойчивость химического состояния почв. Так, соединения фосфора представлены преимущественно ортофосфатами, но они могут находиться одновременно в виде различных соединений с кальцием, алюминием, железом, цинком, свинцом, марганцем. О разнообразии фосфатов дает представление следующий далеко не полный перечень их почвенных соединений: Са8Н2(Р04)6, Са10(Р04)6(ОН)2, Ca10(PO4)6F2, Са4(Р04)3Н • ЗН20, Са3(Р04)2, Са(Н2РО4)2, СаНРО4, А1РО4 • 2Н2О, FePO4 • 2Н2О, Fe3(PO4)2 • 8Н2О, Zn3(P04)2, Pb3(P04)2, РЬ5(Р04)3ОН, РЬА13Н(ОН)6(Р04)2, МпНРО4. Кроме того, значительная часть фосфора может быть представлена органическими соединениями и конденсированными фосфатами [9].
Железо в почвах одновременно входит в кристаллические решетки алюмосиликатов, в гётит FeOOH, гематит Fe2O3, в различные гидроксилы. По мере расхода наиболее растворимых соединений Fe3+ его концентрация поддерживается в почвенном растворе другими соединениями железа. Соединения кремния в почвенном растворе представлены ортокремневой кислотой H4SiO4 или ее полимерными формами, а в твердых фазах одновременно сосуществуют аморфный и кристаллический диоксид кремния SiO2 (кварц), минералы группы алюмосиликатов. В крупных песчаных фракциях почв преобладают каркасные алюмосиликаты, во фракции менее 1 мкм — слоистые алюмосиликаты, из них наиболее распространены монтмориллонит, каолинит и гидрослюды [7].
Особенно многочисленны в почвах соединения углерода. Практически всегда в почвенном воздухе есть диоксид углерода СО2, в почвенном растворе — угольная кислота, в степных и сухостепных почвах — СаСО3 и Na2CO3; это только минеральные соединения. Набор соединений в органическом веществе до сих пор не подсчитан, но в их число входят как низкомолекулярные соединения, начиная от метана СН4, аминокислот, простейших кислот жирного ряда, моносахаридов, и до высокомолекулярных соединений, представленных целлюлозой, лигнином, полипептидами. Особое место занимают так называемые специфические для почв гуминовые вещества [8]. При характеристике почв наиболее информативны не отдельные индивидуальные соединения, а их группы, то есть совокупность соединений со сходными строениями и свойствами. Такими группами могут быть моносахариды, аминокислоты (в почвах обнаруживают до 17 — 22 различных аминокислот), гуминовые кислоты, фульвокислоты. Вещества, входящие в одну группу, примерно одинаково участвуют в почвенно-химических реакциях [9].
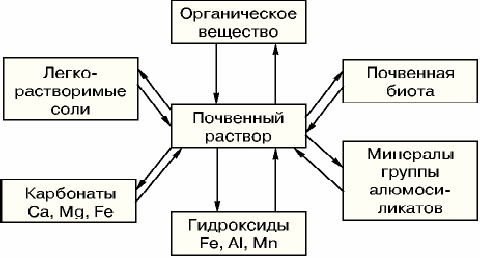
Группы органических соединений подразделяются на фракции по характеру связи с минеральными соединениями, могут быть, например, гуминовые кислоты свободные, связанные с Са2+, Fe3+, алюмосиликатами и т.п. Сложность состава почв, большой набор химических соединений обусловливают возможность одновременного протекания различных химических реакций и способность твердых фаз почв поддерживать сравнительно постоянным состав почвенного раствора, откуда растения непосредственно черпают химические элементы. Эту способность поддерживать постоянным состав почвенного раствора называют буферностью почв. В природной обстановке буферность почв выражается в том, что при потреблении какого-либо элемента из почвенного раствора происходит частичное растворение твердых фаз и концентрация раствора восстанавливается. Если в почвенный раствор извне попадают излишние количества каких-либо соединений, то твердые фазы почв связывают такие вещества, вновь поддерживая постоянство состава почвенного раствора. Это иллюстрируют возможные переходы ионов К+ и трансформация калийсодержащих веществ в почве. Итак, действует общее правило: буферность почв обусловлена большим набором одновременно протекающих химических реакций между почвенным раствором и твердыми частями почвы Химическое разнообразие делает почву устойчивой в изменяющихся условиях природной среды или при антропогенной деятельности [7].
3 Кислотность почв
Обменные катионы участвуют также в формировании потенциальной кислотности почв. Такая кислотность встречается в кислых дерново-подзолистых, серых лесных, красноземных почвах. Проявляется она только при воздействии на почву солевого раствора, так же как и при обычной реакции катионного обмена. Отличие состоит в том, что потенциальная кислотность обусловлена только катионами Н+ и А13+:
ПН+ + КС1 --- ПН+HCl или ПА13+ + ЗКС1--- ПК3+ + А1С13
ПК3+ + А1С13 --- ПК3+ + А1(ОН)3 + ЗНС1.
Где П – почвенно-поглощающий комплекс
И в том и в другом случае в растворе появляется некоторое количество НС1, что и создает кислую реакцию среды.
Устраняют потенциальную кислотность довольно простыми приемами. Обычно к почве добавляют карбонат кальция (известь), который нейтрализует различные формы кислотности:
ПН2 + СаСО3 — ПCa2++Н2СО3 --- ПCa2+ +СО2+Н2О
Природная кислотность почв может быть вызвана органическими кислотами, попадающими в почву с растительными остатками или корневымивыделениями, диоксидом углерода в почвенном воздухе и поступлением азотной и серной кислот с кислыми дождями. Анализ химических равновесий показал, что роль СО2 в этом процессе более значительна, чем это представлялось раньше. Растворение СО2 приводит к образованию угольной кислоты Н2СО3. Сама по себе это довольно слабая кислота, но в почвенном воздухе доля СО2 много выше, чем в атмосферном; в последнем доля СО2 составляет около 0,03%, а в почвенном воздухе достигает целых процентов. Поэтому в некарбонатных почвах только за счет СО2 величина рН может опускаться до 4,5 и даже ниже [4].
Рисунок 7- Реакция взаимодействия между почвенным раствором и другими компонентами почвы [4]
4 Окислительно-востановительный потенциал почвы
Практически в каждой почве происходят реакции окисления или восстановления химических соединений или элементов. Эти реакции являются сопряженными, и если какой-либо компонент почвы окисляется, то другой неизбежно восстанавливается. Окислительные процессы идут за счет кислорода воздуха, при этом органические вещества почвы окисляются или частично, или полностью до конечных продуктов распада — Н2О и СО2. При высоких окислительно-восстановительных потенциалах порядка 0,5 — 0,7 В практически все элементы с переменной валентностью приобретают высшие степени окисления, многие из них становятся малоподвижными и малодоступными растениям. Таковы ионы железа, меди, кобальта, серы, азота. Исключение составляет марганец, для перевода которого из Мп2+ в Мп7+ необходимы потенциалы около 1,4 — 1,5 В, тогда как даже в наиболее аэрированных и малоувлажненных почвах максимальные значения потенциалов редко превышают 0,6 — 0,7 В [19] .
В переувлажненных почвах, особенно в затопляемых рисовых почвах, развиваются восстановительные процессы, потенциалы снижаются до +0,2 -0,2 В, что обусловлено деятельностью микроорганизмов, способных развиваться без доступа свободного О2 и выделяющих в почву органические восстановленные соединения и свободный водород. В таких почвах элементы с переменной валентностью переходят в состояние низших степеней окисления, становятся подвижными, выделяется метан СН4, другие углеводороды. Когда длительно развиваются восстановительные процессы, в почвах появляется сизоватая окраска, железо и марганец восстанавливаются до Fe2+ и Мп2+. Такие почвы называют оглеенными или глеевыми. Кстати, переувлажненные или орошаемые и затопляемые почвы служат одним из важнейших природных источников выделения в атмосферу метана и других углеводородов, вызывающих проявления "парникового" эффекта [4].
5 Механизмы катионного обмена, особенности адсорбции
Содержание тяжелых металлов в почвенном растворе и доступность их для растений, в значительной мере, зависит от адсорбционных свойств почвы, Высокая адсорбционная активность почв способствует большему закреплению металлов и снижению их подвижности.
Адсорбция (от лат. ad - на, при и sorbeo - поглощаю) - преимущественное концентрирование молекул газа или растворенного в жидкости вещества (адсорбата) на поверхности жидкости, или твердого тела (адсорбента), а также растворенного в жидкости вещества на границе ее раздела с газовой фазой.
Если молекулы адсорбата образуют поверхностное химическое соединение с адсорбентом, то говорят о хемосорбции. Адсорбция увеличивается с ростом давления газа или концентрации раствора. При снижении парциального давления адсорбируемого компонента газовой смеси или бесконечном разбавлении раствора адсорбция уменьшается вплоть до полного освобождения поверхности адсорбента от молекул адсорбата. Адсорбцию вызывают молекулярные силы поверхности адсорбента. Неполярные молекулы удерживаются за счет дисперсионных сил. Полярные молекулы (диполи, мультиполи) взаимодействуют с электростатическим полем поверхности адсорбента, что усиливает адсорбцию. Считается, что адсорбционно-десорбционное равновесие в системе почвенно-паглащающий комплекс (ППК) – почвенный раствор осуществляется, как правило, посредствам ионообменного механизма [7].
Под (ППК) по мнению К.К.Гедройц [7] понимают совокупность соединений, проявляющих способность к обменным реакциям в почве. Совокупность обменных реакций обеспечивается в основном наличием в почве обменных катионов, представленных главным образом элементами первой и второй группами периодической системы. В кислых почвах значительную роль играют Н+ и Al 3+
В обменной форме в почве находятся ионы: Zn2+ Cu2+ Mn 2+ Pb2+
Основные учения об ионном обмене и его исследования в теоретическом и практическом почвоведенье создал К.К.Гедройца. Он рассматривал ионный обмен как одну из форм поглотительной способности почв и предложил разделить следующие виды поглотительной способности:
Механическую - свойство почвы задерживать частицы, взмученные в фильтрующей через нее воде.
Физическую – концентрирование или разжижение растворенных в почвенном растворе веществ у поверхности соприкосновения твердых частичек почвы с поглощенной влагой, обусловленную поверхностной энергией почвенных частиц.
Физико-химическую, или обменную- свойство почвы обменивать некоторую часть содержащихся в твердых фазах катионов на эквивалентное количество катионов, находящихся в соприкосаемом с нею растворе
Химическую – образование в почвенном растворе нерастворимых или малорастворимых солей, которые выпадают в осадок и примешиваются к твердым фазам почвы.
Биологическую – обязана населяющим почвы растениям и микроорганизмам и заключается в поглощении живыми организмами различных веществ из почвенного раствора [13].
Катионообменная способность - относится к числу фундаментальных свойств почвы. Ее роль можно охарактеризовать следующими положениями:
От состава обменных катионов зависит пептизируемость почв, их агрегатность.
От состава обменных катионов зависит поглощение органических веществ твердыми фазами, образование органо-минеральных соединений. Способствуют органо-мениральным взаимодействиям катионы железа, алюминия, кальция и магния.
Реакции между обменными катионами и катионами почвенного раствора влияют на рН почвенного раствора и его солевой состав. Эти реакции один из основных способов формирования кислотно-основной и других видов буферной способности почв.
От состава обменных катионов зависит классификация почв.
Законы катионного обмена являются теоретической основой для некоторых видов химической мелиорации почв и известкования кислых почв и гипсования солонцов [7].
Катионный обмен – частный случай ионного обмена, под которым в химии понимают обратимый процесс стехиометрического обмена ионами между двумя контактирующими фазами.
Реакцию обмена катионов Mn+ и Мm+ формально можно записать:
П (Мn+)м + nМм+ = П (Мм+)n + м Мn+
Где П – почвенный поглощающий комплекс.
Почвенный поглощающий комплекс — это совокупность минеральных, органических и органо-минеральных компонентов твердой части почвы, обладающих ионообменной способностью. Согласно определению, в ППК входят и способные к обменным реакциям катионы; в противном случае этот комплекс не смог бы выделить в ходе реакции эквивалентное количество катионов в обмен на катионы почвенного pacтвopa. He все твердые фазы почв способны проявлять катионообменную способность.
Важнейшей характеристикой почвенного поглощающего комплекса и почвы в целом является емкость катионного обмена (ЕКО). Которая равна сумме всех обменных катионов, которые можно вытеснить из данной почвы. Величина ЕКО существенно зависит от рН, взаимодействующего с почвой раствора, и несколько варьирует при замене одного вида насыщающего катиона на другой [7].
Емкость катионного обмена зависит от механического состава почвы и строения веществ, входящих в состав почвенного поглощающего комплекса. Увеличение ЕКО в тяжелых по механическому составу почвах обусловлено не только нарастанием удельной поверхности, но и изменением природы слагающих различные фракции веществ. Пред-илистые и илистые фракции содержат слоистые алюмосиликаты, в них повышено содержание гумусовых веществ.
Основываясь на общих законах ионообменной сорбции, М. Б. Минкин [7] выделяет пять последовательных стадий осуществления реакции обмена катионов раствора на катионы ППК:
перемещение вытесняющего иона из объема раствора к поверхности ППК;
перемещение вытесняющего иона внутри твердой фазы ППК к точке обмена;
химическая реакция обмена катионов;
перемещение вытесненного иона внутри твердой фазы от точки обмена к поверхности ППК;
перемещение вытесненного иона от поверхности ППК в раствор
В почвенной среде поток диффундирующего вещества складывается двумя составляющими: диффузией в поровом растворе и перемещением в адсорбированном состоянии за счет поверхностной диффузии [9].
При количественном описании катионного обмена нередко употребляют уравнения изотерм адсорбции, например уравнения Фрейндлиха, Ленгмюра и др. Иногда и само явление обмена рассматривают как один из видов адсорбции. Между тем различия между адсорбционными явлениями и ионным обменом настолько велики, что на этом следует остановиться подробнее. Реакциям катионного обмена свойственны иные признаки. По Гельфериху [7], для истинного катионного обмена характерны:
обратимость реакции.
скорость реакции контролируется диффузионными процессами.
реакции обмена стехиометричны.
как правило, выражена селективность по отношению к различным ионам.
Одно из главных различий между адсорбцией и ионным обменом заключается в том, что обменные катионы являются обязательным компонентом ППК и могут быть только заменены на катионы другого рода, но не удалены вовсе. Попытка пространственного расчленения ППК на анионную часть и катионы привела бы к нарушению принципа электронейтральности. В противоположность этому поверхность адсорбента может быть полностью лишена молекул адсорбата. Общее содержание обменных катионов остается сравнительно постоянным (в пределах постоянства величины ЕКО), тогда как количество адсорбированного вещества является функцией активности адсорбата в объеме фазы. Иными словами, адсорбент и адсорбат могут существовать раздельно, тогда, как ППК составляет единое целое.
6 Пути поступления тяжелых металлов в почву
В последние десятилетия человек стал причиной быстрой деградации почв, хотя потери почв имели место на протяжении всей человеческой истории. Во всех странах мира сейчас распахивают около 1,5 млрд. га земель, а общие потери почв за историю человечества составили около 2 млрд. га, то есть потеряно больше, чем теперь распахивается, причем многие почвы перешли в разряд непригодных бросовых земель, восстановление которых или невозможно, или слишком дорого стоит. Насчитывают не менее 6 типов антропогенно-технических воздействий, которые могут вызвать разного уровня ухудшение почв. В их числе:
1) водная и ветровая эрозия,
2) засоление, подщелачивание, подкисление,
3) заболачивание,
4) физическая деградация, включая уплотнение и коркообразование,
5) разрушение и отчуждение почвы при строительстве, добыче полезных ископаемых,
6) химическое загрязнение почв [10].
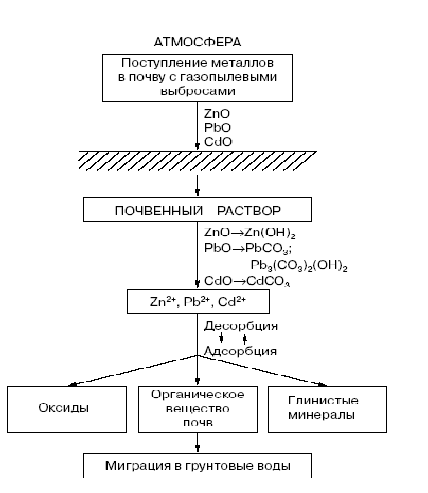
Одним из типов антропогенно-технических воздействий является загрязнения почвы тяжелыми металлами (ТМ). Этот вид загрязняющих веществ начали изучать одним из первых. К тяжелым металлам обычно относят элементы, которые имеют атомную массу более 50. Из атмосферы в почву тяжелые металлы попадают чаще всего в форме оксидов, где постепенно растворяются, переходя в гидрооксиды, карбонаты или в форму обменных катионов.
Если почва прочно связывает тяжелые металлы (обычно в богатых гумусом тяжелосуглинистых и глинистых почвах), это предохраняет от загрязнения грунтовые и питьевые воды, растительную продукцию. Но тогда сама почва постепенно становится все более загрязненной и в какой-то момент может произойти разрушение органического вещества почвы с выбросом тяжелых металлов в почвенный раствор. В итоге такая почва окажется непригодной для сельскохозяйственного использования. Общее количество свинца, которое может задержать метровый слой почвы на одном гектаре, достигает 500 — 600 т; такого количества свинца даже при очень сильном загрязнении в обычной обстановке не бывает. Почвы песчаные, малогумусные, устойчивы против загрязнения; это значит, что они слабо связывают тяжелые металлы, легко отдают их растениям или пропускают их через себя с фильтрующимися водами. На таких почвах возрастает опасность загрязнения растений и подземных вод [10].
В этом заключается одно из трудноразрешимых противоречий: легко загрязняющиеся почвы предохраняют окружающую среду, но почвы, устойчивые к загрязнению, не обладают защитными свойствами в отношении живых организмов и природных вод.
Источники эмиссии тяжелых металлов и пути их проникновения в окружающую среду весьма разнообразны, они могут носить как природный, так и онтропогенный характер. Большинство тяжелых металлов поступает в окружающую среду в результате деятельности человека. По данным O.J.Nriaga [14], источником природной эмиссии тяжелых металлов в окружающую среду является извержение вулканов, лесные пожары, морская вода и д.р. Главные антропогенные источники поступления тяжелых металлов в биосферу - топливные электростанции, предприятия по добычи и переработке цветных металлов, транспорт, машиностроительство, химическая промышленность, сельскохозяйственное производство. При этом общая масса металлов, поступающих от природных источников значительно ниже, чем от антропогенных: свинца- в 17,2 раза, кадмия-8,8.цинка -7,2 ,меди -3,никеля-1.9 [14]. Техногенное поступление тяжелых металлов в окружающую среду происходит в виде пыли газов и аэрозолей (возгонка металлов промышленных предприятий и автотранспорта), в составе сточных вод бытовых отходов.
Рисунок 8 - Трансформация и миграция тяжелых металлов в почве [9]
Загрязнение тяжелыми металлами может происходить и за счет сельского хозяйства, основными источниками которого является: использование в качестве удобрений сточных вод и их осадков, примеси тяжелых металлов в удобрениях (например, кадмий и уран в фосфорных удобрениях), использование пестицидов, отходы интенсивного птицеводства и животноводства [21].
Так из всех используемых в сельском хозяйстве удобрений самыми загрязненными являются фосфорные. Основным загрязнителем в них является кадмий. Исследования показали, что ТМ в удобрениях находятся в виде примесей, максимальное их количество находится в фосфорных удобрениях и доломитовой муке. Данные по содержанию тяжелых металлов в удобрениях представлены в таблице 1.
Таким образом, уровни содержания тяжелых металлов в почвах агроэкосистем формируется под воздействием антропогенных и природных факторов. ТМ, прежде всего, накапливаются в почвенном покрове, где они распределяются между твердой и жидкой фазой почвы. В одной и тоже почве металлы могут находиться в разной по растворимости и подвижности формах.
От того, как сильно ТМ поглощаются и удерживаются почвой и в, какой форме находятся, зависит их фототаксичность и аккумуляция в растениях. Если основной формой загрязнителя в почве является малоподвижная или неподвижная (в поглощенном состоянии, в виде нерастворимых или труднорастворимых соединений), угроза проявления токсических свойств металлов будет минимальна и наоборот. В свою очередь, свойства почвы определяют прочность фиксации соединений элементов и ее буферную способностьпо отношению к ТМ, влияют на токсичность для растений [14].
Чем больше и прочнее почва удерживает ТМ, тем активнее они удаляются из почвенного раствора в состав соединений твердой фазы, Поэтому изучение закономерностей поведения ТМ в почве и выявление факторов, влияющих на эти процессы, имеет важное агроэкологическое значение.
Поэтому в изучении путей поступления ТМ в почву имеет важное научно- практическое значение. Если почвы загрязнены тяжелыми металлами и радионуклидами, то очистить их практически невозможно. Пока известен единственный путь: засеять такие почвы быстрорастущими культурами, дающими большую зеленую массу; такие культуры извлекают из почвы токсичные элементы, а затем собранный урожай подлежит уничтожению. Но это довольно длительная и дорогостоящая процедура. Можно снизить подвижность токсичных соединений и поступление их в растения, если повысить рН почв известкованием или добавлять большие дозы органических веществ, например торфа. Неплохой эффект может дать глубокая вспашка, когда верхний загрязненный слой почвы при вспашке опускают на глубину 50 — 70 см, а глубокие слои почвы поднимают на поверхность. Для этого можно воспользоваться специальными многоярусными плугами, но при этом глубокие слои все равно остаются загрязненными. Наконец, на загрязненных тяжелыми металлами (но не радионуклидами) почвах можно выращивать культуры, не используемые в качестве продовольствия или кормов, например цветы [19].
Таблица 1 - Содержание тяжелых металлов основных удобрениях мелиорантах, применяемых в земледелии Беларуси, мг/кг натуральной влажности [21]
Удобрения, мелиоранты
Свинец
Кадмий
Цинк
Медь
Мочевина
Аммиачная селитра
Сульфат аммония
КАС
Суперфосфат двойной
Суперфосфат аммонизированный
Аммофос
Доломитовая мука
0,12-0.38
0.18
0.11-0.17
0.14
0.34-0.61
0.32
0.11-0.29
0.22
13.1-27.2
19.1
5.6-10.1
7.8
9.2-12.6
1.82
23-32.2
15
0.07-0.12
0.1
0.05-0.12
0.08
0.17-0.27
0.19
0.05-0.13
0,07
1.2-4.5
2.6
0.4-1.1
0.8
1.21-2.59
36.4
0.46-0.57
0.54
8.1-15.2
11
4.9-9.2
7.0
34.1-49.8
41.2
27.7-41.2
36.1
16.4-62.2
23.1
6.7-13.2
8.5
21-51
8.9
24.8-37.1
32
6.1-8.9
7.7
0.4-1.2
0.7
14.6-20
17
23.5-33
31
11.2-32.5
17
5.9-14.6
2
6.6-21
7
14.9-21
18.9
7 Сорбция тяжелых металлов почвами
В то же время количественные закономерности адсорбции и ионного обмена могут быть описаны сходными по форме уравнениями. Для описания изотерм адсорбции ТМ пользуются уравнением Фрейндлиха или уравнением Ленгмюра.
Эмпирическое уравнение Фрейндлиха имеет вид
Lg x/m =lg Kф +1/n lg C C = 1 + C
x/m Klb b
где х/m и С – концентрация ТМ в адсорбированном состоянии и в равновесном растворе соответственно. Кф и 1/n – константная и максимальная адсорбция ТМ в уравнении Ленгмюра [14].
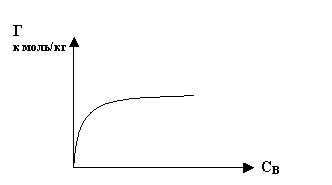
Рисунок 10 - Изотерма адсорбции [14]
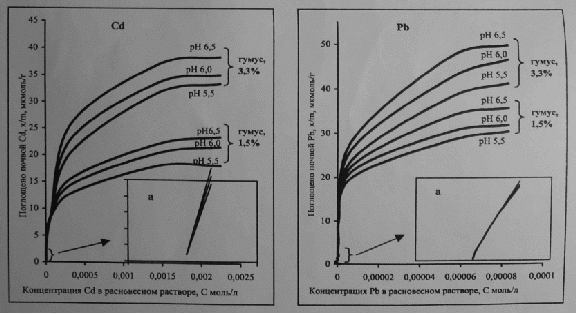
Процессы адсорбции элементов почвами и их компонентами в большинстве случаев удовлетворительно описывают уравнениями Ленгмюра и Фрейндлиха, позволяющее представить криволинейную экспериментальную зависимость между равновесной концентрацией и количеством сортированного элемента в линейной форме. Так, по мнению В.С.Горбатова [15] показатели сорбции ТМ определялись статистическим методом, который заключался в следующем: к серии навесок почвы приливали соли ТМ переменных концентраций (Pb от 0.02 – 9.65, Cd от 0.01 – 4.9,Zn от 0.02 – 15.25 ммоль/л) на фоне 0.0025 М раствора хлорида кальция. Отношение почва: раствор- 1:10, время взбалтывания на ротаторе – 2 часа при 250 градусах, время установления равновесия 24 ч. Суспензии центрифугировали при 10 тыс. об/мин, фильтровали и определяли концентрацию ТМ в равновесных растворах методом атомно-сорбционной спектрофотомерии. Количество металла, адсорбированного повой рассчитывали по разнице между добавленным количеством и содержащимся в растворе.
В исследованиях многих авторов [15] : Т.Е.Bastaи S. Kuo отмечается, что с увеличением почвенной кислотности способность почв адсорбировать ТМ снижается. Влияние кислотности на величину адсорбции обусловлено несколькими процессами, протекание которых зависит от реакции среды: гидролизом ТМ, изменением ЕКО, специфической адсорбцией ТМ на илистых частицах.
На адсорбцию сильно влияет органическое вещество почвы. Так адсорбции ТМ гумусом происходит с участием карбоксильных (-СООН) и фенольных (-ОН) групп, путем замещение водорода на ионы металла. При этом образуются хелаты, в которых металл входит в анионную часть молекул органического вещества. В этом случае металл соединен координационными (гомеополярными) связями и не проявляет себя как катион:
Комплекс также может металл в обмен на катион водорода во вне функциональных группах.
Следовательно металлы могут входить как в катионную так и в анионную частимолекул гумусовых кислот.
Использование логарифмической формулы Фрейндлиха для описания процессов адсорбции ТМ почвами также позволяет обнаружить на изотермах наличие двух и более контрастно адсорбции [15].
Рисунок 11- Изотермы адсорбции свинца дерново-подзолистой
почвы [15]
По мнению В.С.Горбатова [15] разделение изотерм адсорбции на два участка с энергетической гетерогенностью адсорбционных мест и указывает на наличие в почве двух и более групп обменных центров. Наличие нескольких групп обменных центров, обладающих не одинаковым сродством к тяжелым металлам, свидетельствует о, что часть катионов адсорбируется почвой специфически, а часть неспецефически. На эти процессы влияет кислотность почвы. Данные представлены в таблице 2. При низких концентрациях заполняются места с более высокой энергией связи, т. е имеет место специфическая адсорбция. С увеличением концентрации ТМ происходит неспецифическая адсорбция, заполняются места с более низкой энергией связи.
Таблица 2 - Влияние кислотности на специфическую адсорбцию ТМ дерново-подзолистой почвы (гумус 2.2%) [15]
Кислотность почв
ЕКО смоль(+)/кг
Специфическая адсорбция Q смоль/кг
Q от EKO %
кадмий
5
14.22
0.29
2.0
6
18.96
0.30
1.6
6.5
33.97
0.30
0.9
свинец
5.0
14.22
2.4
16.9
6.0
18.96
2.4
12.7
6.5
33.97
2.6
7.7
Содержание гумуса в большей степени влияет на специфическую адсорбцию, чем кислотность. Так с увеличением содержания в почве гумуса с 1.5- 3.3% наблюдается увеличение специфической адсорбции кадмия и цинка на 7-9%,а свинца на 12%. При этом доля максимального количества специфически поглощенных ТМ от ЕКО снижается. Данные представлены в таблице 3. Установлено, что специфическая адсорбция металлов в большей степени зависит от генетических особенностей почвы (гранулометрического и минерального состава, содержания полуторных гидроксидов Fe и Al Mn,чем от их агрохимических свойств. Было доказано, что максимальное количество элементов, адсорбируемых специфически, изменяется в ряду Pb2+, Zn2+, Cd2+ [14].
Свинец по сравнению с другими металлами в больших количествах поглощается и удерживается почвой. Отношение максимальной сорбции свинца к ЕКО находится в пределах 31-58%,в то время как для цинка и кадмия такой показатель равен 25-46 и 17-32% соответственно. Этим и объясняется малая подвижность в почве свинца. При этом с уменьшением кислотности и увеличением содержании гумуса максимальное количество поглощенных металлов, отнесенное к общему количеству ионов в ППК, способных к обмену, снижается, что может быть связано с возрастанием конкуренции за адсорбционные места в ППК [14].
Показано что поглощение свинца черноземом, серой-лесной и дерново-подзолистой почвой при рН 4.5 и 6 сопровождается вытеснением в раствор не только иона кальция, но и иона водорода, и представляет собой не бинарный, а трехкатионный ионный обмен. Этот обмен является обратимым процессом. При рН 6 и выше вступает в действие и начинает превалировать другой механизм поглощения Pb2+ - осаждение карбоната свинца. Поведение Pb2+ в почвах и его доступность растениям зависит от того, насколько прочно он связан и насколько легко может быть высвобожден в раствор под влиянием тех или иных воздействий.
Таблица 3 - Влияние кислотности и содержания гумуса на величину максимальной сорбции ТМ дерново-подзолистой почвы [14]
Гумус %
pH почвы
ЕКO cмоль(+)
кадмий
свиней
Q
смоль(+)
на кг
Q
в% от EKO
Q
смоль(+)/кг
Q
в%от EKO
1.5
5.5
14.22
4.61
32.4
7.55
53
6.0
18.17
5.02
27.6
8,26
45,5
6.5
24.49
5.11
20.9
8,89,
36,3
2.2
5.5
14.22
4.68
32.9
7,87
54,7
6.0
18.96
5.42
28.6
9,56
50,4
6.5
33.97
5.74
16.9
10,64
31,3
3.3
5.5
18.96
6.11
32.2
10,53
55,5
6.0
21.33
6.43
30.1
12,05
56,5
6.5
34.76
6.75
19.4
13,51
38,3
6.5
5.5
24.49
7.02
28.7
14,28
58,3
6.0
27.65
7.6
27.5
15,96
57,7
6.5
39.5
8.1
20.3
20,2
53,0
Поглощение Pb2+ существенно зависит от типа почв и возрастает с увеличением рН. При одинаковых условиях чернозем связывает больше Pb2+, чем серая, лесная и дерново-подзолистая почвы. Известно, что количество поглощенного Pb2+ может превышать величину емкости катионного обмена. Было установлено, что связывание Pb2+ сопровождалось выделением из почв в раствор не только иона кальция, но и иона водорода, а также выделением или поглощения небольшого количества иона калия,
Общий баланс катионов при поглощении Pb2+ при рН 5 , при концентрации раствора примерно до 0.6ммоль/л (содержание Pb2+ до 50ммоль/кг) [20].
SCa+SH+SK=0.83SPb
Где SCa SH SK - количество ионов ,SPb количество поглощенного свинца
При большей концентрации Pb2+ в растворе количество вытесняемых ионов кальция и Н+ в расчете на 1моль Pb2+ оказывается меньшим. При других значениях рН и для других почв поглощение свинца почвой также сопровождалось выделением в раствор как Ca2+так и Н+. Поскольку поглощение Рb2+ всеми рассмотренными почвами сопровождается выделением в раствор, как ионов кальция, так и Н+, можно утверждать, что процессе взаимодействия, происходит ионный обмен, но не бинарный, а трехкатионный [18].
Суммарное количество вытесненных катионов кальция Н+ и К+ при низких концентрациях Рb2+ при рН 4 и 5 близко к количеству поглощенного Рb2+ это свидетельствует в пользу механизма эквивалентного ионного обмена. С ростом рН количество вытесняемых ионов Н+ для всех почв уменьшается это, очевидно вызвано возрастанием заполнением ППК катионами Са2+, При высоких концентрациях рН суммарное количества ионов кальция водорода и калия ниже, чем количество поглощенного свинца [20].
Как правило, поглощение ТМ почвами сопровождается подкислением раствора. Хотя уменьшение рН имеет место и в водных растворах ТМ, при равновесии почвы с растворами ТМ наблюдается более значительное уменьшение рН раствора, т.е. дополнительный источник кислотности связан с адсорбцией ТМ почвой.
Подкисление равновесных растворов происходит счет:
выделение Н+ при гидролизе солей ТМ
вытеснение катионами ТМ обменного водорода (алюминия) из ППК
выделение протонов при специфической адсорбции ТМ глинистыми минералами, оксидами и гидрооксидами железа, алюминия, гумусовыми кислотами
Так гидролиз катионов ТМ в растворе можно записать:
Ме2+ + nН20 = Ме(ОН)м(Н2О)n-m + mH2O (m<n)
Обмен с участием гидролизованных форм ТМ
2Ме(ОН)+ + СаП2 =2Ме(ОН)П + Са2+
Обмен с участием свободных катионов.
Ме2+ + СаП2 = МеП2 + Са2+
Обмен с участием образовавшихся в результате гидролиза протонов
2Н+ + СаП2 = Са2+ + 2НП [17]
При этом протоны, которые образуются в ходе гидролиза также вступают в ионный обмен и частично выводятся из реакционной сферы. В результате поглощения почвой части выделавшейся в процессе гидролиза протонов реальное подкисление равновесных растворов в присутствии почв должно быть меньше, чем в их отсутствие (эффект чистого гидролиза селей ТМ в растворе в аналогичных условиях). В действительности контакт раствора содержащего ТМ, с почвой всегда усиливает подкисление ионообменной системы в целом. Из этого следует, что подкисление почвенных ионообменных систем не может быть связано только с гидролизом катионов и при малых концентрациях тяжелые металлы практически полностью поглощаются почвой. Специфическая адсорбция этих элементов почвами в большей степени зависит от гранулометрического состава почв, чем от их агрохимических свойств. Снижение кислотности и повышение содержания гумуса в почве способствует увеличению неспецефической и общей максимальной адсорбции ТМ и их закреплению в почвенное поглощающем комплексе [17].
8 Фракционный состав тяжелых металлов в почвах
Для прогнозирования поведения ТМ в агроэкосистемах важно располагать сведеньями об их подвижности в почве. Степень подвижности ТМ в почвах зависит от форм нахождения их в почве. При этом необходимы исследования, дающие информацию об основных физико-химических свойств почвы, влияющие на формы накопления ТМ, их способности к аккумуляции и рассеиванию, направленности миграционных процессов. Фракционный состав тяжелых металлов представлен в таблице 4. Считается, что в водорастворимую фракцию переходят свободные ионы металлов и их растворимые комплексы с неорганическими анионами или органическими лигандами различной прочности. Обменная фракция представлена обменосорбируемими соединениями ТМ ,связанными с различными составляющими почвы: глинистыми минералами, гидроксидами Fe, Al, Mn, Sn,Органическим веществом. В фракцию, связанную с Fe , Mn, входят металлы, образующие прочные поверхностные комплексы. К фракциям, связанных с органическим веществом, относятся металлы, образующие сними, прочные метало органические соединения. Остаточная фракция представлена прочносвязанными ТМ ,входящими в кристаллическую решетку первичных и вторичных минералов почвы и неспособными переходить в раствор в природных условиях.
Первые две вытяжки характеризуют подвижную часть элементов и являются, как часто считается, контрольным показателем почвенного микроэлементарного питания растений и всех автотрофов. Ко второй группе относится часть микроэлементов в составе корбонатов, органических и аморфных веществ в виде гидроксидов Fe и Mn. Третья группа объеденяет изоморфные примеси микроэлементов в минералах
Из всех ТМ по мнению Головатого и других авторов наибольше подвижностью обладаетCd. В незагрязненной дерново-подзолистой почве, на долю обменной фракции приходиться 39%, фракций связанных с оксидами и гидроксидами Fe и Mn -31.7.% А наименее подвижным тяжелым металлом(ТМ) является свинец . Как правило, в почве происходит его трансформация в относительно малоподвижные формы. Так , в фоновой почве около 50% свинца связанно с остаточной фракцией , так как этот элемент входит в состав труднорастворимых соединений и кристаллическую структуру минералов. На долю фракции связанной с гидроксидами Fe и Mn, приходится 37.6%от общего содержания. По мере роста уровня загрязнения почв свинцом наблюдается его перераспределение по фракциям. Накопление происходит главным образом во фракции связанной с гидроксидами Fe и Mn ( до 82-88% от общего содержания). Значительную роль в связывании свинца играет содержание органического вещества. Содержание обменного свинца даже при высоких уровнях загрязнения не превышает 4.7% его общего содержания в почве.
Таблица 4 - Условия фракционирования ТМ из почвы [14]
Фракции ТМ
Экстрагент, концентрация
1)водорастворимая
H2O
2)обменная
0.5М Ca(NO3)2
3)связанная с гидроксидами Fe и Mn
0.5М NH2OH*HCl в 25%СH3COOH
4)связанная с органическим веществом
30% H2O2 (pH 2.0) 0.02M HNO3
5)остаточная
HClO4 .HF
Относительная доля остаточной фракции при загрязнении почвы резко снижается [14]. На накопление ТМ в почвах и распределение их по фракциям также влияют кислотно-щелочные условия. Так на незагрязненной почве преувеличении ее кислотности с 6.5 до 4.5 наблюдается увеличение обменной фракции свинца с 4.9 до 9.4% . оксидами При этом ,происходит некоторое снижение количества элемента связанного с Fe и Mn и наиболее значительные изменения в фракционном составе , органическим веществом. При загрязнении почв Pb наблюдается резкое снижение относительной доли остаточной фракции при всех уровнях кислотности соответственно с 45.0-49.6% до 2.9-3.0%
Таким образом, индивидуальные особенности фракции Pb связанны со спецификой их взаимодействия с компонентами почвы. В незагрязненной почве преобладающей фракцией является остаточная связанная с Fe и Mn и их оксидами и гидроаксидами. с ростом уровня загрязнения почвы ТМ основная часть их связывается с оксидами и гидрооксидами Fe и Mn , в результате чего доля этой фракции увеличивается. Подкисление почвы приводит к увеличению обменной фракции. Все это говорит о том , что уровни загрязнения почв и почвенно-агрохимические факторы в значительной степени влияют на поведение ТМ в почве, и доступность для растений [14].
Заключение
В условиях антропогенного загрязнения биосферы одной из важнейших задач является изучение путей поступления и иммобилизации загрязняющих компонентов почвы. Насчитывают не менее 6 типов антропогенно-технических воздействий, которые могут вызвать разного уровня ухудшение почв. В их числе: 1) водная и ветровая эрозия, 2) засоление, подщелачивание, подкисление, 3) заболачивание, 4) физическая деградация, включая уплотнение и коркообразование, 5) разрушение и отчуждение почвы при строительстве, добыче полезных ископаемых, 6) химическое загрязнение почв.
Почва является уникальным адсорбентом особую роль в этом процессе играют органическая и неорганическая составляющая почвы, так состав минеральных почвенных компонентов определяют многие свойства почвы. Глинистые минералы, преобладающие в частицах почвы диаметром меньше 0.002мм. Имеющие незначительное количество тяжелых металлов в качестве структурных компонентов, принадлежит функция обеспечения сорбционных свойств почвы. Частицы глинистых минералов способны удерживать на поверхности катионы благодаря наличию отрицательного заряда, частично распределенного по всей поверхности кристаллической решетки, но в основном локализованного на поверхности. Заряд частиц глинистых минералов может быть как постоянным, так и зависящим от рН. Значительная часть заряда кристаллической решетки является постоянным и определяется изоморфным замещение атомов Si и Al, находящихся в центрах тетраэдров или октаэдров, катионами с более низкой валентностью. Кроме того, частицы глинистых минералов в почве часто бывают покрыты пленками гидроксилов железа, гумуса или аморфных алюмосиликатов, которые сами по себе способны обладают поглотительной способностью. Проанализировав литературу, было установлено, что к специфической сорбции в значительной степени способны катионы с радиусом меньше 0.085нм. Сорбцию таких ионов можно объяснить их миграцией внутрь кристаллической решетки минерала к месту расположения октаэдрических и тетраэдрических зарядов. По другой гипотезе специфическая сорбция почвы обусловлена наличием на поверхности глинистых минералов полостей, образованными атомами кислорода кремнекислородных тетраэдров, которые могут быть заполнены катионами, близкими по размерам, притягиваемые отрицательным зарядом решетки. В такие полости могут проникнуть все дегидратированные катиона, радиус которых меньше 12нм.
Также было установлено, что важную роль в сорбционных свойствах почвы играют органические вещества, представленные в основном гумусовыми и фульвокислотами, которые накапливают тяжелые металлы. Причем фульвокислоты накапливают ТМ в большей степени чем гумусовые кислоты. По мере увеличения содержания в почве гумуса снижается количество подвижных форм металлов в почве, а, следовательно, и их дальнейшее накопление в растениях. По степени влияния гумуса на переход ТМ в сельскохозяйственные культуры из проанализированных тяжелых металлов можно выстроить нисходящий ряд Cu> Pb>Zn>Cd.
Адсорбция тяжелых металлов почвами сопровождается значительным уменьшением значений рН равновесных растворов. Так по мере заполнения почвенно-поглощающего комплекса катионами тяжелых металлов значения рН равновесных растворов уменьшается вследствие вытеснения ионов водорода из слабокислотных основных обменных позиций и, частично, гидролиза катионов ТМ в растворе. Значения максимальный адсорбций катионов ТМ почвами может быть меньше, равно или больше стандартных значений емкости катионного обмена. В присутствии в ППК обменных катионов со слабокислотными и основными функциями, имеющих высокое относительное сродство к ионам водорода, не позволяет получать монотонные формы почвы путем их обработки концентрированными растворами нейтральных солей.
Список использованных источников
Никитин, Д.П. Окружающая среда и человек / Д.П. Никитин, Ю.В. Новиков. – М. : Высш. шк., 1986.
Розанов, Б.Г. Живой покров Земли / Б.Г. Розанов. – М.: Педагогика, 1989.
Добровольский, Г. В. Почва. Город. Экология / Г.В. Добровольский. – М., 1997.
Голуб, А.А. Экономика природопользования / А.А. Голуб, Е.Б.Струкова. – Изд-во М. : Аспект-пресс, 1995.
Головатый, С.Е. Тяжелые металлы в агросистемах Республик / С.Е.Головатый. - М.: Изд-во Институт почвоведенья и агрохимии, 2002.
Гришина, Л.А. Гумусообразование и гумусное состояние почв / Л.А.Гришина. – М., 1986. – 242 с.
Моррисон, Р. Органическая химия / Р. Моррисон, Р. Бойд. – М. : Мир, 1974. – 1132 с.
Орлов, Д.С. Органическое вещество почв России / Д.С. Орлов Почвоведение, 1998. – № 9. – С. 1049-1057.
Орлов, Д.С. Химия почв / Д.С. Орлов. – М. : Изд-во МГУ, 1985. – 376 с.
Чуков, С.Н. Изучение гумусовых кислот антропогенное нарушенных почв методом 13С-ЯМР / С.Н. Чуков. - Почвоведение, 1998. – № 9. – С. 1085-1093.
Орлов, Д.С. Органическое вещество почв Российской Федерации / Д.С. Орлов, О.Н. Бирюкова, Н.И. Суханова. – М. : Наука, 1996.– 256 с.
Костычев, П.А. Почвоведенье / П.А. Костычев. – М.; Л.: Сельхозгиз, 1940.
Докучаев, В.В. Разбор главнейших почвенных классификаций : [избр. соч.]: в 3 т./ В.В. Докучаев. – Т. III. – M. : Гос. изд-во с.-х.лит., 1949.
Почвенно-экологический мониторинг и охрана почв / Под ред. Д.С. Орлова и В.Д. Васильевской. – М. : Изд-во Моск. ун-та, 1994.
Химическое загрязнение и охрана почв: словарь-справочник / Д. С. Орлов и др. М. : Агро-промиздат, 1991.
Орлов, Д.С. Гумусовые кислоты почв и общая теория гумификации / Д.С. Орлов. – М. : Изд-во Моск. ун-та, 1990.
Попова, А.А. Влияниеминеральных и органических удобрений на состояние тяжелых металлов в почвах / А.А. Попова. - Агрохимия. – 1991. – №3. – С. 62-67.
Обухов, А.И., Попова, А.А. Баланс тяжелых металлов в агроценозах дерново- подзолистых почв и проблемы мониторинга / Вестн. Моск. ун-та. Сер.17. Почвоведенние. – 1992. – №3. – С. 21-39.
Горбатов, В.С., Зырин Н.Г., Обухов А. И. Адсорбция почвой цинка, свинца и кадмия / Вестн. Моск. ун-та. Сер.17. Почвоведенье. – 1988. – №3. – С.21-25.
Пинский, Д.Л. К вопросу о механизмах ионообменной адсорбции тяжелых металлов почвами / Д.Л. Пинский. - Почвоведенье, 1998. – №11. – С.1348-1355.
Понизовский, А.А., Мироненко, Е.В. Механизмы поглащения свинца почвами / Почвоведенье, 2001. – №4. – С. 418-429.
Понизовский, А.А., Мироненко, Е.В., Кондакова, Л.П. Закономерности поглащения свинца почвами при рН от4 до 6 / Почвоведенье, 2001. – №7. – С.817-822.
Гедройц, К.К.Учение о поглотительной способности почв : [избр. соч.] | / К.К.Гедройц. – Т. 1. М. : Гос. изд-во с.-х. лит., 1955.
24. Данченко Н.Н., И.В., Перминова, А.В., Гармаш. Определение карбоксильной кислотности гумусовых кислот титриметрическими методами / Вестн. МГУ, 1998. Сер. 2. Химия. Т. 39, № 2. С. 127-131.
25. А.В. Гармаш, И.В. Устимова, А.В. Куд-рявцев. Потенциометрический анализ сложных протолитических систем методом рК-спектроскопии с использованием линейной регрессии / Журн. аналит. химии, 1998. Т. 53, № 3. С. 241-248.
26. А.В. Гармаш, О.Н. Воробьева, А.В. Кудрявцев. Потенциометрический анализ полиэлектролитов методом рК-спектроскопии с использованием линейной регрессии / Журн. аналит. химии, 1998. № 4. С. 411-417.
27. Стокс Р., Робинсон Р. Растворы электролитов. М., 1963. 647 с.

Нравится материал? Поддержи автора!
Ещё документы из категории экология:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ