Расчёт горения газового топлива. Определение состава и количества продуктов горения
Самарский Государственный Технический Университет
Кафедра: «металловедение и порошковая металлургия»
Лабораторная работа № 1
Расчёт горения газового топлива. Определение состава и количества продуктов горения.
Выполнил: студент III – ФТ - 1
Соловьева Ю.Б.
Проверил:
Якубович Е.А.
Самара 2009 г.
Цель работы – изучить методы и освоить практические навыки расчётов горения топлива на примере сжигания смеси газов.
Основные понятия и определения:
Теплота сгорания топлива
Количество необходимого для горения окислителя
Теоретическая и калориметрическая температура горения
Энтальпия
1) Теплота сгорания топлива:
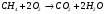 - для метана (полная реакция горения)
- для метана (полная реакция горения)
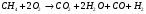 - (не полная реакция горения)
- (не полная реакция горения)
При горении топлива, выделяется большое количество тепла. Как видно из реакции в продуктах сгорания присутствуют пары воды. В зависимости от того, в каком виде водяной пар находится в дымовых газах, различают высшую и низшую теплоту сгорания топлива.
Высшая теплота сгорания ( 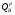 ) соответствует условию, при котором продукты горения охлаждаются до
) соответствует условию, при котором продукты горения охлаждаются до 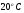 (293 К), а пары воды конденсируются и охлаждаются до
(293 К), а пары воды конденсируются и охлаждаются до 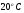 . При этом выделяется две составляющие тепла: теплота нагрева с 293 К до 373 К (418 кДж/кг),а также скрытая теплота парообразования испарения 2256,8 кДж/кг. Итого выделяется 2675,5 кДж/кг.
. При этом выделяется две составляющие тепла: теплота нагрева с 293 К до 373 К (418 кДж/кг),а также скрытая теплота парообразования испарения 2256,8 кДж/кг. Итого выделяется 2675,5 кДж/кг.
Низшая теплота сгорания (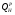 ) соответствует условию, при котором содержащаяся в продуктах сгорания влага в виде пара охлаждается до температуры
) соответствует условию, при котором содержащаяся в продуктах сгорания влага в виде пара охлаждается до температуры 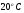 и не конденсируется. При этом выделяется:
и не конденсируется. При этом выделяется:
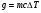 ,
, 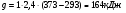
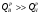
На практике в реальных условиях к сожалению, выделяется только низшая теплота сгорания.
2) Количество необходимого для горения окислителя (воздуха):
Количество окислителя определяется по уравнению реакции горения. Определённое количество является теоретическим. Для реального сжигания всегда подают несколько большее количество окислителя, т.к. есть потери . На 10 – 20 % больше.
Коэффициент избытка воздуха: 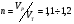
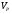 - реальный объём,
- реальный объём, 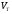 - теоретический объём.
- теоретический объём.
3) Температура горения: теоретическая и калориметрическая:
Необходимость введения двух определений связано с двумя возможными подходами процесса горения. А именно, с учётом или игнорированием затрат тепла на диссоциацию продуктов сгорания. Соответственно различают: теоретическую и калориметрическую температуру горения топлива:
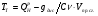
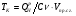
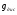 - теплота диссоциации.
- теплота диссоциации.
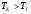
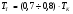
4) Энтальпия:
Это понятие является одним из фундаментальных в теплотехнике и термодинамике. По определению энтальпия представляет из себя произведение теплоёмкости на температуру:
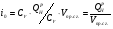
Практическая часть
Рассмотрим горение газа состоящего из: 1) 93,48% метана ( ); 2) 3,85% этана (
); 2) 3,85% этана (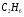 ); 3) 0,67% пропана (
); 3) 0,67% пропана (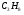 ); 4) 0,3% бутана (
); 4) 0,3% бутана (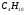 ); 0,75% углекислого газа (СО2) и 0,95% азота (
); 0,75% углекислого газа (СО2) и 0,95% азота (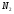 ). Найти объём сгорания количества кислорода,
). Найти объём сгорания количества кислорода, 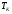 и
и 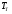 .
.
I. Определение необходимого количества воздуха:
1) 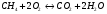
Из реакции видно, что для горения 1 моля 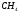 нужно 2 моля
нужно 2 моля 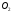 . 1 моль любого газа занимает 22,4
. 1 моль любого газа занимает 22,4 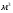 , это значит, что для сжигания 1
, это значит, что для сжигания 1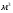 метана, нужно 2
метана, нужно 2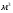
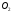 .
.
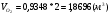
Известно, что в сухом воздухе содержится 21% 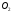 , а остальное азот (
, а остальное азот (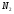 ), 79%.
), 79%.
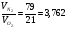
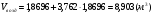 .
.
2) 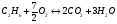 - для этана;
- для этана;
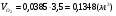
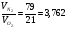
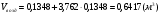 .
.
3) 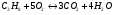 - для пропана;
- для пропана;
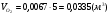
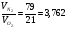
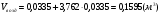 .
.
4) 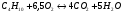 - для бутана;
- для бутана;
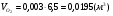
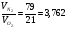
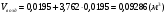 .
.
Поскольку, реальное топливо – это смесь горючих газов, то общий расход воздуха определяется суммированием для отдельно горючих компонентов.
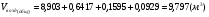 .
.
II. Определение состава и количества продуктов сгорания:
Состав продуктов сгорания: 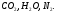
В состав объёма азота войдёт также азот из окислителя (воздуха).
1) для метана:
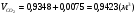 ;
; 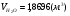 ;
; 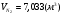 .
.
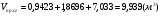 - суммарный объём продуктов сгорания.
- суммарный объём продуктов сгорания.
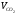 =9,48%,
=9,48%, 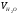 =18,81%,
=18,81%, 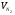 =71,72%;
=71,72%;
2) для этана:
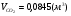 ;
; 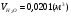 ;
; 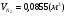 .
.
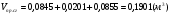 - суммарный объём продуктов сгорания.
- суммарный объём продуктов сгорания.
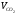 =44,4%,
=44,4%, 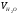 =10,57%,
=10,57%, 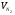 =45,03%;
=45,03%;
3)для пропана:
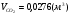 ,
, 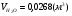 ,
, 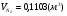 .
.
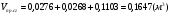 - суммарный объём продуктов сгорания.
- суммарный объём продуктов сгорания.
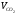 =16,75%,
=16,75%, 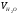 =16,27%,
=16,27%, 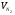 =66,98%;
=66,98%;
4) для бутана:
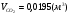 ,
, 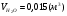 ,
, 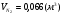 .
.
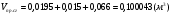 - суммарный объём продуктов сгорания.
- суммарный объём продуктов сгорания.
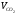 =19,42%,
=19,42%, 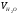 =14,94%,
=14,94%, 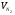 =65,64%;
=65,64%;
Суммируем объёмы продуктов сгорания 4-х газов:
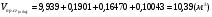 ;
;
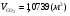 ,
, 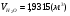 ,
, 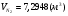
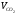 =10,33%,
=10,33%, 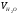 =18,59%,
=18,59%, 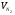 =71,08%.
=71,08%.
III. Определение калориметрической и теоретической температуры:
Как видно, для расчёта калориметрической температуры нужно знать 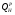 ,
, 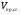 ,
, 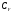 .
.
Требуемую для расчёта 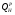 находят расчётным путём, зная тепловые эффекты реакции горения (таблица) и входящие в состав топлива доли соединений.
находят расчётным путём, зная тепловые эффекты реакции горения (таблица) и входящие в состав топлива доли соединений.
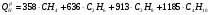 ; (
; (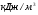 );
);
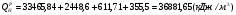 .
.
Для определения температуры ,воспользуемся понятием энтальпии и определим энтальпию продуктов сгорания 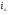 :
:
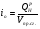 ;
; 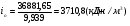 ;
;
С другой стороны, 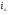 есть сумма энтальпий конкретно составляющих продукты сгорания:
есть сумма энтальпий конкретно составляющих продукты сгорания: 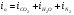
Зададимся возможной температурой продуктов сгорания 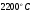 и найдём энтальпию продуктов сгорания при этой температуре:
и найдём энтальпию продуктов сгорания при этой температуре:
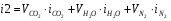 ;
;
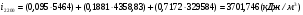 ;
;
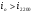 ;
;
Если величина 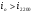 , то значит нами принята низкая температура в
, то значит нами принята низкая температура в 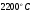 , тогда находим величину энтальпии для большей температуры на
, тогда находим величину энтальпии для большей температуры на 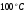 , т.е. для
, т.е. для 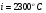 :
:
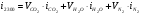 ;
;
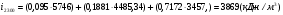 ;
;
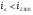 ;
;
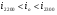 ;
;
Обычно, 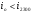 , в этом случае, считается, что действительная калориметрическая температура лежит в пределах
, в этом случае, считается, что действительная калориметрическая температура лежит в пределах 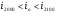 и конкретное её значение находится методом интерполяции по формуле:
и конкретное её значение находится методом интерполяции по формуле:
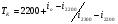 ;
;
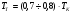 .
.
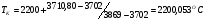
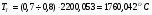 .
.
Вывод: вычислили расход воздуха:
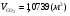 ,
, 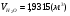 ,
, 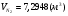
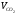 =10,33%,
=10,33%, 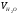 =18,59%,
=18,59%, 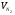 =71,08%.
=71,08%.
количество продуктов сгорания:
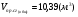
определили температуру калориметрическую и теоретическую:
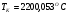 ;
;
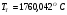 .
.

Нравится материал? Поддержи автора!
Ещё документы из категории физика:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ