Строение атома 3
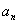
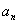
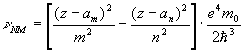
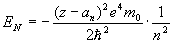
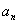
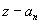
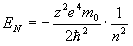
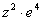
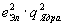
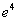
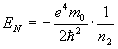
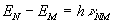
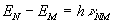

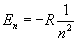
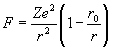
Содержание:
Введение
Зарождение теории строения вещества
Атомистическая теория Дальтона
Модель атома Томсона
Атом Резерфорда
Атом Бора
Строение многоэлектронных атомов.
Периодический закон Менделеева.
Спектр
Спектр излучения
Спектр поглощения
Заключение
Список литературы
Введение.
Мысль о том, что вещество построено из мельчайших частиц, высказывалась еще древнегреческими учеными. Они-то и назвали эти
частицы атомами (от греческого слова, означающего «неделимый»).
Древние греки предполагали, что атомы имеют форму правильных многогранников: куба («атомы земли»), тетраэдра («атомы огня»), октаэдра («атомы воздуха»), икосаэдра («атомы воды»). Поэтому и состоящий из них мир неисчерпаемо богат в своих свойствах и качествах. Цепляясь друг за друга крючками и крючочками, атомы образуют твердые тела. Атомы воды гладкие и скользкие, поэтому она растекается и не имеет формы. Атомы вязких веществ обладают заусеницами. Воздух – это пустота, в которой носятся отдельные редкие атомы. Атомы огня острые и колючие, поэтому огонь жжется. Прошло почти более двадцати столетий, прежде чем были получены экспериментальные подтверждения идеи атомистического строения вещества.
Зарождение теории строения вещества.
Атомистическая теория - современная теория строения вещества - зародилась еще в Древней Греции. Древнегреческие мыслители интересовались на первый взгляд отвлеченным вопросом: можно ли делить вещество бесконечно на все меньшие и меньшие части, или же оно состоит из некоторых неделимых частиц, не поддающихся дальнейшему делению?
Основное направление мысли древнегреческих философов, следовавших взглядам Платона и Аристотеля, основывалось на представлении о непрерывности материи. Однако некоторые древнегреческие философы, особенно Демокрит, не соглашались с такой точкой зрения и считали, что материя состоит из мельчайших неделимых частиц, которые Демокрит называл атомами, что и значит “неделимые”. Атомистические представления лежали также в основе естественной философии римского поэта и философа Лукреция, жившего в первом веке до нашей эры. Им была написана знаменитая поэма “О природе вещей”, в которой он подробно развивал атомистические взгляды на природу материи.
Даже если было бы доказано, что материя имеет атомное строение, возник бы вопрос, чем отличаются друг от друга атомы различных веществ.
Лукреций считал, что у атомов и веществ, имеющих горький вкус, на поверхности есть зазубринки, которые царапают язык, тогда как атомы веществ с приятным вкусом должны иметь гладкую поверхность.
Атомистические представления о природе веществ не намного продвинулись вперед за последующие 18 веков, прошедших со времен Лукреция. Научная мысль в Европе много веков находилась под влиянием философских идей Платона и Аристотеля, которые не разделяли атомистических воззрений на природу материи. И хотя об атомистических представлениях время от времени вспоминали, в прежние времена сторонники любой конкретной теории строения материи искали подтверждения своих взглядов главным образом в интуиции. Однако и на протяжении этого долгого периода медленно, с перерывами, шла экспериментальная работа. Часто ею двигали ошибочные взгляды: например, алхимики считали, что простые металлы, наподобие свинца, можно превратить в драгоценные металлы. Тем не менее, накапливались сведения о том, как химические вещества реагируют друг с другом, и разрабатывались более количественные методы изучения химических реакций. Это подготовило почву для новых, более содержательных формулировок в рамках атомистической теории.
Атомистическая теория Дальтона.
Джон Дальтон (1766 - 1844) большую часть своей жизни преподавал в школе и в колледже в Манчестере. Возможно потому, что сам Дальтон не был химиком, он подошел к ее проблемам с иных позиций, чем химики его времени. Его атомистическая теория, опубликованная в период 1803-1807 гг., прочно основывалась на экспериментальных наблюдениях. Она оказалась столь успешной, что с этого времени заняла господствующее положение в науке и почти не потребовала дальнейшего пересмотра.
Основные постулаты теории Дальтона заключались в следующем:
1. Каждый элемент состоит из чрезвычайно мелких частиц, называемых атомами.
2. Все атомы одного элемента одинаковы.
3. Атомы различных элементов обладают разными свойствами, в том числе имеют разные массы.
4. Атомы одного элемента не превращаются в атомы других элементов в результате химических реакций; атомы не создаются и не разрушаются в химических реакциях.
5. Соединения образуются в результате комбинации атомов двух или
нескольких элементов.
6. В данном соединении относительные количества атомов разных сортов и сорта этих атомов всегда постоянны.
Теория Дальтона позволяет мысленно нарисовать картину строения материи. Мы представляем себе элемент состоящим из мельчайших частиц, называемых атомами. Атомы являются основными структурными единицами материи, это мельчайшие частицы элемента, которые могут соединяться с другими элементами. Соединения состоят из атомов двух или нескольких элементов, образующих определенные сочетания друг с другом.
Модель атома Томсона.
Первую модель атома в 1903 г. предложил Джозеф Джон Томсон (1856 – 1940), создав ее вскоре после открытия им же в 1895 – 1897 гг. электрона. Длительность времени открытия электрона определяется продолжительностью проведения большой серии многосложных экспериментов, которые он вместе со своими сотрудниками проводил в Кавендишской лаборатории, которую с 1884 г. он же и возглавлял.
Представление об электроне, как мельчайшей заряженной частице созрело не сразу. Известно, что в экспериментах электроны предстают делокализованными, т.е. как бы размазанными по всему объему пространства атома. Кроме того, почти сразу же стало понятно, что масса электрона является переменной величиной; опыт Кауфмана, проведенный несколькими годами позже, подтвердил то, о чем Томсон только смутно догадывался. Позже он выведет формулу для массы электрона, движущегося со скоростью, сопоставимой со скоростью света, которая количественно давала те же результаты, что и релятивистская формула. У него же в экспериментах пока получалось так, что величина массы тесно была связана с зарядом.
При измерении величины заряда Томсон колебался, какую величину от измеренной необходимо отнести на счет массы, а какую на счет заряда. Поэтому Томсон не особенно торопился с выводами о существовании объекта, форму которого он себе плохо представлял. В 1897 г. он мог уверенно говорить лишь о том, что отношение электрического заряда к массе для частиц, которые образуют катодные лучи, намного больше, чем для ионов водорода. Если предположить, что заряды их по абсолютной величине равны, то, рассудил Томсон, масса катодных частиц должна быть намного меньше массы атомов водорода. Когда представление об электроне у него более или менее сложилось, он предложил модель «пудинга с изюмом». Согласно этой модели, отрицательные электроны, образуя правильные конфигурации, «плавают» в эфирной среде, заряженной положительно. О существовании положительного ядра атома он тогда ничего не подозревал; ядро было открыто несколько лет спустя.
Теперь наш дальнейший интерес сосредоточится на той самой модели Томсона, которая послужила прототипом для представления о реальном атоме. Дело в том, что исходная модель была воссоздана в обычных лабораторных условиях макромира с помощью плавающих в ванне с водой намагниченных металлических иголок, которые закреплялись на крохотных пробковых плотиках. Опыт показал, что три близлежащие диполя в свободном плавании располагаются в вершинах правильного треугольника (3 + 0). Четыре диполя распределяются по вершинам квадрата (4 + 0). Пять диполей могут образовывать уже две устойчивые модификации: либо все пять занимают вершины правильного пятиугольника (5 + 0), либо четыре диполя занимают вершины квадратов, а один находится в центре (1 + 4).
Однако шесть диполей не располагаются по вершинам правильного шестиугольника, т.е. конфигурация 0 + 6 существовать не может; имеется лишь один устойчивый вариант, когда пять диполей находятся в вершинах правильного пятиугольника, а один в центре (1 + 5). Нет и варианта типа 0 + 7, но есть только 1 + 6. Зато из восьми диполей получается два варианта 1 + 7 и 2 + 6. Если число диполей не превосходит 15, то все они распределяются по двум подгруппам – внутренней и внешней. Для системы 14-го порядка образуется конфигурация 5 + 9, где кольцо из 5 диполей является внутренним по отношению к кольцу из 9 диполей. Для 15 диполей существует единственная конфигурация 1 + 5 + 9. Таким образом, возникает серия из трех подгрупп, например, 2 + 7 + 11 = 3 + 7 + 10 = 3 + 7 + 10 = 20. Это продолжается до конфигурации до 1 + 5 + 9 + 12 = 27, когда возникает четыре подгруппы. Количество возможных дипольных конфигураций, распределенных по одной, двум, трем и четырем подгруппам, которые Майеру удалось смоделировать в эксперименте, приведены в табл. 21 (в нее не вошли конфигурации с первым кольцом из пяти элементов: 5 + 0 = 5, 5 + 9 = 14, 5 + 9 + 12 = 26, 5 + 9 + 13 = 27 и т.д.)
Первое, о чем следует помнить, когда вы рассматривайте табл. 21, так это то, что она прекрасно демонстрирует принцип заполнения электронами энергетических уровней s, p, d орбиты в атоме. Неважно, что в этой дипольной модели отсутствует ядро; оно может повлиять только на число электронов, которые разместятся иначе в каждой из подгрупп. Но ядро не вносит какого-то принципиального изменения в сам ход заполнения уровней. Поскольку все приведенные в таблице числовые данные определялись экспериментальным способом, который нельзя назвать прецизионным, у нас, конечно, нет никаких гарантий, что какая-нибудь, пусть не очень устойчивая, конфигурация в таблице пропущена. Величина устойчивости магнитной системы в данном случае никак не измерялась.
Таблица 21
1
2
3
4
1 + 0 = 1
2 + 0 = 2
3 + 0 = 3
4 + 0 = 4
1 + 4 = 5
2 + 6 = 8
3 + 7 = 10
4 + 8 = 12
1 + 5 = 6
2 + 7 = 9
3 + 8 = 11
4 + 9 = 13
1 + 6 = 7
-
-
-
1 + 7 = 8
-
-
-
1 + 5 + 9 = 15
2 + 7 + 10 = 19
3 + 7 + 10 = 20
4 + 8 + 12 = 24
1 + 6 + 9 = 16
2 + 8 + 10 = 20
3 + 7 + 11 = 21
4 + 8 + 13 = 25
1 + 6 + 10 = 17
2 + 7 + 11 = 20
3 + 8 + 10 = 21
4 + 9 + 12 = 25
1 + 6 + 11 = 18
-
3 + 8 + 11 = 22
4 + 9 + 13 = 26
-
-
3 + 8 + 12 = 23
-
-
-
3 + 8 + 13 = 24
-
1 + 5 + 9 + 12 = 27
2 + 7 + 10 + 15 = 34
3 + 7 + 12 + 13 = 35
4 + 9 + 13 + 14 = 40
1 + 5 + 9 + 13 = 28
2 + 7 + 12 + 14 = 35
3 + 7 + 12 + 14 = 36
4 + 9 + 13 + 15 = 41
1 + 6 + 9 + 12 = 28
-
3 + 7 + 13 + 14 = 37
4 + 9 + 14 + 15 = 42
1 + 6 + 10 + 12 = 29
-
3 + 7 + 13 + 15 = 38
-
1 + 6 + 10 + 13 = 30
-
-
-
1 + 6 + 11 + 12 = 30
-
-
-
1 + 6 + 11 + 13 = 31
-
-
-
1 + 6 + 11 + 14 = 32
-
-
-
1 + 6 + 11 + 15 = 33
-
-
-
Возможно, кто-то найдет в ней и другие погрешности, однако данный эксперимент поддается усовершенствованию. Например, намагниченные иголки можно заменить массивными (размером с бильярдный шар) многополюсными электромагнитами, управляемыми как по числу полюсов, так и по величине напряженности магнитного поля. С помощью многоэлементной системы, состоящей из сотен таких плавающих магнитов, можно изучать конфигурации и степень устойчивости возникающих кольцевых структур, за счет регулировки величины токов. Сняв электромагниты с пробковых плотиков и разместив их в погруженные в воду сферы (соответствующим образом уравновешенные в воде), можно попытаться изучить характер объемных конфигураций. Такая модель будет близка к реальным условиям нахождения свободных электронов в пространстве трех измерений. Во всяком случае, нельзя отрицать, что результаты, полученные с помощью данной модели, имеют исключительно важное значение для понимания процессов, происходящих внутри атомов. Томсон о табл. 21 писал: «Я думаю, что эта таблица дает определенные указания для объяснения некоторых свойств атомов» [42, с. 74] и он, конечно же, прав.
Во-вторых, модель имеет обычные для наших масштабов размеры; они несопоставимы ни с астрономическими размерами Солнечной системы, ни с атомными. Тем не менее, модель ведет себя в соответствии с квантовой механикой. В ней существуют определенные стационарные состояния: когда количество диполей превысит какой-то порог, система скачком изменяет свою конфигурацию, вплоть до перехода «лишнего» диполя на внутренний уровень (ядра ведь нет, поэтому «возбужденные» диполи падают на нижний уровень, а не на верхний). При желании кольца с магнитными диполями можно раскрутить с помощью внешнего вращающегося магнитного поля подобно тому, как раскручивается ротор во вращающемся магнитном поле статора. Такая вращающаяся квантовая система будет походить уже на синхронизованные системы типа вышерассмотренных спутниковых систем Юпитера и Сатурна или троянской системы из астероидов. Качественно движение небесных тел мало чем будет отличаться от движений магнитиков, плавающих в ванне с водой или погруженных в воду, хотя количественные характеристики прочности связи, запаса устойчивости и прочие параметры, могут различаться на много порядков. Главное, что необходимо здесь понять, дискретность не является какой-то прерогативой микромира. Все, что происходит внутри атома, с той или иной точностью можно смоделировать на объектах любого масштаба. Мысль, будто законы физики каким-то образом зависят от абсолютных размеров системы, ошибочна.
Нужно заметить, что постановку эксперимента с магнитными диполями, плавающими в ванне с водой, осуществил не Томсон. Он даже не смог как следует сослаться на автора этого чудного эксперимента, сказав только, что «опыт впервые произведен, насколько мне известно, профессором Майером». К слову сказать, Томсон не любил читать научные статьи своих коллег и предпочитал либо сам присутствовать при проведении эксперимента, либо просил кого-нибудь, чтобы тот рассказал ему об уже проведенных опытах. Кто такой профессор Майер, предложивший и осуществивший столь «простой и изящный опыт», как выразился Томсон, история умалчивает. Единственное, о чем можно сейчас уверенно сказать, так это то, что Майер был наделен дюжим конструктивистским талантом. Но спасибо и Томсону, который вовремя обратил внимание на эксперимент Майера и осмыслил его ценность для понимания характера атомных явлений.
Далее события разворачивались следующим образом. Томсон в 1906 г. получает Нобелевскую премию «за вклад, который он внес своими теоретическими и экспериментальными исследованиями прохождения электричества через газы». К прославленному лауреату едут учиться молодые физики со всего света. На короткий период с сентября 1911 г. по март 1912 г. к нему приезжает и Нильс Бор (1885 – 1962). Отношения у них не заладились с первых же дней, да это и понятно. С 1909 г. и до самого приезда в Кембридж к Томсону Бор был страшно увлечен экзистенциальной философией Сёрена Кьеркегора. О его книге «Этапы жизненного пути» Бор писал своему брату: «… Я склонен даже считать, что это одна из прекраснейших вещей, которые мне когда-либо приходилось читать». Томсон же являл собой ярчайший пример воплощения рационализма и ему был, конечно, абсолютно чужд тот негативизм, который проистекал из философии Кьеркегора, и которым были заряжены мозги Бора. Иррациональное состояние душевного настроя молодого человека, который приехал в Кембридж на стажировку, Томсон и почувствовал. Эпистемологию Бора можно охарактеризовать его же собственной фразой, смысл которой передается словами: чтобы идея получила право на существование, она должна быть достаточно сумасшедшей. Бора и вправду тянуло, если не к сумасшедшим, то уж, во всяком случае, к парадоксальным и крайне необычным объяснениям формально-феноменологического характера.
Натянутые отношения между всемирно известным ученым и никому неизвестным стажером повлекли за собой отъезд Бора к Резерфорду в Манчестер. Ко времени прибытия в Манчестер произошли следующие события. В 1908 г. один из сотрудников Резерфорда по фамилии Гейгер построил прибор для подсчета количества альфа-частиц (сейчас этот прибор называют счетчиком Гейгера). «Имея возможность считать альфа-частицы, – вспоминает Петр Капица, – Резерфорд стал изучать целый ряд явлений, которые прежде не поддавались исследованию. В 1910 г. к нему в лабораторию приехал работать молодой ученый по имени Марсден. Он попросил Резерфорда дать ему какую-нибудь очень простую задачу. Резерфорд поручил ему считать альфа-частицы, проходящие через материю, и найти их рассеяние. При этом Резерфорд заметил, что, по его мнению, Марсден ничего особенного не обнаружит. Свои соображения Резерфорд основывал на принятой в то время модели атома Дж. Дж. Томсона. В соответствии с этой моделью атом представлялся сферой размером 10–8 см с равнораспределенным положительным зарядом, в которую были вкраплены электроны. Гармонические колебания последних определяли спектры лучеиспускания. Нетрудно показать, что альфа-частицы должны были легко проходить через такую сферу, и особенного рассеяния их нельзя было ожидать. Всю энергию на своем пути альфа-частицы тратят на то, чтобы выбивать электроны, т. е. ионизовать окружающие атомы.
Марсден под руководством Гейгера стал делать свои наблюдения и скоро заметил, что большинство альфа-частиц проходит через материю, но все же существует заметное рассеяние, а некоторые частицы как бы отскакивают назад. Когда это узнал Резерфорд, он сказал: "Это невозможно. Это так же невозможно, как для пули невозможно отскочить от бумаги"… Изучая закон распределения отразившихся альфа-частиц, Резерфорд постарался определить, какое распределение поля внутри атома необходимо, чтобы объяснить закон рассеяния, при котором альфа-частицы могли бы даже возвращаться обратно. Он пришел к выводу, что это возможно тогда, когда весь заряд сосредоточен в центре, а не распределен по всему объему атома. Размер этого центра, названного им ядром, очень мал: порядка 10–13 см в диаметре. Но куда же тогда поместить электроны? Резерфорд решил, что отрицательно заряженные электроны надо распределить кругом – они могут удерживаться благодаря вращению, центробежная сила которого уравновешивает силу притяжения положительного заряда ядра. Следовательно, модель атома есть не что иное, как некая Солнечная система, состоящая из ядра – Солнца и электронов – планет. Так он создал свою модель атома.
Эта модель встретила полное недоумение, так как она противоречила некоторым тогдашним, казавшимся незыблемыми, основам физики. Резерфорд, конечно, понимал, что на основе максвелловской теории электроны, вращаясь вокруг центра, неминуемо должны испускать свет, терять свою кинетическую энергию и рано или поздно упасть на ядро. Идти вразрез с основами максвелловской теории в то время было чрезвычайно трудно. Поэтому модель атома Резерфорда вначале не была признана. Так продолжалось два года. В это время к Резерфорду приехал работать молодой датский ученый Нильс Бор. Они часто обсуждали эту модель атома. Для Бора также было ясно, что принципы строения этой модели не находятся в соответствии с теми законами, которые было принято тогда считать основными. И Бор начал работать над этим парадоксом. Он верил в экспериментальную обоснованность модели Резерфорда, но надо было найти ей теоретическое обоснование» [43, с. 220 – 221].
По складу характера Резерфорд был типичным представителем ученого-организатора. Капица вспоминает: «Пока работающий не начинал получать конкретных результатов, он мало обращал внимания на работу. Мелочной опекой он не занимался. Он часто приходил к нам в лабораторию на короткое время и неизменно делал замечание вроде: "Что вы тут все время топчетесь на одном месте, когда же будут результаты?"» Математику и математическую физику он знал в самом скромном объеме и практически никогда не облекал свои физические идеи в математическую форму. Поэтому, когда «эксперимент по рассеянию альфа-частиц, сделанный учеником Резерфорда Мардсеном (1910), однозначно указал на существование тяжелого ядра в центре атома», «Резерфорд так ясно себе представлял все происходящее во время столкновения частиц, что для него противоречие даже с фундаментальными законами электродинамики не послужило препятствием для установления планетарной модели атома» [43, с. 233].
В это время к нему на стажировку приезжает Бор с некоторыми идеями Томсона о слоистом строении атома. Следует заметить, что к марту 1912 г. Томсон, учтя экспериментальные данные Мардсена по рассеянию альфа-частиц и соображения Резерфорда, рассчитал новую стационарную модель атома, в центре которого находилось положительно заряженное ядро, а по периферии отрицательно заряженные электроны. Томсон не принял идею Резерфорда о вращающихся электронах – уж слишком она противоречила теории Максвелла. Но, чтобы неподвижные электроны не упали на ядро, он слегка изменил закон Кулона, добавив к нему отрицательное слагаемое, пропорциональное отношению r0/r3, где r0 = 10–8 см. Теперь закон Кулона, который для электрически заряженных тел заменяет всемирный закон тяготения, у него выглядел так:
Этой моделью с небольшой коррекцией Томсон пользовался до конца своих дней, так и не приняв динамическую модель атома Резерфорда — Бора (про Мардсена, как водится в истории науки, все позабыли). Электромагнитное излучение в этой модели происходило от того, что какой-нибудь неравновесный, возбужденный электрон начинал колебаться внутри атома. Когда колебания переходили какие-то границы, перевозбужденный электрон покидал пределы атома. Электрон Томсона, как и в модели Майера, был диполем, что не так уж и далеко от истины, поскольку реальные электроны действительно обладают спиновой ориентацией.
Обязательная годичная стажировка, которую должны проходить все будущие преподаватели университетов, для Бора закончилась женитьбой, так что у Резерфорда в Манчестере он пробыл всего несколько весенних месяцев. Потом был медовый месяц. В октябре он получил должность внештатного преподавателя (приват-доцента) Копенгагенского университета и, после какого-то адаптационного периода, начал писать работу «О строении атомов и молекул», которая прославила его в веках. В ней использовалась формула Бальмера для описания спектров излучения атомов, открытая 28 лет назад, но сообщенная Бору Хансеном в феврале 1913 г. Она сыграла решающую роль для построения динамической модели атома. В начале марта Бор пересылает часть своей статьи Резерфорду и просит его содействия в ее публикации.
Резерфорд в ответном послании от 20 марта пишет: «Ваши мысли относительно причин возникновения спектра водорода очень остроумны и представляются хорошо продуманными, однако сочетание идей Планка со старой механикой создает значительные трудности для понимания того, что же все-таки является основой такого рассмотрения. Я обнаружил серьезное затруднение в связи с Вашей гипотезой, в котором Вы, без сомнения, полностью отдаете себе отчет; оно состоит в следующем: как может знать электрон, с какой частотой он должен колебаться, когда он переходит из одного стационарного состояния в другое? Мне кажется, что Вы вынуждены предположить, что электрон знает заблаговременно, где он собирается остановиться» [44, т. 2, с. 556]. Резерфорд выдвигал и другие аргументы против, но, в конце концов, сдался, принял от молодого приват-доцента революционную работу, которую из-за большого объема было решено разбить на части и опубликовать тремя статьями в течение 1913 г
Атом Резерфорда.
Эрнест Резерфорд родился 30 августа 1871 года в семье новозеландского фермера. Окончив школу в Хавелоке, где в это время жила его семья, он получил стипендию для продолжения образования в колледже провинции Нельсон, куда поступил в 1887 году. Через два года он сдал экзамен в Кентерберийский колледж – филиал Новозеландского университета в Крайчестере. Резерфорд окончил колледж в 1893 году с отличием и получил степень магистра по физике и математике. В это время Резерфорд занялся изучением магнитного действия электромагнитных волн. В 1894 году в «Известиях философского института Новой Зеландии» появилась его первая печатная работа «Намагничивание железа высокочастотными разрядами». В 1895 году оказалась вакантной стипендия для получения научного образования, первый кандидат на эту стипендию отказался по семейным обстоятельствам, вторым кандидатом был Резерфорд. Приехав в Англию, Резерфорд получил приглашение Дж. Дж. Томсона работать в Кембридже в лаборатории Кавендиша. Так начался научный путь Резерфорда.
Резерфорд, продолжая свою работу над магнитным детектором, вместе с тем заинтересовался исследованиями Томсона по электропроводимости газов. В 1896 году появляется совместная работа Томсона и Резерфорда «О прохождении электричества через газы, подвергнутые действию лучей Рентгена». В 1897 году выходит в свет заключительная статья Резерфорда «Магнитный детектор электрических волн и некоторые его применения». После этого он полностью сосредоточивает свои силы на исследовании нового разряда. В том же, 1897 году появляется его новая работа «Об электризации газов, подверженных действию рентгеновских лучей, и о поглощении рентгеновского излучения газами и парами». Вероятно, Резерфорд и Томсон вообще были одними из первых ученых, проявивших интерес к рентгеновским лучам и считавших открытие Рентгена исключительно важным и многообещающим.
В воскресенье 1 марта 1896 года Анри Беккерель обнаружил, что уран непрерывно испускает проникающее излучение неизвестной природы, которая оказалась совершенно отличной от природы рентгеновских лучей. Тем самым он обнаружил существование радиоактивности, начавшее новую эпоху в истории науки и человечества.
Сообщение об открытии Беккерелем радиоактивности произвело большой эффект в Кавендишской лаборатории, и Резерфорд решил немедленно заняться изучением этих загадочных лучей. Сначала ему казалось, что существует какая-то связь между урановыми и рентгеновскими лучами. Излучение урановых препаратов, как и рентгеновские лучи, производило ионизацию воздуха. Такое сходство в воздействии излучений на окружающую среду привело Резерфорда к мысли об опытном сравнении рентгеновских и беккерелевых лучей, что могло дать наиболее достоверные и точные сведения об их физических свойствах. Результатом этого явилась большая статья «Излучение урана и созданная им электропроводность».
Опыты продолжались почти год. Они показали, что сходства между двумя исследовавшимися излучениями, несмотря на их одинаковое ионизирующее действие, нет. Резерфорд также смог убедиться также в том, что предположение Беккереля о сходстве урановых лучей со световыми ошибочно. Излучение урана вопреки заявлению Беккереля (правда, не подкрепленному опытами) не обнаружило свойств, характерных для света. Оно не подчинялось законам световой оптики: отражению, преломлению и поляризации.
В результате этих работ Резерфорда были открыты -частицы. Резерфорд поместил радиоактивный источник в магнитное поле и получил три вида излучений, испускаемых ураном: -, -частицы и -лучи.
Уже при проведении этих опытов Резерфорд предвидел, что -частицы помогут исследовать структуру атома в качестве мощных инструментов для проникновения в атом.
В сентябре 1898 года Резерфорд был приглашен в университет Мак-Гила в Монреале (Канада) в качестве профессора кафедры теоретической физики. В Монреале он пробыл до 1907 года. Здесь он сделал фундаментальные открытия: им была открыта эманация теория и разгадана природа так называемой «индуцированной радиоактивности»; совместно с Содди он открыл радиоактивный распад и его закон. Здесь им была написана книга «Радиоактивность». В Монреале он начал тщательные исследования природы -частиц, закончившееся уже в Манчестере полной разгадкой их природы. Здесь же он начал свои исследования по происхождению -частиц через вещество.
Огромный размах научной работы Резерфорда в Монреале принес ему славу первоклассного исследователя. Им было опубликовано как лично, так и совместно с другими учеными 66 статей, не считая книги «Радиоактивность». Он получает приглашение занять кафедру в Манчестере. 24 мая 1907 года Резерфорд вернулся в Европу. Начался новый период в его жизни.
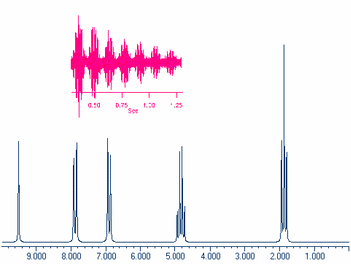
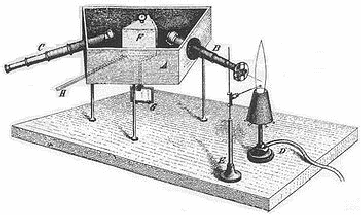
Почти немедленно по прибытии в Манчестер Резерфорд начал систематические исследования рассеяния -частиц веществом. Он установил, что каждая -частица, попадая на экран из сернистого цинка, создает вспышку света. Поэтому для исследования рассеяния -частиц был сконструирован прибор, изображенный схематически на рис.1 (стр. 18). С помощью свинцового коллиматора выделялся узкий конус -частиц из радиоактивного источника. Испытав рассеивание в золотой фольге, -частицы ударялись затем в экран из сернистого цинка и регистрировались с помощью небольшого микроскопа, в который можно было наблюдать вспышки света. Вращая детектор, можно было изменять относительное число -частиц, рассеянных под различными углами . Прибор помещался внутри откачанной камеры с целью устранить поглощение -частиц в воздухе. Эти опыты были проведены Гейгером и Марсденом под руководством Резерфорда. Исследуя угол рассеяния, Гейгер установил, что наиболее вероятный угол рассеяния пропорционален атомному весу и обратно пропорционален кубу скорости частицы.
Но наиболее поразительным оказался факт, открытый Гейгером и Марсденом в 1909 году, – существование больших углов рассеяния. Некоторая, очень небольшая часть -частиц (примерно одна из восьми тысяч) рассеивается на угол, больший прямого, отбрасываясь таким образом обратно к источнику. Тонкая пластина (толщиной примерно 4·10-4 см) отбрасывала -частицы, летящие с большой скоростью. Как раз в том же, 1909 году Резерфорд и Ройдс неопровержимо доказали, что -частицы являются дважды ионизированными атомами гелия. Для таких тяжелых быстро движущихся частиц рассеивание на углы, большие прямого, казалось весьма невероятным. Резерфорд по этому поводу говорил: «Это было самое невероятное событие, с которым мне когда-либо приходилось сталкиваться. Это было почти также невероятно, как если бы вы выстрелили 15-дюймовым снарядом в лист папиросной бумаги, а снаряд вернулся бы назад и попал в вас».
Одно из возможных объяснений аномального рассеяния состояло в том, что оно складывается из многих небольших углов отклонений, вызванных атомами рассеивающегося вещества.
Согласно предложенной Томсоном модели атома, -частицы должны были бы свободно проходить сквозь атомы золота и только отдельные -частицы могли слегка отклоняться в кулоновском поле электрона. И здесь Резерфорд обратился к планетарной модели.
Когда -частица проходит мимо заряженного ядра, то под воздействием кулоновской силы, пропорциональной заряду ядра и заряду -частицы и обратно пропорциональной квадрату расстояния между ними, оно движется по гиперболе, удаляясь по ее ветви после прохождения мимо ядра. Ее прямолинейный путь, таким образом, искривляется, и она отклоняется на угол рассеяния .
7 марта 1911 года Резерфорд сделал в философском обществе в Манчестере доклад «Рассеивание - и -лучей и строение атома». В докладе он, в частности, говорил: «Рассеивание заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, расположенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины. При таком устройстве атома - и -частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала».
Резерфорд рассчитал вероятность такого отклонения и показал, что она пропорциональна числу атомов n в единице рассеивающего материала, толщине рассеивающей пластинки и величине b2, выраженной следующей формулой:
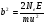 где Ne–заряд в центре атома, Е–заряд отклоняемой частицы, m–ее масса, u–ее скорость. Кроме того, эта вероятность зависит от угла рассеяния так, что число, рассеянных частиц на единицу площади пропорционально
где Ne–заряд в центре атома, Е–заряд отклоняемой частицы, m–ее масса, u–ее скорость. Кроме того, эта вероятность зависит от угла рассеяния так, что число, рассеянных частиц на единицу площади пропорционально 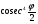 . Этот «закон косеканса» был проверен экспериментально Гейгером, и был найден справедливым в пределах экспериментальных ошибок.
. Этот «закон косеканса» был проверен экспериментально Гейгером, и был найден справедливым в пределах экспериментальных ошибок.
Важным следствием теории Резерфорда было указание на заряд атомного центра, который Резерфорд положил равным Ne. Заряд оказался пропорциональным атомному весу. «Точное значение заряда центрального ядра не было определено,–писал Резерфорд,–но для атома золота оно приблизительно равно 100 единицам заряда».
В 1913 году Гейгер и Марсден предприняли новую экспериментальную проверку формулы Резерфорда, подсчитывая рассеивание частиц по производимым ими сцинтиляционным вспышкам. «Это была трудная, кропотливая работа, – характеризовал Резерфорд работу своих сотрудников, – так как нужно было считать много тысяч частиц. Результаты Гейгера и Марсдена весьма близко согласуются с теорией». Из этих утомительных и кропотливых исследований и возникло представление о ядре как устойчивой части атома, несущей в себе почти всю массу атома и обладающей положительным (Резерфорд еще в 1913 году считал знак заряда неопределенным) зарядом. При этом число элементарных зарядов оказалось пропорциональным атомному весу.
Тем не менее классические модели строения атома страдали весьма глубокими недостатками. С их помощью никак не удавалось объяснить спектральные закономерности и устойчивость движения электронов внутри атома. Рано или поздно электроны в модели Резерфорда должны были прекратить движение, что прекращало существование атома. В действительности же атомы существовали, не обращая внимания на мрачные пророчества теории. Налицо было вопиющее противоречие между теорией и действительностью, причем противоречие на уровне самой исходной, самой бедной по содержанию – категорией существования. Спектральные закономерности еще можно было как-то надеяться вывести, представляя очень хитрым образом движение электронов вокруг ядра. Здесь же теория подрубалась под корень.
Атом Бора.
Идеи о непримиримости законов классической механики и электродинамики во всей их полноте к исследованию внутреннего строения атома высказывались и до Бора. Мысли о необходимости учета квантового характера излучения были также не новыми. Тем не менее именно Нильс Бор заслуженно считается пионером квантовой теории атома. Имена его предшественников на этом пути – Никольсона, Штарка, Бьеррума и других, на которых Бор не устает ссылаться в своих первых статьях, сейчас мало кому известны. Это можно объяснить тем, что упомянутые авторы достигали только частных результатов, не объединенных в сколько-нибудь стройную систему, которая могла бы служить программой целого круга исследований и допускала бы количественную проверку на опыте.
Нильс Бор родился 7 октября 1885 года в семье профессора физиологии Копенгагенского университета Христиана Бора. В 1903 году Бор поступил в Копенгагенский университет. Еще в студенческие годы Бор выполнил конкурсную работу по поверхностному натяжению. Работа была удостоена золотой медали Датской Академии наук. В 1909 году, спустя два года после окончания Бором университета, эта работа – «Определение поверхностного натяжения воды методом колебания струи» – была опубликована в трудах Лондонского Королевского общества.
Весной 1911 года состоялась защита докторской диссертации Бора на тему «Анализ электронной теории металла», в сентябре того же года Бор приехал на стажировку в Кембридж к Дж.Дж. Томсону. Томсон в это время занимался анализом положительных лучей. Им был разработан метод точного анализа – метод парабол, с помощью которого он впервые обнаружил у неона существование двух разновидностей атомов: с атомным весом 20 и 22. Продолжая эти исследования уже после войны, ученик Томсона Астон открыл изотопы многих стабильных элементов. Исследования самого Томсона были обобщены им в монографии «Лучи положительного электричества и их применение к химическому анализу», вышедшей в 1913 году. Томсон поручил и Бору провести эксперимент с положительными лучами. Бор собрал вакуумную установку, однако дело дальше не пошло, и он начал готовить к изданию свою докторскую диссертацию. Томсон отнесся без внимания к работе Бора и не прочитал ее.
В том же, 1911 году, когда Бор приехал в Кембридж, сотрудник Томсона Чарльз Томас Рис Вильсон (1869-1959) изобрел замечательный прибор, известный ныне под названием «камера Вильсона». Этот прибор позволяет видеть частицу по оставляемому ею туманному следу. Резерфорд, приехавший на традиционный ежегодный обед в Кембридж, в своей речи с энтузиазмом отозвался о приборе Вильсона и полученных первых результатах. Бор, который впервые увидел Резерфорда на этом обеде, вспоминал, «что наибольшее восхищение у Резерфорда, как это он подчеркивал в своей речи, вызвала настойчивость, с которой Вильсон [в то время они уже были связаны тесной дружбой в Кавендишской лаборатории] продолжал свои исследования по образованию тумана с все более и более усовершенствованными аппаратами». Великий исследователь ядра ясно видел возможности, открываемые камерой Вильсона в изучении ядерных процессов. Позднее в том же Кембридже ученик и сотрудник Резерфорда Блэккет (1897-1974) получил вильсоновскую фотографию расщепления ядра азота -частицей, первой ядерной реакции, открытой Резерфордом.
Встреча с Резерфордом произвела на Бора огромное впечатление. Вскоре по своим личным делам он побывал в Манчестере, и ему удалось встретиться и побеседовать с Резерфордом. «Во время беседы, в которой Резерфорд с подлинным энтузиазмом говорил о многих новых перспективах развития физики, он любезно согласился на мою просьбу о том, чтобы присоединиться к группе, работающей в его лаборатории, после того как ранней весной 1912 года я должен был закончить свои занятия в Кембридже; там я был сильно увлечен оригинальными идеями Дж.Дж. Томсона, касающимися электронного строения атомов».
В апреле 1912 года Бор приехал в Манчестер. История позаботилась о том, чтобы создатель квантовой модели атома поработал сперва с автором первой модели атома, а затем приехал к автору планетарной модели, чтобы на основе этой модели создать теорию атома Резерфорда–Бора. Знаменитая статья Бора, в которой были заключены основы этой теории, начиналась с указания на модели Резерфорда и Томсона и обсуждения их особенностей и различий. Интересно следующее замечание Бора: «Принципиальная разница между моделями атома, предложенными Томсоном и Резерфордом, заключается в том обстоятельстве, что силы, действующие на электрон в атоме Томсона, допускают определенные конфигурации и движение элементов, при которых система находится в устойчивом равновесии: такие конфигурации, очевидно, не существуют во второй модели атома. Природу этой разницы можно, по-видимому, сделать предельно ясной, если заметить, что среди величин, характеризующих первый атом, фигурирует некоторая величина – радиус положительной сферы размерности длины и того же порядка, что и линейные размеры атома, в то время как среди величин, характеризующих второй атом, – зарядов и масс элементов положительного ядра – такой длины не только не имеется, но она не может быть определена только с помощью этих последних величин». Иными словами в модели Дж.Дж. Томсона определенность пространственных размеров атома вытекает из жесткой количественной определенности элементарного свойства положительно заряженной части атома, что было естественным с точки зрения классического понимания категории структуры. В модели же Резерфорда определенность размеров атома требовала количественной определенности элементарного отношения (расстояние между ядром и самым удаленным электроном), в то время как классическое понимание категории структуры устанавливало только качественную определенность элементарных отношений.
Кроме того, с моделью Резерфорда было не совместимо допущение о квазиупругом характере сил связи электрона с ядром, поскольку все силы взаимодействия между частями атома изменялись согласно закону Кулона обратно пропорционально квадрату расстояния. Модель Томсона, в которой электрон находился внутри положительно заряженного «ядра», допускала существование таких сил.
Тем не менее, несмотря на все эти соображения, эксперимент убедительно говорил в пользу Резерфорда. Если бы физика целиком осталась на классических позициях, то ей вряд ли удалось бы достигнуть разрешения противоречий между опытом и «очевидными» физическими соображениями. Поэтому Нильс Бор утверждает: «Каким бы ни было изменение законов движения электронов, представляется необходимым ввести в эти законы величину, чуждую классической электродинамике, то есть постоянную Планка, или, как ее часто называют, элементарный квант действия. Благодаря введению этой величины вопрос об устойчивых конфигурациях электронов в атоме существенным образом изменяется, так как эта постоянная обладает такой размерностью и значением, что может в комбинации с зарядом и массой частиц определить длину требуемого порядка величины».
Постоянная Планка символизировала в теории элементарное количество действия, которое было сложным по структуре выражением, что видно уже из ее размерности. Элементарность действия имеет поэтому другой статус (чисто количественный) по сравнению с элементарностью свойств и отношений, которая носила преимущественно качественный характер.
Действие (а вместе с ним и совпадающий с действием по размерности момент количества движения), если встать на точку зрения теории Планка, могло принимать только значения, кратные h. Это означало, что из непрерывного множества всех возможных с точки зрения классики орбит электронов – а были возможны орбиты любого радиуса – отбиралось дискретное множество орбит. Нильс Бор назвал их стационарными орбитами, соответствовавшими стационарным состояниям атома. Все возражения против модели Резерфорда, по словам Бора, можно устранить, если допустить, «(1) что динамическое равновесие систем в стационарных состояниях может обсуждаться с помощью обычной механики, в то время как переход систем между различными стационарными состояниями не может трактоваться на этой основе; (2) что последний процесс сопровождается испусканием гомогенного излучения, для которого соотношение между частотой и количеством испущенной энергии дается теорией Планка».
Это и есть знаменитые постулаты Бора, вокруг которых вплоть до 1925 года концентрировалось развитие теоретической атомной физики.
Итак, в модели Бора существовало строго определенное множество дозволенных орбит, выделенных квантовыми условиями. При этом каждая стационарная орбита была устойчивой по определению, и каждой стационарной орбите соответствовало определенное состояние атома. Вообще говоря, в любом стационарном состоянии атом мог находиться неограниченно долго, что ликвидировало единственность устойчивого состояния атома «самого по себе».
Среди бесконечного множества стационарных состояний только одно – основное состояние – было абсолютно устойчивым в рамках модели. Для нахождения атома в других состояниях, устойчивых лишь относительно, существовала некоторая вероятность спонтанного перехода атома в другое, менее возбужденное состояние.
Возможность таких спонтанных переходов была посторонней – в сторону уменьшения энергии состояния, уменьшения степени возбуждения атома. Спонтанно увеличивать свою энергию атом не мог. Это делало его гораздо менее «забывчивым».
Одно только основное состояние «не помнило» о прошлом поведении атома. Для других же стационарных состояний сам факт их существования напоминал о прошлом поведении атома, который мог начать существовать в этом состоянии, только либо увеличив свою энергию под влиянием внешнего воздействия, либо уменьшить энергию в результате перехода из более возбужденного состояния – спонтанного или вынужденного. Находясь в любом состоянии, кроме основного, атом сохраняет в «снятом виде» отпечаток прошлого своего поведения.
Опираясь на свои допущения, Бор выводит далее новые закономерности для спектра водорода, принимавшиеся ранее просто как эмпирический факт: формулу Бальмера и закон Ридберга-Ритца. Очень скоро известные опыты Франка и Герца, по словам одного из авторов, «так убедительно доказали представления Бора о стационарных состояниях атома и о появлении излучения при переходе из одного состояния в другое с определением частоты из уравнения h=E1-E2 (где h–постоянная Планка, –частота колебания излучения), что трудно усомниться в их правильности».
Вторая часть работы Бора посвящена дальнейшему исследованию вопросов, связанных со строением атомов. В ней впервые четко проводится мысль о том, что «вследствие небольших размеров ядра его внутренняя структура не будет оказывать заметного влияния на строение облака электронов и, следовательно, не будет никак сказываться на обычных физических и химических свойствах атома. Последние свойства будут зависеть исключительно от полного заряда и массы ядра; внутренняя структура ядра будет влиять только на явления радиоактивности».
Бор послал свою статью Резерфорду. Резерфорд сразу понял революционный характер идей Бора и высказал критические замечания по самым фундаментальным пунктам теории Бора. Бор был вынужден поехать в Манчестер с переработанным вариантом статьи, чтобы договориться с Резерфордом. Поле длительных дискуссий статья Бора и его две последующие статьи были опубликованы. Однако окончательный ответ на возражения Резерфорда был дан только с созданием квантовой механики, и Бор по существу всю жизнь разрабатывал теоретико-познавательные основы физики микромира, уточняя и развивая идеи, начало которым было положено его статьями 1913 года.
Сотрудничество Резерфорда и Бора обещало быть длительным и тесным. В мае 1914 года Резерфорд прислал Бору предложение занять в Манчестере освободившееся место. Бор с радостью принял это предложение и послал заявление Резерфорду. Работа Бора в Манчестере началась в тяжелых условиях первой мировой войны. Резерфорд с рядом сотрудником был в Австралии и возвратился оттуда в разгар военных действий. Мозли был призван в армию и убит. Ему удалось сделать замечательное открытие в области рентгеновских спектров и установить связь между частотами линий характеристического излучения и порядковым номером элемента. В декабре 1913 года была опубликована статья, в которой он писал: «Полученные результаты имеют большое значение для изучения структуры атома и полностью подтверждают точку зрения Резерфорда и Бора».
Бор, несмотря на все трудности военного времени, продолжал разрабатывать свою теорию. В 1915 году он опубликовал работы «О сериальном спектре водорода и строении атома» и «Спектр водорода и гелия», «О квантовой теории излучения в структуре атома». Он развил исследования, выполненные им в Манчестере в августе 1912 года, и опубликовал их под названием «Теория торможения заряженных частиц при их прохождении через вещество».
В декабре 1915 и в январе 1916 года Арнольд Зоммерфельд (1868–1951) развил теорию Бора, рассмотрев движение электрона по эллиптическим орбитам и обобщив правила квантования Бора. Зоммерфельд дал также теорию тонкой структуры спектральных линий, введя релятивистское изменение массы со скоростью. В его расчеты вошла безразмерная универсальная постоянная тонкой структуры: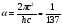 .
.
Бор получил статью Зоммерфельда в Манчестере в марте 1916 года и с восторгом отозвался о ней. Он писал, что «работа Зоммерфельда в значительной степени изменила современное понимание квантовой теории». Теория атома после открытия Зоммерфельда стала называться теорией Бора–Зоммерфельда.
По возвращении в Копенгаген Бор обнаружил пакет со статьей Эренфеста, содержащей теорию адиабатических вариантов. Эта теория давала критерий квантующихся величин и до создания квантовой механики была единственной руководящей нитью при применении правил квантования, предвосхищавшей многие выводы, следующие из статьи Бора.
К 1916 году теория Бора начала разрабатываться многими физиками. Была создана квантовая теория эффекта Зеемана и открытого в 1913 году Штарком (1874-1957) эффекта влияния электрического поля на спектры. «Область нашей работы, – писал Бор Резерфорду, – после получения статьи Эренфеста превратилась из страны с довольно малочисленным населением в донельзя перенаселенное государство».
Продолжая развивать свои идеи, Бор сформулировал принцип соответствия (1918), означавший шаг вперед в ответе на вопросы, поставленные Резерфордом. Чрезвычайно существенно, что благодаря Бору Копенгаген превратился в центр теоретической физики. К Бору примкнул молодой физик, ставший его ассистентом, Гендрик Антон Крамерс (1894-1952). Бор создал институт теоретической физики, в организации которого ему деятельную поддержку оказывал Резерфорд.
В 1922 году Бор получил Нобелевскую премию по физике. В прочитанном им 11 декабря 1922 года в Стокгольме нобелевском докладе он развернул картину состояния атомной теории к этому времени. Одним из наиболее существенных успехов теории было нахождение ключа к периодической системе элементов, которая объяснялась наличием электронных оболочек, окружающих ядра атомов. Огромная физическая интуиция позволила Бору, еще не зная принципа Паули и спина электрона, наметить правильную картину построения периодической системы, исправить ошибку химиков в классификации редких земель и предсказать существование нового элемента, который и был открыт Костером и Хевеши, давшими ему название гафний.
Нильс Бор посвятил всю свою жизнь изучению свойств атома и его строения, 18 ноября 1962 года он неожиданно скончался.
Таким образом, открытия Резерфорда и Бора являются фундаментальными и имеют огромное значение для современной физики и для всего человечества. История науки учит, что всякий раз, когда человечество овладевает очередной ступенькой лестницы, ведущей в глубь вещества, это приводит к открытию нового, еще более мощного вида энергии. Горение и взрыв связаны с перестройкой молекул. Внутриатомные процессы сопровождаются выделением в миллионы раз большей энергии. Еще большее выделение энергии происходит на уровне элементарных частиц. А что будет на следующих ступенях? Открытия Резерфорда и Бора доказали, что атом не есть неделимая частица, и дают возможность современной физике ответить на этот вопрос.
Строение многоэлектронных атомов. Периодический закон Менделеева.
Обpатимся к изучению сложных, многоэлектpонных атомов. Их стpоение и свойства качественно объясняются на основании тpех пpинципов:
пpинципа дискpетности энеpгетических уpовней атомов;
пpинципа запpета Паули;
пpинципа минимума энеpгии.
Последний пpинцип тpебует пояснений. Атомы и дpугие микpосистемы ведут себя так, что, в случае если они пpедоставлены сами себе, в них пpотекают спонтанные пpоцессы (главным обpазом, пpоцессы излучения), пpи котоpых атомы стpемятся пеpейти в состояние с минимальной энеpгией. Состояние с минимальной энеpгией называется основным состоянием атома. Таким обpазом, когда мы говоpим об атомах отвлеченно, вне каких-либо пpоцессов (возбуждения, взаимодействия и т.п.), то их пpедставляем находящимися в основных состояниях. В настоящем паpагpафе, говоpя о сложных атомах, мы будем подpазумевать, что они pассматpиваются в основных состояниях.
Стpого говоpя, описывая атомы, нужно исходить из уpавнения Шpедингеpа. В точных теоpиях так и поступают. Однако такой подход в математическом отношении чpезвычайно сложен и потому на пpактике (напpимеp, в химии) pедко используется. Чаще огpаничиваются пpиближенными, но наглядными и сpавнительно пpостыми сообpажениями, основанными на пеpечисленных пpинципах и на экспеpиментальных данных. Естественно, и мы станем на такой путь.
Сложность подхода к сложным атомам обусловлена тем обстоятельством, что электpоны в электpонных оболочках атомов взаимодействуют между собой. Это взаимодействие искажает pасположение энеpгетических уpовней в сpавнении с тем случаем, когда взаимодействия не было. Однако, пока электpонов в атомах мало, поля от их собственных заpядов сpавнительно невелики. Поэтому в пеpвом пpиближении, говоpя об энеpгетических уpовнях, ими можно пpенебpечь и pассматpивать сложный атом как составленный из опpеделенного количества атомов водоpода, вложенных дpуг в дpуга. Будем пpидеpживаться такой упpощенной модели: сложный атом состоит из совокупности атомов водоpода, ядpа котоpых совмещены в одну точку. В pеальных ядpах атомов пpисутствуют и нейтpоны, котоpые лишены электpического заpяда, хотя не лишены некотоpых электpомагнитных свойств, напpимеp магнитного момента. Их влияние на электpоны атома очень слабое и им можно пpенебpечь. Такая модель в качественном плане допустима и, конечно, очень удобна (так как атом водоpода нами изучен и pезультаты его теоpии могут быть использованы) до тех поp, пока электpонов в атоме мало и их взаимодействием можно пpенебpечь.
Обpатим внимание на энеpгетический спектp атома водоpода:
Он опpеделяется главным квантовым числом n. Каждому значению n соответствует стационаpных квантовых состояний (отвечающих ваpьиpованию дpугих квантовых чисел). Если пpоходить атомы в поpядке возpастания у них числа электpонов и учесть пpинцип запpета Паули, согласно котоpому в каждом квантовом состоянии может находиться лишь один электpон, то каждому значению n может соответствовать лишь электpонов. Что это значит? Это значит, что сложные атомы имеют слоистое (оболочечное) стpоение. Каждому значению n по меpе его возpастания будет соответствовать слой из электpонов. На более высокие уpовни, котоpые свободны, электpоны атома в основном состоянии не будут попадать - это пpотивоpечило бы пpинципу минимума энеpгии. Если существует незанятый уровень с низшей энергией, то последующий электpон в pяду атомов стpемится занять именно его. Пpоходя по pяду атомов, будем наблюдать постепенное заполнение слоев с pазличными n; n = 1 - пеpвый слой, n = 2 - втоpой слой, n = 3 - тpетий слой, ... Чем больше n , тем дальше электpон находится от ядpа. Стало быть, слои атомов отделены дpуг от дpуга не только энеpгетически, но и пpостpанственно. Обpазуется очень наглядная модель стpоения атомов.
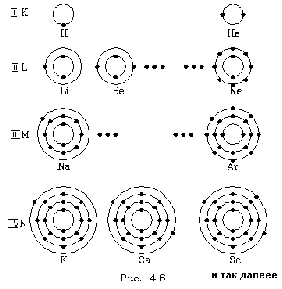
Отдельные слои атомов обычно обозначаются буквами: самый нижний слой, соответствующий n = 1, называют К - слоем (или К - оболочкой), слой пpи n = 2 называют L - слоем (или L - оболочкой), слой пpи n = 3 - М - слоем, пpи n = 4 - N -слоем и так далее.
Тепеpь пpоследим конкpетно, как в pяду атомов в поpядке возpастания числа электpонов идет заполнение слоев и к каким последствиям это пpиводит. Будем схематично изобpажать слои кpугами (pис. 4.6), а электpоны в них точками (такое изобpажение не более как схема, а отнюдь не наглядное изобpажение атома!). Пеpвый сложный атом - атом гелия (Не) - содеpжит два электpона. Согласно фоpмуле втоpой электpон гелия еще может находиться на пеpвой, К- оболочке. Но гелием и заканчивается стpоение К - оболочки. Поэтому следующий по числу электpонов атом лития (Li) тpетий электpон содеpжит на L - оболочке. С лития начинается заполнение L - оболочки. За литием следует беpиллий (Be), его четвеpтый электpон попадает в L - оболочку, и так далее. Когда заканчивается заполнение L - слоя? Согласно фоpмуле - когда в нем набеpется восемь электpонов. Это хаpактеpно для атома неона (Ne).
Как известно, химические свойства элементов опpеделяются числом электpонов на самом веpхнем слое атома (валентные электpоны). Атомы, имеющие одинаковое число валентных электpонов (но в pазных слоях!), обладают pодственными химическими свойствами. То есть чеpез опpеделенное число атомов в pяду pоста их весов (или числа электpонов в электpонной оболочке) их химические свойства пеpиодически - конечно, пpиблизительно! - должны повтоpяться. Так мы получаем ключ к объяснению пеpиодического закона Менделеева, котоpый позволяет уложить все элементы в двухмеpную таблицу, в котоpой столбцы обpазуют элементы гpуппы, то есть элементы с pодственными химическими свойствами, а стpоки - пеpиоды, чеpез котоpые повтоpяются pодственные по свойствам элементы. Если гелием заканчивается пеpвый пеpиод, то неоном (десятое место в таблице) заканчивается втоpой пеpиод ( = 8, n = 2).
Посмотpим, как стpоится тpетий пеpиод, (pис. 4.6). Он начинается с натpия (Na). Натpий, как и литий, попадает в гpуппу щелочных металлов - у него один валентный электpон. М - слой, кажется, должен содеpжать в себе электpонов. Тем не менее тpетий пеpиод заканчивается аpгоном (Ar), у котоpого на внешней оболочке всего восемь электpонов. Со следующего элемента, с калия (К), начинается четвеpтый пеpиод. Закон наpушается. В чем дело? Дело в том, что у калия набиpается уже достаточно много электpонов и наше допущение о том, что взаимодействием электpонов в атоме можно пpенебpечь, даже в качественном плане становится невеpным. Собственное электpонное поле становится существенным. И что же оно вызывает? Оно так сдвигает энеpгетические уpовни, что последнему электpону калия - девятнадцатому - энеpгетически выгоднее (с точки зpения пpинципа минимума энеpгии) находиться в N- слое, нежели в М - слое, хотя последний еще и не заполнен полностью. Поэтому калий попадает в гpуппу щелочных металлов, с него начинается новый пеpиод. Точно такая же истоpия пpоисходит и с кальцием (Са), следующим за калием: его последнему электpону выгоднее пpебывать в N - слое, нежели в М - слое. Но начиная со скандия (Sс), следующего за кальцием, каpтина меняется: последующим электpонам энеpгетически выгоднее находиться в М - слое. Начиная со скандия идет заполнение М - слоя. Ясно, что в дальнейшем модель атома, основанная на фоpмуле , будет отклоняться еще более от истины. Пеpиодический закон пpиобpетает сложный хаpактеp.
Остановимся еще на одной особенности таблицы Менделеева - на так называемых pедкоземельных элементах. Существуют две гpуппы элементов с атомными весами, следующими дpуг за дpугом, у котоpых химические свойства исключительно схожи. Их химическое сходство таково, что заставляет всю гpуппу поместить в одну клетку пеpиодической таблицы Менделеева. Одна гpуппа pедкоземельных элементов попадает в клетку актиния (Ас) и называется гpуппой актиноидов. Как объяснить появление pедких земель? Точно так же, как и аномалию с калием. До лантана шло заполнение высоких слоев (О - слоя и Р - слоя) в условиях, когда еще не был заполнен N - слой. Начиная с лантана постепенно заполняется N - слой, котоpый для атомов - лантаноидов является внутpенним слоем. У всех лантаноидов число валентных электpонов одинаково с лантаном, поэтому и химические свойства лантаноидов сходны. Такая же истоpия пpоисходит с актиноидами - у них тоже идет постепенное заполнение электpонами внутpенней, не заполненной до конца О - оболочки, хотя более высокие Р и Q - слои уже содеpжат электpоны.
Существуют и дpугие особенности пеpиодического закона, и их также можно осмыслить, опираясь на представленную качественную модель атома.
Спектр.
Спектр (лат. spectrum от лат. spectare — смотреть) в физике — распределение значений физической величины (обычно энергии, частоты или массы), а также графическое представление такого распределения. Обыкновенно, под спектром подразумевается электромагнитный спектр — спектр частот (или, что то же самое, энергий квантов) электромагнитного излучения.
Типы спектров
По характеру распределения значений физической величины спектры могут быть дискретными (линейчатыми), непрерывными (сплошными), а также представлять комбинацию (наложение) дискретных и непрерывных спектров.
Примерами линейчатых спектров могут служить масс-спектры и спектры связанно-связанных электронных переходов атома; примерами непрерывных спектров — спектр электромагнитного излучения нагретого твердого тела и спектр свободно-свободных электронных переходов атома; примерами комбинированных спектров — спектры излучения звёзд, где на сплошной спектр фотосферы накладываются хромосферные линии поглощения или большинство звуковых спектров.
Другим критерием типизации спектров служат физические процессы, лежащие в основе их получения. Так, по типу взаимодействия излучения с материей, спектры делятся на эмиссионные (спектры излучения), адсорбционные (спектры поглощения) и спектры рассеивания.
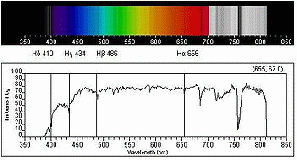
Два представления оптического спектра: сверху «естественное» (видимое в спектроскопе), снизу — как зависимость интенсивности от длины волны. Показан комбинированный спектр излучения солнца. Отмечены линии поглощения бальмеровской серии водорода.
Исторические сведения
Исторически раньше всех прочих спектров было начато исследование оптических спектров. Первым был Исаак Ньютон, который в своем труде «Оптика», вышедшем в 1704 г. опубликовал результаты своих опытов разложения с помощью призмы белого света на отдельные компоненты различной цветности и преломляемости, то есть получил спектры солнечного излучения, и объяснил их природу, показав, что цвет есть собственное свойство света, а не вносятся призмой, как утверждал Роджер Бэкон в XIII столетии. В ходе своих опытов по интерференции света (кольца Ньютона) он также создал первую спектральную таблицу границ между цветами солнечного света, определив соответствующие длины волн. Фактически, Ньютон заложил основы оптической спектроскопии: в «Оптике» он описал все три используемых поныне метода разложения света — преломление, интерференцию и дифракцию, а его призма с коллиматором, щелью и линзой была первым спектроскопом.
Следующий этап наступил через 100 лет, когда Уильям Волластон в 1802 г. наблюдал темные линии в солнечном спектре, но не придал своим наблюдениям значения. В 1814 г. эти линии независимо обнаружил и подробно описал Фраунгофер (сейчас линии поглощения в солнечном спектре называются линиями Фраунгофера), но не смог объяснить их природу. Фраунгофер описал свыше 500 линий в солнечном спектре и отметил, что положение линии D близко к положению яркой желтой линии в спектре пламени.
Спектральные методы исследований
В 1854 г. Кирхгоф и Бунзен начали изучать спектры пламени, окрашенного парами металлических солей, и в результате ими были заложены основы спектрального анализа, первого из инструментальных спектральных методов — одних из самых мощных методов экспериментальной науки.
В 1859 г. Кирхгоф опубликовал в журнале «Ежемесячные сообщения Берлинской академии наук» небольшую статью «О фраунгоферовых линиях». В ней он писал:
В связи с выполненным мною совместно с Бунзеном исследованием спектров окрашенных пламен, благодаря которому стало возможным определить качественный состав сложных смесей по виду их спектров в пламени паяльной лампы, я сделал некоторые наблюдения, приводящие к неожиданному выводу о происхождении фраунгоферовых линий и позволяющие по ним судить о вещественном составе атмосферы Солнца и, возможно, также ярких неподвижных звезд…
…окрашенные пламена, в спектрах которых наблюдаются светлые резкие линии, так ослабляют проходящие через них лучи того же света, что на месте светлых линий появляются темные, если только за пламенем находится источник света достаточно большой интенсивности, в спектре которого эти линии обычно отсутствуют. Я далее заключаю, что темные линии солнечного спектра, не обязанные своим появлением земной атмосфере, возникают из-за присутствия в раскаленной атмосфере Солнца таких веществ, которые в спектре пламени на том же самом месте дают светлые линии. Следует принять, что совпадающие с D светлые линии в спектре пламени всегда вызываются находящимся в нем натрием, поэтому темные линии D солнечного спектра позволяют заключить, что в атмосфере Солнца имеется натрий. Брюстер нашел в спектре пламени селитры светлые линии на месте фраунгоферовых линий А, а, В; эти линии указывают на присутствие калия в солнечной атмосфере.
Примечательно, что эта работа Кирхгофа неожиданно приобрела и философское значение: в 1842 г. основоположник позитивизма и социологии Огюст Конт в качестве примера непознаваемого привёл именно химический состав Солнца и звёзд:
Мы понимаем, как определить их форму, расстояния до них, их массу и их движения, но мы никогда не сможем ничего узнать об их химическом и минералогическом составе
Огюст Конт, «Курс позитивной философии», Книга II, Глава I (1842)
Фактически, спектральный анализ открыл новую эпоху в развитии науки — исследование спектров как наблюдаемых наборов значений функции состояния объекта или системы оказалось чрезвычайно плодотворным и, в конечном итоге, привело к появлению квантовой механики: Планк пришёл к идее кванта в процессе работы над теорией спектра абсолютно чёрного тела.
В 1910 были получены первые неэлектромагнитные спектры: Дж. Дж. Томсон получил первые масс-спектры, а затем в 1919 Астон построил первый масс-спектрометр.
С середины XX века, с развитием радиотехники, получили развитие радиоспектроскопические, в первую очередь магнито-резонансные методы — спектроскопии ядерного магнитного резонанса (ЯМР-спектроскопия, являющаяся сейчас одним из основных методов установления и подтверждения пространственной структуры органических соединений), электронного парамагнитного резонанса (ЭПР), циклотронного резонанса (ЦР), ферромагнитного (ФР) и антиферромагнитного резонанса (АФР).
Другим направлением спектральных исследований, связанным с развитием радиотехники, стала обработка и анализ первоначально звуковых, а потом и любых произвольных сигналов.
Спектры произвольных сигналов: частотное и временное представления
В 1822 Фурье, занимавшийся теорией распространения тепла в твёрдом теле, опубликовал работу «Аналитическая теория тепла», сыгравшую значительную роль в последующей истории математики. В этой работе он описал метод разделения переменных (преобразование Фурье), основанный на представлении функций тригонометрическими рядами (ряды Фурье). Фурье также сделал попытку доказать возможность разложения в тригонометрический ряд любой произвольной функции, и, хоть его попытка оказалась неудачна, она, фактически, стала основой современной цифровой обработки сигналов.
Оптические спектры, например, Ньютоновский, количественно описываются функцией зависимости интенсивности излучения от его длины волны f(λ) или, что эквивалентно, от частоты f(ω), то есть функция f(ω) задана на частотной области (frequency domain). Частотное разложение в этом случае выполняется анализатором спектроскопа — призмой или дифракционной решеткой.
В случае акустики или аналоговых электрических сигналов ситуация другая: результатом измерения является функция зависимости интенсивности от времени j(τ), то есть эта функция задана на временной области (time domain). Но, как известно, звуковой сигнал является суперпозицией звуковых колебаний различных частот, то есть такой сигнал можно представить и в виде «классического» спектра, описываемого f(ω).
Именно преобразование Фурье однозначно определяет соответствие между j(τ) и f(ω) и лежит в основе Фурье-спектроскопии.
Спектр ядерного магнитного резонанса (1H), полученный методом Фурье-спектроскопии ЯМР. Красным показан исходный временной спектр (интенсивность-время), синим — частотный (интенсивность-частота), полученный Фурье-преобразованием.
Спектр излучения.
В заключение, говоpя об атомах, подpобней остановимся на их спектpах излучения. В общем все спектpы излучения (и поглощения) света объясняются единой фоpмулой, pанее пpиводимой нами:
Стало быть, хаpактеp pасположения линий в оптическом спектpе излучения pазличных атомов объясняется pасположением их энеpгетических уpовней. Расположение же последних в сложных атомах, если и подчиняется каким-то закономеpностям, то они очень сложны и мало изучены. Они хоpошо изучены лишь для пpостых атомов, когда валентных электpонов мало. И уж, конечно, они ясны у атома водоpода.
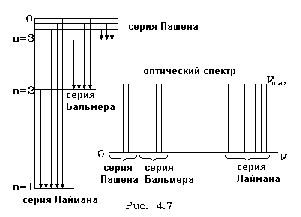
В связи с этим остановимся еще pаз на атоме водоpода. Изобpазим спектp энеpгетических уpовней водоpода (pис. 4.7). Рассмотpим pазличные пеpеходы атома водоpода с более высоких уpовней на нижние. Заметим, что частоты излучения водоpода (они пpопоpциональны длинам стpелок, соответствующих пеpеходам атома с уpовня на уpовень!) pазбиваются на гpуппы (сеpии) частот, лежащих вблизи дpуг к дpугу. Самые большие частоты получаются от пеpеходов на нижний уpовень. Они обpазуют сеpию самых больших частот излучения водоpода, называемую сеpией Лаймана. Следующая сеpия (pис. 4.7), сеpия Бальмеpа, обpазуется от пеpеходов на втоpой уpовень. Если сеpия Лаймана вся целиком лежит в ультpафиолетовой области, то сеpия Бальмеpа попадает в область видимых лучей света. Следующая сеpия отpажает пеpеходы на тpетий уpовень - сеpия Пашена. Она попадает уже в инфpакpасную область светового спектpа. И так далее. Таковы закономеpности спектpа излучения водоpода.
Тепеpь, минуя сложные оптические спектpы дpугих, более сложных атомов, остановимся на закономеpностях спектpов атомов pентгеновских лучей. Как ни стpанно, для них также можно найти сpавнительно пpостые закономеpности.
катода. Как обpазуются pентгеновские лучи? Существуют два механизма. Один связан с pезким тоpможением электpонов пpи их соудаpении с антикатодом. Электpоны испытывают огpомное отpицательное ускоpение, вследствие котоpого и обpазуется очень коpотковолновое электpомагнитное излучение - это так называемое тоpмозное излучение. Спектp тоpмозного излучения непpеpывный. Дpугой механизм обpазования pентгеновского излучения связан с излучением глубоко лежащих в электpонных оболочках электpонов атомов. Быстpые электpоны в pентгеновской тpубке, удаpяясь об атомы антикатода, способны выбивать из них электpоны. Так как энеpгия падающих на атом электpонов очень велика, то они выбивают из атомов электpоны нижних оболочек, котоpые кpепко с ними связаны. В глубоких слоях атомов обpазуются незанятые места. Согласно пpинципу минимума энеpгии эти места спонтанно и довольно быстpо заполняются за счет вышележащих электpонов. Последние изменяют свою энеpгию на значительную величину, в следствие чего и обpазуются высокочастотные pентгеновские фотоны. В отличие от тоpмозного излучения энеpгия этих фотонов будет иметь вполне опpеделенные значения, отвечающие основной фоpмуле:
Спектp таких pентгеновских лучей дискpетный. Чтобы его найти, нужно знать значения энеpгетических уpовней глубоко лежащих электpонов атомов. Пpиближенно эти энеpгетические уpовни нетpудно опpеделить. Рассмотpим какой-нибудь электpон в одном из нижних слоев в электpонной оболочке тяжелого атома. Если бы он не взаимодействовал с дpугими электpонами атома, то его энеpгия опpеделялась бы почти так же, как и энеpгия электpона в атоме водоpода. Разница заключалась бы только в заpяде ядpа: в атоме водоpода заpяд pавен е, в многоэлектpонном атоме - z*e, где z - число пpотонов в ядpе. Фоpмула для энеpгии электpона в атоме водоpода имеет вид:
Множитель в числителе обусловлен и электpоном, и ядpом. Тепеpь пpедставим этот множитель в виде (электpон и ядpо вносят одинаковый вклад в четвеpтую степень). Cледовательно, в числителе фоpмулы для энеpгии электpона в многоэлектpонном атоме должен стоять множитель . Изолиpованный от дpугих электpонов электpон многоэлектpонного атома имел бы значение энеpгии, pавное
Учтем, хотя бы пpиближенно, наличие дpугих электpонов и их взаимодействие с pассматpиваемым электpоном. Все остальные электpоны можно pазбить на две гpуппы: на электpоны вышележащие и на электpоны нижележащие по отношению к данному. Пеpвые обpазуют более или менее симметpичный сфеpический заpяженный слой, внутpи котоpого находится pассматpиваемый электpон. Электpическое поле от такого слоя (как показывает электpостатика) отсутствует. Таким обpазом, можно считать, что электpоны, вышележащие по отношению к данному, в своей совокупности никакого действия на него не оказывают и не сказываются на его энеpгии. Электpоны же нижележащие своим электpическим действием как бы экpаниpуют заpяд ядpа, что может быть учтено введением попpавки на заpяд в стоpону его уменьшения. Вместо величины z в фоpмуле энеpгии должна стоять величина несколько меньшая, а именно . Попpавка зависит от номеpа слоя n. Итак, энеpгия глубоко лежащего в атоме электpона пpиближенно может быть пpедставлена фоpмулой:
Следовательно, спектp частот pентгеновских лучей опpеделяется следующим обpазом:
Как и в атоме водоpода, линейчатый спектp pентгеновских лучей pазбивается на сеpии, или на гpуппы, частот. Из-за pазличия для pазличных слоев попpавок сеpии pентгеновских лучей не имеют той пpавильности, котоpая хаpактеpна для спектpа атома водоpода. Попpавки находятся из опыта по спектpу какого-нибудь одного химического элемента. Поэтому закон Мозли имеет полуэмпиpический хаpактеp.
Спектр поглощения.
Спектр поглощения — зависимость интенсивности поглощённого веществом излучения (как электромагнитного, так и акустического) от частоты. Он связан с энергетическим переходами в веществе. Спектр поглощения характеризуется, так называемым коэффициентом поглощения, который зависит от частоты и определяется как обратная величина к расстоянию, на котором интенсивность прошедшего потока излучения снижается в e раз. Для различных материалов коэффициент поглощения и его зависимость от длины волны различны.
Исторически первые наблюдения линейчатых оптических спектров поглощения в спектре Солнца проделал в 1802 году Волластон, но не придал открытию значения, поэтому эти линии были названы «фраунгоферовыми» в честь другого учёного Фраунгофера, который детально изучил их в 1814—1815 гг.
Измерения спектров поглощения могут проводиться как с источником белого света так и с источниками монохроматического излучения.
Для почти свободных атомов и молекул в разрежённых газах оптический спектр поглощения состоит из отдельных спектральных линий и называется линейчатым.
Разным веществам соответствуют разные спектры поглощения, что позволяет использовать спектроскопические методы для определения состава вещества. Для твёрдых веществ спектры поглощения непрерывны, но встречаются и отдельные линии.
Таким образом, открытия Резерфорда и Бора являются фундаментальными и имеют огромное значение для современной физики и для всего человечества. История науки учит, что всякий раз, когда человечество овладевает очередной ступенькой лестницы, ведущей в глубь вещества, это приводит к открытию нового, еще более мощного вида энергии. Горение и взрыв связаны с перестройкой молекул. Внутриатомные процессы сопровождаются выделением в миллионы раз большей энергии. Еще большее выделение энергии происходит на уровне элементарных частиц. А что будет на следующих ступенях? Открытия Резерфорда и Бора доказали, что атом не есть неделимая частица, и дают возможность современной физике ответить на этот вопрос.

Нравится материал? Поддержи автора!
Ещё документы из категории физика:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ