Новые направления клеточной биологии
 Новые направления клеточной биологии
Новые направления клеточной биологии
Конец ХХ и начало XXI века ознаменовались всплеском интереса к проблемам клеточной биологии. В значительной степени это связано с тем, что достижения в этой области могут оказаться исключительно перспективными для репаративной медицины, т.е. той части медицины, которая занимается пересадкой, восстановлением и воссозданием у человека искусственных органов взамен больных или утраченных.
В современной трансплантологии в большинстве случаев используются человеческие донорские ткани и органы, из-за чего после трансплантации возникает ряд неизбежных осложнений. Конечно, по сравнению с вопросом жизни и смерти они могут показаться незначительными, но все же большинство из них меняет качество жизни пациента, получившего донорский орган. Прежде всего, это необходимость пожизненной иммуносупрессии – подавления иммунных реакций пациента для предотвращения или ослабления тканевой несовместимости (реакции «трансплантат против хозяина» и «хозяин против трансплантата»). Актуальным остается вопрос о возможности передачи пациенту опасных заболеваний вместе с пересаженными органами. Ну и, кроме того, до сих пор сохраняется и, по всей видимости, останется таковым в ближайшие годы острый дефицит донорских органов.
Есть и другая сторона проблемы: существуют состояния, при которых хирургическое вмешательство невозможно или малоэффективно, например когда больной страдает выраженным недостатком функционально активной ткани.
О том, что в ближайшие десятилетия, скорее всего, мы сможем отказаться от трансплантации большей части донорских органов и повысить уровень регенерационных процессов в тканях организма, свидетельствуют обнадеживающие результаты, полученные в таких направлениях медицинской науки о трансплантации органов и тканей, как клеточная трансплантология и тканевая инженерия.
Клеточная трансплантология предполагает введение клеток в больной организм для его лечения. Она может проводиться для замещения нефункционирующей или дефектной ткани или клеточной популяции; стимуляции собственных стволовых клеток организма и усиления репаративной регенерации и даже для адресной доставки лекарственных средств, генетических конструкций и биомолекул.
Тканевая инженерия позволяет решить вопрос о том, где, а главное – как получить достаточное для восстановления органов и тканей количество регенерационного материала для последующей трансплантации, и занимается созданием биоискусственных, или биоартифициальных, органов с последующей пересадкой их в организм.
Клетки, используемые как в клеточной трансплантологии, так и в тканевой инженерии, могут быть собственными (аутогенными), донорскими (аллогенными) или взятыми у животного с предварительно подавленным иммунитетом (ксеногенными). Еще в середине прошлого века морфологи и биологи научились их культивировать вне организма так же, как выращивали бактерии и дрожжи, и длительно поддерживать культуру клеток в живом состоянии. Это позволило вплотную подойти к возникновению и развитию новых отраслей клеточной биологии.
Клеточная трансплантология
Немного истории
Сама идея об использовании вносимых извне клеток для лечения организма возникла более века назад. Уже в 1890 г. Томсон в Нью-Йоркском университете проводит эксперименты по пересадке клеток головного мозга от кошки собаке. В 1884 г. Вильямс подкожно имплантирует больному сахарным диабетом фрагменты ткани поджелудочной железы овцы. Однако первой научно обоснованной клеточной трансплантацией у человека считается проведенное Р.Оттенбергом в 1907 г. переливание АВ0-совместимой крови.
В 1931 г. в Швейцарии Пауль Ниханс спас от смерти больную, которая после ошибочного удаления паращитовидной железы находилась в судорожном состоянии, – он впервые в мире пересадил ей суспензию клеток этой железы от теленка. Интересно, что в это время П.Ниханс разрабатывал метод «замораживания–высушивания» кофе для компании «Nestle» и удачно применил его для заморозки клеток животных, которые затем пересаживал. После такого успеха терапия с помощью замороженных клеток животных и человека, получившая название «метод Ниханса», широко распространилась в Западной Европе. Примерно в это же время во Франции русский врач С.Воронцов занимается процессами омоложения, делая пожилым людям инъекции фетальных (эмбриональных) клеток животных и человека.
Кроме описаний успешных экспериментов, в научных журналах появлялось немало сообщений и о летальных исходах из-за инфекций и иммунных реакций, вследствие чего в конце 1980-х гг. «клеточную терапию» запретили в Германии, а затем и в США.
Современный этап развития клеточной терапии начался с 1968 г., когда Е.Д. Томас (Университет штата Миннесота, США) впервые в мире пересадил больному лейкемией костный мозг, взятый у его родственника. А к настоящему времени этот метод стал практически безальтернативным способом лечения онкологических заболеваний крови.
В конце ХХ в. начали интенсивно развиваться нейротрансплантация, клеточная кардиомиопластика, пересадка островковых клеток поджелудочной железы. В последние годы стали активно изучать стволовые клетки (эмбриональные и взрослого организма) как более перспективный клеточный материал для трансплантации. Основные события в истории развития клеточной трансплантации приведены в таблице 1.
Таблица 1. Основные события в истории развития клеточной трансплантологии (по Берсеневу А.В., 2005)
Год
Событие
1667
Д.-Б. Денис (Франция) сделал первую попытку переливания крови от овцы человеку
1907
Р.Оттенберг впервые в мире провел переливание от человека человеку крови, совместимой по группам АВ0, открытым K.Лендстейнером в 1901 г.
1931
Первая клеточная терапия у человека: П.Ниханс выполнил инъекцию суспензии паращитовидной железы теленка пациентке с судорожным синдромом
1951
Впервые продемонстрирована выживаемость летально облученных животных после трансплантации костного мозга (Лоренц с сотр.)
1958
Ж.Мате провел трансплантацию костного мозга облученным физикам-ядерщикам. Трансплантация оказалась не слишком эффективной, поскольку совместимость определялась только по группам крови и перед пересадкой не было проведено подавление иммунных реакций отторжения
1968
Первая успешная трансплантация HLA-совместимого костного мозга больному лейкемией. Начало современного этапа клеточной терапии
1972
Экспериментальное обоснование эффективности трансплантации островковых клеток поджелудочной железы для лечения сахарного диабета
1981
Выделение эмбриональных стволовых клеток из бластоцисты мыши. Появление термина «эмбриональная стволовая клетка», показаны возможности ее дифференцировки и перспективы использования для клеточной трансплантации
1986
Первое клиническое испытание трансплантации островковых клеток поджелудочной железы больным сахарным диабетом. Основание Общества клеточной трансплантации
1987
Трансплантация ткани надпочечников в головной мозг двум пациентам с болезнью Паркинсона, пересадка эмбриональной нервной ткани человека (Швеция)
«Клеточная терапия» для лечения синдрома Дауна была признана неэффективной (Австралия)
1988
Первая успешная трансплантация клеток пуповинной крови 5-летнему мальчику, больному анемией (Франция)
1992 – 1994
Первые трансплантации гепатоцитов больным с печеночной недостаточностью
1996
Первая клеточная генотерапия в клинике: трансплантация клеток печени, трансфецированных геном рецептора липопротеидов низкой плотности пяти детям с семейной гиперхолестеринемией
Клинические испытания метода трансплантации гемопоэтических клеток при рассеянном склерозе
1997
Первый коммерческий клеточный продукт – аутологичные хондроциты для восстановления суставной поверхности (компания «Genzyme corporation», США)
1998
Успешная трансплантация гепатоцитов ребенку с наследственной формой желтухи
Первая трансплантация нервных клеток в головной мозг пациентке 62 лет, перенесшей инсульт (Медицинский центр Питтсбургского университета)
Первая в мире аутологичная трансплантация пуповинной крови, сохраненной в криобанке
Описание выделения эмбриональных стволовых клеток человека из бластоцисты
2001
Первые опубликованные данные по введению клеток в сердце человека для улучшения его функции после инфаркта
2002
Трансплантация стромальных клеток костного мозга детям с несовершенным остеогенезом
2004
Успешное получение линий эмбриональных стволовых клеток человека методом переноса ядра соматической клетки
2005
Создание индивидуальных линий эмбриональных стволовых клеток методом переноса ядра соматической клетки пациента
Развитие современной клеточной терапии
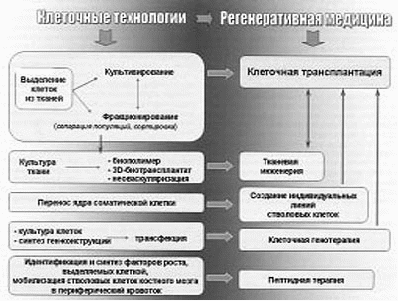
Трансплантация клеток является основным инструментом современной регенеративной медицины и включает следующие последовательные этапы: выделение клеток из ткани, их очистку, фракционирование, культивирование, ген-модификацию и др. и введение в организм донора. Все разнообразие клеточных технологий и направлений, образующих современную регенеративную медицину, представлены на рис. 1.
Рис. 1. Основные направления клеточных технологий
В настоящее время разработаны методы, позволяющие выделять нужную популяцию клеток и хранить ее в криобанках. Это обеспечивает постоянный доступ к трансплантационному материалу и дает возможность помочь большему числу больных.
Для клеточной трансплантации используют как стволовые, так и дифференцированные клетки (гепатоциты, бета-клетки поджелудочной железы, фибробласты, хондроциты). Экспериментально доказано, что даже небольшое количество высокоспециализированных клеток может компенсировать функцию пораженного органа.
Клеточная трансплантология тесно связана с пептидной терапией, которая возникла при изучении механизмов действия пересаженных клеток и регенерации их в организме, и затем выделилась в отдельное направление регенеративной медицины. Среди способов лечения, предлагаемых пептидной терапией, – введение рекомбинантных факторов роста, стимулирующих регенерационные процессы в ткани. Однако после введения рекомбинантных факторов роста или некоторых генных конструкций возможно образование антител и отторжение трансплантата, в то время как использование для пересадки собственных клеток позволяет избежать необходимости подавлять иммунные реакции отторжения, имеющие место при пересадке донорских органов.
Однако, будучи одной из самых активно развивающихся областей медицины, клеточная трансплантология сталкивается в клинике с целым рядом осложнений (табл. 2).
Таблица 2. Осложнения при клеточной трансплантации
Клинические осложнения
Осложнения, описанные в экспериментальных исследованиях и потенциально опасные в клинике
Иммунологические реакции, анафилаксия
Образование опухолей
Клеточная (тканевая) эмболия
Тканевая эмболия и микроинфаркты органов
Связанные с токсичностью криопротектора
Эктопическая оссификация
Фиброз и образование рубца
Клиническое применение
За последние десятилетия было предложено более тысячи экспериментальных разработок, и только единицы стали применяться в клинической практике. Однако их значение огромно. Например, благодаря внедрению трансплантации гемопоэтических клеток некоторые формы детской лейкемии и анемий стали принципиально излечимы, а сотни больных сахарным диабетом смогли обходиться без ежедневных инъекций инсулина после введения островковых клеток поджелудочной железы.
Если раньше трансплантация костного мозга приравнивалась к пересадке органа и эту операцию могли выполнять только в крупных лечебных центрах, теперь как альтернатива широко внедряется трансплантация клеток пуповинной крови и гемопоэтических клеток.
Перспективы развития клеточной трансплантологии
Развитие современной клеточной трансплантологии и ее внедрение в клинику в последние десятилетия позволило продлить жизнь многим тысячам пациентов. В настоящее время наука о трансплантации клеток остается одной из самых интенсивно развивающихся областей биологии и медицины. Уже проходят клинические испытания такие методы, как:
– трансплантация собственных гемопоэтических клеток при рассеянном склерозе, системной красной волчанке, ревматоидном артрите;
– трансплантация гемопоэтических клеток при лечении злокачественных опухолей почек, молочной и поджелудочной желез, головного мозга;
– трансплантация донорских стволовых клеток для профилактики реакции «трансплантат против хозяина» после предшествующей трансплантации гемопоэтических клеток;
– адаптивная иммунотерапия (цитотоксические Т-лимфоциты) в онкологии, клеточные онковакцины;
– трансплантация миобластов скелетной мышечной ткани;
– трансплантация нейрональных клеток пациентам с постинсультным синдромом;
– трансплантация собственных и донорских клеток костного мозга для улучшения регенерации костной ткани после переломов.
Успехи в области изучения стволовых клеток во многом обусловлены повышенным интересом ученых и клиницистов к перспективам их использования в лечении заболеваний, в настоящее время считающихся неизлечимыми. Однако при этом возникает много этических вопросов (таких, например, как использование в качестве трансплантационного материала клеток эмбрионов человека), а также вопросов, связанных с правовой регуляцией клеточных технологий. В развитии клеточных технологий наиболее перспективными считаются следующие направления:
– выделение и трансплантация стволовых клеток, в том числе собственных клеток пациента;
– выявление субпопуляций и клонов стволовых клеток;
– тестирование безопасности трансплантации (инфекционной, онкогенной, мутагенной), составление «клеточного паспорта»;
– выделение индивидуальных линий эмбриональных стволовых клеток методом переноса ядра соматической клетки;
– коррекция генетических дефектов пренатальной трансплантацией клеток или комбинацией методов переноса ядра и генетической терапии.
Тканевая инженерия
Одним из направлений биотехнологии, которое занимается созданием биологических заместителей тканей и органов, является тканевая инженерия (ТИ).
Современная тканевая инженерия начала оформляться в самостоятельную дисциплину после работ Д.Р. Уолтера и Ф.Р. Мейера (1984), которым удалось восстановить поврежденную роговицу глаза с помощью пластического материала, искусственно выращенного из клеток, взятых у пациента. Этот метод получил название кератинопластика. После симпозиума, организованного Национальным научным фондом США (NSF) в 1987 г., тканевая инженерия стала считаться новым научным направлением в медицине. К настоящему времени большинство работ в этой области выполнено на лабораторных животных, но часть технологий уже используется в медицине.
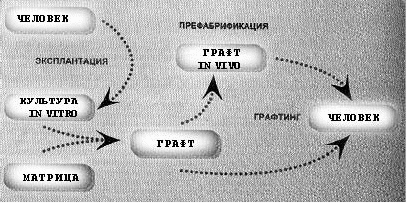
Создания искусственных органов состоит из нескольких этапов (рис. 2).
Рис. 2. Схема процессинга тканеинженерных конструкций
На первом этапе отбирают собственный или донорский клеточный материал (биопсия), выделяют тканеспецифичные клетки и культивируют их. В состав тканеинженерной конструкции, или графта, кроме культуры клеток входит специальный носитель (матрица). Матрицы могут быть выполнены из различных биосовместимых материалов. Клетки полученной культуры наносятся на матрицу, после чего такая трехмерная структура переносится в биореактор1 с питательной средой, где инкубируется в течение определенного времени. Первые биореакторы были созданы для получения искусственной печеночной ткани.
Для каждого типа выращиваемого графта подбирают специальные условия культивирования. Например, для создания искусственных артерий используют проточный биореактор, в котором поддерживается постоянный проток питательной среды с переменным пульсовым давлением, имитирующим пульсацию тока крови.
Иногда при создании графта используют технологию префабрикации: конструкцию вначале помещают не на постоянное место, а в область, хорошо снабжаемую кровью, для дозревания и формирования микроциркуляции внутри графта.
В качестве клеточного материала для создания искусственных органов применяют культуры клеток, входящих в состав регенерируемой ткани или являющихся их предшественниками. Так, например, при получении графта для реконструкции фаланги пальца были использованы приемы, вызывающие направленную дифференцировку стволовых клеток костного мозга в клетки костной ткани.
Если для создания графта применялся собственный клеточный материала пациента, то происходит практически полная интеграция графта со скорейшим восстановлением функции регенерируемого органа. В случае использования графта с донорскими клетками в организме включаются механизмы индукции и стимуляции собственной репаративной активности, и за 1–3 месяца собственные клетки полностью замещают разрушающиеся клетки графта.
Биоматериалы, используемые для получения матриц, должны быть биологически инертными и после графтинга (перенесения в организм) обеспечивать локализацию нанесенного на них клеточного материала в определенном месте. Большинство биоматериалов тканевой инженерии легко разрушаются (резорбируются) в организме и замещаются его собственными тканями. При этом не должны образовываться промежуточные продукты, обладающие токсичностью, изменяющие рН ткани или ухудшающие рост и дифференцировку клеточной культуры. Нерезорбируемые материалы почти не применяются, т.к. они ограничивают регенерационную активность, вызывают избыточное образование соединительной ткани, провоцируют реакцию на инородное тело (инкапсуляцию).
Для создания тканей и органов применяются в основном синтетические материалы, материалы на основе природных полимеров (хитозан, альгинат, коллаген), а также биокомпозитные материалы (табл. 3).
Таблица 3. Классы биоматериалов, применяемых в тканевой инженерии.
Биоматериал
Биосовмести-
мость (включая
цитотоксичность)
Токсичность
Резорбция
Область применения
Синтетические: Полимеры на основе органических кислот
Гидроксиапатит
+
+
++
+
Полная до СО2 и Н2О
Нерезорбируемый
Хирургия, в тканевой инженерии как матрица-носитель практически для всех культур клеток. Костная ткань
Природные:
Альгинат
++
+
Полная
Перевязочные материалы, в тканевой инженерии в виде гидрогелей (хондробласты, нервные клетки)
Хитозан
++
+
Полная
Перевязочные материалы, в ТИ в виде пленок, губок; в сочетании с коллагеном (реконструкция костной, мышечной, хрящевой тканей, сухожилий)
Коллаген
+++
–/+
Замещение собственными белками, ферментативный лизис
Перевязочные материалы, в ТИ (губки, трехмерные модели, пленки) как матрица-носитель практически для всех культур клеток.
Внеклеточный матрикс (естественные биологические мембраны)
++++
(за счет включенных в структуры биологически активных веществ и факторов роста)
–/+
Ремоделирование с заменой собственными белками
Шовный материал, в ТИ (трехмерные модели, пленки) как матрица-носитель для практически всех культур клеток
Одними из первых в тканевой инженерии стали применяться биодеградируемые синтетические биоматериалы на основе полимеров органических кислот, например молочной (PLA, полилактат) и гликолевой (PGA, полигликолид). При этом в состав полимера может входить как один тип кислотного остатка, так и их сочетания в различных пропорциях. Матрицы на основе органических кислот легли в основу создания таких органов и тканей, как кожа, кость, хрящ, сухожилие, мышцы (поперечно-полосатая, гладкая и сердечная), тонкая кишка и др. Однако у этих материалов имеются недостатки: изменение рН окружающих тканей при расщеплении в организме и недостаточная механическая прочность, что не позволяет использовать их как универсальный материал для матриц и подложек.
Особое место среди материалов для биоматриц-носителей занимают коллаген, хитозан и альгинат.
Коллаген практически не имеет антигенных свойств. Использованный в качестве матрицы, он разрушается за счет ферментативного гидролиза и структурно замещается собственными белками, синтезируемыми фибробластами. Из коллагена могут быть изготовлены матрицы с заданными свойствами для реконструкции практически любых органов и тканей. Являясь естественным тканевым (межклеточным) белком, он оптимально подходит в качестве носителя культуры клеток, обеспечивая рост и развитие ткани.
Альгинат – полисахарид из морских водорослей, может быть использован в качестве матрицы-носителя, однако не обладает достаточной биологической совместимостью и оптимальными механическими свойствами. Обычно он используется в виде гидрогелей для восстановления хрящевой и нервной ткани.
Хитозан – азотсодержащий полисахарид, который является основной составляющей наружного покрова насекомых, ракообразных и паукообразных. Этот биоматериал получают из хитиновых панцирей ракообразных и моллюсков. В настоящее время заслуживает внимания комбинированный по составу препарат – коллагеново-хитозановый комплекс. В ходе лабораторных и клинических исследований была показана его инертность и способность сохранять жизнеспособность клеточной культуры как in vitro, так и in vivo. Этот комплекс разрешен Минздравом РФ в качестве перевязочного, ранозаживляющего средства и уже используется в клинической практике в хирургии и стоматологии.
Современные возможности тканевой инженерии
Большинство исследований в области тканевой инженерии направлены на получение того или иного эквивалента тканей. Самое изученное направление тканевой инженерии – реконструкция соединительной ткани, особенно костной. В первой работе в этой области была описана реконструкция костно-хрящевого фрагмента бедренной кости кролика. Основной проблемой, с которой столкнулись исследователи, был выбор биоматериала и взаимодействие костной и хрящевой тканей в графте. Эквиваленты костной ткани получают путем направленной дифференцировки стволовых клеток костного мозга, пуповинной крови или жировой ткани. Затем полученные остеобласты наносят на различные материалы, поддерживающие их деление, – донорскую кость, PGA, коллагеновые матрицы, пористый гидроксиапатит и др. Графт сразу помещают в место дефекта или предварительно выдерживают в мягких тканях. Основной проблемой таких конструкций исследователи считают несоответствие скорости образования кровеносных сосудов в новой ткани и сроков жизни клеток в глубине графта. Для решения этой проблемы графт размещают около крупных сосудов.
Гистогенез мышечных тканей в большой степени зависит от развития нервно-мышечных взаимодействий. Отсутствие адекватной иннервации конструкций мышечных тканей пока не позволяет создать функционирующие тканевые эквиваленты поперечно-полосатой мышечной ткани. Гладкая мускулатура менее чувствительна к денервации, т.к. имеет некоторую способность к автоматизму. Гладкомышечные тканевые конструкции используют при создании таких органов, как мочеточник, мочевой пузырь, кишечная трубка. В последнее время все большее внимание уделяется попыткам реконструкции сердечной мышцы с помощью графтов, содержащих сердечные миоциты, полученные путем направленной дифференцировки малодифференцированных клеток костного мозга.
Одним из самых важных направлений в тканевой инженерии является изготовление эквивалентов кожи. Живые эквиваленты кожи, содержащие донорские или собственные кожные клетки, в настоящее время широко применяются в США, России, Италии. Эти конструкции позволяют улучшить заживление обширных ожоговых поверхностей.
Основными точками приложения тканевой инженерии в кардиологии можно считать создание искусственных клапанов сердца, реконструкцию крупных сосудов и капиллярных сетей. Имплантаты из синтетических материалов недолговечны и часто приводят к образованию тромбов. При использовании трубчатых (сосудистых) графтов на биодеградируемых матрицах получены положительные результаты в экспериментах на животных, однако нерешенной проблемой остается контролируемая прочность и сила сопротивления стенок графта пульсовому давлению крови.
Создание искусственных капиллярных сетей актуально при лечении патологий микроциркуляции крови при таких заболеваниях, как облитерирующий эндартериит, сахарный диабет и др. Положительные результаты здесь получены при использовании биодеградируемых графтов, выполненных в виде сосудистой сети.
Восстановление органов дыхания, таких как гортань, трахея и бронхи, также возможно с помощью тканевых конструкций из биодеградируемых или композитных материалов с нанесенными на них эпителиальными клетками и хондробластами.
Заболевания и пороки развития тонкого кишечника, сопровождающиеся его значительным укорочением, приводят к тому, что пациенты вынуждены пожизненно получать специальные питательные смеси и парентеральные растворы. В таких случаях удлинение функциональной части тонкого кишечника – единственная возможность облегчить их состояние. Алгоритм изготовления графта сводится к следующему: на биодеградируемую мембрану наносятся клетки эпителиального и мезенхимального происхождения и помещаются в сальник или брыжейку кишки для созревания. Спустя определенное время собственную кишку соединяют с графтом. Эксперименты на животных показали улучшение всасывающей активности, однако из-за отсутствия иннервации искусственная кишка не обладает способностью к перистальтике и регуляции секреторной активности.
Основная сложность в тканевой инженерии печени заключается в формировании трехмерной структуры ткани. Оптимальной биоматрицей для клеточной культуры является внеклеточный матрикс печени. Исследователи полагают, что к успеху приведет применение пористых биополимеров с заданными свойствами. Предпринимаются попытки применения постоянного магнитного поля для трехмерной организации клеточной культуры. Остаются нерешенными проблемы кровоснабжения больших по размерам графтов и отвода желчи, поскольку в графтах отсутствуют желчные протоки. Однако существующие методики уже позволяют компенсировать некоторых генетические аномалии печеночных ферментных систем, а также ослабить проявления гемофилии у лабораторных животных.
Конструирование желез внутренней секреции находится на стадии экспериментальной проверки методик на лабораторных животных. Наибольшие успехи достигнуты в тканевой инженерии слюнных желез, получены конструкции, содержащие клетки поджелудочной железы.
Пороки развития мочевыделительной системы составляют до 25% всех пороков развития. Тканевая инженерия в этом направлении медицины очень востребована. Создание эквивалентов почечной ткани – достаточно сложная задача, и решить эту проблему пытаются с помощью технологий прямого органогенеза, используя эмбриональные закладки почечной ткани. На лабораторных животных была показана возможность восстановления различных органов и тканей мочевыделительной системы.
Одной из важнейших задач является восстановление органов и тканей нервной системы. Тканеинженерные конструкции могут быть использованы для восстановления как центральной, так и периферической нервной системы. В качестве клеточного материала для репарации спинного мозга могут быть использованы клетки обонятельных луковиц и трехмерные биодеградируемые гели. Для периферической нервной системы используют биодеградируемые трубчатые графты, внутри которых рост аксона осуществляется по шванновским клеткам.
Создание искусственных органов позволит отказаться от трансплантации большей части донорских органов, улучшит качество жизни и выживаемость пациентов. В ближайшее время эти технологии будут внедряться во все области медицины.

Нравится материал? Поддержи автора!
Ещё документы из категории география:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ