Влияние повышенного и сниженного уровня моноаминов на функциональную организацию колонок C1 коры мозга крысы
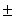
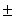
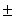
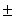
 Влияние повышенного и сниженного уровня моноаминов на функциональную организацию колонок C1 коры мозга крысы
Влияние повышенного и сниженного уровня моноаминов на функциональную организацию колонок C1 коры мозга крысы
В.Н. Ласков
НИИ нейрокибернетики им. А.Б.Когана, РГУ, Россия
Повышение внутримозгового содержания нейромодулятора серотонина после электрической стимуляции ядер шва, а также снижение содержания биогенных моноаминов после внутрибрюшинного введения резерпина вызывали разнонаправленную пластификацию синаптических связей во входных, выходных и ассоциативных нейронных ансамблях бочонковой колонки С1 коры мозга крысы и модулировали уровень ее возбуждения за счет изменения количества фоновоактивных нейронов, а также частоты и структуры их импульсных разрядов. Показана зависимость характера сдвигов частоты, структуры импульсных разрядов, плотности кросскорреляционной взаимосвязи соседних нейронов от предыдущего уровня возбуждения колонки. Новизна работы состоит в модульном аспекте рассмотрения моноаминергических механизмов синаптической пластичности корковых нейронов в контексте действующего в пределах фокальной бочонковой колонки гипотетического авторитмичного сканирующего механизма формирования временной связи.
Механизмы регуляции уровня возбуждения корковых нейронов и модуляции эффективности их связей опосредованы наряду с холинергическими нейромедиаторными системами также и влияниями со стороны нейромодуляторных структур ствола мозга, синтезирующих моноамины: серотонин (СТ), норадреналин и дофамин /2,4,5,6,12,23/. СТ, который транспортируется к коре мозга из ядер шва, рассматривается в качестве нейромодулятора, обеспечивающего механизмы положительного подкрепления посредством стабильного повышения при обучении уровня возбуждения и кросскорреляционного взаимодействия корковых нейронов /4,16,18/. Методами электронной микроскопии показано, что терминали проецирующихся к неокортексу восходящих СТ-ергических пучков не образуют типичных синаптических контактов на мембране нейронов. Они в виде варикозных расширений на большом протяжении выстилают двойным слоем плотно заполненное перикарионами, дендритами и глией межнейронное пространство, и обеспечивают непосредственный контакт транспортируемого моноамина с синапсами специфических и неспецифических афферентов /14,15/. Возбуждение СТ-ядер вызывает быстрое насыщение пресинапсов, которые не имеют собственной постсинаптической комплиментарной части.
Синапсы такой химической природы и конструкции больше не встречаются ни среди корково-корковых, ни среди окончаний иных проекционных систем мозга. Это свидетельствует об их особой роли в обеспечении мозговых функций. Высказано предположение, что моноаминергические системы специфично и адресно модулируют эффективность синапсов первичных специфических, неспецифических и ассоциативных афферентов. Тем самым они обеспечивают необходимый уровень пластичности межнейронных взаимодействий при формировании временных связей и памятных следов /4,16,18/. Модулирующие влияния восходящей моноаминергической системы опосредованы через регуляцию уровня возбуждения корковых нейронов за счет активации вторичных посредников - циклических нуклеотидов /17/, что обеспечивает стабилизацию пластифицированных в ходе обучения межнейронных связей.
Плодотворной для развития идеи о модулировании синаптической эффективности со стороны моноаминергических структур оказались математическая и нейрофизиологическая модели Жадина М.Н. /4,5/, описывающие динамику активности корковых нейронов при длительном воздействии положительного и отрицательного подкрепления на нейроны коры мозга. В основу модели положена гипотеза /4,16,18/, согласно которой СТ- и норадреналинергическая системы являются конечными звеньями, соответственно, положительного и отрицательного подкрепления, вызывающего устойчивые изменения эффективности корково-корковых синапсов. В модели при длительном действии моноамина, обеспечивающего положительное подкрепление, любые превышающие средний уровень изменения уровня активности нейронов доводятся до своих крайних проявлений - предельно высокому и предельно низкому. Баланс возбуждения и торможения при такого рода положительном подкреплении характеризуется крайней неустойчивостью: под влиянием каждой достаточно мощной афферентной посылки в системе происходят быстрые переходы от одного уровня возбуждения на другой. В присутствии моноамина, обеспечивающего отрицательное подкрепление, все происходит с точностью до наоборот: и сильно, и слабо возбуждающиеся нейроны в соответствии с предложенной схемой переходят на устойчивый к разного рода афферентным посылкам промежуточный уровень возбуждения.
В соответствии с нейрофизиологическими данными поведение корковых нейронов в присутствии СТ и норадреналина согласуется с предложенной математической моделью /2,3,5,7/. В работе /12/ длительная аппликация СТ и норадреналина вызывала более сложные по характеру изменения структуры фоновой импульсной активности нейронов зрительной и сенсомоторной областей коры мозга у кроликов, чем простое возбуждение и торможение в ответ на аппликацию нейромедиаторов ацетилхолина и ГАМК. Были также продемонстрированы различные типы реакций корковых нейронов на один и тот же нейромодуляторный моноаминергический стимул: конечный результат при этом обнаружил зависимость, как и предсказано моделью, от исходного уровня возбуждения коркового нейрона. Тем самым подтверждены представления о том, что нейромодуляторы в отличие от нейромедиаторов, действие которых локально и кратковременно, не вызывают простого возбудительного или тормозного эффектов, а влияют на текущую деятельность нейрона, изменяя ее в течение длительного времени в том или ином направлении /1,20,21/.
Краткий обзор наиболее значимых работ, посвященных исследованию механизмов модулирования синаптической эффективности в реальных нейронных сетях и их моделях, свидетельствует о важной роли моноаминергических систем мозга в нейрохимическом обеспечении его ассоциативных функций. Вместе с тем многие аспекты роли и механизмов участия моноаминергических систем в условнорефлекторной деятельности, а также в процессах самоорганизации элементарных нейронных ансамблей /8/ остаются не ясными, либо требуют уточнения. В данной работе исследованы нейронные корреляты временной связи при пониженном после внутрибрюшинного введения резерпина и повышенном после электрической стимуляции ядер шва уровне возбуждения фокальной колонки представительства условного стимула (УС) в С1 коры мозга крыс.
Методика
Опыты выполнены на белых беспородных крысах обоего пола весом 120-200 г, оперированных под эфирным наркозом, обездвиженных тубокурарином (1,5 мг/кг в/м) и переведенных на искусственное дыхание. Трахеотомия не проводилась: воздух в легкие нагнетался через ноздри. Использована местная анестезия (0,5% р-р новокаина) операционного поля. Голова крысы фиксировалась с помощью игольчатых головодержателей. Череп трепанировался над постеромедиальной субзоной бочонков (ПМСБ) корковой области С1 по координатам: 2-3 мм каудальнее брегмы и 5-6 мм латеральнее сагиттального шва. Фоновую импульсную активность нейронов и фокальные ВП регистрировали одиночными стеклянными микроэлектродами (электролит - 2,5 М р-р NaCl) с сопротивлением не ниже 5 мОм, а в ряде случаев склеенными по три-пять вольфрамовыми в стеклянной изоляции микроэлектродами (0,5-1 мОм, расстояние между кончиками - 70-100 мкм), которые погружались в кору перпендикулярно ее поверхности с помощью наклонного манипулятора, оснащенного шаговым двигателем. Регистрацию осуществляли при полосе 2-2000 Гц на входных фильтрах электроэнцефалографа 4ЭЭГ-03. Импульсная активность после предварительного формирования на 4-канальном амплитудном анализаторе АА-4 записывалась на 14-канальный магнитограф EАМ-500 (ЧССР, г. Прага) и вводилась в персональный компьютер IBM-PC/AT-386 для текущей и последующей обработки.
В качестве адекватного стимула использовано сгибание центральной в РП вибриссы с удержанием ее в отклоненном положении в течение 0,1-1,0 с. Чтобы избежать неконтролируемых смещений, дальние от носа вибриссы, достигающие в длину 30-50 мм, билатерально укорачивались до 5-10 мм. Механический датчик представлял собой щуп, приклеенный на свободном конце пьезокерамической пластины, изготовленной в ОКБ "Пьезоприбор" РГУ, на которую подавалось напряжение от 60 до 1 В с выхода ЭСЛ-2, задающего амплитуду отклонения на конце щупа от 90 до 1,5 мкм. Метрологическая проверка показала линейную зависимость напряжения и амплитуды сгибания пьезокерамической пластины в используемом диапазоне, поэтому в опыте амплитуда отклонения щупа оценивалась по напряжению на выходе ЭСЛ-2.
Контролем попадания электродов в ПМСБ служили фокальные ВП, возникающие в ответ на легкое постукивание по контралатеральным вибриссам вручную, а затем с помощью тактильного датчика, запускаемого от ЭСЛ-2. Идентификация бочонковых колонок под каждым из микроэлектродов производилась следующим образом. Сравнивали наблюдаемые на мониторе фокальные ВП по их латентным периодам (ЛП), крутизне и амплитуде в ответ на последовательное сгибание вибрисс и устанавливали соответствие между корковым бочонком и центральной в РП вибриссой. Для уточнения идентификации центра РП производилась стимуляция ближайших к центру вибрисс со ступенчатым уменьшением амплитуды их отклонения. Серия стимулов определенной амплитуды предъявлялась ритмично с частотой 0,5 Гц. По 10-20 реализациям строились точечные или столбиковые перистимульные гистограммы (ПСГ) с бином 1-2 мс за период 100-500 мс. Сужение РП до одной вибриссы в случае ее центрального положения имело место при более низких амплитудах ее отклонения - пороговый тест /9/.
Определяли удельное количество фоновоактивных нейронов, по которому сравнивали исходный уровень возбуждения бочонковой колонки с уровнем, устанавливающимся после стимуляции ядер шва и в последействии резерпина. Нейроны с фоновой активностью исследованы в параллельных проходках, которые осуществлялись через всю толщину коры при межэлектродном расстоянии в склейке - 100 мкм. Треки располагались во фронтальных (AP - 2,0 и AP - 3,0) и сагиттальных (L - 5,0 и L - 6,0) плоскостях. На каждом из треков контролировали 60 точек с интервалом по глубине 30 мкм. Через 2-3 ч после введения резерпина (в/б 2,5 мг/кг), когда в соответствии с многочисленными литературными источниками наблюдается наиболее значительное снижение в мозге уровня СТ, и через 10 и 20 мин после электрической стимуляции ядер шва (частота 1 Гц, длительность серии стимулов 20 с, импульсы длительностью 0,1-1,0 мс, напряжение на выходе стимулятора 15 В) в тех же треках проводилась повторная регистрация фоновых импульсных разрядов. В ряде случаев была уверенность, что тот же нейрон наблюдали до и после введения препарата. В каждом опыте исследовалась также непосредственная динамика импульсной активности наиболее многочисленной группы нейронов, регистрируемых с помощью микроэлектродной склейки одновременно.
Координаты ядер шва определяли по атласу /19/. Стимулирующие электроды погружались с помощью микроманипулятора ММ-1 и под контролем бинокулярного микроскопа МБС-2 по координатам: АР - 6,6; L - 0,4; H - 4,5, с контролем погружения по индикатору глубины ГИ-100. Твердая мозговая оболочка предварительно удалялась. Стимулирующие монополярные полумикроэлектроды представляли собой вольфрамовые в стеклянной изоляции электролитически заточенные проволоки диаметром 50 мкм с сопротивлением 0,5 мОм. Верификацию треков стимулирующих электродов в ядрах шва осуществляли морфологически на парафиновых и замороженных с помощью сухого льда срезах. Выработка условного мигательного рефлекса (УР) осуществлялась по схеме классического обусловливания. Длительность УС и безусловного стимула (БС) равнялась 1 с, интервал между ними - 2 с, а сочетания УС и БС подавались с частотой 0,1 Гц. По каждому десятку стимулов строились ПСГ с квантом 2 мс за эпоху анализа 100 мс или 200 мс в фоне и 900 мс или 800 мс, соответственно, после предъявления УС. Реакции в ответ на обдувание роговицы при выработке мигательного УР, как правило, не регистрировались. Уровень выработки УР ограничивали предъявлением 50-60 подкреплений.
Частоту фоновой импульсации и характер взаимосвязи соседних корковых нейронов методом перекрестных интервальных гистограмм (ПИГ) исследовали до и в разные сроки после электрической стимуляции ядер шва. Частота импульсации нейронов измерялась с помощью частотомера Ч3-36 за 5-секундные интервалы времени.
Запуск стимуляции, амплитудная дискриминация, формирование и запись импульсной активности, а также оцифровка, построение и распечатка ПСГ, гистограмм межимпульсных интервалов (ГМИ) и ПИГ осуществлялись программными средствами. Статистическая обработка ПСГ состояла в вычислении с помощью программы "Statgraf" средней частоты импульсации, стандартной ошибки средней и достоверности различия средних по критерию Стьюдента: между фоновой и вызванной активностью - для установления эффективности каждого из стимулов; между реакциями по ходу выработки мигательного УР - для выявления условнорефлекторной пластичности. Пики на гистограммах считали значимыми, если они удовлетворяли критерию 2-сигма по отношению к среднему значению количества спайков в бине. Достоверность различий между выборочными распределениями оценивали по критерию Фишера.
Результаты исследования
Влияние электрической стимуляции ядер шва.
С помощью метода пошагового определения плотности активных в фоне нейронов в отвесных проходках через кору мозга исследованы в трех острых опытах 15 микроэлектродных треков, которые проходили, как показала пороговая идентификация, в пределах бочонковых колонок представительства вибрисс рядов В, С и D.
В первом опыте в контроле наблюдалось 39, во втором опыте - 37 и в третьем - 35 фоновых нейронов, что составило в контроле в среднем на один трек около 7 нейронов. Более плотно активные в фоне нейроны располагались на глубине 600-1500 мкм - 78% от общего количества зарегистрированных в контроле нейронов находились на этом уровне. Суммарно по трем опытам в контроле было зарегистрировано на уровнях: 2-3 слоев - 13 нейронов, 4 слоя -23 нейрона, 5 слоя - 52 нейрона, 6 слоя - 23 нейрона. В исходном состоянии на треках встречалось от 2 до 13 фоновоактивных нейронов. Как правило, треки с высокой плотностью нейронов были разделены одним-двумя относительно "пустыми" треками, принадлежавшими одноименной бочонковой колонке. В пределах одноименной колонки за одну проходку контролировали импульсную активность на 2-3 соседних треках. В девяти треках с высокой плотностью элементов (от 7 до 13) зарегистрировано 90 фоновых нейронов (82%), а в шести "пустых" (от 2 до 5 нейронов) - 21 нейрон (18%).
Электрическая стимуляция ядер шва приводила к возникновению у части молчащих нейронов спонтанных разрядов в течение 1-2 мин, а в ряде случаев до 20 мин и более. После электрической стимуляции на тех же треках в первом опыте зарегистрирована активность 43, во втором опыте - 40 и в третьем - 38 нейронов, что составило в среднем около 8 нейронов на трек. Из них зарегистрировано на уровнях: 2-3 слоев - 25 нейронов, 4 слоя - 24 нейрона, 5 слоя - 49 нейронов, 6 слоя - 23 нейрона. В 9 треках с высокой плотностью элементов при этом зарегистрировано - 87 нейронов (72%), а в "пустых" треках - 34 нейрона (28%). Из данных послойного и потрекового анализа следует, что электрическая стимуляция ядер шва наиболее значительно увеличивает количество фоновоактивных нейронов в бочонковых колонках на уровне 2-3 слоев - в 2 раза, и в "пустых" треках - в 1,6 раза.
Анализ динамики частоты фоновой импульсной активности корковых нейронов в контроле и после активации шва, результаты которого представлены в таблице, выявил послойную неравномерность в росте уровня возбуждения колонок. В наибольшей степени частота фоновой импульсации увеличивалась у выходных нейронов 5 - 6 слоев (P < 0,001), тогда как у ассоциативных нейронов 2-3 слоев повышение частоты было достоверным при более низком уровне значимости (P < 0,05). У нейронов афферентного уровня снижение средней частоты фонового разряда было недостоверным.
Таблица
Изменение частоты фоновой импульсной активности нейронов разных уровней бочонковой колонки С1 коры мозга крыс при электрической стимуляции ядер шва и под влиянием резерпина.
Уровни
Количество
нейронов
Частота
(имп/с)
Количество нейронов
Частота
(имп/с)
колонки
До стимуляции (контроль)
После стимуляции
(опыт)
2-3 слои
16
13,70,9
16
17,6 0,5 *
4 слой
25
9,70,7
20
9,1 0,6
5-6 слои
38
12,4 0,8
25
20,9 0,7 **
N = 79
N = 61
До введения резерпина (контроль)
После введения резерпина
(опыт)
2-4 слои
33
11,4 1,2
28
8,4 0,7 *
5-6 слои
48
9,5 0,9
36
7,4 0,5 *
Суммарно
81
9,4 0,8
64
7,2 0,4 *
Примечание: * - различия опыт-контроль достоверны при P< 0,05,
** - различия опыт-контроль достоверны при P < 0,001.
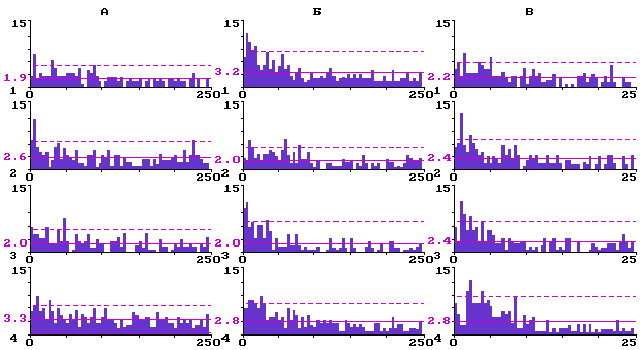
О перестройках структуры фонового импульсного разряда корковых нейронов при активации ядер шва свидетельствуют данные анализа ГМИ. На рис. 1 представлены в качестве типичных примеров ГМИ импульсации трех нейронов, соответственно, с верхнего - ассоциативного, среднего - афферентного и нижнего - эфферентного уровней бочонковой колонки С3 в контроле, а также через одну, две и три минуты после электрической стимуляции ядер шва.
У ассоциативных нейронов на уровне 2-3 слоев (рис.1,А) перестройки структуры фоновых импульсных разрядов были, как правило, динамичными, протекали волнообразно с возвратом к контрольному аритмичному паттерну. Так, у нейронов 2-3 слоев (N=10) средний межимпульсный интервал был равен в контроле 15,9 ± 3,0 мс, через минуту после стимуляции ядер шва возрастал до 21,7± 4,1 мс (P<0,05), через две минуты возвращался к контрольному уровню - 16,4± 2,7 мс, а через три минуты снова достоверно (P<0,05) увеличивался до 27,6± 3,2 мс.
Рис.1. Перестройка структуры фоновой импульсной активности нейронов разных уровней бочонковой колонки С1 коры мозга крыс при электрической стимуляции ядер шва.
Гистограммы межимпульсных интервалов: А - для нейрона ассоциативных слоев; Б - для нейрона афферентного слоя; В - для нейрона эфферентного слоя; 1 - до стимуляции ядер шва; 2 - через одну минуту; 3 - через две минуты; 4 - через три минуты после стимуляции. По вертикали - количество интервалов; по горизонтали - их длительность в мс. Сплошная горизонтальная линия - среднее количество интервалов; штриховая - уровень 2s .
У входных фоновоактивных нейронов 4 слоя (рис.1,Б) исходные пачечные и группированные импульсные разряды становились единично-аритмичными. Средний межимпульсный интервал у входных нейронов (N=10) в контроле был равен 26,7± 5.2 мс. Через одну минуту после стимуляции ядер шва он достоверно (Р<0,05) сокращался до 16,4± 3,4 мс, через две минуты удерживался на том же уровне - 16,4± 5,0 мс, а через три минуты был равен в среднем 23,0± 4,1 мс, что по t- критерию недостоверно (Р<0,05) отличается от контроля. Оценка достоверности различия выборочных распределений межимпульсных интервалов для входных нейронов по критерию Фишера показала достоверную (P<0,05) трансформацию структуры их фонового импульсного разряда через одну минуту после стимуляции ядер шва (F=2,36 при Fst=1,39), возврат к контрольному паттерну через две минуты (F=1,07 при Fst=1,39) и повторную рандомизацию разрядов к третьей минуте (F=1,58 при Fst=1,39).
У выходных нейронов слоя 5 (рис.1,В) наблюдалась прямо противоположная тенденция: их исходный единичный аритмичный разряд после электрической стимуляции ядер шва перемежался вначале пачками (через одну и две минуты), а к третьей минуте - группами фоновых импульсов. Средний межимпульсный интервал у выходных нейронов (N=12) в контроле был равен 18,3± 3,6 мс, через одну минуту после стимуляции ядер шва - 20,2± 4,8 мс, через две минуты - 19,7± 4,7 мс, через три минуты - 23,5± 6,0 мс, что по t- критерию во всех трех случаях недостоверно отличается от контроля (P<0,05). Оценка достоверности различия выборочных распределений межимпульсных интервалов для выходных нейронов по критерию Фишера показала однонаправленную, в течение трех наблюдаемых минут, достоверную (P<0,05) трансформацию структуры единичного аритмичного их разряда в пачечный и групповой (F=1,70; 1,65; 2,66, соответственно, после первой, второй и третьей минуты при Fst=1,39). Такого рода перестройки структуры фоновых разрядов в исследованных выборках входных и выходных нейронов были стабильными в течение десятков минут.
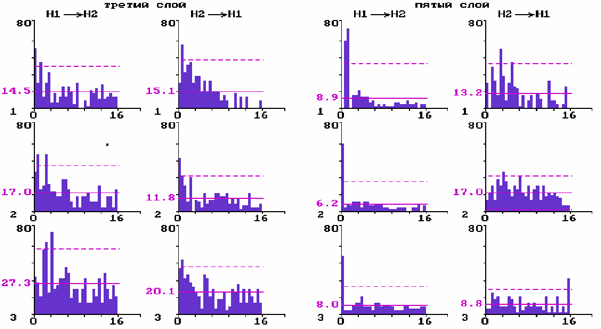
В выборке попарно зарегистрированных нейронов (N=28) оценивались влияния активации ядер шва на характер межнейронных взаимодействий с использованием метода построения ПИГ. Значимые пики на ПИГ рассматривали как проявление статистически выявленной функциональной связи между нейронами, осуществляющейся с определенной задержкой и в определенном направлении.
Рис.2. Перестройки межнейронных взаимодействий нейронов на разных уровнях бочонковой колонки С1 коры мозга крыс при электрической стимуляции ядер шва.
Постимпульсные гистограммы связи для прямых и обратных влияний парных нейронов слоя 3 и парных нейронов слоя 5:
1 - до стимуляции ядер шва; 2 - через десять минут; 3 - через двадцать минут после стимуляции. По вертикали - количество импульсов; по горизонтали - время в мс. Сплошная горизонтальная линия - среднее количество импульсов; штриховая - уровень 2s .
Для верхних слоев показано (рис. 2) появление на ПИГ после электрической стимуляции дополнительных длиннолатентных значимых пиков и уменьшение пиков с нулевой латентностью. В нижних слоях при этом наблюдалось ослабление как прямых, так и обратных межнейронных моно- и полисинаптических влияний и появление односторонних влияний с нулевой и высокой латентностью.
Сниженное под влиянием резерпина внутримозговое содержание СТ.
Анализ средней текущей частоты фоновой импульсной активности нейронов бочонковой колонки С1 до и после введения резерпина, результаты которого представлены в таблице, показал, что на пике действия резерпина суммарно по колонке, и на каждом из ее уровней имеет место достоверное (Р<0,05) снижение частоты импульсации. При этом характерный для контроля более высокий частотный уровень нейронов поверхностных слоев по сравнению с глубокими слоями на фоне резерпина выравнивался. Следует отметить, что около 18 % нейронов, исходная частота импульсации которых не превышала средних значений по выборке (Р<0,05), были резистентными к резерпину. У 10 % нейронов, которые зарегистрированы преимущественно в эфферентных слоях, частота импульсации в последействии резерпина достоверно (Р<0,05) повышалась. Их исходная частота превышала среднее значение по всей выборке (Р<0,01).
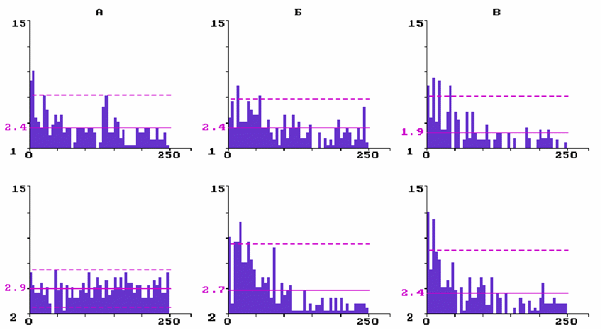
На рис. 3 представлены ГМИ фоновой импульсной активности трех нейронов, принадлежащих бочонковой колонке С3. Нейрон на (А) имел до введения резерпина три отчетливых максимума в ГМИ, что свидетельствует о наличии в структуре его исходного разряда пачек и групп, перемежающих аритмично следующие единичные разряды. Через 2,5 ч после введения резерпина частота импульсации
данного нейрона уменьшилась, а структура рандомизировалась - исчезли пачечные и групповые разряды. Средний межимпульсный интервал у снижающих частоту нейронов (N=10) в контроле был равен 19,8± 4,4 мс, а через 2-3 часа после введения резерпина - 24,5± 2,6 мс, что по t- критерию недостоверно отличается от контроля (P<0,05).
У нейрона на (Б) через 2 ч после введения резерпина ГМИ стала островершинной с двумя достоверными максимумами в диапазоне самых малых интервалов, что отражает появление в структуре непрерывного аритмичного разряда коротких пачек и разной длительности групп импульсов. Такая динамика структуры фонового разряда была характерна для нейронов, которые увеличивали под влиянием резерпина частоту импульсной активности. Средний межимпульсный интервал у повышающих частоту нейронов (N=10) в контроле был равен 22,4± 6,6 мс, а через 2-3 часа после введения резерпина - 19,6± 3,9 мс, что по t- критерию недостоверно отличается от контроля (P<0,05).
Рис.3. Перестройка структуры фоновой импульсной активности трех нейронов разных уровней бочонковой колонки С1 коры мозга крыс при действии резерпина
Гистограммы межимпульсных интервалов: А - при уменьшении частоты импульсации; Б - при увеличении частоты; В - при стабильной частоте; 1 - в контроле; 2 - в последействии резерпина. По вертикали - количество интервалов; по горизонтали - их длительность в мс. Сплошная горизонтальная линия - среднее количество интервалов; штриховая - уровень 2s .
На (В) представлен нейрон, у которого в течение 3 ч после введения резерпина частота фонового разряда существенно не менялись, а его структура изменялась недостаточно отчетливо. Резистентные к резерпину нейроны преимущественно залегали на уровне 4-го слоя колонки, т.е. они в большинстве своем были входными для первичной специфической афферентации. Средний межимпульсный интервал у резистентных к резерпину нейронов (N=10) в контроле был равен 15,4± 5,0 мс, а через 2-3 часа после введения резерпина - 20,2± 6,0 мс, что по t- критерию недостоверно отличается от контроля (P<0,05).
Оценка достоверности различия выборочных распределений межимпульсных интервалов у представленных трех типов нейронов по критерию Фишера показала достоверную (P<0,05) трансформацию под влиянием резерпина структуры их фонового импульсного разряда (F=1,76; 2,88; 1,46, соответственно, для А, Б и В при Fst=1,45).
С помощью метода пошагового определения плотности активных в фоне нейронов в отвесных проходках через кору мозга исследованы в трех острых опытах 9 микроэлектродных треков, которые проходили, как показала пороговая идентификация, в пределах бочонковых колонок представительства средних вибрисс рядов В и С. В первом опыте в контроле наблюдалось 29, во втором опыте - 27 и в третьем - 25 фоновых нейронов, что составило в контроле в среднем на один трек 9 нейронов. Более плотно активные в фоне нейроны располагались на глубине 500-1500 мкм - 70% от общего количества. Суммарно по трем опытам в контроле было зарегистрировано на уровне: 2-3 слоев - 18 нейронов, 4 слоя -26 нейронов, 5 слоя - 23 нейрона, 6 слоя - 14 нейронов. В исходном состоянии на треках встречалось от 4 до 18 фоновоактивных нейронов. Как и в серии опытов с электрической стимуляцией ядер шва, треки с высокой плотностью нейронов были разделены относительно пустыми" треками. В шести треках с высокой плотностью элементов (7 - 18) зарегистрировано 67 фоновых нейронов (83%), а в трех относительно "пустых" треках (4 - 5 нейронов) - 14 нейронов (17%).
Пространственно регулярный профиль распределения фоновоактивных нейронов в ПМСБ CI коры мозга крыс сохранялся и на фоне резерпина. Спустя 2-3 часа после введения резерпина в тех же треках в первом опыте зарегистрирована активность 21 нейрона, во втором опыте - 22 нейронов и в третьем - 21 нейрона, что составило в среднем около 7 нейронов на трек. Из них зарегистрировано на уровне: 2-3 слоев - 10 нейронов, 4 слоя - 23 нейрона, 5 слоя - 21 нейрон, 6 слоя - 10 нейронов. В шести треках с высокой плотностью элементов при этом зарегистрировано - 52 нейрона (81%), а в трех "пустых" треках - 12 нейронов (19%). Из данных послойного анализа следует, что резерпин наиболее существенно уменьшает количество фоновоактивных нейронов в бочонковых колонках на уровне 2-3 слоев (на 44%) и 6 слоя (на 29%). Плотные и относительно "пустые" треки в последействии резерпина содержали, соответственно, на 27% и на 25% меньше активных в фоне нейронов.
Структура фазических возбудительных реакций на отклонение центральной в РП вибриссы на фоне резерпина характеризовалась у 63 % нейронов выборки меньшей по сравнению с контролем частотой и большей длительностью первичного и вторичного возбуждения, а также разделяющей их тормозной паузы. Наряду с этим у многих нейронов с высоким уровнем фоновой импульсной активности (57 %) частота вызванной импульсной активности после введения резерпина достоверно (P < 0,05) увеличивалась, а средняя длительность фаз первичного и вторичного возбуждения и разделяющей их тормозной паузы сокращалась.
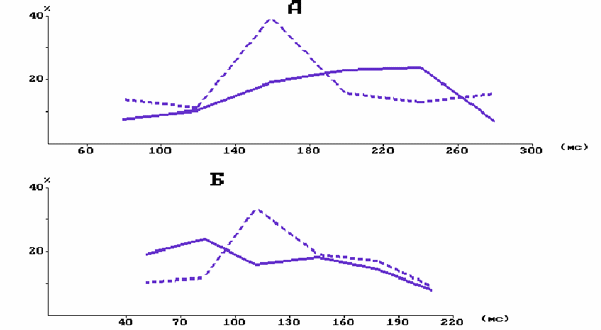
На рис. 4 графиками представлены распределения значений тормозной паузы в фазических возбудительных реакциях одного из нейронов (колонка С3, на уровне слоя 5) по частоте их реализуемости при повторном изолированном и сочетаемой с подкреплением отклонении центральной в РП вибриссы. Показано, что в контроле до введения резерпина (А) при изолированном предъявлении УС не обнаруживается отчетливой зависимости между длительностью тормозной паузы и частотой ее реализуемости в серии повторяющихся стимулов. Однако при выработке мигательного УР в распределении появляется максимум в диапазоне (140-180) мс, в котором находится около 40 % всех значений. Распределение значений тормозной паузы в реакциях этого же нейрона на изолированное предъявление УС в последействии резерпина (Б) апроксимируется также наклонной прямой линией, но возрастающей в направлении минимальных значений исследуемого параметра.
Рис. 4. Распределение значений тормозной паузы в фазированных возбудительных реакциях на УС нейронов фокальной бочонковой колонки С1 коры мозга крысы.
А - при выработке мигательного УР в контроле; В - в последействии резерпина. Сплошная линия - при изолированной тактильной стимуляции; пунктирная - при подкрепляемом предъявлении УС. По вертикали - количество значений длительности тормозной паузы в %; по горизонтали - длительность тормозной паузы в мс.
При выработке мигательного УР на фоне резерпина в распределении значений тормозной паузы, более сглаженный по сравнению с контрольным максимум, возникает в другом диапазоне - (100-130)мс. У данного нейрона под влиянием резерпина размах варьирования значений тормозной паузы становился более узким - (40-220) мс по сравнению с контролем (60-300) мс. Средняя длительность тормозной паузы по всей выборке в контроле на изолированное предъявление УС равнялась (147,7± 0,7) мс, а на подкрепляемые обдуванием роговицы была выше (P < 0,001) - (182,7± 0,4) мс. Средняя длительность тормозной паузы в последействии резерпина при изолированной стимуляции была выше (P < 0,05) по сравнению с контролем - (169,7± 1,1)мс, а при подкрепляемой обдуванием роговицы - не отличалась ни от контрольного значения, ни от значения при неподкреплении УС и равнялась (175,7± 1,0)мс.
Обсуждение результатов
Уникальные гистологические особенности ПМСБ представительства вибрисс в С1 коры мозга многих грызунов и других млекопитающих вызывают повышенный интерес к функциональным свойствам проекционных модулей данной области. Относительно простая их идентифицируемость на порядок повышает точность всех аспектов нейрофизиологического анализа. В предыдущих наших работах /10,11,22/ изучались локальные механизмы замыкания временной связи в фокусе коркового представительства условного стимула, который был ограничен отдельной бочонковой колонкой в С1 мозга крыс. Была показана структура межнейронных, вертикальных и горизонтальных, внутриколонковых и межколонковых взаимодействий в динамике выработки мигательного УР, определены зависимости скорости и характера динамики, а также степени упрочения временной связи от разнообразных форм пластичности паттернов импульсной активности нейронов, имеющих разную топологию в бочонковой колонке.
На основании данных о динамике и взаимной обусловленности отдельных компонентов фазических нейронных реакций фокуса коркового представительства УС на разных этапах обучения была сформулирована гипотеза о механизме авторитмичного сканирующего ассоциирования фокальной колонки с другими колонками, имеющими отношение к обработке параметров сочетаемых при обучении стимулов /10,11,22/. Условнорефлекторная перестройка структуры межнейронных связей в пределах фокальной корковой колонки, согласно такому предположению, состоит в ограничении ее авторитмичных сканирующих взаимодействий в распределенной системе заинтересованных структур. Это приводит к повышению вероятности конвергенции и интеграции синфазных волн возбуждения и, в итоге, к упрочению временной связи. Для обоснования подобного представления о локальных механизмах замыкания временной связи целесообразно было рассмотреть реализуемость отмеченных форм пластичности в нейронных сетях фокальной колонки в разных по эффективности условиях ее функционирования, которая варьирует с изменением общего уровня возбуждения коры мозга.
В данном исследовании показано, что активация ядер шва, следствием которой является повышение в мозге содержания нейромодулятора СТ, а также снижение концентрации СТ (наряду со снижением содержания других биогенных моноаминов) в последействии резерпина вызывали разнонаправленную пластификацию синаптических связей во входных, выходных и ассоциативных нейронных ансамблях бочонковой колонки С1 коры мозга крысы. Модуляция уровня возбуждения колонки осуществляется за счет изменения количества фоновоактивных нейронов, частоты и структуры их импульсных разрядов.
Распределение нейронов с фоновой импульсной активностью по уровням функциональной колонки в ПМСБ, по представленным здесь результатам, соответствует в общих чертах гистологической картине распределения клеточных тел, согласно которой наибольшая их плотность наблюдается в слое 4 и верхней половине слоя 5. Пространственно-регулярный профиль чередования в тангенциальном плане треков с высокой плотностью фоновоактивных нейронов с относительно "пустыми" треками, а также факт принадлежности соседних треков к одной и той же функциональной колонке, свидетельствует о том, что первые принадлежат стенкам "бочонка", а вторые - его полости, немногочисленные нейроны которой, по-видимому, контактируют с моноаминергическими пресинапсами и в большей мере находятся под их влиянием.
Выявлена послойная неравномерность в изменении уровня возбуждения бочонковой колонки. Показано значимое повышение при активации ядер шва частоты фоновой импульсной активности у ассоциативных нейронов слоев 2-3 и у выходных нейронов слоев 5-6 . Средняя частота фоновой импульсной активности у нейронов афферентного уровня при этом не изменялась. В контроле нейроны верхних и нижних слоев имели, кроме того, нерегулярную структуру фоновой импульсации: их единично-аритмичный разряд сочетался с пачечными и групповыми разрядами входных нейронов слоя 4. В первые моменты после активации ядер шва у нейронов верхних и нижних слоев наблюдалась однонаправленная трансформация единичного аритмичного разряда в групповой и пачечный при одновременной перестройке групповых и пачечных фоновых разрядов входных нейронов в непрерывно аритмичный разряд, который уже через три минуты у большинства нейронов слоя 4 возвращался к контрольному паттерну.
Структура сформированного после стимуляции ядер шва разряда фоновоактивных нейронов верхних и нижних уровней бочонковой колонки обнаруживала большую устойчивость, что очевидно обусловлено непосредственным контактом нейронов этих уровней колонки с терминалями СТ-ергических проекций, что соответствует гистологическим данным. Этим же может быть объяснен наибольший прирост количества активных в фоне нейронов после электрической стимуляции ядер шва в поверхностных слоях и уменьшение количества активных нейронов на фоне резерпина - в поверхностных и глубоких слоях. Но если единичный паттерн разряда ассоциативных нейронов переходил в групповую импульсацию и затем волнообразно возвращался к контрольному единичному аритмичному разряду, то у выходных нейронов релаксационного характера пульсаций в перестройке структуры разряда не наблюдалось - трансформация из единично- аритмичного в пачечный и групповой разряд была плавной и устойчивой. Эти данные свидетельствуют о наличии в бочонковой колонке сложной структуры межуровневых взаимодействий, определяющих поливалентный характер моноаминергических влияний.
В динамике выработки мигательного УР при повышенном уровне возбуждения фокальной корковой колонки отмечены существенные особенности в пластичности фазических импульсных реакций нейронов на тактильный стимул. Есть основание полагать, что обусловливающее эту пластичность повышение эффективности межнейронных связей вызвано прямым влиянием СТ на синаптические окончания таламических афферентов.
На пике действия резерпина, как следует из представленных результатов, происходило достоверное снижение частоты фоновой импульсации нейронов разных уровней бочонковой колонки наряду с уменьшением удельного веса их группированной и пачечной активности, а также общего количества активных в фоне нейронов. Входные нейроны на уровне слоя 4 при этом в значительно большей мере сохраняли исходный уровень активности. На этом основании сделано заключение, что при дефиците биогенных моноаминов в меньшей мере подавляются механизмы первичного сенсорного восприятия, которые обеспечиваются мощными, доминантного типа, таламокортикальными афферентами, по сравнению с ассоциативными механизмами, структурной основой которых являются слабые, вероятностного типа, межнейронные связи верхних и нижних уровней бочонковой колонки.
В последействии резерпина существенные изменения наблюдались и в структуре вызванной импульсной активности нейронов фокальной в представительстве УС корковой колонки. Они состояли в уменьшении частоты и увеличении длительности первичного и вторичного разрядов и разделяющей их тормозной паузы в реакциях на УС. Это может быть следствием ослабления в условиях дефицита биогенных моноаминов влияний со стороны вставочных тормозных нейронов верхних и нижних уровней колонки /13/. В характере варьирования длительности тормозной паузы при выработке мигательного УР наблюдалось уменьшение диапазона и менее контрастное выделение наиболее часто реализующихся ее значений. Максимум в распределении значений тормозной паузы может быть адресом структуры, с которой нейрон фокуса коркового представительства УС взаимодействует с возрастающей в процессе выработки мигательного УР вероятностью /10,11,22/. Из этого следует, что в динамике формирования временной связи в условиях дефицита моноаминов имеет место снижение количества корреспондирующих с фокусом заинтересованных нейронных структур, а также уменьшение вероятности их ассоциирования.
В данной работе подтверждены литературные данные /4,5,6,12/ о зависимости характера сдвигов частоты, структуры импульсных разрядов, плотности кросскорреляционной взаимосвязи соседних нейронов от предыдущего уровня возбуждения корковой колонки. Это позволяет рассматривать показанные здесь длительные перестройки в импульсации и взаимодействии корковых нейронов как проявление модуляторной функции СТ и других биогенных моноаминов в регуляции уровня возбуждения проекционного коркового модуля при формировании временной связи. Новизна представленных в данной работе результатов заключается в модульном аспекте рассмотрения моноаминергических механизмов пластификации синаптических контактов корковых нейронов в контексте действующего в пределах фокальной бочонковой колонки гипотетического авторитмичного сканирующего механизма образования временной связи.
Заключение
Стимуляция ядер шва приводила к увеличению на уровне ассоциативных слоев и в полостях бочонковых колонок С1 коры мозга крыс количества фоновоактивных нейронов. Частота фоновой импульсации увеличивалась у ассоциативных и выходных нейронов, а у входных нейронов не изменялась. Наблюдающиеся на верхнем уровне колонок перестройки структуры фоновых импульсных разрядов были динамичными, протекали волнообразно и возвращались к контрольному паттерну. У входных фоновоактивных нейронов импульсные разряды устойчиво рандомизировались, а у выходных - группировались. Это свидетельствует о послойной и тангенциальной неравномерности роста уровня возбуждения коркового проекционного модуля, о наличии в нем сложной структуры внутри- и межуровневых взаимодействий, определяющих поливалентный характер моноаминергических влияний.
Дефицит СТ и других моноаминов в последействии резерпина снижал уровень возбуждения бочонковой колонки, о чем свидетельствует достоверное уменьшение частоты фоновой импульсации нейронов разных ее уровней наряду с уменьшением удельного веса группированной и пачечной активности, а также общего количества активных нейронов. Входные нейроны слоя 4 при этом в значительно большей мере сохраняют исходный уровень возбуждения. Существенные изменения наблюдались также и в структуре вызванной импульсной активности нейронов фокальной в представительстве УС бочонковой колонки. Они состояли в уменьшении частоты и увеличении длительности первичного и вторичного разрядов и разделяющей их тормозной паузы в реакциях на УС. В характере варьирования значений длительности тормозной паузы при выработке мигательного УР наблюдалось опосредованное резерпином сужение их диапазона, а также уменьшение удельного количества наиболее часто реализующихся значений. На основании этого можно заключить, что дефицит СТ и других моноаминов уменьшает количество корреспондирующих с корковым фокусом УС и вероятность их ассоциирования.
Активация ядер шва, повышающая концентрацию в мозге крыс нейромодулятора СТ, а также снижение его концентрации, наряду со снижением концентрации других моноаминов, в последействии резерпина вызывают разнонаправленную пластификацию синаптических связей во входных, выходных и ассоциативных нейронных ансамблях. Подтверждены данные о зависимости характера сдвигов под влиянием СТ частоты и структуры импульсной активности и плотности кросскорреляционных взаимодействий нейронов от предыдущего уровня их возбуждения. Эти перестройки рассматриваются как проявление модуляторной функции моноаминов в регуляции уровня возбуждения коркового модуля при формировании временной связи.
Список литературы
1. Бузников Г.А. Низкомолекулярные регуляторы зародышевого развития // М.: Наука. 1967. 158 с.
2. Гасанов Г.Г., Жадин М.Н., Мамедов З.Г., Абдуллаева З.А. Колебательные процессы в активности корковых нейронов под влиянием серотонина //Физиол.журн.СССР. 1979. Т.65, N 9. С.1257.
3. Гасанов Г.Г., Жадин М.Н., Мамедов З.Г. Колебания в структуре фоновой импульсации коркового нейрона под влиянием норадреналина //Физиол.журн. СССР. 1980. Т.66, N 10. С.1446.
4. Жадин М.Н. Модель формирования условного рефлекса и анализ функциональной значимости электрографических коррелятов обучения //Журн.высш.нерв.деят. 1977. Т.27, N 5. С.949.
5. Жадин М.Н. Электрофизиологические проявления воздействия моноаминергических систем на кору головного мозга //Физиол. журн. СССР. 1986. Т.72, N 8. С.1039.
6. Жадин М.Н., Карпук Н.Н. Влияние серотонина на кросскорреляционную активность нейронов переживающих срезов коры //Журн. высш.нерв.деят. 1996. Т.46, N 3. С.547.
7. Игнатьев Д.А., Мамедов З.Г. Влияние серотонина на импульсную активность коры головного мозга кролика //Журн. высш. нерв. деят. 1983. Т.33, N 1. С.129.
8. Коган А.Б. Функциональная организация нейронных механизмов мозга //Л: Медицина. 1979. 224 с.
9. Ласков В.Н. Кодирование амплитуды тактильного стимула ансамблями нейронов соматосенсорной области коры мозга крысы. //Нейрофизиология/Neurophysiology.- 1995.- 27, N2. - С. 83 - 92.
10. Ласков В.Н. Авторитмичный характер ассоциативных процессов фокальной колонки коркового представительства условного стимула. // В кн.: "Проблемы нейрокибернетики". Ростов н/Д: РГУ, 1992. С.25.
11. Ласков В.Н., Кайдашева Л.А. Ассоциативные взаимодействия нейронных модулей коры мозга. // В кн.: "Нейроинформатика и нейрокомпьютеры", Красноярск: Изд-во КГУ, 1993, С.38.
12. Мамедов З.Г. Изменение активности корковых нейронов под влиянием биогенных моноаминов //Физиол.журн.СССР.1986. N.2, N 8. С.1055.
13. Чиженкова Р.А. Структурно-функциональная организация сенсомоторной коры // М.: Наука. 1986. 240 с.
14. Descarries L., Beaudet A., Watkins K.S. Serotonin nerve terminals in the adult rat neocortex //Brain Res. 1975. V.10, N 3. P.563.
15. Beaudet A., Descaries L. The monoamine innervation of the rat cerebral cortex: synaptic and nonsynaptic terminals // Neurosci. 1978. V.3, N 10. P.851.
16. Freedman R., Hoffer B.J., Woodward D.J., Puro D. Interaction of norepinephrine with cerebellar activity evoked by mossy and climbing fibres //Exper.Neurol. 1977. V.55, N 2. P.269.
17. Libet B., Kobajashi H. Adrenergic mediation of slow inhibitory postsynaptic potential in sympathetic ganglia of the frog //J. Neurophysiol. 1974. N 4. P.805.
18. Libet B., Kobajashi H. , Tanaka T. Synaptic coupling into the production and storage of a neuronal memory trace //Nature. 1975. V.258, N 5531. P.155.
19. Konig J.F.R., Klippel R.A. The rat brain. A stereotaxic atlas of the forebrain and lower parts of the brain stem //Baltimore: Williams and Wilkins. 1963. 162 p.
20. Krnjevic K., Ramdie M., Straugham D. Pharmacology of cortical inhibition // J. Physiol. 1966. V.184, N 4. P.78.
21. Kupferman I. Modulator action of neuromediators // Ann. Rev. Neurosci. 1979. V.2. P.447.
22. Laskov V.N., Kaidasheva L.A. Correlates of temporal connections in barrel cortex. // The Second International Symposium on Neuroinformatics and Neurocomputers, Russia, September 20-23, Rostov-on-Don, 1995, P.412.
23. Zhadin M.N., Bakharev B.V. Model of variations in the level of cortical neuron excitation in increased biogenic amine concentration //Studia Biophysica. 1987. V.121, N 1. P.81.

Нравится материал? Поддержи автора!
Ещё документы из категории география:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ