Фуллерены
1

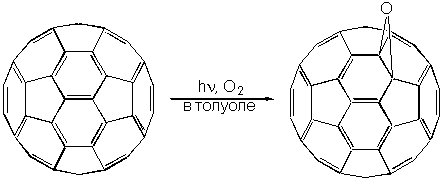


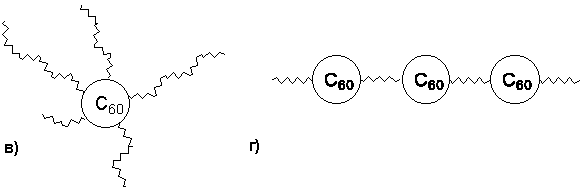
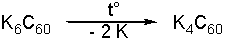

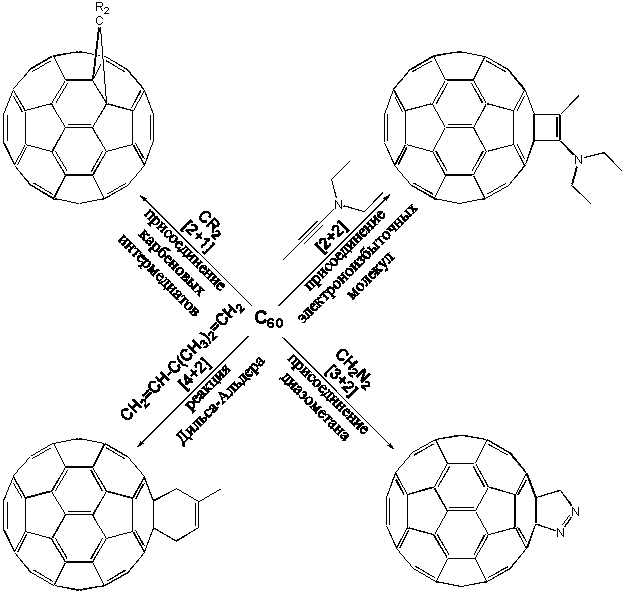



Для химика, основные области интересов которого - изучение превращений известных веществ и синтез новых, элементарный углерод - не самое интересное из веществ. Ситуация замечательным образом изменилась в 1985 г., когда семейство аллотропов углерода, насчитывавших в то время графит и алмаз, обогатилось фуллеренами. Новая форма углерода растворима в целом ряде органических растворителей, что исключительно важно для осуществления химических превращений.
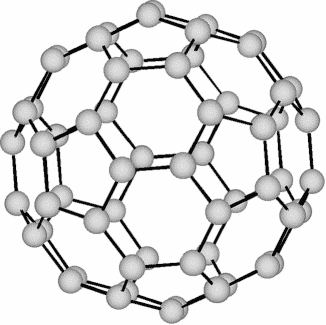
Фуллерены построены из пятиугольников и шестиугольников, в вершинах которых лежат атомы углерода. Наименьшим стабильным фуллереном является бакминстерфуллерен C60 (Рисунок 1). Его следующим устойчивым гомологом является C70, за которым следуют C76, C78, C82, C84, C90, C94, C96 и т.д. В основе строения их молекул лежит одно из следствий теоремы Эйлера, которое говорит о том, что для выстилания сферической поверхности необходимо n шестиугольников и 12 пятиугольников, за исключением n = 1.
По сравнению с двумерными молекулами, такими, как плоский бензол, фуллерены кажутся шедеврами трехмерной архитектуры, взывающими к эстетическому вкусу ученых, в результате чего, вероятно, эта область химии так бурно развивается в последнее десятилетие. Для химиков-синтетиков открылась возможность получения бесчисленных производных, комбинируя фуллерен с представителями множества известных классов веществ. Одним из первых были поставлены вопросы: каким типом реакционной способности обладает фуллерен? Можно ли его представлять себе как трехмерный аналог бензола? Как устроены его производные и какими свойствами они обладают?
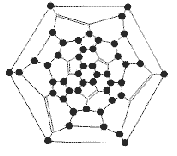
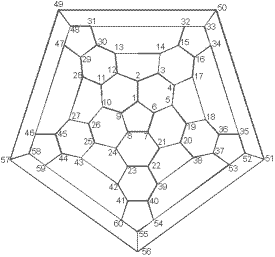
В соответствии с правилами IUPAC фуллерен C60 получил название, которое слишком неудобно для повседневного употребления: гентриаконтацикло-[29.29.0.02,14. 03,12.04,59.05,10. 06,58.07,55.08,53. 09,21.011,20.013,18. 015,30.016,28.017,25. 019,24.022,52.023,50. 026,49.027,47.029,45. 032,44.033,60.034,57. 035,43.036,56.037,41. 038,54.039,51.040,48. 042,46]-гексаконта- 1,3,5(10),6,8,11, 13(18),14,16,19, 21,23,25,27,29(45), 30,32(44),33,35(43), 36,38(54),39(51), 40(48),41,46,49, 52,55,57,59- триаконтаен. Однако возможность существования огромного числа изомеров требует введения более простой номенклатуры. Так, C60 предложено называть [5,6]-фуллереном-60-Ih, где цифры 5 и 6 указывают на структурные единицы молекулы - пятиугольники и шестиугольники, а цифра 60 обозначает общее число атомов углерода в молекуле. Так как у простейших фуллеренов существует только по одному стабильному изомеру, их названия упрощают до фуллерена-60 и фуллерена-70. При записи структурных формул атомы углерода с обратной стороны сферы опускают для ясности (Рисунок 2). Шлегель предложил нумеровать атомы углерода по часовой стрелке, начиная с шестиугольника (Рисунок 3).
Рисунок 3. Диаграмма Шлегеля для нумерации атомов фуллерена-60.
Физические свойства
Внешне фуллерены представляют собой мелкокристаллические порошки черного цвета, лишенные запаха. В воде, этаноле, ацетоне и других полярных растворителях они практически нерастворимы, зато в бензоле, толуоле, фенилхлориде растворяются с образованием окрашенных в красно-фиолетовый цвет растворов. Замечательно, что если к насыщенному раствору C60 в диоксане, имеющему желто-коричневый цвет, добавить каплю стирола, мгновенно происходит явственное изменение окраски раствора на красно-фиолетовую, объясняемую образованием комплекса (сольвата).
Энтальпия образования фуллерена-60 составляет приблизительно 42.5 кДж/моль, а C70 - 40.3 кДж/моль. Это говорит о том, что они менее стабильны, чем графит (0 кДж/моль) и алмаз (1.67 кДж/моль), причем с увеличением размеров сферы (то есть по мере увеличения числа атомов углерода) энтальпия образования асимптотически стремится к энтальпии графита, так как сфера все более напоминает плоскость.
Твердый C60 имеет гранецентрированную кубическую решетку при комнатной температуре, его плотность составляет 1.68 г/см3. Ввиду слабого межмолекулярного взаимодействия молекулы свободно вращаются. Ниже 0° С происходит превращение в кубическую решетку. Фуллерен-70, свободное вращение которого слегка затруднено по причине асимметричности молекулы, испытывает фазовый переход при более низкой температуре.
Из насыщенных растворов в ароматических растворителях фуллерены при низких температурах выпадают в виде кристаллосольватов вида C60·Xn, где в качестве X выступают бензол, толуол, стирол, ферроцен и другие молекулы.
Следует добавить, что так как энтальпия растворения фуллерена в большинстве растворителей положительна, при повышении температуры растворимость, как правило, ухудшается.
Реакционная способность фуллеренов
Фуллерены зачастую сравнивают с ароматическими углеводородами, что не совсем верно, так как наиболее типичные для бензола реакции замещения невозможны для фуллеренов, не имеющих атомов водорода. На этом основании можно выделить три основных типа реакций:
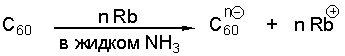
Сравнение химического поведения фуллерена с другими молекулами показывает, что C60 обычно ведет себя как электронодифицитный полиолефин, для которого делокализация электронов не имеет такого же значения, как для бензола. Принимая от 1 до 6 электронов, фуллерен-60 превращается в анион, причем в качестве доноров электронов могут выступать электрический ток, щелочные или щелочноземельные металлы или органические молекулы-доноры.
Подобно алкенам, фуллерены легко образуют продукты циклоприсоединения; например, в реакции Дильса-Альдера он, обладая электронодифицитным характером, выступает в качестве диенофила:
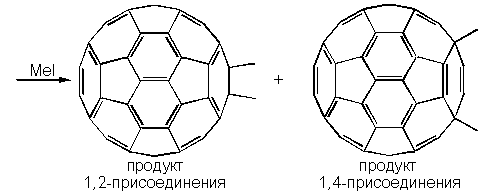
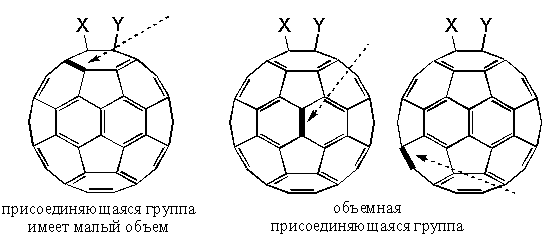
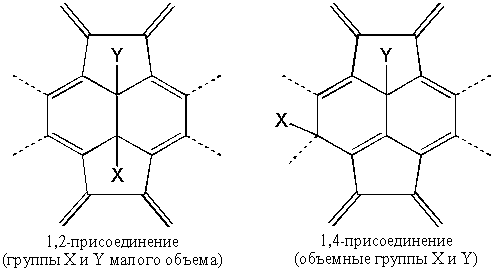
Многие из таких аддуктов обладают замечательной устойчивостью, хотя при этом неизбежно нарушается идеальная сфера молекулы C60, так как атомы углерода, к которым оказываются присоединенными заместители, обладают тетраэдрическими орбиталями (sp3-гибридизация), что деформирует молекулу. Поэтому, несмотря на то, что многие реакции присоединения являются экзотермическими, выделение тепла по мере введения новых групп уменьшается. Вместе с тем появляется вопрос о региоселективности присоединения. Как правило, первая молекула присоединяется в положение 1,2-, то есть в линии, где соприкасаются два шестиугольника (Рисунок 3) или в 1,4-, если группы являются объемными и испытывают пространственные затруднения.
Вопрос о месте присоединения второй группы не так прост и потребовал серьезных исследований. В случае фуллерена-60 места атаки указаны стрелками:
Наиболее интересными из этих реакций являются такие, в которых сфера молекулы раскрывается обратимо. Это открывает путь к получению эндоэдральных соединений. Помещение внутрь сферы атома инертного газа приводит к нейтральным системам, а если внутри оказывается ион, образуется соль. Такие соли, получившие условное название “молекулярных атомов” необычны тем, что центральное “ядро” в них заряжено положительно, а окружающая его оболочка - отрицательно. Теоретически возможно помещение внутрь самых необычных молекул или молекул в необычных состояниях, обычное время жизни которых не превышает миллисекунд, например, синглетного кислорода, карбокатионов и др.
Показано, что многие из эндоэдральных соединений могут обладать высокой биологической активностью, что позволит применять их в медицине.
Далее будут кратко рассмотрены реакции названных типов.
Реакции с переносом электрона
Химические свойства: восстановление
Исторически первым изученным из химических свойств фуллерена было его восстановление. Как только стала понятной электрофильная природа фуллерена, были осуществлены различные реакции, например с активными металлами, энергичными органическими молекулами - донорами электронов, электрохимическое восстановление, для получения фуллереновых солей. Анион фуллерена оказался весьма активным участником многих реакций, подвергаясь электрофильным атакам, что открыло синтетические подходы к органической химии фуллерена.
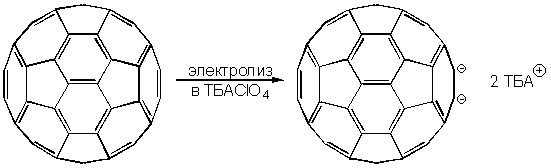
Электрохимическое восстановление фуллерена-60 может быть осуществлено в перхлорате тетра-н-бутиламмония (ТБАClO4), который достаточно полярен для растворения образующегося по приведенной схеме темно-красного дианиона:
Обработка полученного раствора йодистым метилом приводит к образованию темно-коричневого раствора диметилдигидрофуллерена C60(CH3)2 (смесь продуктов 1,2- и 1,4-присоединения в отношении 3:2):
где n = 1-5.
Обработка полученных полианионов алкилйодидами приводит к полиалкилированным фуллеренам; таким образом был получен C60(CH3)24.
Открытие сверхпроводимости комплексов C60 со щелочными металлами привлекло внимание научного сообщества к этому классу соединений. Первой полученной солью этого типа был K3C60, переход которого в сверхпроводящее состояние совершается при 19.3 К. За короткое время было синтезировано и изучено значительно количество таких соединений, изменяющихся на воздухе, но устойчивых к нагреванию. Так, K6C60 разлагается в запаянной трубке при 550 ° С по схеме:
Образование фуллеридов металлов объясняется внедрением ионов в гранецентрированную кубическую решетку, где они занимают свободные тетраэдрические о октаэдрические полости. Например, в соединении Na2C60 ионы натрия занимают две тетраэдрические полости, не изменяя параметров кристаллической решетки фуллерена-60. Более объемные ионы, чем Na+, заметно деформируют решетку, обусловливая низкотемпературную сверхпроводимость при условии, что фуллерен существует в виде аниона C603-.
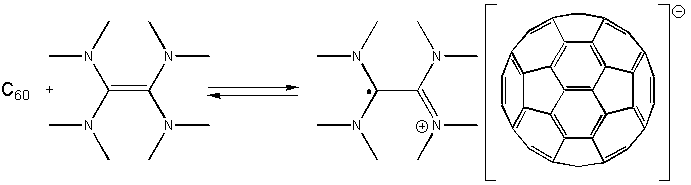
В качестве восстановителей по отношению к фуллерену могут выступать многие органические вещества, являющиеся достаточно энергичными донорами электронов. Первые такие комплексы были синтезированы простым смешиванием реагентов в подходящем неполярном растворителе, например, в бензоле. Получающиеся при этом комплексы с переносом заряда оказываются достаточно хорошо растворимыми в таких полярных растворителях, как бензонитрил или тетрагидрофуран, что исключительно облегчает их выделение. В определенных условиях образование комплексов оказывается обратимым; так, например, комплекс с тетра-(N,N-диметиламино)этиленом в толуоле и других ароматических растворителях они диссоциирует на фуллерен и молекулу - донор электронов:
Полученный комплекс обладает уникальными для органических молекул магнитными свойствами (температура перехода в ферромагнитное состояние 16.1 К).
Образование комплексов с переходными металлами
Высокое сродство молекул C60 и C70 к электрону проявляется в склонности к образованию комплексов с пеходными металлами. Изучение кристаллической структуры получающихся соединений привело к выводу, что процесс комплексообразования переходных металлов с фуллереновым ядром по сути такой же, как и хорошо известная реакция комплексообразования с электронодифицитными алкенами.
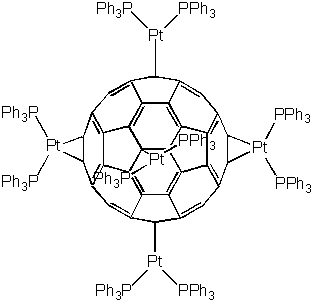
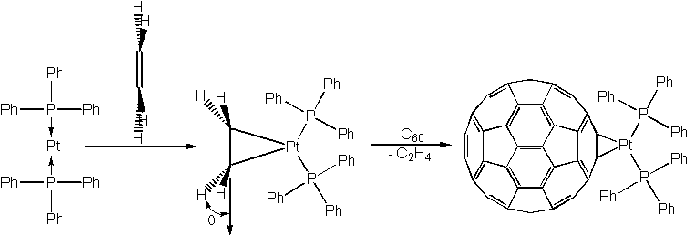
Так, при взаимодействии ди(трифенилфосфин)платины с этиленом (представляющим собой плоскую молекулу) образуется комплекс, сокращенно обозначаемом (Ph3P)2Pt(2-C2H4), в котором атомы водорода в молекуле этилена более не лежат в плоскости, а отклонены на угол , что является мерой прочности донорно-акцепторных связей. Такое изменение конфигурации заместителей усиливается при наличии в молекуле этилена более электроноакцепторных заместителей, чем водород. С раствором фуллерена-60 в толуоле (Ph3P)2Pt(2-C2H4) образует окрашенный в изумрудно-зеленый цвет комплекс (Ph3P)2Pt(2-C60).
Интересно, что образование комплекса, включающего шесть атомов платины, и соответственно имеющего на 6 двойных связей меньше, чем исходный фуллерен, увеличивает степень делокализации электронов в оставшихся бензольных кольцах. Иными словами, образовавшаяся структура имеет более ароматический характер, чем сам фуллерен-60. Проявлением этого является уравнивание длин углерод-углеродных связей в восьми шестиугольниках:
Нуклеофильное присоединение
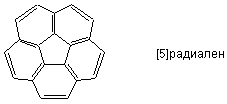
Проявление молекулой C60 окислительный свойств по отношению к щелочным металлам, как было показано ниже, указывает на то, что фуллерен является электронодифицитной молекулой. Рассмотрение же химического строения молекулы представляет фуллерен скорее как сопряженный полиен, в составе могут быть выделены фрагменты структуры искаженного [5]-радиалена и циклогексатриена, чем как “сверхароматическое” соединение. Характерной реакцией такого полиена оказывается нуклеофильное присоединение. Уникальность фуллерена в этом случае заключается в исключительном разнообразии образующихся продуктов, что создает большие трудности для выделения их в чистом виде.
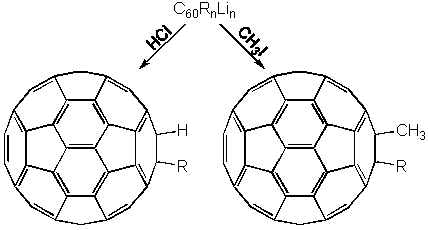
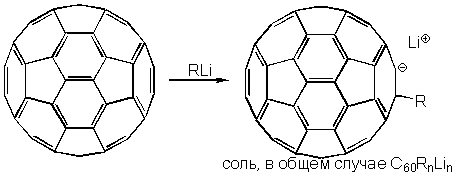
Фуллерен-60 легко взаимодействует с литийорганическими соединениями и реактивами Гриньяра, образуя в качестве первичных интермедиатов анионы RC60-. Процесс проходит очень быстро; например, в толуоле осадок солей выпадает практически мгновенно:
Дальнейшая обработка, например, раствором хлороводорода в метаноле позволяет получить производные гидрофуллеренов, а йодистым метилом - метилфуллеренов:
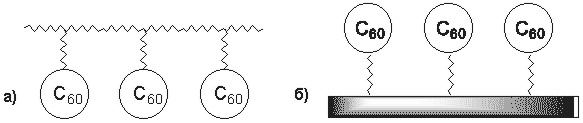
Сродство фуллерена к С-нуклеофилам может проявляться в возможности получения полимеров C60. Такие фуллерены (Рисунок 4) представляют интерес по следующим соображениям: 1) свойства полимера сочетаются со свойствами фуллерена, 2) при соответствующем подборе мономеров они могут образовывать плотные мономолекулярные пленки, проявлять устойчивость к растворителям и быть неплавкими, а также 3) обладать необычными электрическими, оптическими и каталитическими свойствами.
Рисунок 4. Четыре прототипа полимеров, включающие структурную единицу C60: а) прикрепленные к цепи, б) прикрепленные к поверхности (привитые), в) дендритные (ветвящиеся), г) цепочечные.
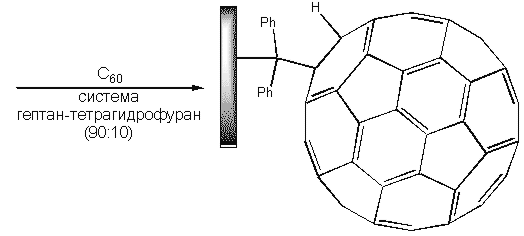
Одним из способов получения, например, привитых полимеров, может служить следующая схема (в качестве основы использована полиэтиленовая пленка с поверхностными дифенилметильными группами):
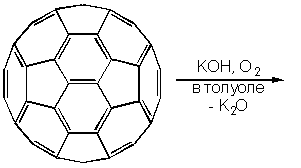
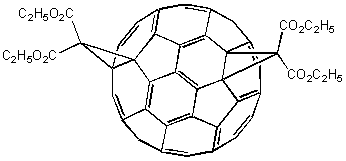
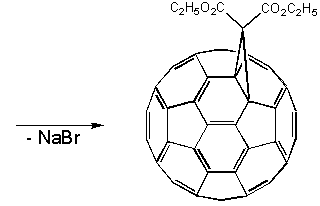
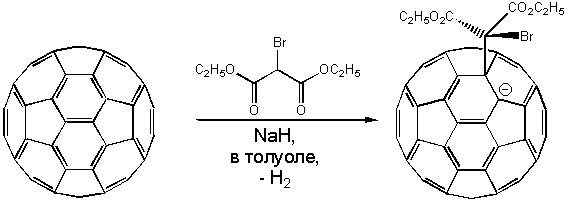
Стабилизация активных интермедиатов RC60- может быть осуществлена путем внутримолекулярного нуклеофильного замещения (SNi), если R представляет собой уходящую группу. Как показал Бингель, при взаимодействии с -галогенэфирами и -галогенкетонами осуществляется гладкое циклопропанирование фуллерена, например, реакция с броммалоновым эфиром (диэтилброммалонатом) с участием гидрида натрия в толуоле осуществляется при комнатной температуре, причем моноаддукт может быть выделен хроматографией на колонке:
В тех же условиях возможно образование бис-аддукта, то есть вещества, в составе которого содержатся два циклопропановых кольца. Для фуллерена-60 изомеров такого вида будет восемь, из которых преобладает следующий:
Еще одним примером реакции нуклеофильного присоединения является гидроксилирование, которое протекает при нагревании толуольных растворов фуллеренов с избытком едкого кали; в осадок выпадают фуллеролы (гидроксофуллерены, C60(OH)n).
Интересно, что C70 в этих условиях взаимодействует быстрее, чем C60, что позволяет судить о ходе реакции по окраске раствора: раствор C60 окрашен в красно-фиолетовый цвет, а C70 - в винно-красный.
Реакции присоединения
Реакции циклоприсоединения
При реакциях циклоприсоединения активную роль всегда играют двойные связи шестичленного кольца, выступая как в качестве диенов, так и диенофилов. Огромное количество циклоаддуктов, которые при этом можно получить, сильно способствовало повышению интереса исследователей к химии фуллеренов. Эта реакция оказалась мощным инструментом, позволяющим вводить в C60 практически любые функциональные группы, получая вещества, многие из которых выдерживают нагревание до 400 ° С без разложения.
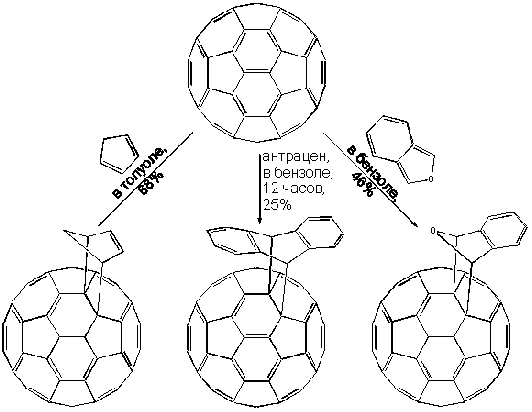
Наиболее типичными являются реакции Дильса-Альдера ([4+2]циклоприсоединение), в которых фуллерен выступает в качестве диенофила. В случае активных диенов характер устанавливающегося равновесия таков, что выход аддуктов весьма высок, а их очистка возможна методами жидкостной хроматографии с использованием толуола в качестве элюента:
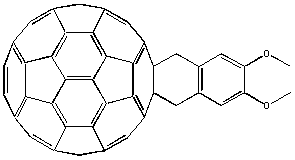
Синтезированный по сходной схеме аддукт содержит электроноизбыточную диметоксифельную группу и электронодифицитный C60 в составе одной молекулы, что обусловливает внутримолекулярное донорно-акцепторное взаимодействие:
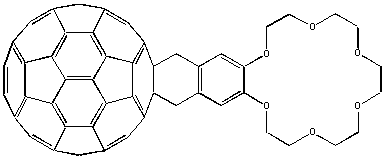
Растворимость другого аддукта, полученного с использованием эфира бензо[18]краун-6, в полярных протонных растворителях, сильно зависит от концентрации ионов K+; это приводит к выводу, что эфирная группировка практически не взаимодействует с фуллереновой частью молекулы:
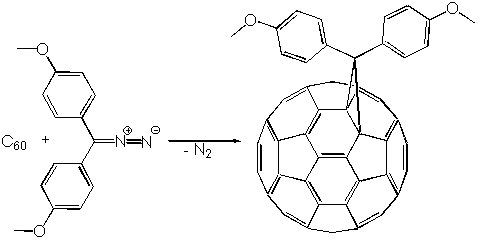
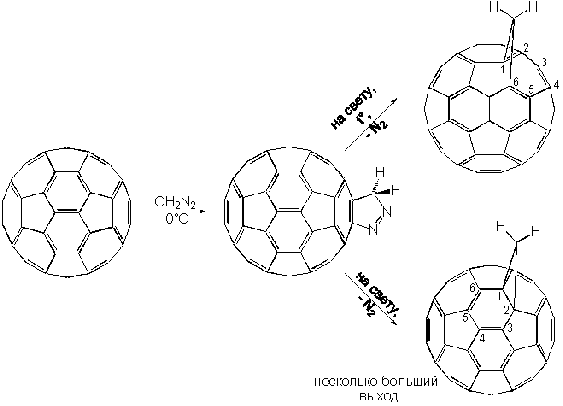
Другим важным типом реакций циклоприсоединения является реакция с диазометаном ([3+2]циклоприсоединение), в ходе которого фуллерен ведет себя как 1,3-диполярофил. При обработке раствора C60 в толуоле диазометаном интермедиат (пиразолин) оказывается относительно устойчивым, как показал Вудль, и разлагается на смесь изомеров только под действием света:
Выходы изомеров заметно отличаются; этот и другие подобные факты, а также теоретические расчеты, позволили придти к заключению, что для фуллерена C60, а также для его производных оказывается энергетически невыгодным образовывать двойные связи в месте соединения пяти- и шестичленных колец или уменьшать максимально возможное число [5]радиаленовых колец. Напомним, что в составе C60 имеется 12 [5]радиаленовых колец:
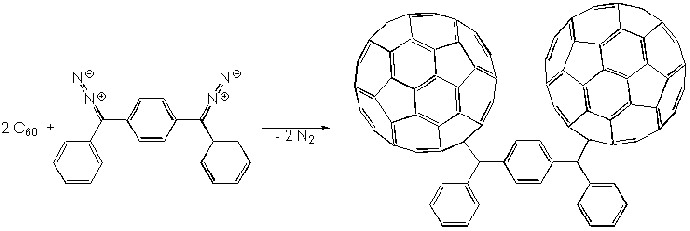
Реакции циклоприсоединения с замещенными фенилдиазометанами открывают широкие возможности для введения различных функциональных групп. При наличии нескольких диазогрупп (такие соединения легко могут быть синтезированы из кетонов через их гидразоны), избирательно реагирующих с фуллереном, могут быть получены соединения, образно названные “нитью жемчуга”:
Другим примером синтеза соединения с дифенилметановым мостиком является диметиловый эфир дифенола, получаемый с выходом 94% при комнатной температуре:
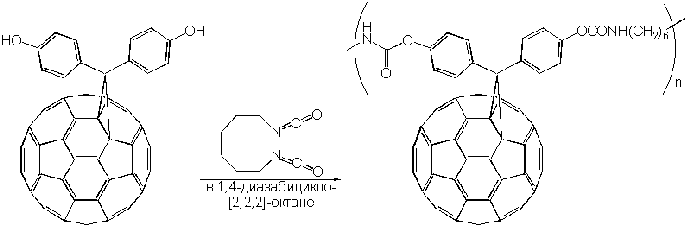
Дифенол, получаемый в результате гидролиза его простого эфира, оказался исключительно интересным исходным веществом для широкого круга синтезов, например, для получения полиуретана при взаимодействии с гексаметилендиизоцианатом:
а также для синтеза растворимого во многих органических растворителях светло-коричневого стеклообразного полимера, обладающего дендритной структурой:
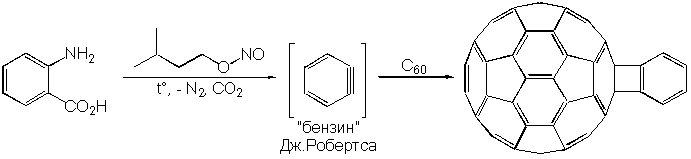
Исключительно важными, наконец, являются реакции [2+2]циклоприсоединения; например, бензина к C60. Напомним, что термин “бензин” относится к открытому Дж.Робертсом в 1953 г интермедиату многих реакций ароматических соединений, формально содержащему тройную связь. Так, бензин, образовавшийся in situ путем диазотирования антраниловой кислоты, может присоединиться к C60 по связи между C-1 и C-2:
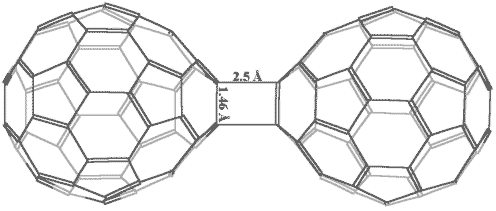
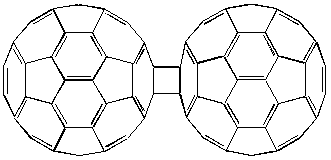
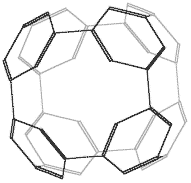
Еще один интересный пример циклоприсоединения того же типа представляет фотохимическая полимеризация фуллерена, которая обратимо осуществляются при освещении видимым или ультрафиолетовым светом тонких (мономолекулярных) пленок C60, получающихся, к примеру, при выливании капли толуольного раствора на поверхность воды и последующем испарении растворителя:
Рисунок 5. Димер состава C120, атомы углерода задней половины сферы показаны серым цветом.
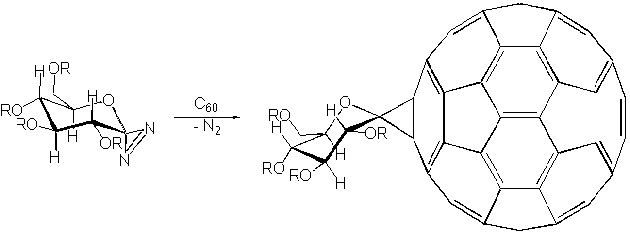
В заключение следует упомянуть еще об одном примере, [2+1]циклоприсоединении. Речь идет о реакции с фуллереном карбеновых частиц, генерируемых из производных диазирина. В приведенном ниже примере рассматривается образование в толуоле моноаддуктов с моносахаридом, гидроксильные группы которого защищены бензильными остатками:
Конфигурация заместителей в аддукте сохраняется такой же, какой она была в исходной молекуле сахара; важно, что в реакции образуется только один энантиомер, а не смесь оптических изомеров.
Гидрирование
Рисунок 6. Модели гидридов фуллерена C60H60: а - изомера, содержащего часть атомов водорода внутри сферы, б - имеющего все атомы водорода вне сферы.
Приводимая ниже таблица позволяет получить представление о различиях в энергиях молекулы, связанных в искажением валентных углов в молекуле C60H60, а также с другими факторами. Следует иметь в виду, что возможен только один “полностью экзо-” изомер и множество изомеров, содержащих часть атомов водорода внутри сферы. Расчеты выполнены с помощью программы Chem 3D Pro v.3.5 (Cambridge Soft).
Изомер а
изомер б
Заслонение соседних атомов водорода, кДж/моль
483.8
905.8
Искажение валентных углов, кДж/моль
630.3
827.9
Отталкивание 1,4-заместителей в циклогексановых кольцах, кДж/моль
374.6
1027.7
Общий запас энергии
1556.5
2580.9
Вместе с тем гидриды с небольшим числом водородных атомов, такие как C60H2, C60H4, C70H2, получены и охарактеризованы.
Прямое восстановление фуллерена водородом на активированном угле с рутением в качестве катализатора возможно только в жестких условиях (высокое давление и температура) по схеме:
Наибольшая достигнутая степень гидрирования соответствует C60H50 и C70H36, являющихся энергичными восстановителями.
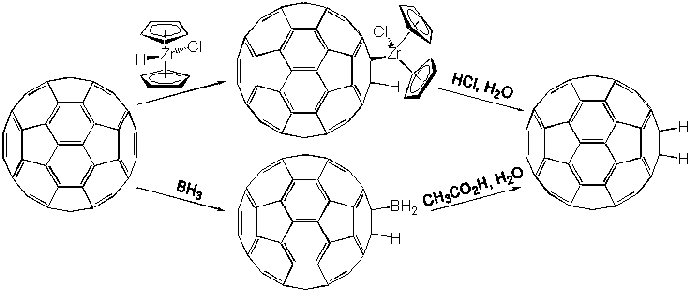
Для получения ди- и тетрагидридов наиболее подходящими оказались методы гидроборирования (взаимодействие с бораном) и гидроцирконирования (восстановление дициклопентадиенилцирконийгидрохлоридом, имеющим сэндвич-структуру):
В случае фуллерена-60 получается единственный изомер, выделение которого методом жидкостной хроматографии высокого давления не представляет серьезных трудностей; в случае C70 образуется смесь двух изомеров. Дальнейшее восстановление C60H2 может быть осуществлено только с весьма низким выходом: 15% для C60H4.
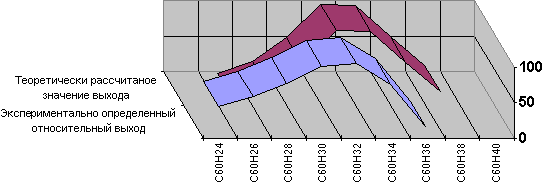
Исключительно интересным способом восстановления оказался метод, предложенный в свое время Берчем и Хюккелем, который заключается в обработке литием в жидком аммиаке в присутствии трет-бутилового спирта. Темно-фиолетовая суспензия фуллерена при этом превращается в смесь продуктов гидрирования, окрашенную в светло-кремовый или вообще белый цвет. Исследование ее состава показало, что в ней преобладает C60H32, хотя количества других гидридов фуллерена значительны:
Продукты гидрирования по Берчю-Хюккелю легко теряют водород и превращаются в C60, то есть гидрирование является полностью обратимым.
Окисление и реакции с электрофильными агентами
Хотя восстановление фуллеренов кажется значительно более легким, учитывая склонность к принятию электронов (максимально может быть принято 6 электронов), многие реакции окисления, протекающие без разрыва фуллереновой сферы и изменения общего характера связей, оказываются вполне осуществимыми.
Продукты окисления фуллеренов C70On и C60On могут быть найдены в составе фуллеренового экстракта, полученного при испарении графита в вольтовой дуге. Образование этих оксидов происходит при совместном действии кислорода и света. Так, в склянке, в которой в течение полугода на солнечном свету хранили раствор C60 в толуоле, на стенках образовался коричневый налет, представляющий собой плохо растворимый в толуоле оксид C60O:
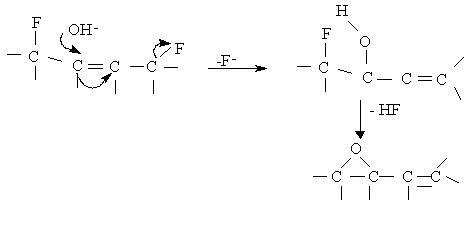
Значительно больший интерес представляет галогенирование фуллерена, в особенности его фторирование. В первых работах, посвященных фторидам, использовалась реакция с газообразным фтором, что в результате приводило к смесям продуктов. В 1992 г (Сидоров Л.Н., Болталина О.В.) было предложено использовать фториды переходных металлов, что сделало возможным получение в макроколичествах определенных фторидов фуллерена C60 практически в чистом виде:
Продукты фторирования С60 фторидами металлов
MFn (cr) MFn-1 (cr) +1/2 F2 (g)
- lgKp
(550°С)
C60Fx(max)
температура синтеза, °С
TbF4 TbF3 + 1/2 F2
2.4
42 - 44 (70)
320(350)
CoF3 CoF2 + 1/2 F2
4.2
36-40
350
MnF3 MnF2 + 1/2 F2
7.8
36
320
1/4 PtF4 1/4 Pt + 1/2F2
9-11
18
460
CuF2 CuF + 1/2 F2
13.7
2
650
FeF3 FeF2 + 1/2 F2
15.9
2
650
Таким образом был охарактеризован ряд фторидов, устойчивых на воздухе:
C60F18
C60F36
C60F48
Цвет
зеленовато-желтый
бледно-желтый
белый
Температура сублимации
от 516 до 658
от 422 до 525
от 395 до 528
Диаграмма Шлегеля
169 ± 6
134 ± 6
112 ± 7
Структура
В растворах фториды весьма легко окисляются, а также образуют гидроксофториды фуллеренов под действием следов воды, что затрудняет работу с ними. Деградация фторидов осуществляется по механизму нуклеофильного замещения, например:
или
C60F36 + H2O C60F34O + 2 HF
Нельзя не упомянуть, говоря о взаимодействии фуллерена со фтором, о явлении гиперфторирования, то есть продуктах состава C60Fn>60. Впервые такие вещества были получены Тюинманном в 1993 г при обработке C60 фтором под действием ультрафиолетового излучения. Дальнейшие исследования показали, что часть углерод-углеродных связей в продуктах оказывается разрушенной, а реакция протекает по радикальному механизму.
Для фуллеренов относительно легко осуществляются реакции хлорирования и бромирования; так, например, описан хлорид C60Cl6, бромиды C60Br8, C60Br24, причем последняя молекула является высокосимметричной. Все они исключительно легко теряют галоген при нагревании уже до 150° С.
Реакции, сопровождающиеся раскрытием сферы
Эндоэдральные комплексы
При образовании фуллереновых молекул в результате испарения графита в вольтовой дуге в атмосфере гелия внутри молекулы может оказаться атом этого инертного газа. Однако такие комплексы, как He@C60, теряют инертный газ при обычных условиях приблизительно за 90 миллисекунд.
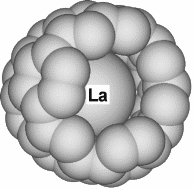
Если в составе графита присутствует, например, оксид лантана или карбиды других редкоземельных элементов, образуются комплексы состава La@C60, La@C70, La@C74 или La@C82. Описаны эндоэдральные комплексы иттрия, скандия, церия, неодима, самария, европия, гадолиния, тербия, диспрозия, гольмия, эрбия и других элементов. Интересно отметить, что в общем невысокий выход C82 при дуговом синтезе повышается в присутствии солей лантана (получается комплекс La@C82). Исследования показали, что атом металла внутри находится в степени окисления +3, а фуллереновая оболочка заряжена отрицательно: C823-, то есть эндоэдральный комплекс одновременно оказывается и комплексом с переносом заряда (Рисунок 7).
Рисунок 7. Комплекс La@C82 (15 атомов углерода из 82-х убраны для наглядности).
Образование комплексов типа X@C60, где X - атом инертного газа, относительно легко происходит под давлением. Проникновение внутрь атомов аргона и более тяжелых инертных газов может происходить только в результате обратимого разрыва одной из связей C-C. Такой механизм образования комплекса получил название “оконного”. Считается, что если окажется на время разорванной связь между пяти и шестичленным кольцами, возникнет девятичленное кольцо, которое достаточно велико для того, чтобы через него “протиснулся” даже атом ксенона.
Перспективы химии фуллеренов
Нобелевский лауреат Г.Крото образно сравнил открытие фуллерена с открытием Колумбом Америки: “Подобно тому как Земля 500 лет назад перестала казаться плоской, в наши дни внимание химиков привлечено к сферическому углероду”. Другой химик, Ф.Дидрих, говоря о перспективах новой области химии, сказал: “За несколько лет фуллерен сделался одним из главных строительных блоков органической химии. На всестороннее исследование бензола, открытого М.Фарадеем в начале XIX века, потребовалось почти 100 лет, а химия фуллеренов за 10 лет достигла такого расцвета, что химики стали рассматривать его применение в синтезах как обычное дело“.
В настоящее время, несмотря на ряд замечательных открытий в этой области химии и общее прояснение картины реакционной способности фуллеренов, ощущается недостаток глубоких и полных исследований, как практического характера, так и теоретических.
Интересным направлением обещает оказаться химия гетерофуллеренов, молекулы которых содержат атомы бора, серы, азота и других элементов вместо одного или нескольких углеродных атомов.
Исключительны перспективы получения эндоэдральных соединений: внутри молекул фуллеренов достаточно места, чтобы разместить там атом, ион или небольшую молекулу. Поэтому столь большое внимание привлекают реакции, в ходе которых сфера раскрывается, например, реакции гиперфторирования.
В будущем совершенно неожиданными могут оказаться открытия, связанные с высшими фуллеренами (Cn>84), так как в настоящее время эти вещества практически недоступны в заметных количествах. Если вспомнить, что для фуллерена-60 число изомеров вида C60XY исчисляется десятками, для высших фуллеренов их будет значительно больше.
В заключение перечислим некоторые возможные области применения фуллеренов и их производных в ближайшем будущем:
электронные и оптические устройства, основанные на применении фуллеренов или полимерных материалов на их основе,
фотоматериалы и материалы для преобразования электрической энергии в световую,
катализаторы,
лекарственные средства
Некоторые области применения пока остаются гипотетическими, ввиду недостаточности современного уровня знаний:
получение алмазов (в том числе тонких пленок),
источники тока,
молекулярные сита и устройства для аккумулирования газов,
материалы для нелинейной оптики (лазеры),
преобразователи солнечной энергии,
сверхпроводники.
Не стоит сомневаться в том, что будущее химии фуллеренов окажется значительно интереснее любых прогнозов о нем.

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ