Характеристика ацетиленовых углеводородов
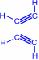


АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
(АЛКИНЫ)
Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2. Родоначальником гомологического ряда этих углеводородов является ацетилен HCCH.
Изомерия
Алкинам свойственна изомерия углеродного скелета (начиная с C5H8), изомерия положения тройной связи (начиная с C4H6) и межклассовая изомерия с алкадиенами.
Получение
1) В промышленном масштабе для технических целей ацетилен получают высокотемпературным пиролизом метана.
2CH4 ––1500C HCCH + 3H2
2) Алкины можно получить из дигалогенопроизводных парафинов отщеплением галогеноводорода при действии спиртового раствора щелочи. Атомы галогена при этом могут быть расположены как у соседних атомов углерода, так и у одного углеродного атома.
СH3–CH–CH2 + 2 KOH ––этанол CH3–CCH + 2KBr + 2H2O
I I
Br Br
Br
I
CH3–C–CH2–CH3 + 2KOH ––этанол CH3–CC–CH3(бутин-2) + 2KBr + 2H2O
I
Br
3) Ацетилен получают также из ацетиленида (карбида) кальция при разложении его водой.
CaC2 + 2H2O Ca(OH)2 + HCCH
Физические свойства
По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных условиях алкины С2–С3 – газы, С4–С16 – жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами. Физические свойства некоторых алкинов сведены в таблице.
Таблица. Физические свойства некоторых алкинов
Название
Формула
tпл.,
C
tкип.,
C
d420
Ацетилен
HCCH
-80,8
-83,6
0,565 1
Метилацетилен
CH3–CCH
-102,7
-23,3
0,670 1
Бутин-1
C2H5–CCH
-122,5
8,5
0,678 2
Бутин-2
CH3–CC–CH3
-32,3
27,0
0,691
Пентин-1
CH3–CH2–CH2–CCH
-98,0
39,7
0,691
Пентин-2
CH3–CH2–CC–CH3
-101,0
56,1
0,710
3-Метилбутин-1
CH3–CH–CCH
I
CH3
–
28,0
0,665
1 При температуре кипения.
2 При 0°C.
Химические свойства
Углеродные атомы в молекуле ацетилена находятся в состоянии sp-гибридизации. Это означает, что каждый атом углерода обладает двумя гибридными sp- орбиталями, оси которых расположены на одной линии под углом 180 друг к другу, а две p- орбитали остаются негибридными.
sp- Гибридные орбитали двух атомов углерода в состоянии,
предшествующем образованию тройной связи и связей C–H
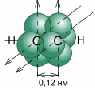
По одной из двух гибридных орбиталей каждого атома углерода взаимно перекрываются, приводя к образованию - связи между атомами углерода. Каждая оставшаяся гибридная орбиталь перекрывается с s- орбиталью атома водорода, образуя - связь С–Н.
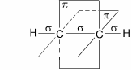
Схематическое изображение строения молекулы ацетилена (ядра атомов углерода и водорода на одной прямой,
две - связи между атомами углерода находятся в двух взаимно перпендикулярных плоскостях)
Две негибридные p- орбитали каждого атома углерода, расположенные перпендикулярно друг другу и перпендикулярно направлению - связей, взаимно перекрываются и образуют две - связи. Таким образом, тройная связь характеризуется сочетанием одной - и двух - связей.
Для алкинов характерны все реакции присоединения, свойственные алкенам, однако у них после присоединения первой молекулы реагента остается еще одна - связь (алкин превращается в алкен), которая вновь может вступать в реакцию присоединения со второй молекулой реагента. Кроме того, "незамещенные" алкины проявляют кислотные свойства, связанные с отщеплением протона от атома углерода, составляющего тройную связь (С–Н).
I. Реакции присоединения
1) Гидрирование. Гидрирование алкинов осуществляется при нагревании с теми же металлическими катализаторами (Ni, Pd или Pt), что и в случае алкенов, но с меньшей скоростью.
CH3–CCH(пропин) ––t,Pd;H2• CH3–CH=CH2(пропен) ––t,Pd;H2 CH3–CH2–CH3(пропан)
2) Галогенирование. Алкины обесцвечивают бромную воду (качественная реакция на тройную связь). Реакция галогенирования алкинов протекает медленнее, чем алкенов.
HCCH ––Br2 CHBr=CHBr(1,2- дибромэтен) ––Br2 CHBr2–CHBr2(1,1,2,2- тетрабромэтан)
3) Гидрогалогенирование. Образующиеся продукты определяются правилом Марковникова.
CH3–CCH ––HBr CH3–CBr=CH2(2- бромпропен -1) ––HBr CH3–CBr2–CH3(2,2- дибромпропан)
4) Гидратация (реакция Кучерова). Присоединение воды осуществляется в присутствии сульфата ртути. Эту реакцию открыл и исследовал в 1881 году М.Г.Кучеров.
Присоединение воды идет по правилу Марковникова, образующийся при этом неустойчивый спирт с гидроксильной группой при двойной связи (так называемый, енол) изомеризуется в более стабильное карбонильное соединение - кетон.
C2H5–CCH + H2O ––HgSO4 [C2H5–
C=CH2](енол) C2H5–
I
OH
C–CH3(метилэтилкетон)
II
O
В случае гидратации собственно ацетилена конечным продуктом является альдегид.
O
II
HCCH + H2O ––HgSO4 [CH2=
CH](енол) CH3–
I
C(уксусный альдегид)
I
H
O
H
5) Полимеризация. Ацетиленовые углеводороды ввиду наличия тройной связи склонны к реакциям полимеризации, которые могут протекать в нескольких направлениях:
a) Под воздействием комплексных солей меди происходит димеризация и линейная тримеризация ацетилена.
HCCH ––kat.HCCH CH2=CH–CCH ––kat.HCCH CH2=CH–CC–CH=CH2
b) При нагревании ацетилена в присутствии активированного угля (реакция Зелинского) осуществляется циклическая тримеризация с образованием бензола.
+
––600C,C
II. Кислотные свойства
Водородные атомы ацетилена способны замещаться металлами с образованием ацетиленидов. Так, при действии на ацетилен металлического натрия или амида натрия образуется ацетиленид натрия.
HCCH ––NaNH2 HCCNa + NH3
Ацетилениды серебра и меди получают взаимодействием с аммиачными растворами соответственно оксида серебра и хлорида меди.
HCCH + 2[Ag(NH3)2]OH AgCCAg + 4NH3 + 2H2O
Ацетилениды серебра, меди обладают исключительной взрывчатостью. Они легко разлагаются при действии соляной кислоты.
AgCCAg + 2HCl HCCH + 2AgCl
Данным свойством ацетиленидов пользуются при выделении ацетиленовых углеводородов из смесей с другими газами.
Применение
При горении ацетилена в кислороде температура пламени достигает 3150C, поэтому ацетилен используют для резки и сварки металлов. Кроме того, ацетилен широко используется в органическом синтезе разнообразных веществ - например, уксусной кислоты, 1,1,2,2- тетрахлорэтана и др. Он является одним из исходных веществ при производстве синтетических каучуков, поливинилхлорида и других полимеров.

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ