Химические свойства ароматических углеводородов. Полиядерные ароматические соединения
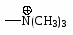
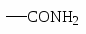
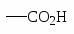
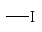
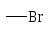

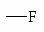
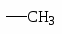

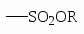

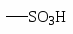
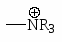
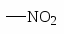

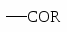
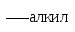
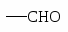

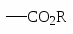
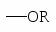
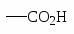

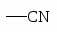
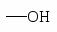
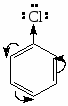

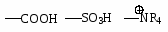
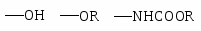

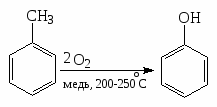
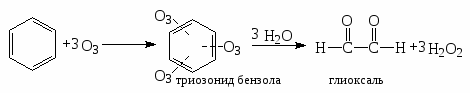
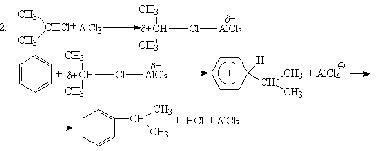
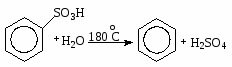
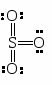
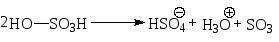
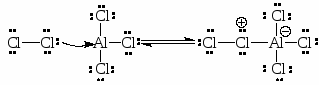

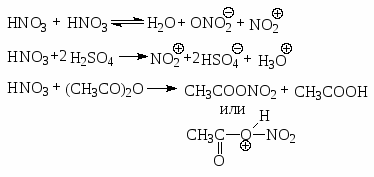
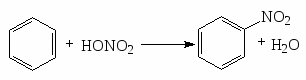
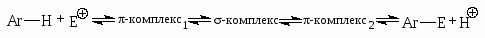
 ХИМИЧЕСКИЕ СВОЙСТВА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ. ПОЛИЯДЕРНЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
ХИМИЧЕСКИЕ СВОЙСТВА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ. ПОЛИЯДЕРНЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
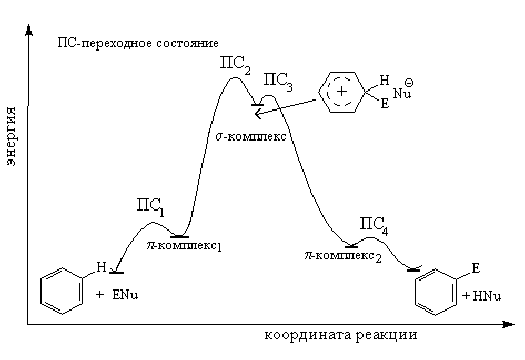
Реакции электрофильного замещения: галогенирование, нитрование, сульфирование, алкилирование, ацилирование. Механизм реакции электрофильного замещения. Понятие о - и -комплексах, их строение. Энергетическая диаграмма. Влияние заместителей на направление и скорость электрофильного замещения. Галогенирование и нитрование боковых цепей. Окисление бензола и его гомологов. Озонолиз. Реакции присоединения: гидрирование, галогенирование.
Нафталин: строение, ароматичность, номенклатура. Химические свойства: реакции электрофильного замещения (галогенирование, нитрование, сульфирование, ацилирование); реакции присоединения, гидрирование, галогенирования. Окисление. - и -Нафтолы и нафтиламины. Бифенил, трифенилметан. Понятие об устойчивых радикалах.
ХИМИЧЕСКИЕ СВОЙСТВА
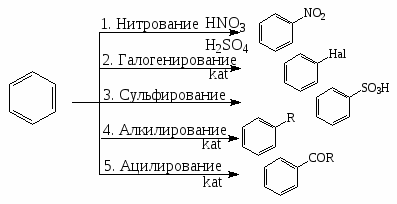
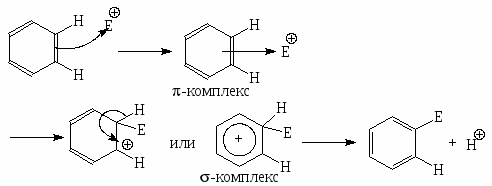
В силу строения бензольного кольца для ароматических соединений ряда бензола характерны реакции электрофильного замещения.
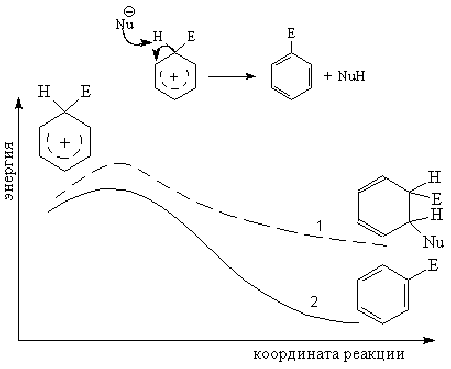
Конкуренция между присоединением нуклеофильной частицы и отрывом протона в реакции бензониевого иона.
реакция 1 не происходит;
реакция 2 происходит:
В -комплексе -электронная система бензола выступает как донор электронов, а электрофильный агент действует как акцептор электронов. Однако образование и диссоциация -комплекса происходят очень быстро, и образование -комплекса в большинстве случаев не оказывает существенного влияния ни на скорость реакции, ни на природу подавляющего большинства образующихся соединений.
Бензол вступает в следующие реакции:
Нитрование.
Нитрующие агенты HNO3, HNO3/H2SO4, HNO3 и CH3COOH, HNO3/(СН3СО)2О, NO2BF4 и др.
Природа нитрующих агентов:
Условия, температура, концентрация.
Галогенирование.
Одним из наиболее часто используемых катализаторов является безводный хлорид алюминия. Функция катализатора состоит в связывании с галогеном.
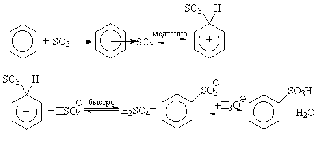
Сульфирование.
Для сульфирования часто применяется серная кислота, содержащая избыток SO3.
кислотно-основное равновесие между двумя молекулами серной кислоты.
Хотя серный ангидрид не несет положительного заряда, но он обладает дефицитом электронов, и, следовательно, является кислотой.
Поскольку бензолсульфокислота - сильная кислота, то она сильно диссоциирует. Реакция сульфирования - обратимая. При взаимодействии бензолсульфокислоты с перегретым паром при 1800 С образуется бензол.
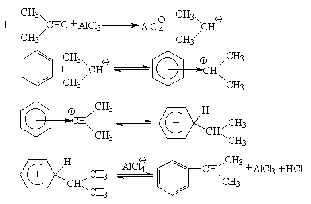
Алкилирование по Фриделю-Крафтсу.
Принято два возможных механизма реакции:
Во втором случае можно предполагать, что электрофилом служит алкильная группа полырного комплекса AlCl3 с алкилгалогенидом.
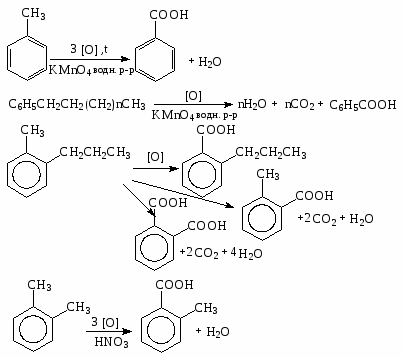
Реакции окисления.
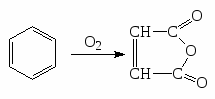
1). Бензольное кольцо в обычных условиях окисляется с трудом. При действии кислорода воздуха на бензол в присутствии V2O5 (пятиокись ваннадия) при температуре 4000С получается малеиновый ангидрид.
2). Окисление алкилпроизводных бензола идет с образованием карбоксилсодержащих бензольных производных:
3). Озонирование.
4). Каталитическое окисление О2 в присутствии медного катализатора.
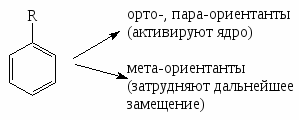
Правила ориентации в бензольном кольце
Введение заместителя в молекулу бензола требует ответа на два вопроса:
Какое влияние оказывает заместитель на скорость реакции - затрудняет или ускоряет?
Куда он направляет электрофильную частицу Е+, в какое положение?
Эти вопросы связаны с перераспределением электронной плотности в бензольном кольце (I-эффект и С-эффект).
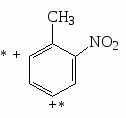
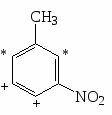
Примеры нитрования бензола, нитробензола, толуола.
Рассмотрим два типа заместителей:
+ I-эффект
, -гиперконъюгация
сверхсопряжение + С
- I-эффект
- С
Донор (увеличение электр. плотности)
активизирует
Акцептор (уменьшение электр. плотности)
деактивизирует
Ряд активности:
NH2 OH OR Cl I Br CH3; COOH SO3H NO2.
Ориентация:
Особенности влияния галогенов.
Галогены являются о-,п-ориентантами, но в то же время дезактивируют кольцо.
Влияние заместителей в ядре на электрофильное замещение.
орто-, пара- Ориентанты
мета-Ориентанты
Активирующие
Дезактивирующий
Дезактивирующие
Хотя заместители и подразделяются для удобства на 2 класса - о-, п- и м-ориентанты, однако практически существует очень мало реакций, в которых образовались бы только о-, п- или м-замещенные. Большинство реакций приводит к получению всех трех изомеров, а ориентирующее влияние сказывается просто в том, какой из них образуется в избытке.
В приведенной таблице показано, что большинство заместителей о-, п-направляющих больше дают продуктов пара-замещенных, чем орто, несмотря на то, что орто-положений два. Причиной тому служат стерические факторы.
Распределение изомеров при нитровании производных бензола.
R
Распределение продуктов, %
орто
пара
мета
58
38
4
12
88
-
30
70
-
37
62
1
38
60
2
19
1
80
27
3
70
-
11
89
Электрофильное замещение в дизамещенных бензолах
При наличии двух заместителей, действующих несогласованно, разного типа место вступления заместителя определяет активирующий (электронодонорный) заместитель.
Если оба ориентанта одного типа, то место вступления определяет более сильный, а если заместители не очень отличаются по силе, то образуются смеси продуктов.
Ориентация в дизамещенных может быть и согласованной:

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ