Исследование пожароопасных свойств метилового спирта
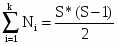
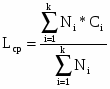
МЧС России
Санкт-Петербургский университет
Государственной противопожарной службы
Кафедра физико-химических основ процессов горения и тушения
КУРСОВАЯ РАБОТА
Тема: «Исследование пожароопасных свойств метилового спирта»
Выполнил:
Проверил:
заместитель начальника кафедры
капитан внутренней службы
Мельник Антон Анатольевич
.
Дата сдачи на проверку: «___»_________200__г.
Дата защиты: «___» ________ 200__ г.
Оценка________________
_____________________________
(подпись научного руководителя)
Санкт-Петербург 2007
МЧС России
Санкт-Петербургский университет
Государственной противопожарной службы
Кафедра физико-химических основ процессов горения и тушения
-
УТВЕРЖДАЮ
Научный руководитель
_____________________________________
(ученая степень, ученое звание, специальное звание)
_____________________________________
(подпись) (инициалы, фамилия)
«____»___________________200__г.
ПЛАН-ГРАФИК
выполнения курсовой работы
Тема_________________________________________________________
_____________________________________________________________
Курсант (слушатель, студент) ___________________________________
(Ф.И.О., факультет, курс, № группы)
_______________________________________________________________________
Разделы, подразделы
и их содержание
Срок
выполнения
Отметка научного руководителя о выполнении
1 часть
10.02.2007г.
2 часть
01.03.2007г.
3 часть
20.03.2007г.
4,5 часть
10.04.2007г.
Сдача на проверку
30.04.2007г.
Подпись курсанта (слушателя, студента) ___________________
СОДЕРЖАНИЕ:
Сводная таблица …………………………………………………………………………….55
Метиловый спирт ICSC: 0113
метанол
древесный спирт
CAS № 78-83-1 CH4O
RTECS № NP9625000 Молекулярная масса: 32.04
ООН № 1212
ЕС № 603-004-00-6
ВИДЫ ОПАСНОСТИ / ВОЗДЕЙСТВИЯ ОСТРАЯ ОПАСНОСТЬ / СИМПТОМЫ ПРЕДУПРЕЖДЕНИЕ ПЕРВАЯ ПОМОЩЬ / ЛИКВИДАЦИЯ ПОЖАРА
ПОЖАРНАЯ ОПАСНОСТЬ Огнеопасно.
НЕ ДОПУСКАТЬ открытого огня, искр и курения.
Средства тушения преимущественно порошки ПСБ и ПФA, с пеной ПО-1, порошком, форэтон, пеной, спиртоустойчивой пеной, порошком, двуокисью углерода,
ВЗРЫВООПАСНОСТЬ
При температуре выше 28°C могут образоваться взрывоопасныe смеси пар/воздух.
При температуре выше 28°C применять закрытую систему, вентиляцию, защищенное от взрыва электрооборудование.
В случае пожара: сохранять бочки и пр. охлажденными, обливая их водой.
ВОЗДЕЙСТВИЕ
Сильный, преим. нервный и сосудистый яд с резко выраженным кумулятивным действием; отравление наступает при приеме внутрь (смертельная доза для человека 30 г, а 5-10 г могут вызвать тяжелое отравление), вдыхании паров и проникновении через кожу. ПДК 5мг/м³
Обратиться за медицинской помощью.
ЛИКВИДАЦИЯ УТЕЧЕК . УПАКОВКА И МАРКИРОВКА.
Собрать подтекающую жидкость в герметичные контейнеры. Засыпать оставшуюся жидкость песком или инертным абсорбентом, собрать и удалить его в безопасное место.
Символ: Xn
R: 10-20
S: (2-)16
Примечание: C
Классификация ООН
Класс опасности ООН: 3
Группа упаковки ООН: III
ПЕРВАЯ ПОМОЩЬ ХРАНЕНИЕ
Карта Транспортной Безопасности: TEC (R)-583 Код NFPA: H1; F3; R0;
Защищенным от огня. Отдельно от сильных окислителей,
МЕТАНОЛ ICSC: 0113
ВАЖНЫЕ ДАННЫЕ
ФИЗИЧЕСКОЕ СОСТОЯНИЕ, ВНЕШНИЙ ВИД:
БЕСЦВЕТНАЯ ЖИДКОСТЬ С ХАРАКТЕРНЫМ ЗАПАХОМ.
Пар тяжелее воздуха и может стелиться по земле; возможно возгорание на расстоянии. Пар хорошо смешивается с воздухом, легко образует взрывчатые смеси.
ХИМИЧЕСКАЯ ОПАСНОСТЬ:
Реагирует с сильными окислителями, такими как триоксид хрома с опасностью пожара.
НОРМАТИВЫ ДЛЯ РАБОЧЕЙ ЗОНЫ:
TLV (предельная пороговая концентрация, США): 50 ppm; 152 мг/м^3 (как TWA - среднесменная концентрация, США) (ACGIH 1994-1995). MAС (максимальная допустимая концентрация, США): 100 ppm; 300 мг/м^3; (1994)
ПУТИ ПОСТУПЛЕНИЯ:
Вещество может всасываться в организм при вдыхании паров, через кожу и через рот.
РИСК ПРИ ВДЫХАНИИ:
Опасное загрязнение воздуха будет достигаться довольно медленно при испарении этого вещества при 20°C.
ФИЗИЧЕСКИЕ СВОЙСТВА:
Температура кипения: 64.9°C
Температура плавления: -93.9°C
Относительная плотность (вода = 1): 0.786
Давление паров, кПа при 20°C: 0.13
Теплота образования: - 201.3 кДж/моль
Относительная плотность пара (воздух = 1): 1.1
Температура вспышки: 6°C c.c.
Температура самовоспламенения: 470°C
2. Определение характеристик горения.
2.1. Характер свечения пламени.
метилового спирта –СН4О.
Характер свечения пламени при горении веществ зависит от процентного содержания элементов в веществе, главным образом, углерода, водорода, кислорода и азота.
Свечение пламени связано с наличием несгоревших раскаленных твердых частиц углерода С, а также трехатомных молекул.
Если в горючем веществе при термическом разложении углерод не образуется, то вещество горит бесцветным пламенем как, например, в случае горения водорода Н2.
При термическом разложении веществ с массовой долей углерода менее 50 % и содержащих в своем составе кислород (более 30 %) несгоревших частиц углерода образуется очень мало, и в момент образования они успевают окислиться до СО.
СН3ОН  СО + 2Н2
СО + 2Н2
Такие вещества имеют голубоватые пламена (пламя угарного газа СО, метанола СН3ОН и этанола С2Н5ОН).
При горении веществ, содержащих более 75 % углерода (ацетилен С2Н2, бензол С6Н6), в зоне горения образуется настолько много частиц С, что поступающего путем диффузии воздуха не хватает для полного окисления всего углерода.
С6Н6  6С + 3Н2
6С + 3Н2
Не окислившийся в пламени углерод выделяется в виде копоти, и пламя при горении таких веществ будет ярким и коптящим.
Если кислород в веществе отсутствует или его содержание не превышает 30 %, но, в свою очередь, и массовая доля углерода не очень велика (менее 75 %), то при термическом разложении будет выделяться значительное количество частиц углерода, но при нормальном доступе воздуха в зону горения они успевают окислиться до СО2.
Возможная реакция при термическом разложении ацетона :
СН3СОСН3 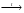 СО + 2С + 3Н2.
СО + 2С + 3Н2.
В подобных случаях пламя будет яркое, но не коптящее.
Массовые доли углерода и кислорода в молекуле изобутилового спирта составляют:
(С) = 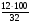 = 37.5%; (Н) =
= 37.5%; (Н) = 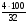 = 12.5%; (О) =
= 12.5%; (О) = 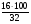 = 50%;
= 50%;
Массовая доля углерода < 75 %, а массовая доля кислорода > 30 %, следовательно, при горении метилового спирта пламя будет бесцветное или голубоватое.
2.2. Теоретический и практический расход воздуха на горение.
Расчет объема воздуха, необходимого для горения, предполагает вычисление:
а) теоретического объема воздуха Vвтеор и б) практического объема воздуха Vвпр, затраченного на горение (с учетом коэффициента избытка воздуха).
Стехиометрическое количество воздуха в уравнении реакции горения предполагает, что при данном соотношении компонентов, участвующих в реакции горения, воздух расходуется полностью. Объем воздуха в данном случае называется теоретическим (Vвтеор).
Горение может происходить не только при стехиометрическом соотношении компонентов, но и при значительном отклонении от него. Как правило, в условиях пожара на сгорание вещества воздуха затрачивается больше, чем определяется теоретическим расчетом. Избыточный воздух Vв в реакции горения не расходуется и удаляется из зоны реакции вместе с продуктами горения. Таким образом, практический объем воздуха равен:
Vвпр = Vвтеор + Vв
и, следовательно, избыток воздуха будет равен:
Vв= Vвпр - Vвтеор
Обычно в расчетах избыток воздуха при горении учитывается с помощью коэффициента избытка воздуха (). Коэффициент избытка воздуха показывает, во сколько раз в зону горения поступило воздуха больше, чем это теоретически необходимо для полного сгорания вещества:
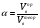
Для горючих смесей стехиометрического состава (т.е. состава, соответствующего уравнению реакции горения) коэффициент избытка воздуха = 1, при этом реальный расход воздуха равен теоретическому. В этом случае обеспечивается оптимальный режим горения.
При > 1 горючую смесь называют бедной по горючему компоненту, а при < 1 – богатой по горючему компоненту.
Избыток воздуха имеется только в смеси, бедной по горючему компоненту. Из формул (3.2) и (3.3) следует
Vв= Vвтеор( 1)
В закрытом объеме диффузионное горение большинства горючих материалов возможно только до определенной пороговой концентрации кислорода, так называемой остаточной концентрации кислорода в продуктах горения (О2)ПГ. Для большинства органических веществ она составляет 12 – 16 % О2. Для некоторых веществ, например, ацетилена С2Н2, ряда металлов, горение возможно и при значительно меньшем содержании кислорода (до 5 % объемных О2).
Зная содержание кислорода в продуктах горения, можно определить коэффициент избытка воздуха (коэффициент участия воздуха в горении) на реальном пожаре:
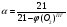
Расчет выполняется двумя способами: по уравнению химической реакции и по элементному составу вещества:
способ
Записываем уравнение реакции горения изобутилового спирта:
СН4О + 1.5 (О2 + 3,76·N2) → СО2 + 2Н2О + 1.5·3,76·N2
По условию масса изобутилового спирта равна 1 кг., условия нормальные, тогда:
m=1кг. Vв. теор.-Х
С4Н10О + 6 (О2 + 3,76·N2) → 4СО2 + 5Н2О + 6·3,76·N2
М=32кг/кмоль 1.5·4,76·Vm
Vвтеор = 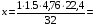 5 м3.
5 м3.
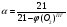 =
=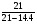 =3,2
=3,2
φ(О2)ПГ=14,4 %
Vвпр = Vвтеор =5*3.2 = 16 м3.
Vв= Vвтеор( 1)=5·(3,2-1)=11 м3.
способ
Процентный элемент состава изобутилового спирта:
(С) = 37.5%; (Н) = 12,5%; (О) = 50%;
Найдем объем воздуха на горение по формуле для изобутилового спирта с известным процентным составом, тогда:
Vвтеор = 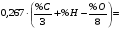
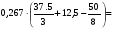
= 5м3.
Vвпр = Vвтеор =5·3,2 = 16м3.
Vв= Vвтеор( 1)=5·(3,2-1)=11м3.
Ответ: практический объем воздуха равен 16 м3, а теоретический
объем воздуха равен 5 м3 при коэффициенте избытка воздуха
равном 3,2.
2.3. Объём и состав продуктов полного сгорания.
Состав продуктов горения зависит от химической природы горючего материала и условий его горения. Практически всегда органические вещества горят с образованием продуктов полного и неполного горения.
К продуктам полного сгорания относятся: углекислый газ, образующийся при горении углерода, разложении карбонатов; водяной пар, образующийся при горении водорода и испарении влаги в исходном веществе; оксид серы (IV) SO2 и азот – продукты горения соединений, содержащих серу и азот.
Продукты неполного сгорания – это оксид углерода (II) – угарный газ СО, сажа С, продукты термоокислительного разложения – смолы.
Неорганические вещества сгорают, как правило, до соответствующих оксидов.
Выход продуктов горения количественно установить невозможно из-за чрезвычайной сложности их состава, поэтому материальный баланс процесса горения рассчитывается из предположения, что вещество сгорает полностью до конечных продуктов. При этом в состав продуктов горения включают также азот воздуха, израсходованного на горение, и избыток воздуха при > 1.
Как и в случае расчета объема воздуха, необходимого для горения, свои особенности имеет расчет продуктов горения для индивидуальных веществ, смеси газов и веществ с известным элементным составом.
m=1кг. Х1 Х2 Х3
СН4О + 1.5 (О2 + 3,76·N2) → СО2 + 2Н2О + 1.5·3,76·N2
М=74,12кг/кмоль Vm 2·Vm 1.5·3.76·Vm
VПГ = 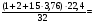 6 м3.
6 м3.
Избыток воздуха определим по формуле (3.4):
Vв= Vвтеор( 1)=8,63·(3,5-1)=21,6м3.
С учетом избытка воздуха практический объем продуктов горения составит:
VПГ* = VПГ + Vв = 6 + 11 = 17 м3.
По уравнению реакции определяем объем СО2, Н2О и N2.
V(СО2) = х2 = 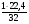 = 0.7 м3
= 0.7 м3
V(Н2О) = х3 = 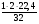 = 1,4 м3
= 1,4 м3
V(N2) = х4 = 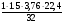 =3.95 м3
=3.95 м3
Vв=11м3 (рассчитано).
Объемная концентрация каждого компонента смеси рассчитывается следующим образом:
об (СО2) = 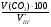 =
= 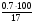 = 4.1 %
= 4.1 %
об (Н2О) = 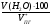 =
= 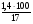 = 8.2 %
= 8.2 %
об (N2) = 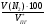 =
= 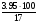 =23.2 %
=23.2 %
об (О2) = 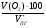 =
= 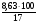 =50.8 %
=50.8 %
об (Vв) = 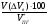 =
= 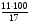 = 64.7%
= 64.7%
Проверка:
∑φоб. = 100 % ± 1 %. 4.1+8.2+23.2+64.7 = 100 %,
Ответ: теоретический объем продуктов горения составил 6 м3,а практический объем продуктов горения- 17 м3. В процентном составе СО2- 4.1 %, Н2О- 8.2%, N2- 23.2%, Vв – 64.7%
2.4. Низшая теплота горения.
Энтальпией горения (Нгор, кДж/моль) вещества называется тепловой эффект реакции окисления 1 моль горючего вещества с образованием высших оксидов.
Теплота горения (Qгор) численно равна энтальпии горения, но противоположна по знаку.
В пожарно-технических расчетах часто пользуются понятием удельной теплоты горения. Удельная теплота горения – это количество теплоты, которое выделяется при полном сгорании единицы массы или объема горючего вещества. Размерность удельной теплоты горения – кДж/кг или кДж/м3.
В зависимости от агрегатного состояния воды в продуктах горения различают низшую и высшую теплоту горения. Если вода находится в парообразном состоянии, то теплоту горения называют низшей теплотой горения Qн. Если пары воды конденсируются в жидкость, то теплота горения – высшая Qв.
Температура пламени достигает 100 К и выше, а вода кипит при 373 К, поэтому в продуктах горения на пожаре вода всегда находится в парообразном состоянии, и для расчетов в пожарном деле используется низшая теплота горения Qн.
Низшая теплота горения индивидуальных веществ может быть определена переводом значения Нгор, кДж/моль в Qн, кДж/кг или кДж/м3. Для веществ сложного элементного состава низшая теплота горения может быть определена по формуле Д.И. Менделеева.
QН = 339,4(C) + 1257(H) 108,9 [((O) +(N)) (S)] 25,1[9(H) +(W)], кДж/кг,
где
(С), (Н), (S), (О), (N) – – массовые доли элементов в веществе, %; (W) – содержание влаги в веществе, %.
Для нашего вещества:
(С) = 37.5%; (Н) = 12,5%; (О) = 50%; тогда:
QН = 339,437.5 + 125712,5 108,95025,1[912,5+ 0] =
= 23025 кДж/кг.
Ответ: низшая теплота горения СН4О равна 23025 кДж/кг
2.5 Стехиометрическая концентрация паров в смеси.
Стехиометрическая концентрация паров в смеси рассчитывается по следующим формулам:
Объемная концентрация:
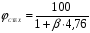 %.
%.
Массовая канцентрация:
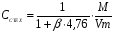 кг/м3.
кг/м3.
Подставим наши данные:
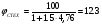 %.
%.
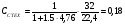 кг/м3=180 г/м3.
кг/м3=180 г/м3.
Ответ: стехиометрическая концентрация в паровоздушной смеси
метилового спирта равна 12.3% (объемная) и 0,18 кг/м3 (массовая)- это является опасной концентрацией
2.6 Температура горения адиабатическая.
Алгоритм расчета температуры горения
1. Рассчитать суммарный объем продуктов горения и отдельно объем каждого компонента продуктов горения.
VПГпр = V(CO2) + V(H2O) + V(N2) + V(SO2) + Vвозд
Расчет объема продуктов горения выполняется в зависимости от характера горючего вещества (индивидуальное вещество, смесь газов или вещество сложного элементного состава).
Для индивидуальных веществ можно также определять количество продуктов горения в молях (коэффициенты в уравнении реакции горения).
2. Рассчитать низшую теплоту сгорания вещества.
Для индивидуальных веществ расчет выполняется по I следствию закона Гесса (при наличии табличных значений энтальпий образования).
По формуле Д.И. Менделеева расчет Qн может быть выполнен как для веществ с известным элементным составом, так и для индивидуальных веществ.
3. Если по условию задачи есть теплопотери (), то рассчитывается количество тепла, пошедшего на нагрев продуктов горения QПГ
QПГ = Qн (1 – ), кДж/кг или кДж/м3
4. Находим среднее теплосодержание продуктов горения Qср
при отсутствии теплопотерь ()
Qср = 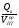 , кДж/м3
, кДж/м3
при наличии теплопотерь
Qср = 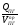 , кДж/м3
, кДж/м3
5. По значению Qср с помощью таблиц приложений 3 и 4 (“Теплосодержание газов при постоянном давлении”), ориентируясь на азот , приближенно определяем температуру горения Т1.
При подборе температуры горения ориентируются на азот, т.к. в большей степени продукты горения состоят именно из азота. Однако, поскольку теплосодержание углекислого газа и паров воды выше, чем у азота, то их присутствие в продуктах горения несколько понижает температуру горения, поэтому ее нужно принимать несколько ниже (на 100-2000С), чем по азоту.
6. Рассчитываем теплосодержание продуктов горения при выбранной температуре Т1:
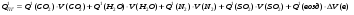
где
Q1(CO2), Q1(H2O), Q1(N2), Q1(SO2), Q1(возд) – табличные значения теплосодержания газов
при выбранной температуре Т1.
7. Сравниваем Q1ПГ с Qн или QПГ, рассчитанных по п.2 или п.3.
Если Q1ПГ < Qн (QПГ), то выбираем температуру Т2 > Т1 на 1000С;
если Q1ПГ > Qн (QПГ), то выбираем температуру Т2 < Т1 на 1000С .
8. Повторяем расчет теплосодержания продуктов горения при новой температуре Т2:
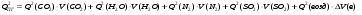
9. Расчет проводим до получения неравенства:
Q1ПГ < Qн (QПГ) < Q2ПГ , где
Q1ПГ и Q2ПГ – теплосодержание продуктов горения при температурах Т1 и Т2,
отличающихся на 1000С.
10. Интерполяцией определяем температуру горения ТГ:
ТГ = Т1 + 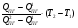
Если потери тепла не учитывались, то получаем адиабатическую температуру горения, а если учитывались, то действительную температуру горения вещества.
Для метилового спирта:
СН4О + 1.5 (О2 + 3,76·N2) → СО2 + 2Н2О + 6·3,76·N2
nвозд=1.5·4,76=7.14 моль
2. nвозд=7.14·(1-1)=0 моль
3. VПГпр =6+ 0=6 м3/кг.
теплопотерь нет
4. Qср = 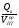 =
=  = 3838 Дж/моль
= 3838 Дж/моль
5. Т1 принимаем равную 25000 С.
6. Q1пг = 6209,6·0,7 + 5136,5·1,4+ 3797,4·3,95 = =26537,53Дж.
7. Q1ПГ < QПГ, выбираем температуру Т2 >Т1 на 1000С;
Т2 = 24000 С.
8. Q2пг = 5933·0,7 + 4890,9·1.4 + 3633,1·3,95 =
=25350 кДж.
9. Q3пг = 5660,7·0,7 + 4667,1·1.4 + 3469,3·3,95 =
=24200 кДж.
10. Q4пг = 5392,5·0,7 + 4405,8 ·1.4 + 3306,3·3,95 =
=23020 кДж.
11. Q4ПГ < QПГ < Q3ПГ
10. ТГ=Т1+ 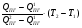 = 2000 + +
= 2000 + +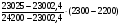 = 2202К.
= 2202К.
Ответ: температура горения метилового спирта равна =2202К.
3. Определение показателей пожарной опасности.
Температура вспышки - наименьшая температура конденсированного вещества, при которой в условиях специальных испытаний над его поверхностью образуются пары, способные вспыхивать в воздухе от источника зажигания; устойчивое горение при этом не возникает.
Вспышка - быстрое сгорание газо- , паровоздушной смеси над поверхностью горючего вещества, сопровождающееся кратковременным видимым свечением.
Значение температуры вспышки следует применять для характеристики пожарной опасности жидкости, включая эти данные в стандарты и технические условия на вещества; при определении категории помещений по взрывопожарной и пожарной опасности в соответствии с требованиями норм технологического проектирования, при разработке мероприятий по обеспечению пожарной безопасности и взрывобезопасности в соответствии с требованиями ГОСТ 12.1.004 и ГОСТ 12.1.010.
1-й способ.
tвсп = tкип - 18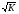
К – коэффициент горючести.
К = 4 n(C) + 4 n(S) + n(H) + n(N) – 2 n(O) – 2 n(Cl) – 3 n(F) – 5 n(Br),
где:
n(C), n(S), n(H), n(N), n(O), 2 n(Cl), n(F), n(Br) – число атомов углерода, серы, водорода, азота, кислорода, хлора, фтора и брома в молекуле вещества.
Для изобутилового спирта:
К = 4·1 + 1·4 - 2 = 6, тогда:
tвсп = 64.9 - 18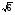 = 20.80 С.
= 20.80 С.
2-й способ.
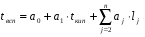 , оС.
, оС.
где а0 - размерный коэффициент, равный минус 73,14 °С;
а1 -. безразмерный коэффициент, равный 0,659;
tкип- температура кипения исследуемой жидкости, °С;
аj - эмпирические коэффициенты, приведённые в табл. 9.3. в зависимости от связей в структурной формуле вещества;
lj - количество связей вида j в молекуле исследуемой жидкости.
Структурная формула метилового спирта:
Н
|
Н─ С─OH
|
H
tвсп =- 73,14 + 0,659·64.9 + (1.105·3+2,47+23,9) = -0.70 С.
Ответ: температура вспышки метилового спирта равна по 1-му способу 20.8 0С , по 2-му способу -0.7 0С.
(ГОСТ-12.1.044-89 приложение 2)
3.2. Температура воспламенения.
Температура воспламенения
Температура воспламенения - наименьшая температура вещества, при которой в условиях специальных испытаний вещество выделяет горючие пары и газы с такой скоростью, что при воздействии на них источника зажигания наблюдается воспламенение.
Воспламенение - пламенное горение вещества, инициированное источником зажигания и продолжающееся после его удаления.
Значение температуры воспламенения следует применять при определении группы горючести вещества, оценке пожарной опасности оборудования и технологических процессов, связанных с переработкой горючих веществ, при разработке мероприятий по обеспечению пожарной безопасности в соответствии с требованиями ГОСТ 12.1.004 и ГОСТ 12.1.010, а также необходимо включать в стандарты и технические условия на жидкости.
Температура воспламенения жидкости рассчитывается по той же формуле что и температура вспышки, но со своими коэффициентами:
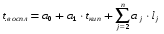 , оС,
, оС,
где:
а0 = - 47,78 С;
а1 = 0,882;
tкип - температура кипения жидкости, С;
аj - коэффициент j-той химической связи, приведены в табл. 9.5
lj - число химических связей вида j в молекуле жидкоcти
tвосп = -47,78 + 0,882·64.9 + ( – 2,118·3-0,111+8,216) = 11.20 С.
Ответ: температура воспламенения метилового спирта равна 11.2ОС
ГОСТ 12.1.044-89 приложение 3
3.3 Температура самовоспламенения.
Температура самовоспламенения - наименьшая температура окружающей среды, при которой в условиях специальных испытаний наблюдается самовоспламенение вещества.
Самовоспламенение - резкое увеличение скорости экзотермических объемных реакций, сопровождающееся пламенным горением и/или взрывом.
Значение температуры самовоспламенения следует применять при определении группы взрывоопасной смеси по ГОСТ 12.1.011 для выбора типа взрывозащищенного электрооборудования, при разработке мероприятий по обеспечению пожаровзрывобезопасности технологических процессов в соответствии с требованиями ГОСТ. 12.1.004 и ГОСТ 12.1.010, а также необходимо включать в стандарты или технические условия на вещества и материалы.
Расчетные формулы:
где Ci-длина i-той углеродной цепи в молекуле,
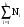 - число цепей.
- число цепей.
где S - число концевых групп в молекуле( -СН3, -С6Н5 и т.д.)
Для спиртов алифатического ряда концевой считается и гидроксильная группа -ОН. Из общего числа цепей последовательно выбирают цепи с одинаковым числом углеродных атомов, причем для ароматических соединений атомы углерода ароматического ядра в расчет не включаются. Для спиртов расчетная длина цепи, содержащая гидроксильную группу, увеличивается на единицу по сравнению с фактической углеродной цепью. Для ароматических соединений длина цепи, содержащая арильный радикал, уменьшается на единицу по сравнению фактической длиной.
Lср = 4, по таблице определяем температуру самовоспламенения – 695 К или – 4220 С.
Однако этот расчет можно применить к определенному классу веществ, поэтому температуру самовоспламенения в основном определяют по справочным данным. tсмв = 440 0 С.
Ответ: температура самовоспламенения по данным справочника Баратова Тсмв=440 ОС
(Справочник Баратова)
3.4. Концентрационные пределы распространения пламени.
Нижний (верхний) концентрационный предел распространения пламени - минимальное (максимальное) содержание горючего вещества в однородной смеси с окислительной средой, при котором возможно распространение пламени по смеси на любое расстояние от источника зажигания.
Значения концентрационных пределов распространения пламени необходимо включать в стандарты или технические условия на газы, легковоспламеняющиеся индивидуальные жидкости и азеотропные смеси жидкостей, на твердые вещества, способные образовывать взрывоопасные пылевоздушные смеси (для пылей определяют только нижний концентрационный предел). Значения концентрационных пределов следует применять при определении категории помещений по взрывопожарной и пожарной опасности в соответствии с требованиями норм технологического проектирования; при расчете взрывобезопасных концентраций газов, паров и пылей внутри технологического оборудования и трубопроводов, при проектировании вентиляционных систем, а также при расчете предельно допустимых взрывобезопасных концентраций газов, паров и пылей в воздухе рабочей зоны с потенциальными источниками зажигания в соответствии с требованиями ГОСТ 12.1.010, при разработке мероприятий по обеспечению пожарной безопасности объекта в соответствии с требованиями ГОСТ 12.1.004.
φн = 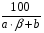 =
= 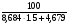 = 5,64 %.
= 5,64 %.
φв = 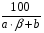 =
= 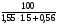 = 34,5 %.
= 34,5 %.
Для расчета массовой концентрации:
Сн = 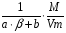 =
= 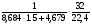 = 0,08 кг/м3.
= 0,08 кг/м3.
Св = 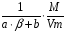 =
= 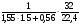 = 0,5кг/м3.
= 0,5кг/м3.
Ответ: область распространение пламени для метилового спирта: 5,64-34.5% (об.), 0,08-0,5 кг/м3 (масс.).
(ГОСТ 12.1.044-89 приложение 4)
3.5. Температурные пределы распространения пламени.
Температурные пределы распространения пламени - такие температуры вещества, при которых его насыщенный пар образует в окислительной среде концентрации, равные соответственно нижнему (нижний температурный предел) и верхнему (верхний температурный предел) концентрационным пределам распространения пламени.
Значения температурных пределов распространения пламени следует применять при разработке мероприятий по обеспечению пожаровзрывобезопасности объекта в соответствии с требованиями ГОСТ 12.1.004 и ГОСТ 12.1.010; при расчете пожаровзрывобезопасных температурных режимов работы технологического оборудования; при оценке аварийных ситуаций, связанных с разливом горючих жидкостей, для расчета концентрационных пределов распространения пламени, а также необходимо включать в стандарты или технические условия на горючие жидкости.
Температурные пределы Тн и Тв связаны с КПР пламени зависимостью:
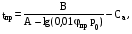
где пр - нижний или верхний КПР, %;
Р0 - атмосферное давление, кПа;
А, В, Са - константы уравнения Антуана для давления насыщенных паров,(Справочник Баратова).
А=7,3522
В=1660,454.
С=245,818.
Тогда:
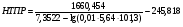 = 6,06 0С.
= 6,06 0С.
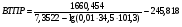 =39.890 С.
=39.890 С.
Если неизвестна зависимость давления насыщенного пара от температуры, то для веществ, состоящих из атомов С, Н, О, N значение нижнего или верхнего температурного предела (tп) вычисляют по формуле
tп = а0 + а1tкип + 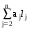
где а0 — размерный коэффициент, равный минус 62,46°С для нижнего и минус 41,43°С для верхнего пределов;
а1 — безразмерный коэффициент, равный 0,655 для нижнего и 0,723 для верхнего пределов;
aj — эмпирические коэффициенты, характеризующие вклад j-х структурных групп.
НТПР = -62,46 + 0,655·107,8 + ( – 0,009·3+0,11+19,75) = 25,20 С.
ВТПР = -41,43 + 0,723·107,8 + ( 0,570·3+1,267+17,8) = 56,10 С.
Ответ: температурные пределы распространения пламени для метилового спирта равны tн=0,3ОС и tв=26,3 ОС.
(ГОСТ12.1.044 приложение 6)
3.6. Нормальная скорость распространения пламени паровоздушной смеси (максимальная нормальная скорость горения).
Нормальная скорость распространения пламени - скорость перемещения фронта пламени относительно несгоревшего газа в направлении, перпендикулярном к его поверхности.
Значение нормальной скорости распространения пламени следует применять в расчетах скорости нарастания давления взрыва газо- и паровоздушных смесей в закрытом, негерметичном оборудовании и помещениях, критического (гасящего) диаметра при разработке и создании огнепреградителей, площади легкосбрасываемых конструкций, предохранительных мембран и других разгерметизирующих устройств; при разработке мероприятий по обеспечению пожаровзрывобезопасности технологических процессов в соответствии с требованиями ГОСТ 12.1.004 и ГОСТ 12.1.010.
Максимальная нормальная скорость горения – максимальная линейная скорость распространения фронта пламени в газовых смесях, определяемая в специальных условиях.
Максимальная нормальная скорость распространения пламени в настоящей работе определяется по справочной литературе и расчетом.
Максимальная скорость горения Su для органических веществ, состоящих из атомов С, Н, N, O, S и структурных групп, представленных в таблице, вычисляется по формуле:
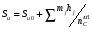
где 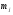 - число структурных групп j-го вида в молекуле;
- число структурных групп j-го вида в молекуле; 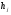 - коэффициент, соответствующий j-й структурной группе; nC – число атомов углерода в молекуле;
- коэффициент, соответствующий j-й структурной группе; nC – число атомов углерода в молекуле; 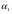 - показатель степени, равный двум; Su0 – значение нормальной скорости горения
- показатель степени, равный двум; Su0 – значение нормальной скорости горения
Для органических веществ, состоящих из атомов С, Н, N, O, и для веществ, состоящих из структурных групп, не учтенных в таблице максимальная нормальная скорость горения вычисляется по формуле:
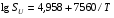
где Т – адиабатическая температура горения смеси стехиометрического состава.
Для веществ, состоящих из структурных групп, приведенных в таблице, значение Т может быть определено по формуле:
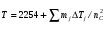 ,
,
где mj – число структурных групп j-го вида в молекуле;
Таким образом для изобутилового спирта:
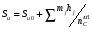 =
= 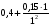 = 0,55 м/с.
= 0,55 м/с.
(ГОСТ 12.1.044-89 приложение 7).
3.7. Критический диаметр огнегасящего канала и безопасного экспериментального максимального зазора.
Расчет критического диаметра dкр длинного цилиндрического огнегасящего канала производится по формуле:
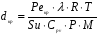
где Рекр = 72 – число Пекле; Su – нормальная скорость горения; Сpv – удельная теплоемкость, Дж/кг·К; λ – коэффициент теплопроводности исходной смеси, Вт/м·К; Т – температура, К; Р – давление, Па; R – универсальная газовая постоянная, равная 8,31 Дж/моль·К; М – молярная масса, кг/моль.
Максимальный экспериментальный безопасный зазор (БЭМЗ) рассчитывается по формуле:
БЭМЗ = dкр/3
Относительная средняя квадратическая погрешность расчета составляет 18%.
Для метилового спирта:
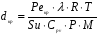
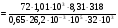 = 3.3 мм.
= 3.3 мм.
БЭМЗ = dкр/3 = 3,3/3 = 1.1 мм
3.8. Минимальная энергия зажигания.
Минимальная энергия зажигания - наименьшая энергия электрического разряда, способная воспламенить наиболее легко воспламеняющуюся смесь горючего вещества с воздухом.
Значение минимальной энергии зажигания следует применять при разработке мероприятий по обеспечению пожаровзрывобезопасных условий переработки горючих веществ и обеспечения электростатической искробезопасности технологических процессов в соответствии с требованиями ГОСТ 12.1.004, ГОСТ 12.1.010 и ГОСТ 12.1.018.
Минимальная энергия зажигания Еmin - это наименьшее значение электрического разряда, способного воспламенить наиболее легковоспламеняющуюся смесь горючего газа, пара или пыли с воздухом.
Минимальная энергия зажигания - один из показателей пожарной опасности веществ, применяется при разработке мероприятий по пожаровзрывобезопасности и электростатической искробезопасности технологических процессов с обращающимися горючими газами, жидкостями и пылями. Эти мероприятия касаются выбора взрывобезопасного электрооборудования, материалов, условий их безопасной эксплуатации и т.д.
Минимальная энергия зажигания зависит от множества различных параметров. Она определяется экспериментально.
Минимальная энергия зажигания в курсовой работе определяется по справочной литературе и расчетом.
Минимальная энергия зажигания W (Дж) рассчитывается по формуле6
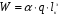 ,
,
где α= 0,5 – коэффициент пропорциональности ; q- удельное объемное количество тепла, необходимое для нагрева горючей смеси от её начальной температуры tн до температуры самовоспламенения. Дж/м3; lк – величина критического зазора, м.
Удельное объемное количество тепла, необходимое для нагрева горючей смеси от tнач до tсв, рассматривается как тепло, нужное для нагрева воздуха qг, и вычисляется (Дж) по формуле
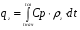 ,
,
где СР – теплоемкость воздуха, Дж/(кг град); ρг – плотность воздуха, кг/м3.
Величину qг можно вычислить по таблице 12.
При расчете критического зазора зажигания lк используется значения максимального экспериментального безопасного зазора (МЭБЗ), ГОСТ 12.1.001-78:
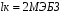
Таким образом для метилового спирта:
Еmin=0,17 мДж
Ответ: минимальная энергия зажигания равна 0,17 мДж
3.9. Способность гореть и взрываться при взаимодействии с водой, кислородом и другими веществами.
Способность взрываться и гореть при взаимодействии с водой, кислородом воздуха и другими веществами - это качественный показатель, характеризующий особую пожарную опасность некоторых веществ.
Данные о способности веществ взрываться и гореть при взаимном контакте необходимо включать в стандарты или технические условия на вещества, а также следует применять при определении категории помещений по взрывопожарной и пожарной опасности в соответствии с требованиями норм технологического проектирования; при выборе безопасных условий проведения технологических процессов и условий совместного хранения и транспортирования веществ и материалов; при выборе или назначении средств пожаротушения.
Сущность метода определения способности взрываться и гореть при взаимном контакте веществ заключается в механическом смешивании исследуемых веществ в заданной пропорции и оценке результатов испытания.
(ГОСТ 12.1.044-89 п.4.15).
3.10. Минимальная флегматизирующая концентрация флегматизатора.
Минимальная флегматизирующая концентрация флегматизатора - наименьшая концентрация флегматизатора в смеси с горючим и окислителем, при которой смесь становится неспособной к распространению пламени при любом соотношении горючего и окислителя.
Значение минимальной флегматизирующей концентрации флегматизатора следует применять при разработке мероприятий по обеспечению пожаровзрывобезопасности технологических процессов методом флегматизации в соответствии с требованиями ГОСТ 12.1.004 и ГОСТ 12.1.010.
Фгф - концентрация горючего в экстремальной точке области воспламенения, объемные проценты;
μгф – то же, но в нормальных долях, моль/моль;
φф - минимальная флегматизирующая концентрация негорючего компонента, объемные проценты;
μФ - мольная доля флегматизатора в смеси;
φкис(ф) – минимальное взрывоопасное содержание кислорода в воздухе в точке флегматизации, (объемные проценты);
Концентрация флегматизатора в экстремальной точке рассчитывается по формуле:
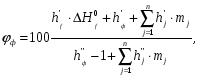
где h' и h" - параметры, зависят от рода флегматизатора, приведены в таблице 9, а ΔНf0 – энтальпия образования горючего, причём, если параметры h даны в моль/Дж. то и ΔНf0 – необходимо брать в Дж/моль; индексом mj в формуле обозначено число атомов и групп одного вида в молекуле горючего. (Справочник Баратова ).
В расчетной работе необходимо определить минимальную флегматизирующую концентрацию для водяного пара, СО2 и N2.
Разбавление азотом: mc = 1, mh = 4, mo = 1.
φф = 100·(0,800·10-5·276300 + 0,780 + (1,651·1 + 0,527·4 + 0,446·1))/2,236 – 1 + (5,000·1 + 1,250·4 - 2,500·1) =49,1%.
Разбавление водяным паром:
φф = 100·(0,735·10-5·276300 + 0,579 + (1,251·1 + 0,418·4 + 0,542·1))/2,020 – 1 + (4,642·4 + 1,160·10 - 2,321·1) = 39%.
Разбавление двуокисью углерода:
φф = 100·(0,864·10-5·276300 + 1,256 + (2,5277·1 + 0,7592·4+ 0,197·1))/2,8 – 1 + (5,964·4 + 1,486·10 - 2,973·1) = 31,8 %.
Ответ: минимальная флегматизирующая концентрация флегматизатора
равна для водяного пара- 49,1%, для углекислого газа- 39%, для
азота- 31,8%.
3.11. МВСК Минимальное взрывоопасное содержание кислорода.
Минимальное взрывоопасное содержание кислорода - такая концентрация кислорода в горючей смеси, состоящей из горючего вещества, воздуха и флегматизатора, меньше которой распространение пламени в смеси становится невозможным при любой концентрации горючего в смеси, разбавленной данным флегматизатором.
Значение минимального взрывоопасного содержания кислорода следует применять при разработке мероприятий по обеспечению пожаровзрывобезопасности технологических процессов в соответствии с требованиями ГОСТ 12.1.004 и ГОСТ 12.1.010.
Минимальное взрывоопасное содержание кислорода— такая концентрация кислорода в горючей смеси, состоящей из горючего вещества, воздуха и флегматизатора, меньше которой распространение пламени в смеси становится невозможным при любой концентрации горючего в смеси, разбавленной данным флегматизатором.
Минимальное взрывоопасное содержание кислорода (МВСК) в объемных процентах рассчитывается по формуле :
φО2 = 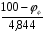 ,
,
тогда:
при разбавлении азотом:
φО2 = 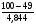 = 10,53 %.
= 10,53 %.
при разбавлении водяным паром:
φО2 = 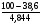 = 12,68%.
= 12,68%.
при разбавлении двуокисью углерода:
φО2 = 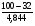 = 14,04 %.
= 14,04 %.
Ответ: минимальное взрывоопасное содержание кислорода для
водяного пара равно- 12,68%, для углекислого газа- 8,77%,
для азота- 10,53%.
3.12. Максимальное давление взрыва.
Максимальное давление взрыва - наибольшее избыточное давление, возникающее при дефлаграционном сгорании газо-, паро- или пылевоздушной смеси в замкнутом сосуде при начальном давлении смеси 101,3 кПа.
Значение максимального давления взрыва следует применять при определении категории помещений по взрывопожарной и пожарной опасности в соответствии с требованиями норм технологического проектирования, при разработке мероприятий по обеспечению пожаровзрывобезопасности технологических процессов в соответствии с требованиями ГОСТ 12.1.004 и ГОСТ 12.1.010.
Рвзр = 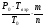 , где
, где
Р0 – начальное давление, кПа (МПа);
Т0 – начальная температура, К;
Твзр – температура взрыва, К;
m – число молей (киломолей) газообразных продуктов горения;
n – число молей (киломолей) исходных газообразных веществ.
Рвзр = 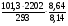 =808,07 кПа.
=808,07 кПа.
СН4О + 1,5 (О2 + 3,76·N2) → СО2 + 2Н2О + 1.5·3,76·N2
m = 1+2+1.5·3,76 = 8,64 киломоль.
n = 1 + 1,5·4,76 = 8,14 киломоль.
Твзр = 2202 К.
Ответ: максимальное давление взрыва равно 808,07 кПа.
(ГОСТ 12.1.044 приложение 11)
3.13.Вывод: проведя анализ пожарной опасности данного вещества, можно дать рекомендации по работе с ним, например, данное вещество имеет tвсп=- 0,7 0С - это вещество относится к ЛВЖ; КПР-1,04%-6,84%-пожаровзрывоопасная зона; оно опасно при взаимодействии с галогенами и с сильными окислителями.
4.1. Интенсивность испарения при заданных условиях.
1. Скорость воздушного потока – 0,37 м/с;
2. Площадь помещения –780 м2;
3. Высота помещения – 4.8 м;
4. Объем емкости ( аппарата ) – 200 литров;
5. Температура в помещении – 400 С.
Wисп=10-6·η·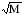 ·Рн,
·Рн,
по таблице 3 НПБ 105-03 принимаем коэффицент η=2,3.
Молярная масса изобутилового спирта равна: М = 32 кг/кмоль.
Давление насыщенного пара:
В пожарных расчетах наиболее распространенным способом определения давления насыщенного пара при заданной температуре является расчет по уравнению Антуана:
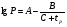
 ; Рs
; Рs  ,
,
где
Рs - давление насыщенного пара, кПа;
tР - рабочая (заданная) температура, 0С;
А, В, С - константы уравнения Антуана из справочной литературы.
А=7,3522.
В=1660,454.
С=245,818.
Рs  =
= 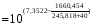 = 34,8 кПа.
= 34,8 кПа.
Тогда:
Wисп=10-6·2,3·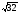 ·34,8= 453,03·10-6 кг/м2·с.
·34,8= 453,03·10-6 кг/м2·с.
Ответ: скорость испарения составила 453,03·10-6 кг/м2·с
4.2. Время образования минимальной взрывоопасной концентрации паров в помещении.
Из предыдущих расчетов известно, что минимальная взрывоопасная концентрация паров равна 0,08 кг/м3.
0,058 кг - 1 м3
mкг - 1600 м3
m = 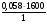 = 92,8кг - минимальная взрывоопасная концентрация для объёма равного 1600 м3.
= 92,8кг - минимальная взрывоопасная концентрация для объёма равного 1600 м3.
2.Время образования минимальной взрывоопасной концентрации выражается из формулы:
m = Wисп·Sисп·τисп.
Тогда:
τисп = 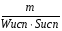 ;
;
Все данные для этого расчета у нас имеются.
τисп = 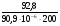 = 1865,5 сек. = 31мин.
= 1865,5 сек. = 31мин.
Ответ: в рассмотренном помещении при выбранной аварийной ситуации
минимальная среднеобъемная взрывоопасная концентрация паров
в помещении образуется через 31 минуты после аварии.
4.3. Избыточное давление взрыва газопаровоздушной смеси при выбранной аварийной ситуации.
Избыточное давление взрыва Р для индивидуальных горючих веществ (газов и паров ЛВЖ и ГЖ), состоящих из атомов С, Н, О, N, Cl, Br, I, F, определяется по формуле
Расчет избыточного давление взрыва для индивидуальных веществ производится согласно ГОСТ Р 12.3.047 – 98 и НПБ 105-03.
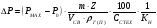 , кПа.
, кПа.
Где,
РMAX - максимальное давление взрыва стехиометрической газовоздушной и паровоздушной смесив замкнутом объеме. Определяется экспериментально или по справочным данным. При отсутствии данных допускается принимать РMAX = 900 кПа.
Р0 - начальное давление, кПа. Допускается принимать равным 101,3кПа.
m - масса горючего газа или паров ЛВЖ и ГЖ, вышедших в результате аварии в помещение.
Z - коэффициент участия горючего во взрыве. Допускается принимать значение Z по таблице.
VСВ - свободный объем помещения, м3. Свободный объем помещения определяется как разность между объемом помещения и объемом, занимаемым технологическим оборудованием.
Если свободный объем помещения определить невозможно, то его допускается принимать равным 80 % геометрического объема помещения.
VСВ = 0,8V.
Г - плотность газа или пара при расчетной температуре tРАСЧ, кг/м3,
где
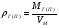 , кг/м3, а
, кг/м3, а 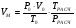 , м3/кмоль.
, м3/кмоль.
Если принять, что давление в помещении равно нормальному атмосферному давлению (101,3 кПа) то плотность газа или пара можно рассчитать по следующей формуле:
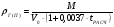 , кг/м3, где
, кг/м3, где
М - молярная масса газа или пара, кг/кмоль;
Примечание: Бывают случаи, когда рассчитанная таким образом масса паров превышает массу жидкости. Это говорит о том, что жидкость испарится полностью менее чем за час. В этом случае расчетная масса паров принимается равной массе жидкости.
V0 - молярный объем при нормальных условиях, равный 22,4 м3/кмоль.
tРАСЧ - расчетная температура, 0С.
ССТЕХ - стехиометрическая концентрация горючих газов или паров ЛВЖ и ГЖ, % (объемных). Стехиометрическая концентрация вычисляется по формуле
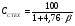 , % ,
, % ,
Где:
- стехиометрический коэффициент кислорода в уравнении реакции горения. Коэффициент также может быть рассчитан по следующей формуле:
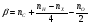 ,
,
Где:
nC, nH, nX,, nO - число атомов С, Н, О, галогенов в молекуле горючего вещества.
КН - коэффициент, учитывающий негеометричность помещения и неадиабатичность процесса горения. Допускается принимать КН = 3.
Для того, чтобы воспользоваться этой формулой необходимо рассчитать массу, стехиометрическую концентрацию и свободный объем помещения. По условию время испарения не более часа.
m = Wисп·Sисп·τисп = 453·10-6·200·3600 = 158 кг.
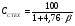 =
= 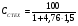 = 12,3 %.
= 12,3 %.
VСВ = 0,8VПОМЕЩ = 0,8· = 2995,2 м3.
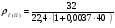 =1,25 , кг/м3,
=1,25 , кг/м3,
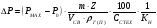 =
=
=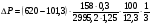 = 17,8кПа.
= 17,8кПа.
Ответ: избыточное давление взрыва газопаровоздушной смеси
равно 17,8 кПа.
4.4. Размер взрывоопасной зоны.
Метод расчета размеров зон, ограниченных НКПР газов и паров, при аварийном поступлении горючих газов и паров ненагретых легковоспламеняющихся жидкостей в помещение регламентируется ГОСТ Р 12.3.047 – 98 и НПБ 105-03.
Расстояния ХНКПР, YНКПР и ZНКПР для ГГ и ЛВЖ, ограничивающие область концентраций, превышающих НКПР, рассчитывают по формулам:
ХНКПР = 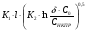 ,
,
YНКПР = 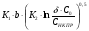 ,
,
ZНКПР = 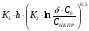 ,
,
Где:
К1 – коэффициент, принимаемый равным:
1,1314 для горючих газов и
1,1958 для легковоспламеняющихся жидкостей;
К2 – коэффициент, равный:
1 для ГГ и
Т/3600 для ЛВЖ;
Т – продолжительность поступления паров ЛВЖ, с;
К3 – коэффициент, принимаемый равным:
0,0253 для ГГ при отсутствии подвижности воздушной среды,
0,02828 для ГГ при подвижности воздушной среды,
0,04714 для ЛВЖ при отсутствии подвижности воздушной среды,
0,3536 для ЛВЖ при подвижности воздушной среды;
l – длина помещения , м;
b – ширина помещения, м;
h – высота помещения, м;
– допустимые отклонения концентраций при задаваемом уровне значимости. При уровне значимости Q = 0,05 значения будут равны:
1,27 для ЛВЖ при работающей вентиляции,
1,25 для ЛВЖ при неработающей вентиляции,
1,37 для ГГ при работающей вентиляции,
1,38 для ГГ при неработающей вентиляции;
С0 – предэкспоненциальный множитель, % (объемн.), равный:
С0 = 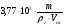
для ГГ при отсутствии подвижности воздушной среды,
С0 = 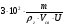
для ГГ при подвижности воздушной среды,
U – подвижность воздушной среды, м/с;
С0 = 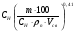
для ЛВЖ при отсутствии подвижности воздушной среды,
С0 = 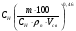
для ЛВЖ при подвижности воздушной среды;
СН – концентрация насыщенных паров при расчетной температуре, кПа.
СН может быть рассчитана по формуле:
СН =  ,
,
Где:
РН – давление насыщенных паров при расчетной температуре, кПа;
Р0 – атмосферной давление, равное 101, 3 кПа;
п – плотность паров, кг/м3.
Плотность паров п рассчитывается по формуле:
п = М/Vм, кг/м3.
При отрицательных значениях логарифмов расстояния ХНКПР, YНКПР и ZНКПР принимают равным 0.
Во всех случаях значения расстояний ХНКПР, YНКПР и ZНКПР должны быть не менее 0,3 м для ГГ и ЛВЖ.
В нашем случае при нерабочей вентиляции:
С0 = 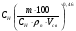 =
= 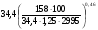 = 13,12
= 13,12
СН =  =
= 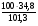 = 34,4
= 34,4
ХНКПР = 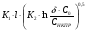 =
= 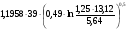 = 28 м.
= 28 м.
YНКПР = 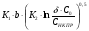 =
=  = 14,35м.
= 14,35м.
ZНКПР = 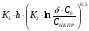 =
= 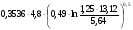 = 1,02 м.
= 1,02 м.
при работающей вентиляции:
ХНКПР = 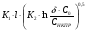 =
= 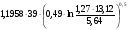 = 34 м.
= 34 м.
YНКПР = 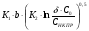 =
= 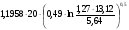 =17,5 м.
=17,5 м.
ZНКПР = 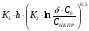 =
= 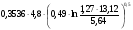 = 1,24 м.
= 1,24 м.
(НПБ 105-03 )
4.5. Определение класса зоны по ПУЭ.
Электрооборудование и электрические сети являются потенциальными источниками зажигания на любом объекте, поэтому при проектировании и строительстве производственных объектов, одной из наиболее важных задач является выбор электрооборудования. Для этого ПУЭ предусматривает определение классов пожароопасных или взрывоопасных зон в производственных помещениях.
Выбор и установка электрооборудования (машин, аппаратов, устройств), электропроводок и кабельных линий производятся в соответствии с Правилами устройства электроустановок на основе классификации взрывоопасных и пожароопасных зон, и взрывоопасных смесей.
Класс взрывоопасной зоны, в соответствии с которым производится выбор электрооборудования, определяется технологами совместно с электриками проектной или эксплуатирующей организации.
При определении взрывоопасных зон принимается, что:
а) взрывоопасная зона в помещении занимает весь объем помещения, если объем взрывоопасной смеси превышает 5 % свободного объема помещения;
б) взрывоопасной считается зона в помещении в пределах до 5 м по горизонтали и вертикали от технологического аппарата, из которого возможно выделение горючих газов или паров ЛВЖ, если объем взрывоопасной смеси равен или менее 5 % свободного объема помещения. Помещение за пределами взрывоопасной зоны следует считать невзрывоопасным, если нет других факторов, создающих в нем взрывоопасность.
Объемы взрывоопасных газо- и паровоздушной смесей, а также время образования паровоздушной смеси определяются в соответствии с НПБ 105.
Минимальной взрывоопасной концентрацией горючего в смеси является НКПР. При этом необходимо учитывать коэффициент безопасности, который принимается в соответствии с ГОСТ 12.1.044-89* равным 0,8.
Для определения объема взрывоопасной смеси необходимо:
1. Определить количество паров, выходящих в объем помещения
Определяем объем, занимаемый 65,4 кг паров:
плотность паров равна:
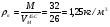
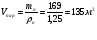
2. Определить минимальную взрывоопасную концентрацию смеси
Минимальная взрывоопасная концентрация паров в смеси с учетом коэффициента безопасности составляет:
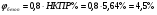
Определяем объем взрывоопасной смеси. Составляем пропорцию:
135 м3 -------- 4,5 %
Х м3 -------- 100%
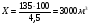
взрывоопасная концентрация при рассматриваемой аварийной ситуации образуется в объеме 3000 м3, это более 5% от свободного объема помещения.
3. Определение категории и группы взрывоопасной смеси
БЭМЗ для изобутилового спирта составляет 1,1 мм. В соответствии с п.7.3.26 ПУЭ категория взрывоопасной смеси IIА.
Температура самовоспламенения метилового спирта 470°С. В соответствии с п.7.3.27 ПУЭ группа взрывоопасной смеси Т1.
Вывод: В помещении обращается ЛВЖ, категория взрывоопасной смеси IIА, группа взрывоопасной смеси Т1. Образование взрывоопасной концентрации в помещении возможно только в результате аварийной ситуации. Объем взрывоопасной смеси превышает 5% свободного объема помещения. В соответствии с ПУЭ, класс зоны во всем объеме рассматриваемого помещения - В-Iа.
Зоны класса В-Iа — зоны, расположенные в помещениях, в которых при нормальной эксплуатации взрывоопасные смеси горючих газов (независимо от нижнего концентрационного предела воспламенения) или паров ЛВЖ с воздухом не образуются, а возможны только в результате аварий или неисправностей.
4.6. Определение тротилового эквивалента взрыва паровоздушной смеси.
Для сравнительной оценки уровня воздействия взрыва газо- паровоздушной смеси используется тротиловый эквивалент взрыва.
Тротиловым эквивалентом взрыва называется условная масса тринитротолуола (тротила), взрыв которой адекватен по степени разрушения взрыву парогазовой среды с учетом реальной доли участия во взрыве горючего вещества.
Тротиловый эквивалент взрыва определяется по формуле:
WТ = 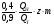 , кг,
, кг,
где
0,4 – доля энергии взрыва парогазовой смеси, затрачиваемой непосредственно на формирование ударной волны;
0,9 – доля энергии взрыва тринитротолуола, затрачиваемой непосредственно на формирование ударной волны;
QH – удельная (низшая) теплота сгорания парогазовой среды , кДж/кг;
QТ – удельная теплота взрыва ТНТ (qТ = 4240 кДж/кг);
z – доля приведенной массы паров, участвующей во взрыве.
WТ = 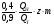 =
= 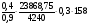 = 118,6кг.
= 118,6кг.
Ответ: тротиловый эквивалент составляет 118,6 кг.
4.7. Определение радиусов зон разрушения.
Зоной разрушения считается площадь с границами, определяемыми радиусами R, центром которой является рассматриваемый технологический блок или наиболее вероятное место разгерметизации технологической системы. Границы каждой зоны характеризуются значениями избыточных давлений по фронту ударной волны DР и соответственно безразмерным коэффициентом К.
Радиус зоны разрушения (м) в общем виде определяется выражением:
R = 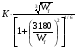 , где
, где
К — безразмерный коэффициент, характеризующий воздействие взрыва на объект.
При массе паров т более 5000 кг радиус зоны разрушения может определяться выражением:
R = 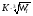 .
.
Ответ: радиус зоны разрушения составляет 6 м.
4.8 Исследование возможности снижения пожарной опасности помещения
Очевидно, что уровень пожарной опасности помещения определяет требуемые расходы на системы противопожарной защиты. Часто для оптимизации расходов на проектирование, строительство и эксплуатацию объектов требуется снизить их пожарную опасность.
В классификации помещений на взрывопожароопасные и пожароопасные определяющим показателем является величина избыточного давления взрыва в случае аварийной ситуации. Граничным значением принято 5 кПа, поскольку при таком давлении взрыва возможно повреждение человека волной давления (см. п.4.3).
Основными способами снижения пожарной опасности помещений, в которых обращаются ЛВЖ или ГЖ являются:
ограничение объемов используемых жидкостей;
ограничение площади возможного разлива жидкостей;
устройством аварийной вентиляции.
4.8.1 Ограничение объема хранения
Определяется максимальный объем сосуда (аппарата) с жидкостью в рассматриваемом помещении, при котором избыточное давление взрыва (см. п.4.3 курсовой работы) не превышает 5 кПа.
В качестве аварийной ситуации принимаем разрушение аппарата, выход жидкости в объем помещения, ее испарение с образованием взрывоопасной паровоздушной смеси.
1. Избыточное давление при взрыве паров:
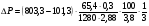 = 32,7кПа.
= 32,7кПа.
Определяем количество паров жидкости в помещении, при взрыве которого избыточное давление взрыва составит 5 кПа
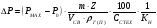 =>
=> 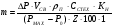
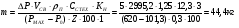
Определяем количество паров, образующихся при разливе 1 литра жидкости
Wисп=10-6·2,3·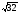 ·34,8= 453,03·10-6 кг/м2·с.
·34,8= 453,03·10-6 кг/м2·с.
С учетом того, что 1 л изобутилового спирта разливается на площадь 1 м2, площадь испарения составляет 1 м2.
Время полного испарения 1 литра жидкости составляет:
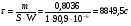 ,
,
это более 3600 сек.
За один час испарится:
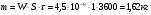
4. Определяем площадь, с которой испарится 9,9 кг жидкости за один час:
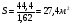
Таким образом, для того чтобы за один час испарилось 9,9 кг изобутилового спирта, необходимо разлить 30,9 л жидкости. Т.е. при хранении изобутилового спирта в аппаратах менее чем по 30,9 л, избыточное давление взрыва в случае аварийной ситуации составит менее 5 кПа.
5. Произведем проверочный расчет:
Объем жидкости 27,4 л
Площадь разлива 27,4 м2
Масса паров, образующихся за один час
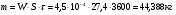
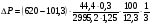 = 4,99 кПа.
= 4,99 кПа.
Вывод: при использовании емкостей для метилового спирта объемом не более 27,4 л избыточное давление взрыва в случае аварийной ситуации не превысит 5 кПа.
Количество испаряющейся жидкости в случае аварийной ситуации можно уменьшить путем ограничения площади разлива. Для этого могут быть предусмотрены обвалования, бортики, аварийный слив и т.п. Расчет максимальной площади обвалования производится аналогично как в п.4.8.2. При этом необходимо рассчитать минимальную высоту обвалования.
При определении высоты обвалования, учитывается, что фактическая высота должна быть не менее чем на 0,1 м больше расчетной.
Vапп=Sисп hобвал.
Vапп= 200 л= 0,2 м3
Sисп=27,4 м2
hобвал.= 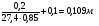
Проверка: Объем жидкости 0,2 м3
Площадь разлива 27,4 м2
Масса паров, образующихся за один час

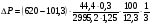 = 4,99 кПа.
= 4,99 кПа.
Ответ: площадь обвалования составила 27,4 м2.
При хранении емкости с метиловым спиртом в обваловании площадью 27,4 м2 и более, высотой 0,109 м избыточное давление взрыва составит не более 5 кПа и помещение перейдет в пожароопасную категорию.
В случае обращения в помещении горючих газов, легковоспламеняющихся или горючих жидкостей при определении значения массы т горючего вещества для расчета избыточного давления взрыва, допускается учитывать работу аварийной вентиляции, если она обеспечена резервными вентиляторами, автоматическим пуском при превышении предельно допустимой взрывобезопасной концентрации и электроснабжением по первой категории надежности (ПУЭ), при условии расположения устройств для удаления воздуха из помещения в непосредственной близости от места возможной аварии.
При этом массу m горючих газов или паров легковоспламеняющихся или горючих жидкостей, нагретых до температуры вспышки и выше, поступивших в объем помещения, следует разделить на коэффициент К, определяемый по формуле
К = АТ + 1,
где А – кратность воздухообмена, создаваемого аварийной вентиляцией, с-1; Т – продолжительность поступления горючих газов и паров легковоспламеняющихся и горючих жидкостей в объем помещения (в случае испарения жидкости – 3600 сек, или время полного испарения).
Кратность воздухообмена обычно обозначается n и показывает сколько раз за один час полностью меняется атмосфера в помещении, т.е. размерность [1/час]. Поэтому при выполнении расчетов, необходимо привести это значение к размерности [1/сек].
Так же необходимо учесть, что при работе аварийной вентиляции скорость воздушных потоков в помещении может увеличиться, что приведет к увеличению интенсивности испарения. Скорость воздушного потока в помещении при работе аварийной вентиляции определяется по формуле:
 ,
,
где l - длина помещения, м;
n - кратность воздухообмена ч-1.
Принимаем n=2,5
Помещение оборудовано аварийной вентиляцией обеспечивает вентиляцию помещения кратностью воздухообмена равной 2,5.
W=10-6η√МРн
ω=L/τ=2·l·g/3600=2·20·7/3600=0,054 м/с
в соответствии с таблицей №3 НПБ 105-03 при температуре 40ОС и скорости воздушного потока 0,054 м/с η=1,2
Wисп=10-6·1,2·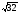 ·25= 169,7·10-6 кг/м2·с.
·25= 169,7·10-6 кг/м2·с.
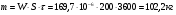
mав=102,2 /(1+7 · 3600/3600)= 4,7 кг
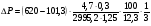 = 3,75 кПа.
= 3,75 кПа.
Ответ: при кратности воздухообмена равной 2,5, давление взрыва будет меньше 5 кПа.
5. Выбор и обоснование огнетушащих средств
Осуществляется по справочникам, выбираются все ОТВ с указанием их расходных показателей: интенсивности подачи, удельного расхода, времени тушения поверхностным и объемным способом.
Вода
Воздушно-механическая пена средней кратности на основе ПО-1Д, Сампо, ПО-6К, ПО-3АИ
Объёмное тушение
Порошки
Наиболее целесообразные средства тушения
СО2
Хладоны
85% (масс) СО2 + 15% (масс) C2F4Br2(CF2Br)
ПСБ-3
П-2АП, пир. А, ПФ
ПГС-М, ПС, МГС, РС, ПФК
СИ-2
I, л/(м2·с) при t=(30-60) мин
I, л/(м2·с) при t=(30-60) мин
G, кг/м3 при t=2 мин
G, кг/м3 при t=2 мин
G, кг/м3 при t=2 мин
ε·104, кг/(кВт·с)
G, кг/м3
ε·104, кг/(кВт·с)
G, кг/м3
G, кг/м2
G, кг/м2
0,25
-
0,7
0,22
0,27
1,50
(0,66)
1,42
(0,89; 0,65; 0,47)
-
-
При крупных проливах – распыленная вода, пена, порошок ПСБ
В помещениях объёмное тушение
Малые очаги – СО2, вода
Рекомендуемый список литературы
1. Основная
Теоретические основы процессов горения /Кутуев Р.Х., Малинин В.Р.,
Кожевникова Н.Ю. и др.: Учебник. - СПб.: СПбВПТШ МВД РФ, 1996.
-236с.Решетов А.П., Ловчиков В.А. Теоретические основы процессов горения: Учебно-методическое пособие по решению задач. - СПб: СПбИПБ МВД
России, 1997. - 123 с.Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник под редакцией А.Н. Баратова и А.Я. Корольченко - М.:Химия, 1990.
Расчет основных показателей пожаровзрывоопасности веществ и материалов: Руководство. – М.: ВНИИПО, 2002. – 77 с.
С.И. Таубкин. Пожар и взрыв. Особенности их экспертизы. – М.:ВНИИПО МВД России, 1999. – 600 с.
Власов Д.А. Взрыв и его последствия: Учебное пособие. – СПб.: СПбГТИ (ТУ), 2001. – 152 с.
2. Дополнительная
Демидов П.Г., Саушев B.C. Горение и свойства горючих веществ: Учебное пособие. М.: ВИПТШ МВД СССР, 1984.
Абдурагимов И.М. и др. Физико-химические основы развития и тушения пожаров (Учебное пособие) М.: ВИПТШ МВД СССР, 1980.
Химия. Большой энциклопедический словарь / Гл. ред. И.Л. Кнуянц. - М.: Большая Российская энциклопедия, 2000. - 792 с.
Пожарная безопасность. Взрывоопасность / А.Н.Баратов, Е.Н.Иванов, А.Н.Корольченко и др. – М.: Химия, 1987.-272с.
Пожарная опасность веществ и материалов, применяемых в химической промышленности: Справочник / Под ред. Рябова И.В. – М.: Химия, 1970. – 336 с.
Иванников В.П., Клюс П.П. Справочник руководителя тушения пожара. – М.: Стройиздат, 1987
Драйздейл Д. Введение в динамику пожаров /Пер. с англ. К.Г. Бомштейна; Под. ред. Ю.А. Кошмарова, В.Е. Макарова. – М.: Стройиздат, 1990. – 424 с.: ил. – Перевод. изд. An Introduction to Fire Dynamics/ D. Drysdale. – John Wiley and Sons, Chichester, 1985. – ISBN 5-274-00771-6.
Краткая химическая энциклопедия (в 5-ти томах), 1987.
Справочник химика, в 6-ти томах.
3. Нормативно-техническая
ГОСТ 2.105-95 ЕСКД. Общие требования к текстовым документам.
ГОСТ 7.1-84. Система стандартов по информации, библиотечному и издательскому делу. Библиографическое описание документа. Общие требования и правила составления.
ГОСТ 7.9-95. Система стандартов по информации, библиотечному и издательскому делу. Реферат и аннотация. Общие требования.
ГОСТ 7.32-2001. Система стандартов по информации, библиотечному и издательскому делу. Отчет о научно-исследовательской работе. Структура и правила оформления.
ГОСТ 12.1.004-91* Пожарная безопасность. Общие требования.
ГОСТ 12.1.044-89. Пожаровзрывоопасность веществ и материалов. Номенклатура показателей и методы их определения.
ГОСТ Р 12.3.047-98 Пожарная безопасность технологических процессов
НПБ 105-03 Определение категорий помещений, зданий и наружных установок по взрывопожарной и пожарной опасности.
Пособие по применению НПБ 105-95 "Определение категорий помещений и зданий по взрывопожарной и пожарной опасности" при рассмотрении проектно-сметной документации /Шебеко Ю.Н. и др. - М.: ВНИИПО, 1998. - 119 с
ПУЭ-85. Правила устройства электроустановок / Минэнерго СССР. - М.: Энергоатомиздат, 1986. - 648 с.
ПБ 09-170-97 Общие правила взрывобезопасности для взрывопожароопасных химических, нефтехимических и нефтеперерабатывающих производств
№ п/п
Наименование
Данные по пожарной опасности
справочные
расчетные
Требования пожаровзрывобезопасности
(с учетом коэффициентов безопасности)
1
2
3
4
5
1.
Общие сведения:
Название вещества
Структурная формула
Область применения
метиловый спирт
СН4О
лвж
Физико-химические свойства
2.
Агрегатное состояние
Внешний вид, цвет и запах
Жидкость
бесцветная
Плотность, кг/м.куб
786,9
Относительная плотность пара по воздуху
1,1
Температура плавления Тпл, оС
------
Температура кипения, Ткип, оС
64,9
Коэффициент диффузии пара в воздухе, кв.см/с
0,162
Растворимость в воде, %
Хорошо растворим
Характеристики горения
3.
Расход воздуха на горение м.куб/кг:
Теоретический
Практический
5
16
Коэффициент избытка воздуха
3,2
Объем продуктов горения, м.куб/кг:
Теоретический
Практический
9,5
31,1
Состав продуктов горения практический, % об
СО2
Н2О
N2
4,1
8,2
74,1
Стехиометрическая концентрация, % об.
г/м.куб
12,3
180
Низшая теплота горения Qн, кДж/кг
23025
Температура горения адиабатическая Тгор, К
2202
Показатели пожарной опасности
4.
Температура вспышки, tвсп, оС
6
0,7
лвж
Температура воспламенения tв, оС
13
11,2
Температура самовоспламенения tсв, оС
440
440
tбез≤0,8 · tсв=
0,8 ·440=352 0С
Концентрационные пределы распространения пламени,
% об.: НКПР
ВКПР
6,98
35,5
5,64
34,5
С источником зажигания:
φбез=φн÷20=
=5,64÷20=0,282
Без источника зажигания:
φбез=φн÷2=
=5,64÷2=2,82
Температурные пределы распространения пламени, оС:
НТПР
ВТПР
5
39
6
39,9
НТПР-10≤tбез≤ВТПР+15
-4 ≤ tбез ≤ 54
Минимальная энергия зажигания, Emin, мДж
0,17
0,14
Еmin без. ≤0,4Еmin заж =0,4·0,17=0,068
Способность гореть и взрываться при взаимодействии с H2O, O2, и др.
Опасно при взоимодействии с алогенами и с сильными окислитеями
Нормальная скорость распространения пламени, Uн, м/с
0,572
----
Максимальное давление взрыва, Pmax, кПа
620
----
Минимальная флегматизирующая концентрация % об.
N2
CO2
H2O (пар)
49
38,6
32
----
Рекомендуемые огнетушащие вещества
5.
Вода (интенсивность подачи)
Пена (интенсивность подачи)
Негорючие газы (наименование, расход)
Хладоны (наименование, расход)
Порошки (наименование, расход)

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ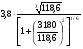 = 6 м
= 6 м