Кислород химическая характеристика
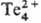
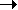
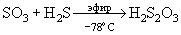
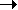
§8 Элементы VI А группы.
Кислород, сера, селен, теллур, полоний.
Элементы
O
S
Se
Te
Po
Содержание в земной коре мас,%
47,2
1
6∙10-5
1∙10-6
2∙10-6
Валентная электронная конфигурация
2s22p 4
3s23p4
4s24p4
5s25p4
6s26p4
Атомный радиус,нм
0,073
0,104
0,116
0,135
-
Ионный радиус,нм
0,140
0,174
0,191
0,211
-
Потенциал ионизации,еВ
13,61
10,36
9,75
9,01
8,43
ОЭО
1,47
2,08
2,02
2,00
1,35
Температура пл.0С
-218,8
-112,8
220,5
450,0
250,0
Температура кип.0С
-183,0
44,6
657,0
990,0
-
Плотность,г/м 3
1,13
2,07
4,82
6,25
9,50
Общие сведения элементов VI А группы:
Элементы VI А группы (кроме полония) называются халькогенидами. На внешнем электронном уровня этих элементов находятся шесть валентных электронов (ns2np 4),поэтому они в нормальном состоянии проявляют валентность 2, а в возбужденном -4 или 6 (кроме кислорода). Атом кислорода отличается от атомов других элементов подгруппы отсутствием d-подуровня во внешнем электронном слое, что обуславливает большие энергетические затраты на «распаривание» его электронов, некомпенсируемые энергией образования новых ковалентных связей. Поэтому ковалентность кислорода равна двум. Однако в некоторых случаях атом кислорода, обладающий неподеленными электронными парами, может выступать в качестве донора электронов и образовывать дополнительные ковалентные связи по донорно-акцепторному механизму.
Электроотрицательность этих элементов постепенно уменьшается в порядке О-S-Se-Те-Ро. Cтепень окисления от -2,+2,+4,+6 . Увеличивается радиус атома, что ослабляет неметаллические свойства элементов.
Элементы этой подгруппы образуют с водородом соединения вида H2R (H2О,H2S,H2Se,H2Те,H2Ро).Эти соединения растворяясь в воде, образуют кислоты. Кислотные свойства увеличиваются в направлении H2О→H2S→H2Se→H2Те→H2Ро. S,Se и Те образуют с кислородом соединения типа RO2 и RO3. Из этих оксидов образуются кислоты типа H2RO3 и H2RO4. С увеличением порядкового номера,силы кислот уменьшаются. Все они имеют окислительные свойства. Кислоты типа H2RO3 проявляют и восстановительные свойства.
Кислород
Природные соединения и получения: Кислород - самый распространенный элемент земной коры. В свободном состоянии он находится в атмосферном воздухе (21%); в связанном виде входит в состав воды (88,9%), минералов, горных пород и всех веществ, из которых построены организмы растений и животных. Атмосферный воздух представляет собой смесь многих газов, основную часть которой составляют азот и кислород, и небольшое количество благородные газы, углекислый газ и водяные пары. Углекислый газ образуется в природе при горении дерева, угля и других видов топлива, дыхании животных, гниении. В некоторых местах земного шара CO 2 выделяется в воздух вследствие вулканической деятельности, а также из подземных источников.
Природный кислород состоит из трех стабильных изотопов: 816О(99,75%),817О(0,04), 818О(0,20). Искусственным путем были также получены изотопы 814О, 815О, 819О.
Кислород был получен впервые в чистом виде К.В.Шееле в 1772 г., а затем в 1774 г. Д.Ю.Пристли, который выделил его из HgO. Однако Пристли не знал, что полученный им газ входит в состав воздуха. Только спустя несколько лет Лавуазье,подробно изучивший свойства этого газа , установил, что он является основной частью воздуха.
В лаборатории кислород получается следующими методами:
Электролизом воды. Чтобы увеличить электропроводность воды в нее добавляют раствор щелочи (обычно 30%-ый KOH) или сульфаты щелочных металлов:
В общем виде: 2H2О →2H2+О2
На катоде: 4H2О+4e¯→ 2H2+4OH¯
На аноде: 4OH−4е→2H2О+О2
- Разложением кислородосодержащих соединений:
Термическое разложение Бертолетовой соли под действием катализатора MnO2.
KClO3→2KCl+3О2
Термическое разложение перманганата калия
KMnO4→K2MnO4+MnO2+О2.
Термическое разложение нитратов щелочных металлов:
2KNO3→2KNO2+О2.
Разложением пероксидов:
2H2О 2→2H2О+О2.
2ВаО2→2ВаО+О2.
Термическим разложением оксида ртути (II):
2HgO→2HgO+О2.
- Взаимодействием пероксидов щелочных металлов с оксидом углерода (IV):
2Na2О2+2CO2→2Na2CO 3+О2.
Термическим разложением хлорной извести в присутствии катализатора - солей кобальта:
2Ca(OCl)Cl →2CaCl 2+О2.
-Окислением пероксида водорода перманганатом калия в кислой среде:
2KMnO4+H2SO4+5H2О 2→K2SO4 +2Mn SO4+8H2О+5О2.
В промышленности: В настоящее время в промышленности кислород получают фракционной перегонкой жидкого воздуха . При слабом нагревании жидкого воздуха из него сначала отделяется азот (tкип(N2)=-196ºC), затем выделяется кислород (tкип(О2)=-183ºС).
Кислород полученный этим способом содержит примеси азота. Поэтому для получения чистого кислорода полученную смесь заново дистиллируют и в конечном итоге получается 99,5% кислород. Кроме того некоторое количество кислорода получают электролизом воды. Электролитом служит 30% раствор KOH.
Кислород обычно хранят в баллонах синего цвета под давлением 15МПа.
Физико-химические свойства: Кислород - газ без цвета , запаха , вкуса , немного тяжелее воздуха, слабо растворяется в воде. Кислород при давлении 0,1 МПа и температуре -183ºС переходит в жидкое состояние, при -219ºС замерзает. В жидком и твердом состоянии притягивается магнитом.
Согласно методу валентных связей строение молекулы кислорода, представленное схемой -:Ö::Ö:, не объясняет большую прочность молекулы, имеющей паромагнитные свойства, то есть неспаренные электроны в нормальном состоянии.
В результате связи электронов двух атомов образуется одна общая электронная пара, после этого неспаренный электрон в каждом атоме образует взаимную связь с неразделенной парой другого атома и между ними образуется трех электронная связь. В возбужденном состоянии молекула кислорода проявляет диамагнитные свойства, которым соответствует строение по схеме :Ö=Ö:,
Для заполнения электронного уровня в атоме кислорода не хватает двух электронов. Поэтому кислород в химических реакциях может легко присоединять два электрона и проявлять степень окисления -2. Кислород только в соединениях с более электроотрицательным элементом фтором проявляет степень окисления +1 и +2: О2F 2,ОF 2.
Кислород - сильный окислитель. Он не взаимодействует только с тяжелыми инертными газами (Kr,Xe,He,Rn), с золотом и платиной. Оксиды этих элементов образуются другими путями. Кислород входит в реакции горения, окисления как с простыми веществами так и со сложными. При взаимодействии неметаллов с кислородом образуются кислотные или соленеобразующие оксиды, а при взаимодействии металлов образуются амфотерные или смешанные оксиды Так, с фосфором кислород реагирует при температуре ~ 60 °С,
4P+5О2→ 2Р2О5
С металлами- оксиды соответствующих металлов
4Al + 3O2 → 2Al2O3
3Fe + 2O2 → Fe3O4
при нагревании щелочных металлов в сухом воздухе только литии образует оксид Li2O, а остальные-пероксиды и супероксиды:
2Na+O2→Na2O2 K+O2→KO2
С водородом кислород взаимодействует при 300 °С:
2Н2 + О2 = 2Н2О.
При взаимодействии с фтором он проявляет восстановительные свойства:
O2 + F2 = F2O2 (в электрическом разряде),
с серой - при температуре около 250 °С:
S + О2 = SO2.
С графитом кислород реагирует при 700 °С
С + О2 = СО2.
Взаимодействие кислорода с азотом начинается лишь при 1200°С или в электрическом разряде:
N2 + О2 2NО - Q.
Кислород реагирует и со многими сложными соединениями, например, с оксидом азота (II) он реагирует уже при комнатной температуре:
2NО + О2 = 2NО2.
При окислении сероводорода, при нагревании, образуется сера, или оксид серы (IV) в зависимости от соотношения между кислорода и сероводорода :
2Н2S + О2 = 2S + 2Н2О
2Н2S + ЗО2 = 2SО2 + 2Н2О
В большинстве реакций окисления с участием кислорода выделяется тепло и свет - такие процессы называются горением.
Озон
Озон-O3-вторая аллотропная модификация элемента кислорода. Молекула O3 имеет угловое строение (угол между связями 116º, длинна связи О=О, l=0,1278нм) При н.у. это газ синего цвета. Жидкий озон- темно-синего цвета. Он ядовит и взрывчат особенно в жидком и твердом состоянии). Озон образуется в атмосфере при грозовых разрядах, и имеет специфический запах свежести.
Обычно озон получают в озонаторах пропусканием тихого электрического разряда через кислород (реакция эндотермическая и сильно обратима; выход озона составляет 5%):
3О2 2О3 ΔН=-285 кДж. В лабораторных условиях озон получают при подкислении азотной кислотой персульфата
аммония:
(NH4)2S2O8→H2S2O8+2NH4+
H2S2O8→2SO2+O3+H2O
O3 образуется с небольшим выходом в результате реакции:
3F2+H2O(г)→6HF+O3
O3-сильнейший окислитель, окисляет все металлы ,( кроме золота и платиновых металлов) и большинство неметаллов. Он переводит низшие оксиды в высшие, а сульфиды металлов- в их сульфаты. В реакциях с участием О3 обычно образуется О2, например:
2Ag+O3→Ag2O+O2
PbS+4O3→PbSO4+4O2
NH2+3O3→HNO2+H2O
Pb(OH)2+O3→PbO2+H2O+O2
При воздействии O3 на щелочные металлы можно получить озониды- неустойчивые соединения, которые разлагаются:
2KO3→2KO2+O2
Как сильный окислитель ,озон убивает бактерии и потому применяется для дезинфекции воздуха. Устойчивый слой озона находится в атмосфере на высоте~22км. Этот озоновый слой защищает Землю от губительного для жизни чистого ультрафиолетового излучения.
При взаимодействии озона с раствором иодида калия выделяется йод, тогда как с кислородом эта реакция не идет:
2КI + О3 + Н2О = I2 + 2КОН + О2.
Реакция часто используется как качественная для обнаружения ионов I- или озона. Для этого в раствор добавляют крахмал, который дает характерный синий комплекс с выделившимся йодом, причем качественная еще и потому, что озон не окисляет ионы Сl- и Br-.
Вода
Физические и химические свойства воды: Чистая вода представляет собой бесцветную, без вкуса, запаха, прозрачную жидкость. Плотность воды при переходе ее из твердого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает.
Вода-вещество привычное и необычное. Нет на земле вещества, более важного для нас, чем обыкновенная вода, и в то же время не существует другого вещества, в свойствах которого было бы столько противоречий и аномалий, сколько в ее свойствах.
Почти ¾ поверхности нашей планеты занято океанами и морями. Твердой водой- снегом и льдом- покрыто 20% суши. От воды зависит климат планеты. Геофизики утверждают, что Земля давно бы остыла и превратилась в безжизненный кусок камня, если бы не вода. У нее очень большая теплоемкость. Нагреваясь, она поглощает тепло, остывая, отдает его. Земная вода и поглощает и возвращает очень много тепла, тем самым выравнивает климат. От космического холода предохраняют Землю те молекулы, которые рассеяны в атмосфере- в облаках и в виде паров.
Вода по физическим свойствам существенно отличается от других растворителей: При 4ºС вода имеет максимальную плотность, и лишь при дальнейшем нагревании ее плотность уменьшается. Если бы при понижении температуры и при переходе из жидкого состояния в твердое вода изменялась аналогично другим веществам, то при приближении зимы поверхностные слои природных вод охладилась бы до 0ºС и опускались на дно до тех пор, пока вся масса водоема не приобрела бы температуру 0ºС. Вода замерзала бы, льдины погружались на дно, и водоем промерзал бы на всю глубину. Многие формы жизни в воде были бы невозможны. В действительности охлажденный слой, обладающий меньшей плотностью, остается на поверхности, замерзает и тем самым защищает лежащие ниже слои от охлаждения.
Вода обладает аномально высокой теплоемкости (4,18 Дж/г∙К), поэтому в ночное время, а также при переходе от лета к зиме, вода остывает медленно. А днем, или при переходе от зимы к лету , так же медленно нагревается , являясь, таким образом регулятором температуры на земном шаре.
Вода при обычном состоянии является жидкостью, в то время как H2S,H2Se,H2Te- газы. Температуры кристаллизации и испарения воды значительно выше соответствующих температур указанных соединений.
Вода обладает очень высокой диэлектрической проницаемостью (78.5 при 298К).
Вода- хороший растворитель полярных жидкостей и соединений с ионными связями, образует кристаллогидраты со многими химическими соединениями.
Долгое время необычные свойства воды были загадкой для ученых. Они в основном обусловлены следующими причинами:
- полярный характер молекул;
- наличие не поделенных электронных пар у атома кислорода;
- водородные связи.
Связь между атомами водорода и кислорода полярная, что приводит к асимметрии в распределении электронных зарядов и, следовательно, к полярности молекулы. Длина связи составляет 96 нм, а угол между связями ~ 105º.
Наличие неподеленных пар электронов у кислорода и смещение обобществленных электронных пар от атомов водорода к кислороду обуславливают образование водородных связей. Энергия связи равна 25 кДж/моль. Атом кислорода в молекуле воды находится в состоянии sp3-гибридизации. Поэтому валентный угол НОН близок к тетраэдическому углу (109,5º).
Молекулярная масса парообразной воды равна 18 и отвечает ее простейшей формуле. Однако молекулярная масса жидкости оказывается более высокой. Это свидетельствует о том, что в жидкой фазе происходит ассоциация молекул, т.е. соединение их в более сложные агрегаты, вследствие образования между молекулами водородных связей.
В твердой воде (лед) атом кислорода каждой молекулы участвует в образовании двух водородных связей с соседними молекулами воды.
Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы воды. При плавлении льда его структура разрушается, но и в жидкой фазе сохраняются водородные связи, образуются ассоциаты , однако они существуют короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких «ледяных» агрегатов могут размещаться одиночные молекулы воды, при этом упаковка молекул воды становится плотной. Именно поэтому при плавлении льда объем , занимаемый водой, уменьшается, а ее плотность возрастает . При нагревании воды часть теплоты затрачивается на разрыв водородных связей. Этим объясняется высокая теплоемкость воды. Водородные связи между молекулами воды полностью разрываются только при переходе воды в пар.
На Земле на 6800 атомов протия приходится один атом дейтерия, а в межзвездочном пространстве один атом дейтерия приходится уже на 200 атомов протия.
Вода- весьма реакционноспособное вещество.
Вода реагирует со многими металлами с выделением водорода:
2Na + 2H2O = H2 + 2NaOH (бурно)
2K + 2H2O = H2 + 2KOH (бурно)
3Fe + 4H2O = 4H2 + Fe3O4 (только при нагревании)
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы .
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2O H2 + CO
CH4 + 2H2O 4H2 + CO2
Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем:
2H2O 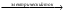 2H2 + O2
2H2 + O2
Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
P2O5+3H2O→2H3PO4 ; N2O5+H2O→2HNO3
Оксиды щелочных и щелоочно-земельных металлов вступают в реакции соединения с водой с образованием соответствующих щелочей:
CaO+H2O→Ca(OH)2
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует. Это ZnO, TiO2, Cr2O3, из которых приготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней. Многие соединения металлов с неметаллами легко взаимодействуют с водой с образованием соответствующих гидроксидов металлов и водородных соединений неметаллов:
PCl3+3H2O → H3PO3 + 3HCl
Al2S3+6H2O→2Al(OH)3+3H2S
Ca3P2+6H2O→3Ca(OH)2+2PH3
Na3N+3H2O→3NaOH+NH3
KH+H2O→KOH+H2
Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом, например:
CuSO4+5 H2O→CuSO4.5H2O
H2SO4 + H2O = H2SO4.H2O (гидрат серной кислоты)
NaOH + H2O = NaOH.H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха.
Особая реакция воды- фотосинтез – синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO2 + 5n H2O = (C6H10O5)n + 6n O2 (при действии света)
Вода обладает каталитической активностью. В отсутствии следов влаги практически не протекают обычные реакции, например, не окисляется натрий, белый фосфор, хлор не взаимодействует с металлами, фторводород не разрезает стекло.
Пероксид водорода
Пероксид водорода H2O2 - соединение водорода c кислородом, содержащее рекордное количество кислорода – 94% по массе. В молекулах Н2О2 содержатся пероксидные группы –О–О–которые во многом определяют свойства этого соединения.
Из-за несимметричного распределения связей Н-О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, приводящая к их ассоциации. Поэтому в обычных условиях пероксид водорода- сиропообразная жидкость бледно-голубого цвета (плотность 1,44) с довольно высокой температурой кипения (150ºС). При хранении Н2О2 разлагается.
2H2O2 2H2O + O2.
Получение Н2О2. Молекулы Н2О2 всегда получаются в небольших количествах при горении и окислении различных соединений. При горении Н2О2 образуется либо при отрыве атомов водорода от исходных соединений промежуточными гидропероксидными радикалами, например:
HO2. + CH4 H2O2 + CH3
либо в результате рекомбинации активных свободных радикалов:
2ОН. Н2О2,
Н. + НО2. Н2О2.
Например, если кислородно-водородное пламя направить на кусок льда, то растаявшая вода будет содержать в заметных количествах Н2О2, образовавшийся в результате рекомбинации свободных радикалов (в пламени молекулы Н2О2 немедленно распадаются). Аналогичный результат получается и при горении других газов. Образование Н2О2 может происходить и при невысокой температуре в результате различных окислительно-восстановительных процессов.
В промышленности пероксид водорода уже давно не получают способом Тенара – из пероксида бария:
BaO2+2HClBaCl2+H2O2,
а используют более современные методы. Один из них – электролиз растворов серной кислоты при высокой плотности тока, низкой температуре, на платиновом аноде. При этом на аноде сульфат-ионы окисляются до надсульфат-ионов: 2SO42– – 2e S2O82–. Надсерная кислота затем гидролизуется:
H2S2O8 + 2H2O H2O2 + 2H2SO4.
На катоде, как обычно, идет выделение водорода, так что суммарная реакция описывается уравнением :
2H2O H2O2 + H2.
Но основной современный способ (свыше 80% мирового производства) – окисление некоторых органических соединений, например, этилантрагидрохинона кислородом воздуха в органическом растворителе, при этом из антрагидрохинона образуются Н2О2 и соответствующий антрахинон, который потом снова восстанавливают водородом на катализаторе в антрагидрохинон. Пероксид водорода извлекают из смеси водой и концентрируют перегонкой. Аналогичная реакция протекает и при использовании изопропилового спирта (она идет с промежуточным образованием гидропероксида):
(СН3)2СНОН + О2 (СН3)2С(ООН)ОН (СН3)2СО + Н2О2
При необходимости образовавшийся ацетон также можно восстановить до изопропилового спирта.
Физические и химические свойства. Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н2О2, который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см3). Замерзает Н2О2 при температурой немного меньшей, чем температура замерзания воды – при минус 0,41°С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н2О2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30°С, а 60%-ный – при минус 53°С. Кипит Н2О2 при температуре более высокой, чем обычная вода, – при 150,2ºС. Смачивает стекло хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н2О2, жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.
Чистый пероксид водорода – вещество очень опасное, так как при некоторых условиях возможно его взрывное разложение:
Н2О2 Н2О + 1/2 О2
с выделением 98 кДж на моль Н2О2 (34г).Опасны и концентрированные водные растворы Н2О2, в их присутствии легко самовоспламеняются многие органические соединения, а при ударе такие смеси могут взрываться. Для хранения концентрированных растворов используют сосуды из особо чистого алюминия или парафинированные стеклянные сосуды.
Чаще приходится встречаться с менее концентрированным 30%-ным раствором Н2О2, который называется пергидролем, но и такой раствор опасен: вызывает ожоги на коже (при его действии кожа сразу же белеет из-за обесцвечивания красящих веществ),
Пероксид водорода – кислота, но очень слабая. Константа диссоциации H2O2 H+ + HO2– при 25° С равна 2,4·10–12, что на 5 порядков меньше, чем для H2S. Средние соли Н2О2 щелочных и щелочноземельных металлов обычно называют пероксидами. При растворении в воде они почти полностью гидролизуются:
Na2O2 + 2H2O 2NaOH + H2O2.
Гидролизу способствует подкисление растворов. Как кислота Н2О2 образует и кислые соли, например, Ва(НО2)2, NaHO2 и др. Кислые соли менее подвержены гидролизу, но легко разлагаются при нагревании с выделением кислорода:
2NaHO2 2NaOH + O2.
Выделяющаяся щелочь, как и в случае Н2О2, способствует разложению.
Растворы Н2О2, особенно концентрированные, обладают сильным окислительным действием. Так, при действии 65%-ного раствора Н2О2 на бумагу, опилки и другие горючие вещества они воспламеняются. Менее концентрированные растворы обесцвечивают многие органические соединения, например, индиго. Необычно идет окисление формальдегида: Н2О2 восстанавливается не до воды (как обычно), а до свободного водорода:. Окислительное действие разбавленных растворов Н2О2 больше всего проявляется в кислой среде, например :
H2O2 + H2C2O4 2H2O + 2CO2,
но возможно окисление и в щелочной среде:
Na[Sn(OH)3] + H2O2 + NaOH Na2[Sn(OH)6];
2K3[Cr(OH)6] + 3H2O2 2K2CrO4 + 2KOH + 8H2O.
Окисление черного сульфида свинца до белого сульфата можно использовать для восстановления потемневших свинцовых белил на старых картинах:
PbS + 4H2O2 PbSO4 + 4H2O
Под действием света идет окисление и соляной кислоты:
H2O2 + 2HCl 2H2O + Cl2.
Добавление Н2О2 к кислотам сильно увеличивает их действие на металлы. Так, в смеси H2O2 и разбавленной H2SO4 растворяются медь, серебро и ртуть; иод в кислой среде окисляется до иодной кислоты HIO3, сернистый газ – до серной кислоты и т.д.
Совершенно иначе реагирует пероксид водорода в присутствии сильных окислителей, а также веществ, легко отдающих кислород. В таких случаях Н2О2 может выступать как восстановитель с одновременным выделением кислорода (так называемый восстановительный распад Н2О2), например:
2KMnO4 + 5H2O2 + 3H2SO4 K2SO4 + 2MnSO4 + 5O2 + 8H2O;
Ag2O + H2O2 2Ag + H2O + O2;
О3 + Н2О2 H2O + 2O2;
NaOCl + H2O2 NaCl + H2O + O2.
Последняя реакция интересна тем, что в ней образуются возбужденные молекулы кислорода, которые испускают оранжевую флуоресценцию. Аналогично из растворов солей золота выделяется металлическое золото, из оксида ртути получается металлическая ртуть и т.д. Такое необычное свойство Н2О2 позволяет, например, провести окисление гексацианоферрата(II) калия, а затем, изменив условия, восстановить продукт реакции в исходное соединение с помощью того же реактива. Первая реакция идет в кислой среде, вторая – в щелочной:
2K4[Fe(CN)6] + H2O2 + H2SO4 2K3[Fe(CN)6] + K2SO4 + 2H2O;
2K3[Fe(CN)6]+H2O2+2KOH2K4[Fe(CN)6]+2H2O+O2.
Пероксид водорода находит широкое применение, а его мировое производство исчисляется сотнями тысяч тонн в год. Его используют для получения неорганических пероксидов, как окислитель ракетных топлив, в органических синтезах, для отбеливания масел, жиров, тканей, бумаги, для очистки полупроводниковых материалов, для извлечения из руд ценных металлов (например, урана путем перевода его нерастворимой формы в растворимую), для обезвреживания сточных вод. В медицине растворы Н2О2 применяют для полоскания и смазывания при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина), для лечения гнойных ран. В пеналах для хранения контактных линз в крышку иногда помещают очень небольшое количество платинового катализатора. Линзы для их дезинфекции заливают в пенале 3%-ным раствором Н2О2, но так как этот раствор вреден для глаз, пенал через некоторое время переворачивают. При этом катализатор в крышке быстро разлагает Н2О2 на чистую воду и кислород.
8.2 Сера.
Нахождение в природе и получение: Сера была известна людям со II века до нашей эры. Название элемента было взято со слова <<сира>> обозначающее светло-желтый. Сера распространена в природе как в виде соединений так и в свободном виде. В свободном виде сера встречается обычно в виде залежей. Такие рудники встречаются в северной части Украины, в Италии, в Америке, в Туркменистане. Кроме этого сера встречается в организмах животных и растений. В виде соединений сера распространена в виде сульфидов и сульфатов:
FeS2-пирит или медный колчедан. H2S-сероводород
ZnS- сфалерит или цинковая обманка Na2SO4∙10H2O-сульфат натрия - глауберова
PbS- или свинцовый блеск. Соль
Cu2S- или медный блеск (халькозин) CaSO4∙2H2O- гипс
CuFeS2-медный колчедан или халькопирит. MgSO4∙7H2O- горькая соль
HgS- киноварь. BaSO4- тяжелый шпат
В промышленности серу получают путем выталкивания из рудников горячими струями пара. Чтобы получать серу этим способом в подземные трубы накачивают горячие струи пара и сжатый воздух. Под действием пара расплавившаяся сера поднимается по трубам с помощью горячих паров и воздушного давления , поднявшись превращается в кристаллы.
Чтобы отделить от примесей серу, полученную в свободном виде, плавят.
В промышленности чтобы получить серу из сульфида водорода H2S окислением O2, при 500°С участием катализатора ( активированного угля или Fe(OH)3).
2H2S+O2→2H2O+2S
SO2+2C→S+2CO
SO2+2H2S→3S+2H2O
В лаборатории серу получают следующими способами:
-Термическим разложением пирита:
FeS2→FeS +S
-Взаимодействием сульфида водорода с гологенами:
H2S+Сl2→2HCl+S H2S+J2→2HJ+S
H2S+Br2→2HBr+S
-Окислением сульфида водорода SO2 при высокой температуре:
2H2S+SO2 → 2H2O+3S
-Восстановлением из сульфатов:
CaSO4+4C→CaS+4CO
CaS+CO2+H2O→↓CaCO3+H2S
2H2S +O2→2S+2H2O
Физические и химические свойства: Сера имеет 4 стабильных изотопа: 33S, 34S, 35S,36S. Сера - кристаллическое вещество желтого цвета. Она не проводит тепла и электричества, не растворяется в воде, но растворяется в дисульфиде углерода ( CS 2 ) , толуоле (C6H5-CH3). Сера плавится при температуре 112,8 ºС,и кипит при температуре 444,6 ºС.
Сера имеет три аллотропных модификации: ромбическая, моноклинная, и пластическая. Первые 2 относятся к кристаллическим разновидностям, а третья – аморфная. Кристаллическая сера, состоящая из восьми атомов S8 при температуре > 160ºС распадается и переходит в различные виды пластической серы:
S8 450ºС → S6650ºС → S4 900ºС →S21500ºС→S
Сера типичный неметалл. В химических реакциях сера проявляет себя как окислитель, так и восстановитель. Окислительные свойства серы выражены слабее чем у кислорода, поэтому в реакциях с элементами с большей электроотрицательностью (F, Cl, O, N) она проявляет себя как восстановитель, а с элементами с низшей электроотрицательностью чем у нее, она проявляет себя как окислитель. Сера вступает в реакции с металлами при нагревании, а с ртутью и щелочами взаимодействует при обычных условиях:
2Na+S→Na2S 2Al+3S →Al2S3
2Hg+S→HgS C+2S→CS2
Fe+S→FeS Si+S→SiS
Сера взаимодействует со всеми неметаллами кроме инертных газов и йода.
S+3F2→SF6 Si+2S→SiS2 H2+S→H2S
2P+5S→P2S5 S+O2 →SO2 2S+Cl2→S2Cl2 C+2S→CS2
Сера взаимодействует со сложными веществами:
Na2S+S→Na2S2
С горячими растворами концентрированной серной, с концентрированной и разбавленной азотной кислот:
2H2SO4(конц)+S→3SO2+2H2O
6HNO3(конц)+S→2H2SO4+6NO2+2H2O
2HNO3(разб) +S → H2SO4 +2NO
При нагревании сера вступает в реакцию со щелочами и пероксидами:
Na2O2+2S→Na2S+SO2
6KOH+3S→K2SO3+2K2S+3H2O
Сера используется в сельском хозяйстве как защита от насекомых, в производстве спичек, при получении серной кислоты, при вулканизации каучука, широко используется в производстве пороха.
Для приготовления черного пороха используется смесь из 75% KNO3 , 15% C и 10% S; при нагревании происходит реакция:
2KNO3 + S + 3C → K2S + 3CO2 + N2 ,
в результате которой происходят резкое увеличение объема смеси ( в 2000 раз) – взрыв.
Сероводород
Н2S- бесцветный газ с резким запахом тухлых яиц; молекула Н2 S имеет угловую форму, длина связи S —H 0,1336 нм, угол HSH 92,06°.
При обычной температуре сероводород устойчив, в вакууме начинает диссоциировать выше 500 °С, при ~ 1690°С полностью разлагается. В воде Н2S хорошо растворим ( 3 объема на 1 объем воды при 20°С. Водный раствор сероводорода-сероводородная кислота-слабая кислота (K1 = 9,5·10-8, K2 = 1·10-14), образующая соли-сульфиды и гидросульфиды. Известен клатрат Н2S · 6Н2О. Лучше, чем в воде,сероводород растворяется в органических растворителях; например, в одном объеме этанола растворяется 7,42 (20 °С) объемов H2S. В промышленности сероводород получают как побочный продукт при очистке нефти, природных и промышленных газов. Основные методы очистки этих газов с получением сероводорода-моноэтаноламиновый, вакуум-карбонатный, содовый. Принципиальная схема выделения сероводорода из природных. и промышленных газов заключается в следующем: газ вводится в нижнюю часть абсорбера, который сверху орошается раствором абсорбента, затем насыщенный H2S раствор поступает в отгонную колонну, где при нагревании горячим паром происходит десорбция сероводорода из раствора.
В лаборатории сероводород получают действием Н2 SO4 на FeS; а также из Н2 и паров S при 500-600 °С в присутствии катализатора (пемза); удобный метод получения H2S-нагревание серы с парафином:
FeS+2HCl→FeCl2+H2S↑
Cероводород-сильный восстановитель:
KMnO4+5H2S+3H2SO4→2MnSO4+5S+K2SO4+8H2O
H2S+4Br2+4H2O→H2SO4+8HBr
3FeCl3 + H2S → 2FeCl2 + 2HCl + S
При нагревании на воздухе постепенно окисляется, при ~ 250 °С воспламеняется. Горит, при избытке О2 образует SO2 и воду, при недостатке-S и воду. Сероводород легко окисляется в водном растворе кислородом, галогенами. На восстановление I2 до HI в растворе основано определение H2S методом иодометрии. Сильные окислители (HNO3, Cl2) окисляют сероводород до Н2SO4.
2H2S + SO2 → 2H2O + 3S
3H2S + 8HNO3 → 3H2SO4 + 8NO + 4H2O
Сероводород взаимодействует с большинством металлов и их оксидами при нагревании в присутствии влаги и воздуха с образованием сульфидов металлов.
Ca + H2S → CaS + H2
CuO + H2S → CuS↓ + H2O
2NaOH + H2S → Na2S + 2H2O
CuCl + H2S → CuS↓ + 2HCl
С олефинами и гидроксидами, солями, спиртами, хлорароматическими соединениями, эпоксидами дает тиолы, с нитрилами –тиоамиды и другими соединениями S с водородом - сульфоны H2Sx.
На реакции H2S с солями тяжёлых металлов с образованием осадков основано определение сульфид-иона в растворе и атмосфере :
Pb(NO)3 + H2S → PbS↓(черный) + 2HNO3
В природе H2S встречается главным образом в месторождениях нефти и природного газа, а также в вулканических газах и водах минеральных источников; он растворен в глубоких (ниже 150-200 м) слоях воды Черного моря (концентрация сероводород у дна достигает 11-14 мл/л). сероводород постоянно образуется в природе при разложении белковых веществ.
Сероводород применяют в основном для производства S и H2SO4. Его используют также для получения различных сульфидов (в частности, сульфидов и гидросульфидов Na, NH4), сераорганических соединений (тиофены, тиолы и т. п.), тяжелой воды, для приготовления лечебных сероводородных ванн, в аналитической химии для осаждения сульфидов металлов. Взрывоопасен, ПДК (предельно допустимая концентрация) в воздухе 4,5-45,5% по объему.
Оксиды серы
Оксид серы (IV) SО2 - сернистый ангидрид ,бесцветный газ с резким запахом, угнетающе действующий на растения. Молекула SО2 изоэлектронна молекуле озона, имеет угловую форму: валентный угол O- S- O равен 119о. Кратность связи S- O составляет 1.5 .
Диоксид серы получают непосредственным сжиганием серы на воздухе или длительным отжигом сульфидов:
4FeS2 + 11O2→2Fe2O3 + 8SО2
SО2 хорошо растворяется в воде (39.3 объема в 1 объеме Н2О при 20оС, то есть около 10% по массе) с образованием гидратов SО2 . nH2O. Раствор имеет кислую реакцию, но в индивидуальном виде H2SO3 не выделена из-за ее термодинамической неустойчивости.
Восстановительные свойства SО2 обусловлены присутствием в его молекуле неподеленной электронной пары. SО2 взаимодействует с окислителями различной силы (свободные галогены, хлорная, бромная и иодная вода; растворы KMnO4,HNO3, H2SeO3 и др.), образуя различные производные S(VI):
I2 + SO2 + 2H2O = 2HI +H2SO4 ,
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
H2SeO3 + 2SO2 + H2O Se + 2H2SO4 .
SO2 + 2HNO3 → H2SO4 + 2NO2
Важнейший процесс для химической промышленности и экологии - окисление SO2кислородом до SO3 :
SO2+1/2O2 SO3,
в технике осуществляется при повышенной температуре с использованием катализатора :
V2O5+ К2O.
При отсутствии воды выше 210оС диоксид серы реагирует с NO2 с образованием нитрозилдисерной кислоты (NO)2S2O7:
2NO2 2NO + О2 ,
2SO2 + О2 2SO3,
2SO3 + NO2 + NO (NO)2S2O7.
В присутствии следов воды на стенках колбы обнаруживаются Н2SO4 и NOНSO4:
3NO2 + 2SO2 + H2O 2NOHSO4 + NO .
Нитрозилсерная кислота разлагается :
2NOHSO4 + Н2О 2H2SO4 + NO + NO2.
Ранее этот процесс использовался для получения серной кислоты.
При взаимодействии с более слабыми окислителями SО2 может окисляться до других степеней окисления. Например, при пропускании SО2 через взвесь MnO2 в воде образуется дитионат MnS2O6, производное серы(V).
2SO2 + MnO2 → MnS2O6 ,
Окислительные свойства SО2 проявляются при взаимодействии с сильными восстановителями, например, H2S :
2 H2S(г) + SО2(г) =3S + 2H2O(г).
С этим процессом связано образование свободной серы при вулканических процессах.
SO2 диспропорционирует в щелочном растворе с образованием сульфатов и сульфидов:
4SO2 + 8KOH → 3K2SO4 + K2S + 4H2O
Взвесь пыли металлического цинка в воде восстанавливает SO2 до производных серы (III) - дитионитов и дитионистой кислоты:
Zn + 2SO2 = ZnS2O4 или 2NaHSO3 + SO2 + Zn = ZnSO3 + Na2S2O4 + H2O.
Наличие неподеленной электронной пары в молекуле SO2 обусловливает не только восстановительные, но и комплексообразующие свойства, в частности, образование гидратов.
Молекула SO2 служит нейтральным лигандом в многочисленных комплексах с переходными металлами, например: [RuCl(NH3)4(SO2)]Cl.
Их образование протекает по донорно-акцепторному механизму, при этом молекула SO2 может присоединяться (координироваться) к атому металла через атом серы или атом кислорода и действовать как концевой (однодентатный) или мостиковый (бидентатный) лиганды.
Оксид серы (VI) – черный триоксид : SО3 производится каталитическим (V2O5, Pt, NO) окислением SO2 при 500оС для получения H2SO4. Он выделяется также при термическом распаде сульфатов металлов:
PbSO4 ←→ PbO + SO3
или дисульфатов:
BaS2O7 ←→ BaSO4 + SO3
При этом SО3 частично диссоциирует на SО2 и О2. В лаборатории чистый SО3 получают пропусканием его над P2O5. Образующийся продукт присоединения (аддукт) P2O5. SО3 при нагревании выделяет чистый SО3.
Кристаллический триоксид SО3 плавится при 16оС. Мономерная газообразная молекула SО3 имеет форму симметричного плоского треугольника с длиной связи S- O1.43˚A и не обладает дипольным моментом. Они связаны общими вершинами в циклические тримеры S3О9, напоминающие циклические метаполифосфаты и силикаты, или бесконечные спиральные цепи.
SО3 - одно из самых реакционноспособных соединений. Проявляет окислительные свойства. Серой и углеродом SО3 восстанавливается до SO2:
2SO3 + C 2SO2 + CO2.
Выше 500оС SО3 восстанавливается моноксидом СО:
SО3 + СО SO2 + СО2 .
Особенности взаимодействия SО3 с галогеноводородами связаны с ростом восстановительных свойств в ряду HCl- HBr- HI. Окислительные свойства SО3 усиливаются с повышением температуры. При нагревании SО3 реагирует с газообразным HCl, образуя хлорсерную кислоту HSO3Cl. При дальнейшем повышении температуры HCl восстанавливает SО3 до SO2 с одновременным выделением Cl2. При взаимодействии с HBr триоксид серы уже при 0оС восстанавливается до SO2:
2SO3+2HBr SO2+Br2+Н2SO4.
В жидком HI при -51оС немедленно выделяется I2, а SO3 восстанавливается до Н2 S.
Взаимодействие SО3 с газообразным Н2S протекает с образованием SO2, Н2О, S. Но при ~ - 78оС получается твердый аддукт SO3. Н2S - изомер тиосерной кислоты. При проведении этой реакции в сухом эфире образуется свободная тиосерная кислота:
SО3 действует как сильнейшая кислота Льюиса, образуя с оксидами металлов соответствующие сульфаты:
Fe2O3 + 3SO3 Fe2(SO4)3 .
и проявляет все свойства кислотных оксидов .
Серная кислота.
H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3:H2O < 1, то это водный раствор серной кислоты, если > 1, — раствор SO3 в серной кислоте.
Физические и химические свойства. Чистая 100 %-ная серная кислота (моногидрат) представляет собой бесцветную маслянистую жидкость, застывающую в кристаллическую массу при +10 °С. Реактивная серная кислота имеет обычно плотность 1,84 г/см3 и содержит около 95 % H2SO4. Затвердевает она лишь ниже -20 °С.
Температура плавления моногидрата равна 10,37 °С при теплоте плавления 10,5 кДж/моль. В обычных условиях он представляет собой очень вязкую жидкость с весьма высоким значением диэлектрической проницаемости (e = 100 при 25 °С).
В промышленности серную кислоту получают контактным( гетерогенный) и нитрозным ( гомогенный процесс) методами.
Химизм обоих методов одинаков и идет в несколько стадий:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
с той лишь разницей, что в контактном методе используется гетерогенный катализатор – V2O5 – для окисления SO2 в SO3 , а в нитрозном – катализатором служит газ –NO:
NO +1∕2 O2 → NO2
SO2 + NO2 → SO3 + NO
SO3 + H2O → H2SO4
H2SO4 - сильная двухосновная кислота.
H2SO4 H+ + HSO4- 2H+ + SO42-
Первая ступень (для средних концентраций) приводит к 100%-ой диссоциации, константа диссоциации второй ступени равна к2 = 10-2.
Серная кислота проявляет все свойства характерные кислотам – взаимодействует с металлами, оксидами, основаниями:
Zn + H2SO4(разб) ZnSO4 + H2
с основными оксидами:
CuO + H2SO4 CuSO4 + H2O
с гидроксидами:
H2SO4 + 2NaOH Na2SO4 + 2H2O
H2SO4 + Cu(OH)2 CuSO4 + 2H2O
обменные реакции с солями:
BaCl2 + H2SO4↓ BaSO4 + 2HCl
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
Концентрированная серная кислота широко используется в органической химии как водоотнимающее (дегидратирующее) средство:
С11H22O11 + H 2SO4 → 12C + H2SO4∙ 11H2O
HCOOH + H2SO4 → CO + H2SO4∙ H2O
C2H5OH + H2SO4 → C2H4 + H2SO4∙ H2O
с основными оксидами:
CuO + H2SO4 CuSO4 + H2O
с гидроксидами:
H2SO4 + 2NaOH Na2SO4 + 2H2O
H2SO4 + Cu(OH)2 CuSO4 + 2H2O
обменные реакции с солями:
BaCl2 + H2SO4↓ BaSO4 + 2HCl
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
с основными оксидами:
CuO + H2SO4 CuSO4 + H2O
с гидроксидами:
H2SO4 + 2NaOH Na2SO4 + 2H2O
H2SO4 + Cu(OH)2 CuSO4 + 2H2O
обменные реакции с солями:
BaCl2 + H2SO4↓ BaSO4 + 2HCl
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов
с основными оксидами:
CuO + H2SO4 CuSO4 + H2O
с гидроксидами:
H2SO4 + 2NaOH Na2SO4 + 2H2O
H2SO4 + Cu(OH)2 CuSO4 + 2H2O
обменные реакции с солями:
BaCl2 + H2SO4↓ BaSO4 + 2HCl
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
Концентрированная H2SO4 - сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до SO2, SO или H2S(Fe, Al, Cr – пассивируются в холодном растворе серной кислоты):
2Ag + 2H2SO4 Ag2SO4 + SO2 + 2H2O
8Na + 5H2SO4 4Na2SO4 + H2S + 4H2O
Концентрированная H2SO4 реагирует при нагревании с некоторыми неметаллами, превращаясь в соединения серы более низкой степени окисления:
С + 2H2SO4 CO2 + 2SO2 + 2H2O
S + 2H2SO4 3SO2 + 2H2O
2P + 5H2SO4 5SO2 + 2H3PO4 + 2H2O
Моногидрат (чистая, 100%-ая серная кислота) является ионизирующим растворителем, имеющим кислотный характер. В нём хорошо растворяются сульфаты многих металлов (переходя при этом в гидросульфаты), тогда как соли других кислот растворяются, как правило, лишь при возможности их сольволиза.
8.3 Селен
Селен (Selenium), природный Селен представляет собой смесь шести устойчивых изотопов - 74Se (0,87%), 76Se (9,01%), 77Se (7,58%), 78Se (23,52%), 80Se (49,82%), 82Se (9,19%). Из радиоактивных изотопов наибольшее значение имеет 75Se с периодом полураспада 121 сут. Элемент открыт в 1817 году И. Берцелиусом (название дано от греч. selene - Луна).
Природные соединения и получения. Селен - очень редкий и рассеянный элемент, его содержание в земной коре (кларк) 5·10-6% по массе. История селена в земной коре тесно связана с историей серы. Селен обладает способностью к концентрации и, несмотря на низкий кларк, образует 38 самостоятельных минералов - природных селенидов, селенитов, селенатов и других. Характерны изоморфные примеси селена в сульфидах и самородной сере.
В биосфере селен энергично мигрирует. Источником для накопления селена в живых организмах служат изверженные горные породы, вулканические дымы, вулканические термальные воды. Поэтому в районах современного и древнего вулканизма почвы и осадочные породы нередко обогащены селеном .
Селен получают из отходов сернокислотного, целлюлозно-бумажного производства и анодных шламов электролитического рафинирования меди. В шламах селен присутствует вместе с серой, теллуром, тяжелыми и благородными металлами. Для извлечения селена шламы фильтруют и подвергают либо окислительному обжигу (около 700 °С), либо нагреванию с концентрированной серной кислотой. Образующийся летучий SeO2 улавливают в скрубберах и электрофильтрах. Из растворов технический селен осаждают сернистым газом. Применяют также спекание шлама с содой с последующим выщелачиванием селената натрия водой и выделением из раствора селена. Для получения селена высокой чистоты, используемого в качестве полупроводникового материала, черновой селен рафинируют методами перегонки в вакууме, перекристаллизации и другими.
Физические и химические свойства селена. Конфигурация внешней электронной оболочки атома Se 4s24p4; у двух p-электронов спины спарены, а у остальных двух - не спарены, поэтому атомы селена способны образовывать молекулы Se2 или цепочки атомов Sen. Цепи атомов селена могут замыкаться в кольцевые молекулы Se8. Разнообразие молекулярного строения обусловливает существование селена в различных аллотропических модификациях: аморфной (порошкообразный, коллоидный, стекловидный) и кристаллической (моноклинный α- и β-формы и гексагональный γ-формы). Аморфный (красный) порошкообразный и коллоидный селен (плотность 4,25 г/см3 при 25 °С) получают при восстановлении из раствора селенистой кислоты H2SeO3, быстрым охлаждением паров селена и другими способами. Стекловидный (черный) селен (плотность 4,28 г/см3при 25 °С) получают при нагревании любой модификации селена выше 220 °С с последующим быстрым охлаждением. Стекловидный селен обладает стеклянным блеском, хрупок. Термодинамически наиболее устойчив гексагональный (серый) селен. Он получается из других форм селена нагреванием до плавления с медленным охлаждением до 180-210 °С и выдержкой при этой температуре. Решетка его построена из расположенных параллельно спиральных цепочек атомов. Атомы внутри цепей связаны ковалентно. Все модификации селена обладают фотоэлектрическими свойствами. Гексагональный селен вплоть до температуры плавления - примесный полупроводник с дырочной проводимостью. Селен - диамагнетик (пары его парамагнитны).
На воздухе селен устойчив; кислород, вода, соляная и разбавленная серная кислоты на него не действуют, хорошо растворим в концентрированной азотной кислоте и царской водке, в щелочах растворяется диспропорционируя:
Se + 4HNO3 → H2SeO3 + 4NO2 + H2O
3Se + 6KOH → K2SeO3 + 2K2Se + 3H2O
Селен в соединениях имеет степени окисления -2, + 2, + 4, +6. С кислородом селен образует ряд оксидов: SeO, Se2O3, SeO2, SeO3. Два последних являются ангидридами селенистой H2SeO3 и селеновой H2SeО4 кислот (соли -селениты и селенаты). Наиболее устойчив SeO2. SeO2 и H2SeO3 с сильными окислителями проявляют восстановительные свойства:
3H2SeO3 + HClO3 → 3H2SeO4 + HCl
С галогенами селен дает соединения SeF6, SeF4, SeCl4, SeBr4, Se2Cl2 и другие. Сера и теллур образуют непрерывный ряд твердых растворов с селеном. С азотом селен дает Se4N4, с углеродом -CSe2. Известны соединения с фосфором Р2Sе3, Р4Sе3, P2Se5. Водород взаимодействует с селеном при t>=200 °С, образуя H2Se; раствор H2Se в воде называется селеноводородной кислотой. При взаимодействии с металлами селен образует селениды. Получены многочисленные комплексные соединения селена. Все соединения селена ядовиты.
Применение селена. Благодаря дешевизне и надежности селен используется в преобразовательной технике в выпрямительных полупроводниковых диодах, а также для фотоэлектрических приборов (гексагональный), электрофотографических копировальных устройств (аморфный селен), синтеза различных селенидов, в качестве люминофоров в телевидении, оптических и сигнальных приборах, терморезисторах и т. п. селен широко применяется для обесцвечивания зеленого стекла и получения рубиновых стекол; в металлургии - для придания литой стали мелкозернистой структуры, улучшения механических свойств нержавеющих сталей; в химической промышленности - в качестве катализатора; используется селен также в фармацевтической промышленности и других отраслях.
8.4 Теллур
Природные соединения и получение. Основные. источники теллура-шламы электролитического рафинирования меди и шламы сернокислотного производства, а также щелочные дроссы рафинирования свинца . При переработке сернокислотных шламов методом обжига (см. Селен)теллур остается в огарке, который выщелачивают соляной кислотой. Из солянокислого раствора пропусканием SO2 осаждают Se, после чего р-р разбавляют до содержания кислоты 10-12% и при нагревании действием SO2 осаждают теллур.
При спекании шламов с содой и последующим выщелачивании теллур переходит в р-р и при нейтрализации осаждается в виде ТеО2. Теллур получают либо прямым восстановлением ТеО2 углем, либо осаждением при действии SO2 на солянокислые растворы ТеО2. При переработке шламов сульфидным методом (выщелачивание раствором Na2S) теллур выделяют из раствора (после осаждения Se аэрацией) действием сухого Na2S2O3:
Na2TeS3 + 2Na2SO3 → Те + 2Na2S2O3 + Na2S
При переработке медеэлектролитных шламов теллур в основном переходит в содовые шлаки, получающиеся при переплавке остатков на золото-серебряный сплав ("металл Дорэ"). При использовании сульфатизации часть теллура переходит в сульфатные растворы вместе с Си. Из них теллур осаждают действием металлической меди:
Н2ТеО3 + 4H2SO4 + 6Сu → Те + Си2Те + 4CuSO4 + 6Н2О
Из содовых шлаков теллур извлекают после растворения в воде либо нейтрализацией с осаждением ТеО2 (его очищают переосаждением из сульфидных или кислых растворов, растворяют в щелочи и выделяют теллур электролизом), либо прямо из содового раствора электролизом осаждают черновой теллур. Его восстанавливают А1 в щелочном растворе:
6Те + 2А1 + SNaOH → 3Na2Te2 + 2NaAlO2 + 4Н2О. Затем теллур осаждают аэрацией:
2Na2Te2 + 2Н2О + О2 → 4Те + 4NaOH
Для получения теллура высокой чистоты используют его летучие соединения, в частности ТеСl4, который очищают дистилляцией или ректификацией и экстракцией из солянокислого раствора. После гидролиза хлорида ТеО2 восстанавливают Н2. Иногда для очистки используют также Н2Те. На завершающих стадиях очистки применяют вакуумную сублимацию, дистилляцию или ректификацию теллура, а также зонную плавку или направленную кристаллизацию.
Физические и химические свойства. Теллур-серебристо-серое вещество с металлическим блеском, в тонких слоях на просвет-красно-коричневого цвета, в парах-золотисто-желтый. Расплав теллура выше ~ 700 °С обладает металлической проводимостью. Теллур диамагнитен, магн. восприимчивость — 0,31·10-9. Твердость по Моосу 2,3, по Бринеллю 180-270 МПа; сопротивление разрыву 10,8 МПа. Теллур хрупок, при нагревании становится пластичным.
Для теллура нормальный электродный потенциал 0,56 В. Теллур, даже дисперсный, устойчив на воздухе, но при нагревании горит (пламя голубое с зеленым ореолом) с образованием ТеО2 . Кристаллический теллур реагирует с водой выше 100°С, аморфный-выше 50 °С. Концентрированные растворы щелочей растворяют теллур с образованием теллуридов и теллуритов. Соляная кислота и разбавленная H2SO4 на теллур не действуют, конц. H2SO4 растворяет его, образующиеся красные растворы содержат катион. HNO3 окисляет теллур до теллуристой кислоты Н2ТеО3 (соли-теллуриты):
Te + HNO3→ H2TeO3 + 4NO2 + H2O
Сильными окислителями (HСlО3, КМnО4 и др.) окисляется до теллуровой кислоты Н2ТеО4 (соли-теллураты):
4Te + 3HClO4 + 4H2O → 4H2TeO4 + 3HCl
Te + 3H2O2 → H2TeO4 + 2H2O
Теллур растворяется в растворах сульфидов и полисульфидов щелочных металлов (с образованием тиотеллуридов и тио-теллуритов). Реагирует с растворами солей Ag. В CS2 не растворяется. С Сl2, F2 и Вr2 реагирует при комнатной т-ре, с I2-при нагревании, сплавляется с S, P (соединений при этом не образует), As (давая As2Te3), с Si (с образованием Si2Te3 и SiTe), с Se (образуя при кристаллизации твердые растворы). С бором и углеродом непосредственно не взаимодействует, с СО при нагревании образует газообразный нестойкий карбонил ТеСО. При сплавлении с металлами получают теллуриды.
Теллуроводород Н2Те-бесцветный газ с неприятным запахом; в жидком состоянии зеленовато-желтый, кристаллический-лимонно-желтый; т. кип. — 2°С, т. пл. — 51 °С; плотн. 5,81 г/л; для газа; а в сухом воздухе при комнатной температуре медленно разлагается, во влажном окисляется до теллура; при нагревании на воздухе горит, давая ТеО2; растворимость в воде 0,1 М, водный раствор-слабая кислота, К1 2·10-3; сильный восстановитель; получают взаимодействием Аl2Те3 с соляной кислотой, а также электролизом раствора H2SO4 с теллуровым катодом при 0°С; применяют для получения теллура высокой чистоты.
Гексафторид ТеF6-бесцветный газ; т. пл. — 37,8°С, т. возг. -38,6°С; плотн. 10,7 г/л; в сухом воздухе устойчив, не действует на стекло; в воде растворяется, постепенно гидролизуясь с образованием фторотеллуровых кислот ТеFn(ОН)6-n, где n — от 1 до 4, и в конечном счете теллуровой кислоты; с фторидами металлов образует соединения , напр. Ag[TeF7] и Ba[TeF8]; получают фторированием теллура при нагревании. Тетрафторид TeF4-кристаллы ромбической сингонии; т. пл. 129,6°С, т. кип. 194°С (с разложением); плотность 4,22 г/см3; очень гигроскопичен, легко гидролизуется; с фторидами щелочных металлов образует пентафторотеллураты M[TeF5]; получают действием SeF4 на ТеО2. Фториды теллурафторирующие агенты.
Тетрахлорид ТеС14-желтые кристаллы; т. пл. 224°С, т. кип. 381,8°С; плотн. 3,01 г/см3; ур-ние температурной зависимости давления пара \gp (мм рт. ст.) = 8,791 — - 3941/T (497 – 653); очень гигроскопичен, водой гидролизуется; в концентрированной НС1 раств., образуя хлоротел-луровую кислоту Н2ТеС16; из солянокислых растворов экстрагируется трибутилфосфатом и другими органическими растворителями ; с хлоридами щелочных металлов образует гекса- М2[ТеСl6] и пентахлортел-лураты М[ТеС15], с хлоридами Al, Fe(III), Zr и другие комплексы с катионами, например, ТеС13 [GaCl4]; получают хлорированием теллура; ТеСl4-исходное вещество для получения теллура высокой чистоты. Коричневый дихлорид ТеС12 устойчив в парах и может быть сконденсирован в жидкость. Получены также два кристаллических низших хлорида-серебристо-серый Те2Сl3 и метастабильный черный с металлическим блеском Те2Сl.
Осаждением из водных р-ров можно получить сульфиды TeS2 и TeS3, разлагающиеся при нагревании; известны TeS7 и Te7S10. Тиотеллураты (напр., Na2TeS3) могут быть получены растворением теллура в растворе полисульфидов щелочных металлов или сере -в растворах полителлуридов, а также сплавлением. Тиотеллураты-промежуточные продукты в некоторых процессах извлечения теллура.
Применение. Важнейшая область применения теллура—синтез разложения теллуридов, обладающих полупроводниковыми свойствами. Теллур используют также в металлургии для легирования чугуна и стали, Рb, Сu (для повышения их механической и химической стойкости). Теллур и его соединения применяют в производстве катализаторов, спец. стекол, инсектицидов, гербицидов и т.п.
Полоний
Природные соединения и получение полония. Радиоактивный химический элемент VI группы периодической системы, аналог теллура. Атомный номер 84. Не имеет стабильных изотопов. Известно 27 радиоактивных изотопов полония с массовыми числами от 192 до 218, из них семь (с массовыми числами от 210 до 218) встречаются в природе в очень малых количествах как члены радиоактивных рядов урана, тория и актиния, остальные изотопы получены искусственно. Наиболее долгоживущие изотопы полония – искусственно полученные 209Ро (t1/2 = 102 года) и 208Ро (t1/2 = 2,9 года), а также содержащийся в радиево-урановых рудах 210Ро (t1/2 = 138,4 сут). Содержание в земной коре 210Ро составляет всего 2·10–14%; в 1 т природного урана содержится 0,34 г радия и доли миллиграмма полония-210. Самый короткоживущий из известных изотопов полония – 21ЗРо (t1/2 = 3·10–7 с). Самые легкие изотопы полония – чистые альфа-излучатели, более тяжелые одновременно испускают альфа- и гамма-лучи. Некоторые изотопы распадаются путем электронного захвата, а самые тяжелые проявляют также очень слабую бета-активность . Разные изотопы полония имеют исторические названия, принятые еще в начале 20 в., когда их получали в результате цепочки распадов из «родительского элемента»: RaF (210Po), AcC" (211Po), ThC" (212Po), RaC" (214Po), AcA (215Po), ThA (216Po), RaA (218Po).
Полоний-210 синтезируют путем облучения нейтронами природного висмута (он содержит только 208Bi) в ядерных реакторах (промежуточно образуется бета-активный изотоп висмута-210): 208Bi + n→210Bi → 210Po + e. При облучении висмута ускоренными протонами образуется полоний-208, его отделяют от висмута возгонкой в вакууме – как это делала М.Кюри. В СССР методику выделения полония разработала Зинаида Васильевна Ершова (1905–1995). В 1937 она была командирована в Париж в Институт радия в лабораторию М.Кюри (руководимую в то время Ирэн Жолио-Кюри). В результате этой командировки коллеги стали называть ее «русской мадам Кюри». Под научным руководством З.В.Ершовой в стране было создано постоянно действующее, экологически чистое производство полония, что позволило реализовать отечественную программу запуска луноходов, в которых полоний использовали в качестве источника тепла.
Долгоживущие изотопы полония пока не получили заметного практического применения из-за сложности их синтеза. Для их получения можно использовать ядерные реакции
207Pb + 4He 208Po + 3n,
208Bi + 1H 208Po + 2n,
208Bi + 2D 208Po + 3n,
208Bi + 2D 208Po + 2n,
где 4Не – альфа-частицы, 1Н – ускоренные протоны, 2D – ускоренные дейтроны (ядра дейтерия).
Свойства полония. Уже теллур частично проявляет металлические свойства, полоний же – мягкий серебристо-белый металл. Из-за сильной радиоактивности светится в темноте и сильно нагревается, поэтому нужен непрерывный отвод тепла. Температура плавления полония 254° С (чуть выше, чем у олова), температура кипения 962° С, поэтому уже при небольшом нагревании полоний возгоняется. Плотность полония почти такая же, как у меди – 9,4 г/см3. В химических исследованиях применяется только полоний-210, более долгоживущие изотопы практически не используются ввиду трудности их получения при одинаковых химических свойствах.
Химические свойства металлического полония близки к свойствам его ближайшего аналога – теллура, он проявляет степени окисления –2, +2, +4, +6. На воздухе полоний медленно окисляется (быстро при нагревании до 250° С) с образованием красного диоксида РоО2 (при охлаждении он становится желтым в результате перестройки кристаллической решетки). Сероводород из растворов солей полония осаждает черный сульфид PoS.
Сильная радиоактивность полония отражается на свойствах его соединений. Так, в разбавленной соляной кислоте полоний медленно растворяется с образованием розовых растворов (цвет ионов Ро2+):
Po + 2HCl PoCl2 + H2,
однако под действием собственной радиации дихлорид превращается в желтый PoCl4. Разбавленная азотная кислота пассивирует полоний, а концентрированная быстро его растворяет:
Po + 8HNO3 → Po(NO3)4 + 4NO2 + 4H2O
С неметаллами VI группы полоний роднит реакция с водородом с образованием летучего гидрида РоН2 (т.пл. –35° С, т.кип. +35° С, легко разлагается), реакция с металлами (при нагревании) с образованием твердых полонидов черного цвета (Na2Po, MgPo, CaPo, ZnPo, HgPo, PtPo и др.) и реакция с расплавленными щелочами с образованием полонидов:
3Po + 6NaOH 2Na2Po + Na2PoO3 + H2O.
С хлором полоний реагирует при нагревании с образованием ярко-желтых кристаллов PoCl4, с бромом получаются красные кристаллы PoBr4, с иодом уже при 40° С полоний реагирует с образованием черного летучего иодида PoI4. Известен и белый тетрафторид полония PoF4. При нагревании тетрагалогениды разлагаются с образованием более стабильных дигалогенидов:
PoCl4 PoCl2 + Cl2.
В растворах полоний существует в виде катионов Ро2+, Ро4+, анионов РоО32–, РоО42–, также разнообразных комплексных ионов, например, PoCl62–.
Применение полония. Полоний-210 испускает альфа-лучи с энергией 5,3 МэВ, которые в твердом веществе тормозятся, проходя всего тысячные доли миллиметра и отдавая при этом свою энергию. Время его жизни позволяет использовать полоний как источник энергии в атомных батареях космических кораблей: для получения мощности 1 кВт достаточно всего 7,5 г полония. В этом отношении он превосходит другие компактные «атомные» источники энергии. Такой источник энергии работал, например, на «Луноходе-2», обогревая аппаратуру во время долгой лунной ночи. Конечно, мощность полониевых источников энергии со временем убывает – вдвое каждые 4,5 месяца, однако более долгоживущие изотопы полония слишком дороги. Полоний удобно применять и для исследования воздействия альфа-излучения на различные вещества. Как альфа-излучатель, полоний в смеси с бериллием применяют для изготовления компактных источников нейтронов:
9Be + 4He 12C + n.
Вместо бериллия в таких источниках можно использовать бор. Сообщалось, что в 2004 инспекторы международного агентства по атомной энергии (МАГАТЭ) обнаружили в Иране программу по производству полония. Это привело к подозрению, что он может быть использован в бериллиевом источнике для «запуска» с помощью нейтронов цепной ядерной реакции в уране, приводящей к ядерному взрыву.
Полоний при попадании в организм можно считать одним из самых ядовитых веществ: для 210Ро предельно допустимое содержание в воздухе составляет всего 40 миллиардных долей микрограмма в 1 м3 воздуха, т.е. полоний в 4 триллиона раз токсичнее синильной кислоты. Вред наносят испускаемые полонием альфа-частицы (и в меньшей мере также гамма-лучи), которые разрушают ткани и вызывают злокачественные опухоли. Атомы полония могут образоваться в легких человека в результате распада в них газообразного радона. Кроме того, металлический полоний способен легко образовывать мельчайшие частицы аэрозолей. Поэтому все работы с полонием проводят дистанционно в герметичных боксах.
Открытие полония. Существование элемента с порядковым номером 84 было предсказано Д.И.Менделеевым в 1889 – он назвал его двителлуром (на санскрите – «второй» теллур) и предположил, что его атомная масса будет близка к 212. Конечно, Менделеев не мог предвидеть, что этот элемент окажется неустойчивым. Полоний – первый радиоактивный элемент, открытый в 1898 супругами Кюри в поисках источника сильной радиоактивности некоторых минералов. Когда оказалось, что урановая смоляная руда излучает сильнее, чем чистый уран, Мария Кюри решила выделить из этого соединения химическим путем новый радиоактивный химический элемент. До этого было известно только два слабо радиоактивных химических элемента – уран и торий. Кюри начала с традиционного качественного химического анализа минерала по стандартной схеме, которая была предложена немецким химиком-аналитиком К.Р.Фрезениусом (1818–1897) еще в 1841 и по которой многие поколения студентов в течение почти полутора веков определяли катионы так называемым «сероводородным методом». Вначале у нее было около 100 г минерала; затем американские геологи подарили Пьеру Кюри еще 500 г. Проводя систематический анализ, М.Кюри каждый раз проверяла отдельные фракции (осадки и растворы) на радиоактивность с помощью чувствительного электрометра, изобретенного ее мужем. Неактивные фракции отбрасывались, активные анализировались дальше. Ей помогал один из руководителей химического практикума в Школе физики и промышленной химии Густав Бемон.
Прежде всего, Кюри растворила минерал в азотной кислоте, выпарила раствор досуха, остаток растворила в воде и пропустила через раствор ток сероводорода. При этом выпал осадок сульфидов металлов; в соответствии с методикой Фрезениуса, этот осадок мог содержать нерастворимые сульфиды свинца, висмута, меди, мышьяка, сурьмы и ряда других металлов. Осадок был радиоактивным, несмотря на то, что уран и торий остались в растворе. Она обработала черный осадок сульфидом аммония, чтобы отделить мышьяк и сурьму – они в этих условиях образуют растворимые тиосоли, например, (NH4)3AsS4 и (NH4)3SbS3. Раствор не обнаружил радиоактивности и был отброшен. В осадке остались сульфиды свинца, висмута и меди.
Не растворившуюся в сульфиде аммония часть осадка Кюри снова растворила в азотной кислоте, добавила к раствору серную кислоту и выпарила его на пламени горелки до появления густых белых паров SO3. В этих условиях летучая азотная кислота полностью удаляется, а нитраты металлов превращаются в сульфаты. После охлаждения смеси и добавления холодной воды в осадке оказался нерастворимый сульфат свинца PbSO4 – радиоактивности в нем не было. Осадок она выбросила, а к отфильтрованному раствору добавила крепкий раствор аммиака. При этом снова выпал осадок, на этот раз – белого цвета; он содержал смесь основного сульфата висмута (BiO)2SO4 и гидроксида висмута Bi(OH)3. В растворе же остался комплексный аммиакат меди [Cu(NH3)4]SO4 ярко-синего цвета. Белый осадок, в отличие от раствора, оказался сильно радиоактивным. Поскольку свинец и медь были уже отделены, в белом осадке был висмут и примесь нового элемента.
Кюри снова перевела белый осадок в темно-коричневый сульфид Bi2S3, высушила его и нагрела в вакуумированной ампуле. Сульфид висмута при этом не изменился (он устойчив к нагреву и лишь при 685° С плавится), однако из осадка выделились какие-то пары, которые осели в виде черной пленки на холодной части ампулы. Пленка была радиоактивной и, очевидно, содержала новый химический элемент – аналог висмута в периодической таблице. Это был полоний – первый после урана и тория открытый радиоактивный элемент, вписанный в периодическую таблицу (в том же 1898 году были открыты радий, а также группа благородных газов – неон, криптон и ксенон). Как потом выяснилось, полоний при нагревании легко возгоняется – его летучесть примерно такая же, как у цинка.
Супруги Кюри не спешили назвать черный налет на стекле новым элементом. Одной радиоактивности было мало. Коллега и друг Кюри французский химик Эжен Анатоль Демарсе (1852–1903), специалист в области спектрального анализа (в 1901 он открыл европий), исследовал спектр испускания черного налета и не обнаружил в нем новых линий, которые могли бы свидетельствовать о присутствии нового элемента. Спектральный анализ – один из самых чувствительных методов, позволяющий обнаруживать многие вещества в микроскопических, невидимых глазом количествах. Тем не менее, в статье, опубликованной 18 июля 1898 супруги Кюри написали: «Мы думаем, что вещество, выделенное нами из урановой смолки, содержит не известный пока металл, являющийся по аналитическим свойствам аналогом висмута. Если существование нового металла будет подтверждено, мы предлагаем назвать его полонием, по родине одного из нас» (Polonia на латыни – Польша). Это единственный случай, когда еще не идентифицированный новый химический элемент уже получил название. Однако получить весовые количества полония не удалось – его в урановой руде было слишком мало (позднее полоний был получен искусственно). И прославил супругов Кюри не этот элемент, а радий.

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ