Конспект урока для 8 класса "Кислород химический элемент и простое вещество"
«Утверждено» «Рассмотрено»
Директор школы: ________________ Зам УВР: ________________
Урок № 34 дата____________
Краткосрочное планирование урока по химии -8 класс
Тема урока: Кислород химический элемент и простое вещество
Лабораторный опыт № 4 получение кислорода разложением пероксида водорода в присутствии
Цель урока: Формирование системы знаний о химическом элементе кислороде, его распространенности и роли в природе.
Усвоение понятий “аллотропия”, “аллотропные модификации” при сравнении состава, строения, свойств, изучение роли в природе и жизни человека кислорода и озона.сравнивать химические объекты и давать им сравнительную характеристику и
Оборудование: Презентация, постер, карточки Для опыта «Получение кислорода разложением пероксида водорода в присутствии катализатора»: металлический штатив, перекись водорода (3%-ный раствор), оксид марганца (IV), колба, воронка с краном, газоотводная трубка, химический стаканчик для собирания кислорода методом вытеснения воздуха, лучинка, спички.
Для опыта «Несгораемый платок»: спирт, вода, щипцы, носовой платок, два маленьких кристаллизатора, спички.Коллекция «Минералы»
Ход урока
Этапы урока
Методы и приемы
Действие учителя
Действие ученика
Ст. вызова
Приветствие
Наш урок посвящен химическому элементу и веществу им образованному, который занимает особое место в жизни человека и всего живого.
В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно без …
На уроке вы больше узнаете о химическом элементе — кислороде, о простых веществах — кислороде и озоне, выясните, что такое аллотропия и аллотропные модификации, а также узнаете, как и кем был открыт кислород. Попытаемся получить его в лаборатории, собрать и доказать его наличие в сосуде. Запишете тему урока в своих тетрадях.
Учитель: На доске составляем план характеристику химического элемента кислорода. Выйти к доске и записать этот план (по желанию). Все остальные это делают в тетради.
Как вы думаете, в каком виде кислород содержится в природе? Какие образует вещества? Ответы учащихся могут быть разными. Для того, чтобы познакомиться с этим вопросом, посмотрим презентацию учащихся. Посмотрев ее, ответьте на эти вопросы.
Далее- презентация к уроку


Приветствие
Ученики: Без кислорода
План характеристика химического элемента:
Символ — О
Положение в ПСХЭМ — VI Г (А)
II период
Порядковый номер — 8.
Химическая природа — неметалл.
Относительная атомная масса — Ar (O) = 16
Валентность — II.
Основная часть урока
Презентация к уроку
 Учитель: Кислород можно получить и разложением других кислородсодержащих веществ в присутствии катализаторов.
Учитель: Кислород можно получить и разложением других кислородсодержащих веществ в присутствии катализаторов.
Катализаторы – это вещества, которые ускоряют ход химической реакции, но сами при этом не расходуются.
Реакции, протекающие с участием катализаторов, называются каталитическими реакциями. Например, разложение бертолетовой соли (хлората калия).
Примечание: Ученики записывают определение понятий в тетради.
Затем идет презентация учителя (просмотр уравнения химической реакции разложения бертолетовой соли в присутствии катализатора MnO2). Учащиеся переписывают уравнение химической реакции в свои тетради.
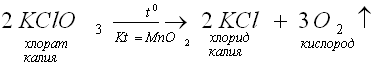

Учитель: А теперь попробуем сами получить кислород и доказать наличие газа в сосуде. У вас на столе стоит одна пробирка с оксидом марганца (IV) MnO2, в бутылочках пероксид водорода H2O2, лучинка, спички, спиртовка, пробиркодержатель.
Возьмите пробирку с черным порошком MnO2 (это катализатор), добавьте несколько миллилитров пероксида водорода. Сразу же жидкость начинает вскипать, бурно выделяя газ. Спиртовку зажгите и внесите лучинку. Тлеющую лучинку внесите в пробирку с газом. Лучинка ярко вспыхивает и горит до тех пор ,пока выделяется кислород. Кислород поддерживает горение.
Итак, мы провели каталитическую реакцию разложения пероксида водорода.
Посмотрим на презентации уравнение реакции разложения пероксида водорода в присутствии катализатора — оксида марганца (IV) и запишем его в тетрадь.
Примечание: Учитель демонстрирует уравнение реакции.
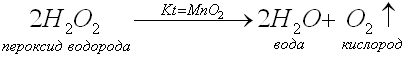
Учитель: А как же кислород получают в промышленности?


Основные понятия:
химический элемент кислород, аллотропия, аллотропные модификации, простые вещества — кислород и озон; катализаторы.
Знакомятся с презентацией к уроку
Запишем уравнение реакции разложения перманганата калия при нагревании:
![]()
Так как кислород тяжелее воздуха и малорастворим в воде, собирают его двумя методами:
а) методом вытеснения воздуха
б) методом вытеснения воды
Практическое применение полученых знаний
Проблемный вопрос
Подведем итоги сегодняшнего урока. На уроке мы познакомились с химическим элементом кислородом, с его аллотропными модификациями — кислородом и озоном, их составом, строением, а так же познакомились с историей открытия кислорода, способами его получения в лаборатории и в промышленности, методами собирания и обнаружения этого газа. Узнали, что такое катализаторы, каталитические реакции.
Ставим перед учащимися проблемный вопрос: Почему на картинке кислород в виде жидкости голубого цвета?
Слайд 8

Рис. 1
Задание для учащихся: расставьте коэффициенты в данных уравнениях реакций.
Учитель: Проверим, внимание на экран.
Учитель: Вопрос для учащихся: из какого вещества еще можно получить кислород?
Ученик: Электролиз воды
![]()
Записываем в тетрадь определение:
Электролиз – действие постоянного электрического тока.
А теперь обобщаем способы собирания кислорода, которые вы сегодня видели на уроке.

Рис. 8

Рис. 9
Собирание кислорода методом вытеснения воды
Собирание кислорода методом вытеснения воздуха
Учитель: В завершении урока, проверим свои знания.
Отвечают на вопрос
Ответ учащихся (дополняет учитель): Этот кислород в сжиженном состоянии, а жидкий кислород голубого цвета.
Теперь давайте обобщим и запишем в тетрадь разные способы получения кислорода, которые мы сегодня с вами наблюдали.
Слайд 12
Способы получения кислорода: I. Лабораторные способы:
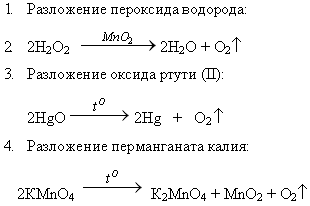
1. Разложение пероксида водорода:
![]()
2. Разложение оксида ртути (II):![]()
3. Разложение перманганата калия:
![]()
Закрепление
Беседа по вопросам
Тест
Неверные суждения
Агрегатное состояние – газ.
Цвет – без цвета
Запах – без запаха
Растворимость в воде – плохо растворим
t° кип. – 183°С
Электропроводность – неэлектропроводен
Теплопроводность – плохо проводит тепло (плохая)
Тяжелее воздуха
Тест
Часть А.
1. Чтобы доказать наличие в сосуде кислорода, а не воздуха, проще всего использовать:
А) разницу в плотности воздуха и кислорода;
Б) совпадение цвета;
В) тлеющую лучинку;
Г) разницу в степени растворимости в воде
2. Впервые об открытии кислорода сообщил:
A) К. Шееле;
Б) Д. Пристли;
B) А. Лавуазье;
Г) М.Ломоносов.
3. Свойство вещества кислорода:
А) газ с резким запахом;
Б) твердое вещество;
В) тяжелее воздуха;
Г) газ желто-зеленого цвета.
Часть В.
4. Для получения кислорода в лаборатории мы не использовали вещество, формула которого:
а) H2O; б) KMnO4; в) H2O2; г) Fe3O4.
Часть С.
5. Почему в историю открытия кислорода записана фамилия Пристли как первооткрывателя, а не Шееле?
A) Он первым получил кислород в истории химии;
Б) Он первым опубликовал свою работу по получению кислорода;
B) Он первым поставил биологические опыты;
Г) Он первым установил, что кислород содержится в воздухе.
Тест
Вариант 2.
Часть А.
1. Самый распространенный элемент в земной коре?
А) железо;
Б) кислород;
В) кремний;
Г) алюминий.
2. Кислород впервые был получен:
А) нагреванием бертолетовой соли;
Б) разложением воды электрическим током;
В) разложением перманганата калия;
Г) разложением оксида ртути (II) при нагревании.
3. В каком веке был открыт кислород?
А) XVII;
Б) XVI;
В) XVIII;
Г) XIX.
Часть В.
4. Кислород можно получить в лаборатории и собрать:
А) вытеснением воды и воздуха в пробирку, расположенную отверстием
вниз;
Б) над водой и вытеснением воздуха в пробирку, расположенную дном вниз;
В) только вытеснением воды;
Г) только вытеснением воздуха в пробирку, расположенную дном вниз.
Часть С.
5. Что делать, если пролилась ртуть?
А) Оставить её испаряться.
Б) Засыпать измельчённой серой и удалить через некоторое время.
В) Аккуратно собрать, и выбросить в мусорный ящик.
Г) Собрать ртуть и вылить в раковину.
Вычеркните неверные суждения. Самопроверка.
В промышленности получают из воздуха.
Сложное вещество.
При обычных условиях бесцветный газ.
Собирают вытеснением воздуха
В природе встречается только в составе сложных веществ.
Собирают в перевернутый вверх дном сосуд.
В лаборатории получают из перекиси водорода.
Газ, имеющий запах.
Поддерживает горение.
Тяжелее воздуха.
Входит в состав минералов, горных пород, песка, воды.
При обычных условиях жидкость.
Входит в состав воздуха.
Образуется в природе в процессе фотосинтеза.
Отвечают на вопросы
1вопрос-1балл
Все задания выполняются в тетради
Рефлексия
беседа с учащимися
Что запомнилось с урока?
Что для вас было самым интересным на уроке?
С какими трудностями столкнулись в течении урока?
Что не понравилось в уроке?
Как вы считаете , на какую оценку поработали?
Отвечают на вопросы
Д/задание
Творческое задание: Одно из веществ, при разложении которого получается О2 это оксид ртути, чрезвычайно опасное вещество, ученый Пристли из него с помощью лупы, собирая солнечные лучи для нагревания, получил кислород. А первооткрывателем не является. Почему? И кому принадлежит право открытия кислорода. Найти ответ на этот вопрос, оформить в виде небольшого сообщения.
Записывают в дневники
Итоги

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ