Конспект урока по Химии "Окислительно-восстановительные реакции" 8 класс
Санкт-Петербургское государственное автономное
профессиональное образовательное учереждение
« морской технический колледж»
Методические указания
к практической работе по теме:
«Окислительно-восстановительные реакции»
(для студентов дневного отделения)
Дисциплина ХИМИЯ
Автор Бачило Т.П.
Санкт Петербург
2014
Пояснительная записка
Данные методические указания предназначены для студентов 1 курса дневного отделения.
Методические указания содержат краткий теоретический материал по теме:«Окислительно-восстановительные реакции»
При необходимости студенты могут обратиться к следующим источникам информации:
1. Габриелян О.С. Химия: учебник для студ.сред.проф.учеб. заведений
/4 изд./, стер. – М: Издательский центр «Академия», 2008.-336с.
2. Берман Н.И. «Решение типовых задач», ФО «Слово», 1996г., 574с.
Окислительно-восстановительные реакции.
Окислительно-восстановительные процессы идут с изменением степеней окисления элементов, участвующих в них.
Степень окисления – это условный заряд атома, который вычисляется исходя из допущения, что молекула состоит из атомов.
Окислитель – это атом, ион или вещество их содержащее, который принимает электрон.
Восстановитель – это атом, ион или вещество их содержащее, который отдает электрон.
Окисление – это процесс отдачи электронов.
Восстановление – это процесс приема электронов.
Сокращения:
окислитель – о-ль,
восстановитель – в-ль,
окисление – о-ние,
восстановление – в-ние,
окислительно-восстановительные реакции – ОВР,
степень окисления – с.о.
Правила определения степени окисления:
1) С.о. элемента в простом веществе = 0;
2) Максимальная положительная с.о. элемента = номеру группы в которой стоит элемент (исключения- О2+, F0, элементы побочной подгруппы 8 группы);
3) Минимальная степень окисления = 8 – номер группы в которой стоит элемент
( только для элементов главных подгрупп 4-7 групп);
4) Сумма степеней окисления всех элементов в сложном веществе равна 0.
Алгоритм составления уравнений электронного баланса.
![]()
1) Расставить с.о. элементов.
![]()
2) Выписать те элементы, у которых изменились с.о.
 P0 P+5
P0 P+5
 O02 2O-2
O02 2O-2
3) Электронами сбалансировать разницу в с.о.
![]()
4) Найдите наименьшее общее кратное для количества электронов участвующих в процессе.

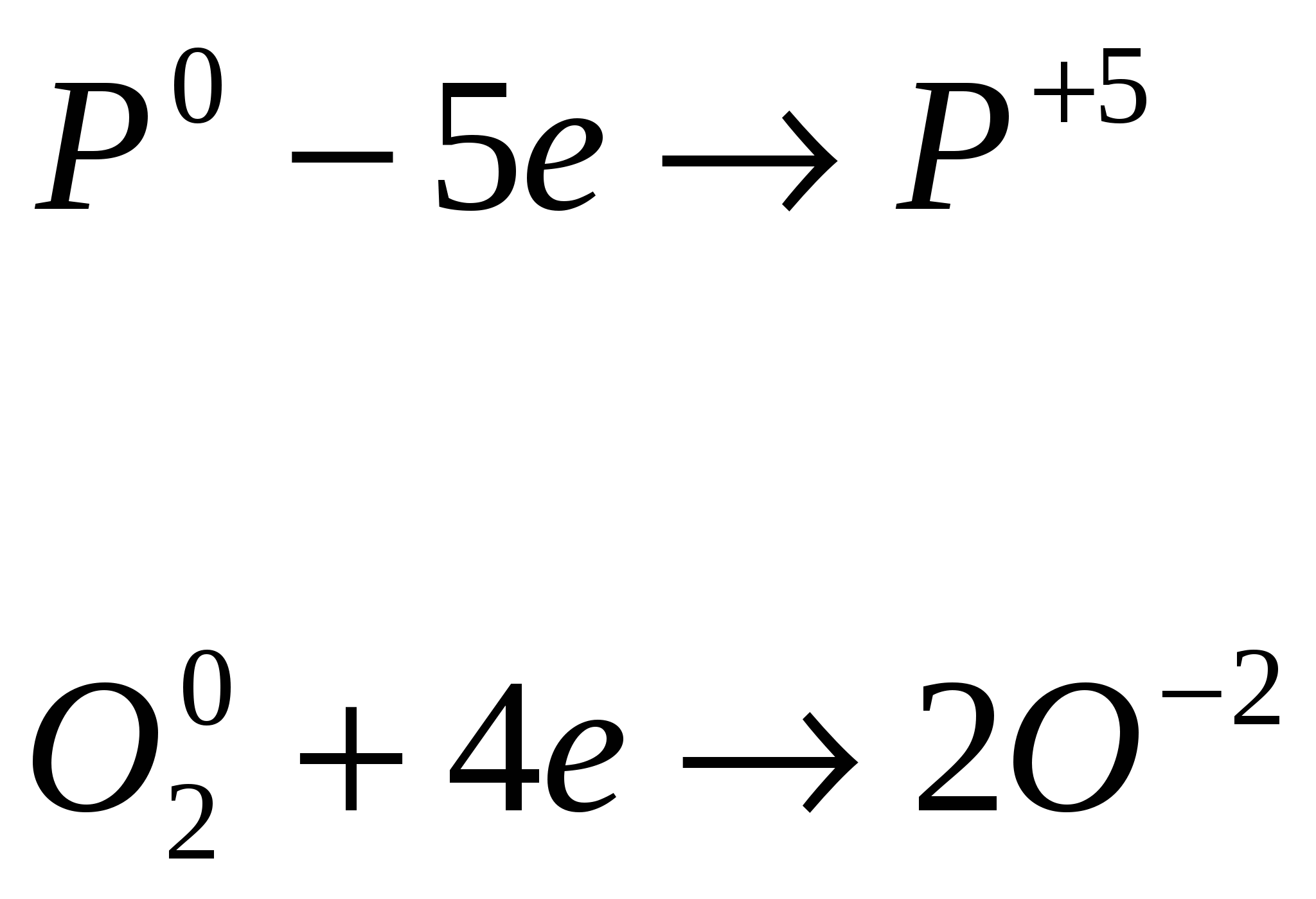 20
20
5) Определить коэффициенты.


![]() 4
4
20
![]() 5
5
6) Уравнять уравнение ОВР.
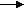 4P+5O2 2P2O5
4P+5O2 2P2O5
7) Определить о-ль, в-ль, процессы о-ния, в-ния.


в-ль ![]() 4
4
20
о-ль ![]() 5
5
Практическая работа по теме:
«Уравнения окислительно – восстановительных реакций»
Цель работы:
знать определение химического уравнения;
понятия: окислитель, восстановитель, окисление, восстановление;
уметь: определять значение степени окисления элементов; составлять схему смещения электронов; определять процессы окисления и восстановления; определять функции веществ в окислительно-восстановительных реакциях; расставлять коэффициенты методом электронного баланса;
Задание: из таблицы №1 выбрать по своему варианту номера заданий.
Таблица №1
№ варианта (по журналу)
№ задания
1
1,17,32,77,101,126
2
2,7,18,78,102,127
3
3,9,15,79,103,128
4
4,14,21,80,104,129
5
10,16,30,81,105,130
6
13,24,28,82,106,131
7
19,25,33,83,107,132
8
22,29,40,84,108,133
9
26,38,43,85,109,134
10
23,39,45,86,110,135
11
34,42,46,87,111,136
12
27,37,50,88,112,137
13
35,41,48,89,113,138
14
36,44,51,90,114,139
15
52,49,73,91,115,140
16
53,47,57,92,116,34
17
19,56,72,93,117,54
18
55,64,69,94,118,25
19
58,61,66,95,119,89
20
59,62,67,96,120,90
21
60,63,68,97,121,56
22
65,70,74,98,122,58
23
5,71,75,99,123,66
24
8,31,39,100,124,34
25
11,12,76,90,125,65
Расставьте степени окисления атомов, подберите коэффициенты методом электронного баланса.

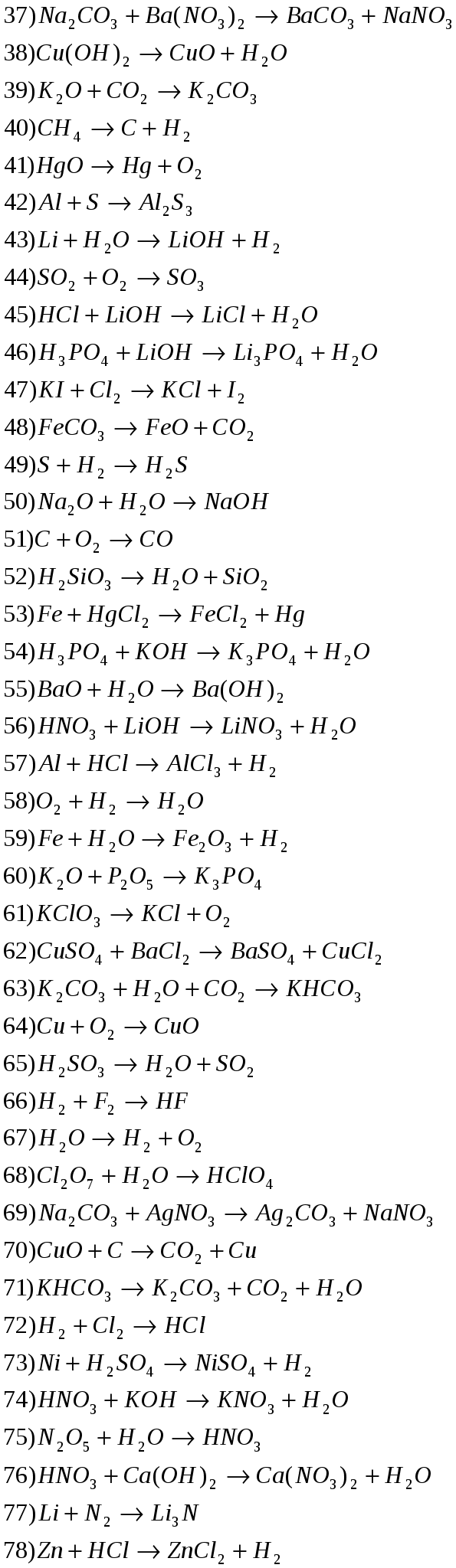
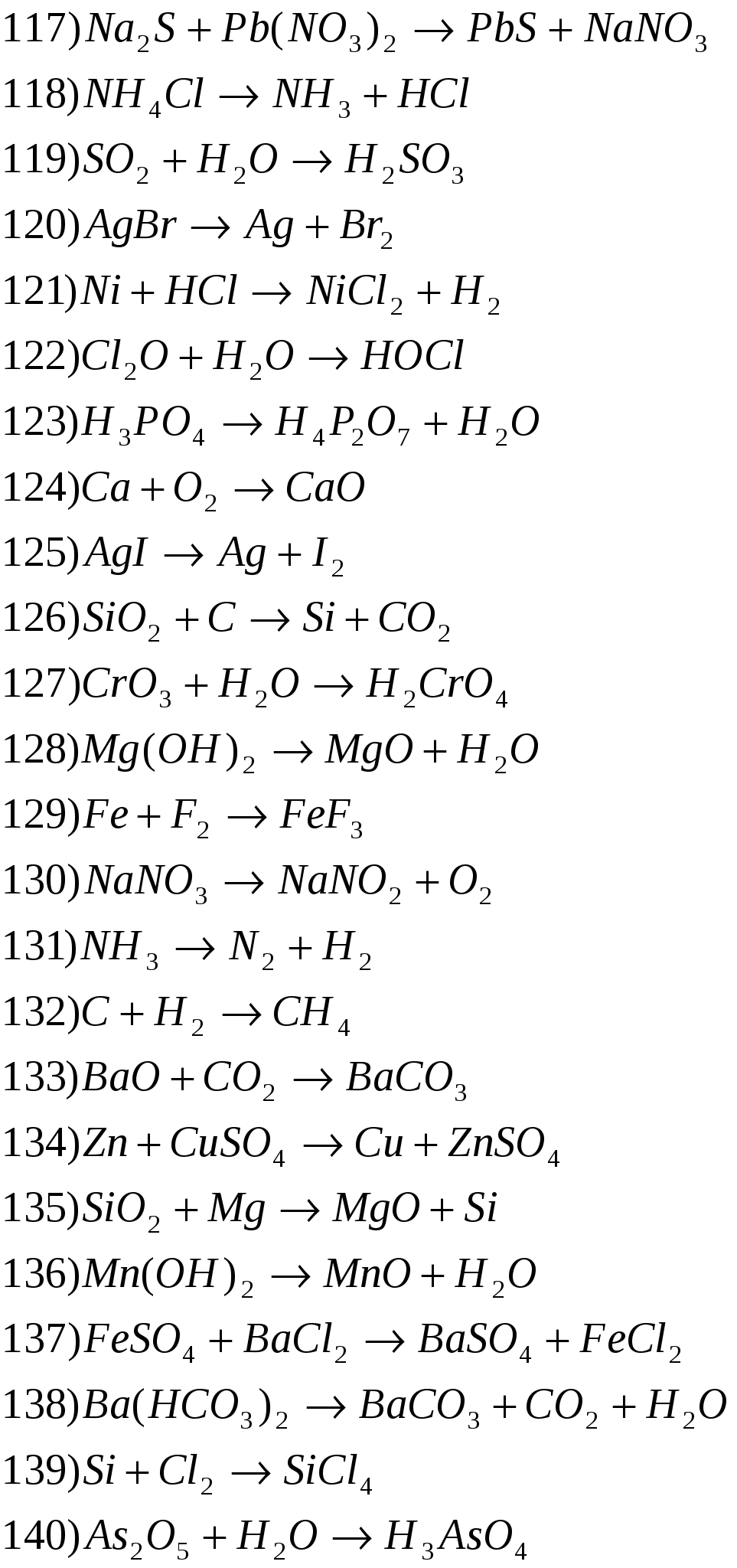

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ