Лекарственные препараты
1
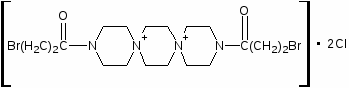
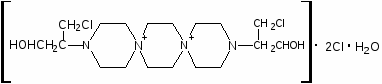
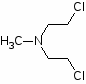

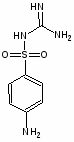
Содержание
Вопрос №1. Сульфаниламидные препараты. Какие препараты получены в результате модификации амидной группы белого стрептоцида? 2
Вопрос №2. Антибиотики. Тетрациклины. Структура. Отдельные представители. 4
Антибиотики 4
Тетрациклины. Структура 6
Отдельные представители: 7
Вопрос №3. Противоопухолевые препараты. Механизм действия алкилирующих препаратов. 9
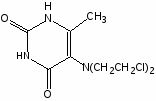
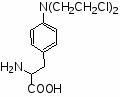
Вопрос №1. Сульфаниламидные препараты. Какие препараты получены в результате модификации амидной группы белого стрептоцида?
Важным этапом в развитии химиотерапии до наступления эры антибиотиков надо считать создание мощных антимикробных средств, эффективных против граммположительных и граммотицательных бактерий, что связано с появлением сульфаниламидных препаратов.
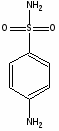
Простейший представитель этой группы – амид сульфаниловой кислоты, или сульфаниламид (белый стрептоцид), был известен еще с 1908 г. как один из компонентов при синтезе красителей; его второе рождение произошло в 1935 г., когда Г. Домарк в германии открыл антимикробную активность пронтозила, или красного стрептоцида. Было установлено, что пронтозил неактивен in vitro, но проявляет эффект in vivo, поскольку при разложении в организме превращается в активный сульфаниламид. Механизм бактериостатического действия сульфамидов связан с их вмешательством в биосинтез фолиевой кислоты – соединения, которое необходимо для жизнедеятельности бактерий. Фолиевая кислота представляет собой N-птериол-L-глутаминовую кислоту; благодаря химическому сходству с парааминобензойной кислотой (ПАБК) сульфаниламиды блокируют ее включение в фолиевую кислоту. Нарушение же синтеза фолиевой кислоты препятствует образованию из нее фолиновой (5,6,7,8-тетрагидрофолиевой) кислоты, необходимой для синтеза пуриновых и пиримидиновых оснований нуклеиновых кислот. В тканях человека это не происходит, так как они утилизируют уже готовую фолиевую кислоту, чем и объясняется избирательность действия сульфаниламидов.
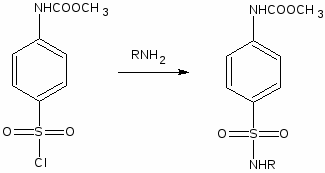
Ряд сульфаниламидных препаратов получен путем введения в сульфонамидную группу остатков гетероциклических оснований. Введение дополнительных заместителей позволяет пролоногировать действие препаратов, улучшить проникновение их в жидкости и ткани организма и тем самым увеличить эффективность действия.
Введение гетероциклицеских заместителей обычно осуществляют по реакции сульфонилхлорида с аминопроизводными гетероциклов:
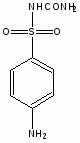
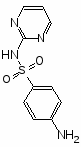
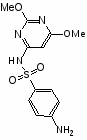
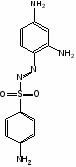
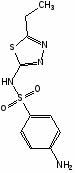
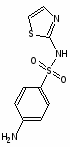
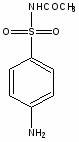
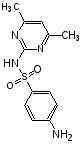
Сульфаниламидные препараты, полученные в результате модификации амидной группы белого стрептоцида:
Таблица 1
Бел. стрептоцид
Сульгин
Сульфадимезин
Альбуцид
Нурсульфазол
Этазол
Кр. стрептоцид
Сульфа
диметоксин
Сульфазин
Уросульфан
Сульфален
Вопрос №2. Антибиотики. Тетрациклины. Структура. Отдельные представители.
Антибиотики
Антибиотики – это химические вещества, образуемые микроорганизмами, которые обладают способностью подавлять рост или даже разрушать бактерии и другие микроорганизмы. Это определение дано С. Ваксманом.
Однако З. В. Ермольева дает более широкое толкование этому понятию: “Антибиотики – вещества природного происхождения, обладающие выраженной биологической активностью. Они могут быть получены из микробов, растительных и животных тканей, синтетическим путем”.
Микробиологические основы химиотерапии инфекционных заболеваний.
Каждый антибиотик обладает специфическим избирательным действием на определенные виды микробов. Благодаря такому избирательному действию многие антибиотики способны подавлять жизнедеятельность патогенных микроорганизмов в безвредных для организма концентрациях. Такие антибиотики широко используют для лечения различных инфекционных болезней.
Основными продуцентами антибиотиков служат микроорганизмы, обитающие в почве и воде, где они постоянно вступают между собой в самые разнообразные взаимоотношения. Последние могут быть нейтральными, взаимовыгодными (например, деятельность гнилостных бактерий создает условия для деятельности нитрифицирующих бактерий), но очень часто они являются антагонистическими. И это понятно. Только таким путем в природе могло сложиться сбалансированное сосуществование громадного числа видов живых существ. И. И. Мечников предложил использовать антагонизм между бактериями на пользу человеку. Он, в частности, рекомендовал подавлять активность гнилостных бактерий в кишечнике человека, продукты жизнедеятельности которых, по его мнению, сокращают жизнь человека, молочнокислыми бактериями.
Механизмы микробного антагонизма различны. Они могут быть связаны с конкуренцией за кислород и питательные вещества, с изменением рН среды в сторону, неблагоприятную для конкурента, и т.д.
Одним из универсальных механизмов микробного антагонизма является синтез химических веществ-антибиотиков, которые либо подавляют рост и размножение других видов микроорганизмов (бактериостатическое действие), либо убивают их (бактерицидное действие).
Требования, предъявляемые к антибиотикам.
Чтобы быть хорошим лечебным средством, антибиотик должен иметь, по крайней мере, некоторые обязательные свойства.
1.При низкой концентрации (10-30 мкг /мл) он должен убивать возбудителя болезни или подавлять его рост и размножение.
2.Активность антибиотика не должна существенно снижаться под действием жидкостей организма.
3.Он должен быстро воздействовать на микроорганизм, чтобы за короткий срок прервать его жизненный цикл.
4.Антибиотик не должен вредить макроорганизму. Аллергенность и токсичность и после введения разовой дозы, и после многократного введения должны отсутствовать.
5.Антибиотик не должен препятствовать процессу выздоровления.
6.Антибиотик не должен снижать и тем более подавлять иммунологические реакции. Он не должен наносить никакого ущерба иммунной системе организма.
Хотя, здесь есть и исключения. Речь идет о поиске таких антибиотиков, которые бы подавляли трансплантационный иммунитет. К числу последних относится циклоспорин А, который обладает мощным иммуносупрессивным действием. Однако его широкому применению препятствует цитотоксическое действие на почки.
Основные группы антибиотиков.
Антибиотики имеют различное химическое строение. Нашедшие применение в медицине антибиотики относятся к нескольким группам:
-лактамные антибиотики;
тетрациклиновые антибиотики;
стрептомициновые антибиотики;
аминогликозиды;
микролидные антибиотики;
рифамициновые антибиотики;
противогрибковые антибиотики;
левомицетиновые антибиотики.
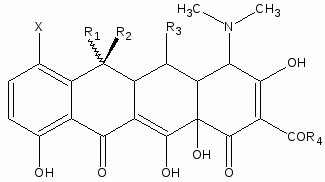
Тетрациклины. Структура
Это группа природных антибиотиков, продуцируемых Streptomyces aurefaciens, Str. rimosus и другими родственными микроорганизмами, и их полусинтетических производных.
В основе их химического строения лежит конденсированная четырехциклическая система:
Тетрациклины являются антибиотиками широкого спектра действия, они активны в отношении грамположительных грамотрицательных бактерий, спирохет, лептоспир, риккетсий, крупных вирусов (возбудители трахомы, орнитоза).
Малоактивны или неактивны в отношении протея, синегнойной палочки, большинства грибов и мелких вирусов (гриппа, полиомиелита, кори и др.), недостаточно активны в отношении кислотоустойчивых бактерий.
В основе механизма антибактериального действия тетрациклинов лежит подавление ими биосинтеза белка микробной клетки на уровне рибосом; они блокируют связывание аа-тРНК на А участке рибосомы 70S.
Тетрациклины легко проникают через плацентарный барьер, поэтому препараты этой группы не назначают беременным женщинам. Вследствие возможного образования нерастворимых комплексов тетрациклинов с кальцием и отложения их в костном скелете, эмали и дентине зубов препараты этой группы нельзя, как правило, назначать детям до 8 лет.
Отдельные представители:
Таблица 2
Название
X
R1
R2
R3
R4
Природные тетрациклины
Тетрациклин
H
CH3
OH
H
NH2
Хлортетрациклин
Cl
CH3
OH
H
NH2
Окситетрациклин
H
CH3
OH
OH
NH2
7-Бромтетрациклин
Br
CH3
OH
H
NH2
6-Диметилтетрациклин
H
H
OH
H
NH2
7-Хлор-6-диметилтетрациклин
Cl
H
OH
H
NH2
2-Декарбоксамидо-2-ацетилтетрациклин
H
CH3
OH
H
CH3
7-Хлор-2-Декарбоксамидо-2-ацетилтетрациклин
Cl
CH3
OH
H
CH3
5-Окси-2-Декарбоксамидо-2-ацетилтетрациклин
H
CH3
OH
OH
CH3
Полусинтетические тетрациклины
Ролитетрациклин
H
CH3
OH
H
Метациклин
H
CH2
H
NH2
Миноциклин
N(CH3)2
H
H
H
NH2
Терапевтическое действие некоторых тетрациклиновых антибиотиков
Тетрациклин:
эффективен в отношении холерного вибриона, гонококков, спирохет, риккетсий, сальмонелл, возбудителей пситтакоза, туляремии, бруцелл, гемолитических стрептококков.
Тетрациклина гидрохлорид:
то же.
Окситетрациклина дигидрат:
то же.
Окситетрациклина гидрохлорид:
то же.
Метациклина гидрохлорид (полусинтетическое производное тетрациклина):
активен в отношении большинства грамположительных (стафилококки, пневмококки, стрептококки) и грамотрицательных (эшерихии, сальмонеллы, шигеллы, аэробактер) микроорганизмов, возбудителей орнитоза, пситтакоза, трахомы и некоторых простейших.
Доксициклина гидрохлорид (полусинтетическое производное окситетрациклина):
активен в отношении большинства грамположительных и грамотрицательных микроорганизмов, как и др. тетрациклины, действует также на риккетсии, микоплазмы, возбудителей орнитоза, пситтакоза, трахомы и на некоторые простейшие.
не воздействует на большинство штаммов протея, синегнойную палочку, грибы, мелкие и средние вирусы.
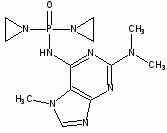
Вопрос №3. Противоопухолевые препараты. Механизм действия алкилирующих препаратов.
Известно несколько групп соединений, которые проявляют противоопухолевое действие, но при этом, как правило, затрагивают и нормальные клетки. Это антиметаболиты, цитостатические препараты (алкилирующие агенты, комплексы металлов, природные соединения – алкалоиды, антибиотики, ферменты, гормоны).
Антиметоболиты достаточно разнообразны по структуре; обычно они являются производными витаминов, гетероциклических оснований кислот, нуклеозидов. К антиметоболитам относят:
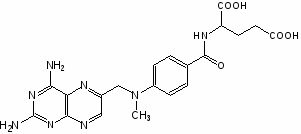
Метотрексат
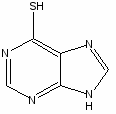
6-меркаптопурин
Фторурацил
Фторафур
Цитарабин
Тиазофурин
Фопурин
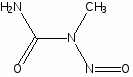
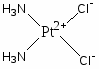
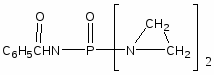
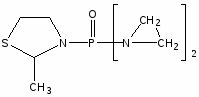
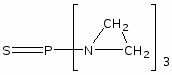
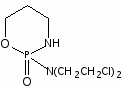
Наиболее многочисленной является группа цитостатических препаратов, включающая алкилирующие агенты (эмбихин, допан, сарколизин, циклофосфан, проспидин, спиробромин и др.), соединения, содержащие остаток этиленимина, нитрозометилмочевину и комплексы металлов.
Таблица 3
Эмбихин
Сарколизин
Допан
Циклофосфан
Проспидин
Спиробромин
Тиофосфамид
Имифос
Бензотеф
Цисплатин
Нитрозометилмочевина
Одними из первых в качестве противоопухолевых средств стали применять производные бис-(-хлорэтил)-амина. Поводом к использованию этих соединений послужили данные о способности азотистого иприта, или трихлорэтиламина, вызывать выраженную лейкопению и аплазию костного мозга. В медицинской практике используются менее токсичные производные бис-( -хлорэтил)-амина (циклофосфан, эмбихин и др.). Вслед за бис-( -хлорэтил)-аминами были получены цитостатические алкилирующие соединения других химических групп: этиленимины, алкилированные cульфонаты, триазены, препараты платины, нитрозомочевины и др.
Алкилирующие агенты способны реагировать с нуклеофильными центрами белковых молекул, нарушая главным образом синтез ДНК, в меньшей степени синтез РНК. В результате нарушается жизнедеятельность клеток, блокируется их митоз. Высокой чувствительностью к этим веществам обладают ядра клеток гиперплазированных (опухолевых) тканей и лимфоидной ткани. В то же время производные бис-(-хлорэтил)аминов легко взаимодействует с нуклеопротеидами клеточных ядер кроветворных тканей, угнетая процесс кроветворения.
Хлорэтиламины обладают высокой токсичностью и в дозах, близких к лечебным, могут вызывать побочные явления, проявляющиеся в сильном угнетении костно-мозгового кроветворения и нарушениях функции желудочно-кишечного тракта. Такие препараты, как эмбихин, допан и другие применяют при лимфогрануломатозе, миелолейкозе, хроническом лимфолейкозе.
Сарколизин обладает алкилирующими свойствами и подавляет развитие гиперплазированных тканей. Применяют для лечения семиномы яичка, ретикулосаркомы, миеломной болезни и др.
Проспидин и спиробромин применяют при лечении рака гортани. Они не проявляют явного угнетающего действия на кроветворение, однако обладают иммунодепрессивными свойствами.
Этиленимины по механизму действия близки к производным бис-(-хлорэтил)-амина. Они блокируют митотическое деление клеток с помощью образования поперечных связей между цепями молекулы ДНК, что препятствует ее репликации.
Механизм противоопухолевого действия производных платины (карбоплатина, цисплатина) связан со способностью к бифункциональному алкилированию нитей ДНК, ведущему к длительному подавлению биосинтеза нуклеиновых кислот и гибели клеток.
Список используемой литературы
Евстигнеева Р.П. Тонкий органический синтез. М.: Химия, 1991. 184 с.
Овчинников Ю.А. Биоорганическая химия. М.: Просвещение, 1987. 815 с.
Энциклопедический словарь медицинских терминов. В 3 т. М.: Советская энциклопедия, 1982-1984.
Химия биологически активных природных соединений / Евстигнеева Р.П., Серебренникова Г.А., Звонкова Е.Н. и др. Под ред. Н.А. Преображенского и Р.П. Евстигнеевой. М. Химия, 1976. 456 с.

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ