Основы химической технологии

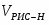
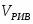
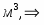
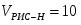
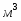
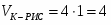
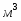
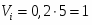
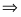
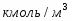
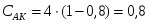
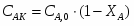
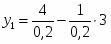
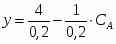
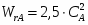
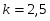
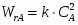
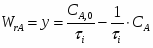
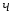
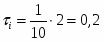
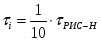
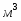
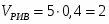
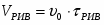
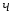
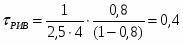
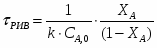
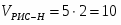
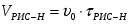
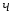
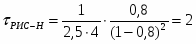
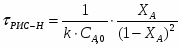
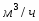
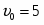
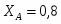

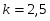
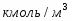
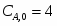
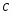
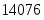
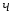
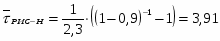
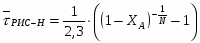
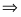
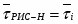
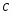
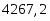
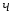
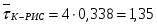
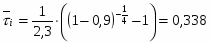
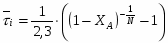
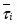
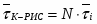
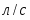
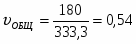

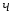
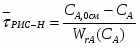
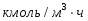
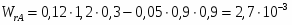
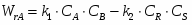
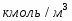
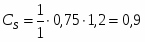
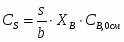
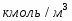
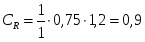
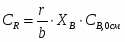
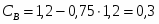
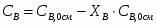
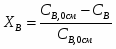
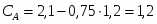
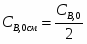
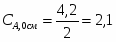
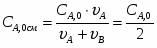
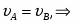

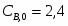
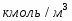
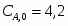
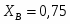
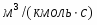
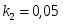
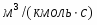
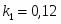
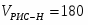
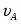
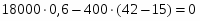
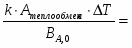
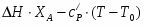
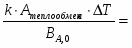
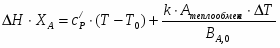
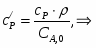
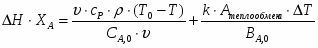
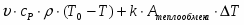
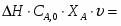
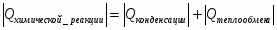
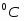
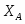
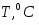
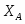
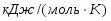
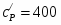
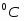
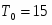

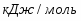
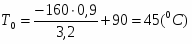
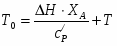
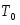
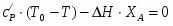
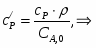
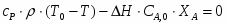
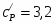
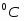
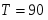
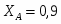
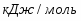
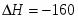
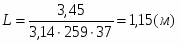
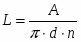
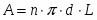
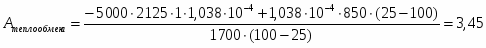
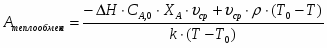
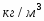
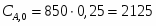
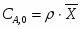
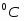

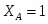
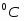
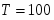
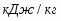
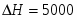
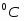
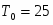
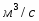
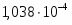
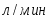
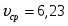
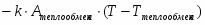
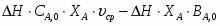

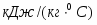
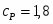
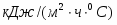
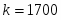
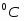
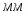
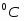
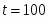
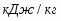
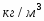
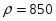
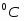
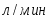
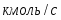
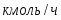
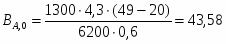
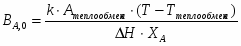
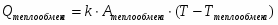
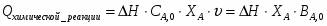
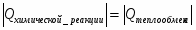
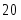
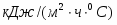
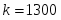
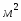
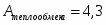
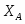
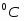
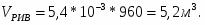
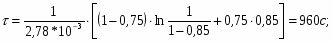
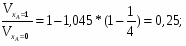
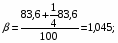

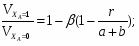
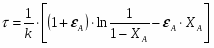
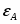
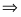
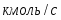
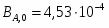
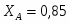
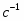
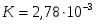
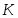
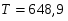
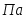
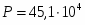
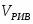
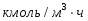
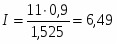
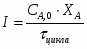
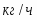
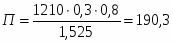
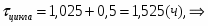
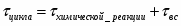
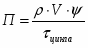
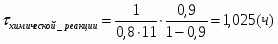
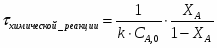
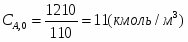
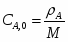

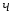
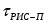
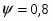
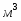
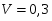
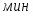
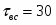
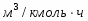
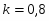
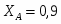
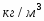
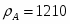
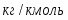
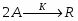
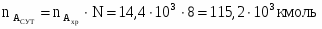
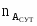
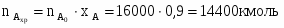
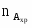
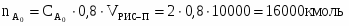
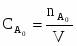
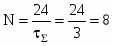
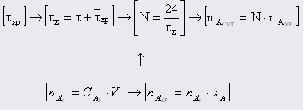
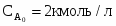
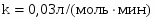
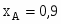
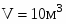
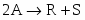
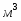
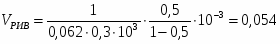
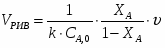
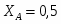
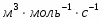
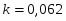
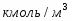
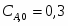
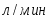
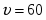
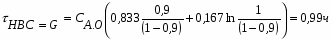
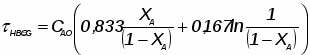
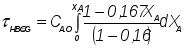

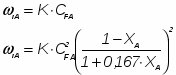
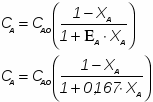
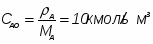
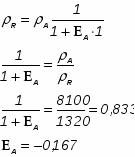

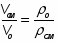
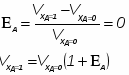

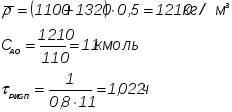
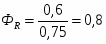
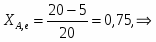
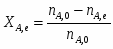
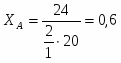
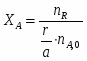
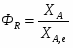
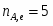
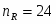
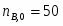
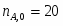
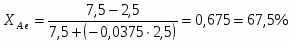
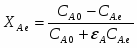
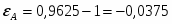
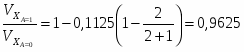

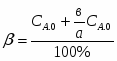
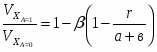
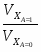
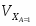
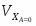

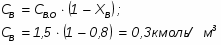
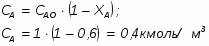
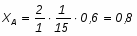
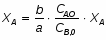
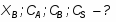
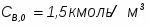

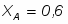
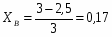
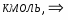
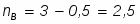
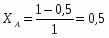
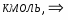
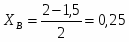
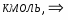
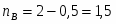
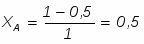
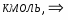
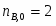
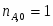
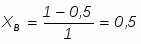
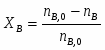
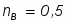
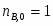
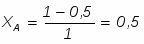
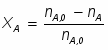
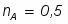

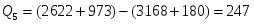
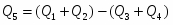
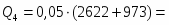
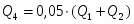
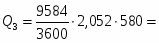
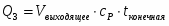
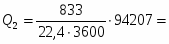
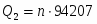
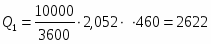
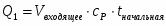

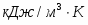
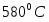
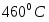
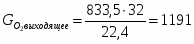
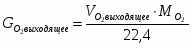
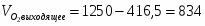
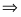
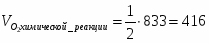
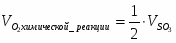
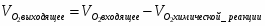
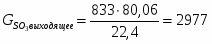
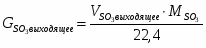
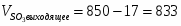
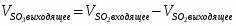
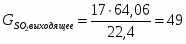
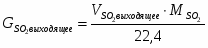
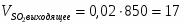
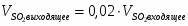
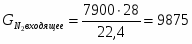
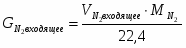
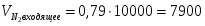
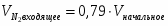
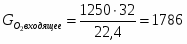
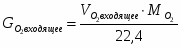
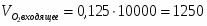
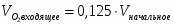
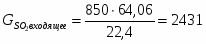
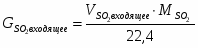
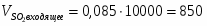
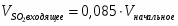

 Министерство по образованию и науке РФ
Министерство по образованию и науке РФ
Бийский технологический институт
(Филиал государственного образовательного учреждения высшего и профессионального образования)
"Алтайский государственный технический университет имени И.И. Ползунова" (БТИ Алт ГТУ)
Кафедра ТГВ ПАХТ
Контрольная работа
по курсу "Общая химическая технология"
Выполнила:
студентка группы ХТПК – 71
Диго Т.А.
Проверил:
доцент, к. т. н. Багров Г.В.
2010
Задача 1
Составить материальный баланс нитратора, производительностью 3 т/ч нитробензола. Выход нитробензола 98% от теоретического. Состав нитрующей смеси [%(мас)]: HNO3 – 20, H2SO4 – 60, H2O – 20. Расход нитруюшей смеси 4 кг на 1 кг бензола: С6Н6+НNI3=C6H5-NO2+H2O
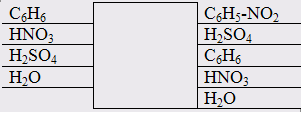
1 Изобразим процесс на схеме
Рисунок 1- Схема входящих и выходящих материальных потоков
Определим молекулярные массы веществ
µ(С6Н6) = 78 кг/кмоль; µ(C6H5-NO2) = 125 кг/кмоль; µ(HNO3) = 63 кг/кмоль; µ(H2O) = 18 кг/кмоль.
Составим приходную часть материального баланса
3.1 Определим количество бензола необходимого для получения 3000 кг/ч C6H5-NO2
76 – 123
х – 3000
х = G С6Н6 теор = (3000*78)/123 = 1902 кг/ч
G С6Н6 действ = С6Н6 / 0,98
G С6Н6 действ = 1902 / 0,98= 1941 кг/ч
3.2 Определим количество нитрующей смеси
Gнитр смеси = 4 * G С6Н6 действ
Gнитр смеси = 4 * 1941= 7764 кг/ч
3.3 Определим количество азотной кислоты
G HNO3 вх = 0,2 * Gнитр смеси
G HNO3 вх = 0,2 * 7764 = 1553 кг/ч
3.4 Определим количество воды на входе
G H2O вх = 0,2 * Gнитр смеси
G H2O вх = 0,2 * 7764 = 1553 кг/ч
3.5 Определим количество серной кислоты
G H2SO4 вх = 0,6 * Gнитр смеси
G H2SO4 вх = 0,6 * 7764 = 4659 кг/ч
4 Составим расходную часть материального баланса
4.1 Определим количество бензола
G С6Н6 вых = G С6Н6 теор – G С6Н6 действ
G С6Н6 вых = 1941 – 1902 = 39 кг/ч
4.2 Определим количество азотной кислоты
G HNO3 вых = G HNO3 вх – G HNO3 хр
63 – 123
х – 3000
х = G HNO3 хр = 63 * 3000/123 = 1537 кг/ч
G HNO3 вых = 1553 – 1537 = 16 кг/ч
4.3 Определим количество воды
G Н2О вых = G Н2О вх + G Н2О хр
18 – 123
х – 3000
х = G Н2О хр = 18*3000/123 = 439 кг/ч
4.4 Определим количество серной кислоты
Серная кислота выступает в качестве водоотнимающего средства. Следовательно,
G Н2SO4 вых = G Н2SO4 вх
G Н2SO4 вых = 4659 кг/ч
5 Составим итоговую таблицу
Таблица 1 – Итоговый баланс нитратора
Потоки
Приход, кг/ч
Расход, кг/ч
С6Н6
1941
39
HNO3
1553
16
H2O
1553
1992
H2SO4
4659
4659
C6H5-NO2
-
3000
Итого
9706
9706
Задача 2
Рассчитать материальный баланс нейтрализатора для получения аммиачной селитры, производительностью 20 т/ч. В производстве применяется 47% азотная кислота HNO3 и 100% газообразный аммиак NH3. Потеря HNO3 и NH3 в производстве составляет 1% от теоретически необходимого количества, для обеспечения заданной производительности. Из нейтрализатора аммиачная селитра составляет 60% раствора NH4NO3 в воде. Определить количество влаги, испарившейся в результате экзотермической реакции нейтрализатора.
1 Изобразим процесс на схеме
Рисунок 2- Схема входящих и выходящих материальных потоков
2 Определим молекулярные массы веществ
µ(NH4NO3) = 80 кг/кмоль; µ(NH3) = 17 кг/кмоль; µ(HNO3) = 63 кг/кмоль; µ(H2O) = 18 кг/кмоль.
3 Составим приходную часть материального баланса
3.1 Определим количество аммиака, необходимого для получения аммиачной селитры
17 - 80
х – 20000
х = GNH3 хр = 17*20000/80 = 4250 кг/ч
GNH3 вх = GNH3 хр/0,99 = 4293 кг/ч
3.2 Определим количество азотной кислоты
63 – 80
х – 20000
х = GHNO3 хр = 63*20000/80 = 15750 кг/ч
GHNO3 вх = GHNO3 хр/0,99 = 15909 кг/ч
3.3 Определим количество воды
15909 – 0,47
х – 0,53
х = GH2O хр = 15909*0,53/0,47 = 17740 кг/ч
4 Составим расходную часть материального баланса
4.1 Определим количество азотной кислоты
G HNO3 вых = G HNO3 вх – G HNO3 хр
G HNO3 вых = 15909 – 15750 = 159 кг/ч
4.2 Определим количество аммиака
G NH3 вых = G NH3 вх - G NH3 хр
G NH3 вых = 4293 – 4250 = 43 кг/ч
4.3 Определим количество воды
20000 – 0,6; х – 0,4; х = GH2O вх = 20000*0,4/0,6 = 13333 кг/ч
GH2O вых = GH2O хр - GH2O вх
GH2Oвых = 17740 – 13333 = 4407 кг/ч
5 Составим итоговую таблицу
Таблица 2 – Итоговый баланс нейтрализатора
Потоки
Приход, кг/ч
Расход, кг/ч
NH3
4293
43
HNO3
15909
159
H2O
17740
13333
H2Oпар
-
4407
NH4NO3
-
20000
Итого
37942
37942
Задача 3
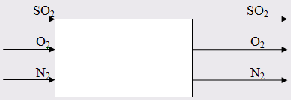
Составить материальный баланс контактного аппарата для каталитического окисления SO2 в SO3 производительностью 10 000 м3/ч исходного газа следующего состава [%(об.)]: SO2-8,5; О2-12,5; N2-79 . Степень окисления SO2 в SO3 составляет 98%
(SO2+1/2О2 SO3).
1 Изобразим процесс на схеме
Рисунок 3 - Схема входящих и выходящих потоков в контактном аппарате
2 Определим молекулярные массы веществ
µ(SO2) = 64,06 г/моль; µ(О2) = 32 г/моль; µ(SO3) = 80,06 г/моль; µ(N2) = 28 г/моль.
3 Составим приходную часть материального баланса
3.1 Определим количество SO2 на входе
м3/ч (0,236 м3/с)
кг/ч (0,675 кг/с)
3.2 Определим количество O2 на входе
;
м3/ч (0,347 м3/с);
;
кг/ч (0,496 кг/с);
3.3 Определим количество N2 на входе
;
м3/ч (2,194 м3/с);
;
кг/ч (2,743 кг/с)
4 Составим расходную часть материального баланса
4.1 Определим количество SO2 на выходе
;
м3/ч (0,005 м3/с);
;
кг/ч (0,014 кг/с)
4.2 Определим количество SO3 на выходе
;
м3/ч (0,231 м3/с);
;
кг/ч (0,827 кг/с)
4.3 Определим количество O2 на выходе
;
м3/ч (0,116 м3/с),
м3/ч (0,232 м3/с);
; кг/ч (0,331 кг/с)
4.4 Определим количество N2 на выходе
Так, как азот присутствует в исходном газе в качестве балласта, то его количество в ходе химической реакции не меняется.
5 Сведём данные по расчётам в таблицу:
Таблица 3 - Итоговый баланс контактного аппарата
Потоки
Приход, кг/ч
Расход, кг/ч
Приход, м3/ч
Расход, м3/ч
SO3
-
2977
-
833
SO2
2431
49
850
17
O2
1786
1191
1250
834
N2
9875
9875
7900
7900
Итого
14092
14092
10000
9584
Так, как реакция протекает с уменьшением объёма, то объёмные расходы отличаются, а массовые совпадают.
Задача 4
Добавим к предыдущей задаче следующие условия:
Температура газовой смеси на входе в аппарат , а на выходе из него . Средняя теплоёмкость смеси (условно считать постоянной) равна 2,052 .
Потери теплоты в окружающую среду составляют 5% от прихода теплоты
(SO2+1/2О2 SO3+94207 кДж)
Определить количество теплоты, отводимой от аппарата.
1 Изобразим процесс на схеме:
Q1 – теплота, вносимая в контактный аппарат реакционной смесью; Q2 – теплота химической реакции; Q3 – теплота, выводимая из контактного аппарата реакционной смесью; Q4-потери теплоты в окружающую среду; Q5- количество теплоты, отводимое в аппарате
Рисунок 4 - Схема входящих и выходящих потоков в контактном аппарате
2 Определим Q1
;
кВт
3 Определим Q2
,
где n-число молей полученного SO3
973 кВт
4 Определим Q3
;
3168 кВт
5 Определим Q4
;
180 кВт
6 Определим Q5:
;
кВт
7 Сведём данные по расчётам в таблицу
Таблица 4 – Приход теплоты в контактном аппарате
Потоки
кВт
%
Q1
2622
73
Q2
973
27
Итого
3595
100
Таблица 5 – Расход теплоты в контактном аппарате
Потоки
кВт
%
Q3
3168
88
Q4
180
5
Q5
247
7
Итого
3595
100
Задача 5
В реакторе протекает реакция: : А+В R . Определить степень превращения ХА и ХВ, при условии А и В взяты в стехиометрическом соотношении; если вещества В в 2 раза больше ( то есть 2 моля вещества на 1 моль вещества А); если вещества В в 3 раза больше.
1 Определим степень превращения, если реагенты взяты в стехиометрическом соотношении
Принимаем: моль, моль
По условию известно, что
Можно определить степень превращения вещества А:
;
Поскольку вещества А и В взяты в стехиометрическом соотношении, то ,
Можно определить степень превращения вещества В:
;
2 Определим если в 2 раза больше
По условию известно, что ,
Можно определить степень превращения вещества А:
Поскольку реагирует половина вещества А, то
Можно определить степень превращения вещества В:
3 Определим если в 3 раза больше
По условию известно, что ,
Можно определить степень превращения вещества А:
Поскольку реагирует половина вещества А, то
Можно определить степень превращения вещества В:
Задача 6
Определить состав смеси и степень превращения для реакции: А+2В 2R+S. Если ;. Определить
1 Степень превращения реагента В можно определить следующим образом:
;
;
2 Концентрацию реагента А можно определить следующим образом:
3 Концентрацию реагента В можно определить следующим образом:
4 Из стехиометрических коэффициентов определим :
Задача 7
Определить Х SO2 в реакции 2SO2 + O2 → 2SO3, если реакционная смесь имеет состав в начале процесса [% (об.)]: С SO2-7,5; С O2-10,3; С N2-82,2. Содержание SO2 в конце процесса равна 2,5% об.
Замечание:
реакция протекает с уменьшением объема, следовательно, необходимо учитывать - относительное изменение объема реакционной смеси.
формализуем задачу, т.е. переведем ее в привычные понятия:
аА+вВrR,
где а=2 в=1 r=2
СА.0=7,5% об. СА.е=2,5% об. СВ.0=10,3% об.
реагенты взяты не в стехиометрическом соотношении, т.е. О2 в избытке.
в реакционной смеси присутствует балластный азот, т.е. для окисления используется О2 воздуха.
1 Определим относительные изменения объема
,
где - первоначальный объем смеси
- объем смеси в конце реакции.
Отношение определим по формуле [2,с.22]:
,
где β – доля стехиометрической смеси исходных реагентов в реакционной смеси.
В нашем случае
,
.
.
.
2 Определим равновесные степени превращения по формуле [2, с.22]:
;
.
Задача 8
В реакторе протекает реакция: А+2В 2R+S. Начальные количества ; . В реакционной смеси, выходящей из реактора . Известно, что в равновесной смеси содержится . Определить выход продукта .
1 Выход продукта можно определить из следующего соотношения:
2 Степень превращения реагента А можно определить следующим образом:
;
3 Равновесную степень превращения реагента А можно определить из выражения:
;
4 Определим выход продукта:
Задача 9
Определить необходимое время пребывания τ в РИС-П для достижения ХА = 0,9.В реакторе проводится изотермическая необратимая реакция второго порядка, реактор заполнен частично веществом А, мольная масса 110кг/кмоль, плотность исходного раствора и продукта 1100кг/м3 и1320кг/м3, константа химической реакции К =0,8м3/моль ч.
Задачу решаем двумя способами без учета плотности и с учетом плотности.
1 Определим τрис-п без учета изменений плотности:
1.1 Изобразим схему расчета:
Рисунок 5 - Расчетная схема
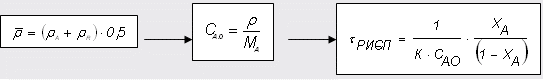
2 Определим τрис-п с учетом изменения плотности( объема):
2.1 Изобразим схему расчета
Рисунок 6 - Схема расчета
2.2 Определим степень изменения объема :
[мет. 2 с.30]
Принимаем , что объем и плтности взаимосвязаны следующим образом.
где это объем и плотность смеси в данный, объем и плотность в начальный момент времени.
По условию, если ХА =1, то
2.3 Определим СА.О:
2.4 Определим концентрацию СА :
Примечание: задачу решаем в общем виде.
2.5 Определим скорость химической реакции:
2.6 Определим τрис-п :
Подставим значение скорости и получим:
Проинтегрируем и получим:
Подставим численные значения:
Задача 10
Рассчитать объём реактора идеального вытеснения (РИВ) при проведении в нём реакции: А R+SО.
Условия:
1 Объёмный расход исходного компонента ;
2 Начальная концентрация ;
3 Константа скорости химической реакции
4 Степень превращения .
Примечания:
1 Данная реакция второго порядка (это следует из уравнения реакции и размерности константы скорости химической реакции);
2 Размерность величин переведём в систему СИ , так как объёмный расход и константа скорости химической реакции приведены в разных размерностях.
Рассчитаем объём реактора идеального вытеснения:
;
.
Задача 11
Определить какое количество вещества А можно переработать в РИС-П за сутки при проведении реакции : , если
объём РИС-П ;
степень превращения ;
константа скорости реакции ;
начальная концентрация реагента А ;
коэффициент заполнения реактора ψ=0,8;
время загрузки и выгрузки за одну операцию 30 мин;
1 Изобразим алгоритм расчета на схеме:
Рисунок 7 – Алгоритм решения
2 Определим
3 Определим
4 Определим N
5 Определим количество вещества
6 Определим
7 Определим
Задача 12
В реакторе идеального смешения периодического действия (РИС-П) проводится изотермическая реакция: . Реактор заполнен чистым веществом А, мольная масса М которого 110 . Плотность вещества . Степень превращения вещества . Константа равновесия . Продолжительность вспомогательных операций . Объём реактора ; степень заполнения реактора исходным реагентом .
Определить продолжительность реакции , производительность реактора и количество вещества А, подвергнутого превращению в 1 реактора за 1, то есть интенсивность реактора I.
Рисунок 8 – Схема расчёта
1 Определим начальную концентрацию реагента А:
;
.
2 Определим продолжительность химической реакции:
;
.
3 Определим производительность реактора:
,
где ;
.
4 Определим интенсивность реактора:
;
.
Задача 13
Определить объём РИВ () для гомогенной реакции: 4А R+6S.
;.
Мольный расход .
Примечания:
1 Реакция протекает с изменением объёма, нужно учесть .
2 Считать, что реакция протекает по первому порядку
;
( );
;
;
Отношение объемов определяется по формуле [1. стр. 22]
где β- доля стехиометрической смеси, исходных реагентов в исходной смеси.
εА=0,25-1=-0,75;
Задача 14
Рассчитать максимальный секундный расход (мольный расход) вещества А при соблюдении следующих условий:
1 В изотермическом РИС-Н проводится обратимая экзотермическая реакция
А R+6200 кДж/кмоль.
2 При оптимальной температуре 49 степень превращения составляет 60 %.
3 Для создания изотермических условий используется погружной водяной холодильник с поверхностью теплообмена .
4 Коэффициент теплопередачи .
5 Температура на выходе из холодильника составляет .
1 Составим тепловой баланс для изотермического реактора:
или ,
Где
2 Выражаем из уравнения теплового баланса мольный расход:
;
(0,012).
Задача 15
Рассчитать длину труб теплообменника для осуществления процесса, описываемого ниже.
В реакторе полупериодического действия проводится реакция взаимодействия в жидкой фазе продукта А с концентрацией 25 масс.% с первоначально загруженным в количестве 500 л продуктом В с концентрацией 38 масс.%.
Скорость подачи реагента А составляет 6,23 . Температура на входе 25. Плотность раствора . Тепловой эффект реакции 5000 . Для проведения реакции следует поддерживать температуру , что достигается с помощью теплообменника, диаметр трубок которого d=250 . Расход хладоагента должен быть таким, чтобы его температура не превысила 25. Коэффициент теплопередачи . Теплоёмкость смеси реагентов .
Рисунок 9 - Схема расчёта
1 Составим тепловой баланс реактора
=0.
();
;
.
2 Определим начальную концентрацию компонента А
;
.
3 Определим поверхность теплообмена:
;
(),
Выбираем одноходовой кожухотрубчатый теплообменник (n=37, d=259 ).
Выразим длину трубок теплообменника из следующего соотношения:
,
Откуда
;
.
Задача 16
Определить температуру нагревания реагента А на входе в РИС-Н адиабатически при осуществлении необратимой экзотермической реакции А R.
Тепловой эффект химической реакции .
Степень превращения .
Температура проведения реакции .
Теплоёмкость .
1 Составим тепловой баланс реактора:
,
Где
.
2 Выразим из последнего выражения :
;
.
Задача 17
Определить количество теплоты, которое необходимо отводить в РИС-Н при проведении в нём обратимой экзотермической реакции А+B R+18000, с тем, чтобы обеспечить максимальную степень превращения реагента А().
Температура реакционной смеси на входе в реактор .
Теплоёмкость .
Известна также экспериментальная зависимость, представленная в таблице 6.
Таблица 6 – Экспериментальная зависимость степени превращения от температуры Т
5
15
25
35
40
42
45
55
65
0,18
0,31
0,46
0,56
0,58
0,60
0,59
0,49
0,38
1 Из экспериментальной зависимости, представленной в таблице 6, видно, что максимальная степень превращения реагента А достигается только при температуре реакционной смеси, равной 42 . Для этой температуры и будем производить все дальнейшие расчёты.
2 Принимаем, что реактор работает в политропическом режиме
3 Составим уравнение теплового баланса для реактора, работающего в политропическом режиме:
;
.
.
преобразуем последнее выражение к следующему виду:
,
Откуда
;
Следовательно, режим работы реактора должен быть адиабатическим.
Задача 18
Определить объёмные расходы реагентов и в РИС-Н при проведении реакции А+В=R+S. Объём РИС-Н
л;
;.
1 Составим алгоритм расчёта:
Рисунок 10 – Схема расчёта
2 Определим начальные концентрации компонентов А и В в смеси:
Принимаем
;
;
;
;
3 Определим концентрации реагентов А и В в реакционной смеси:
,
Откуда
;
;
,
Откуда
;
;
;
;
;
.
4 Определим скорость химической реакции:
;
.
5 Определим время пребывания реакционной смеси в аппарате:
;
(1 200 000 с).
6 Определим объёмные расходы реагентов А и В:
;
;
;
.
Задача 19
Скорость превращения в реакции А 2R описывается кинетическим уравнением первого порядка .
Вычислить среднее время пребывания реагирующей смеси, необходимое для достижения в К-РИС из четырёх реакторов (N=4).
Какое время пребывания реакционной смеси потребовалось бы для достижения такой же степени превращения в РИС-Н?
1 Определим среднее время пребывания реагирующей смеси в К-РИС:
,
где - время пребывания реагирующей смеси в одном реакторе.
;
(),
().
2 Определим среднее время пребывания реагирующей смеси в РИС-Н:
, так как в данном случае N=1,
;
().
Задача 20
Определить объём реактора идеального смешения непрерывного действия (РИС-Н), каскада реакторов идеального смешения (К-РИС), реактора идеального вытеснения (РИВ), при проведении реакции второго порядка: 2А R+S.
Условия:
1 Начальная концентрация ;
2 Константа скорости химической реакции ;
3 Степень превращения ;
4 Первоначальный расход смеси
Примечание: объём реакционной смеси на протяжении всей реакции остаётся постоянным.
1 Определим время пребывания реакционной смеси в реакторе идеального смешения и его объём:
;
;
;
.
2 Определим время пребывания реакционной смеси в реакторе идеального вытеснения и его объём:
;
;
;
.
3 Для каскада реакторов идеального смешения принимают, что все секции имеют одинаковый объём, причём
.
.
Построим зависимость скорости химической реакции от концентрации:
;
Так как
, ;
Например,
Построение продолжается до тех пор, пока не будет обеспечена заданная степень превращения, то есть при выполнении следующего условия:
;
.
Дробного числа секций быть не может, принимаем число секций равным 4, причём четыре секции дают степень превращения больше, чем требуется по условию.
;
;
.

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ