Реакции замещения гидроксильной группы
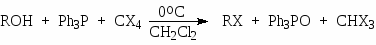
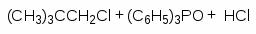
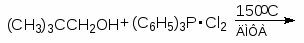
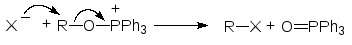
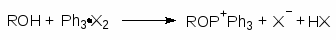
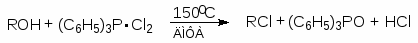
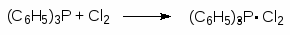
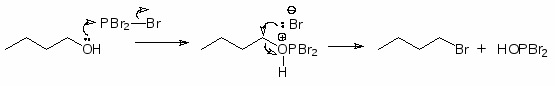
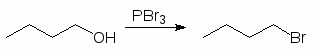
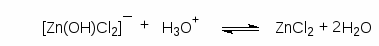
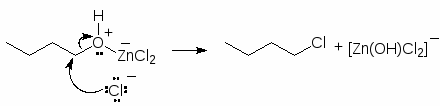
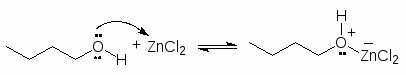
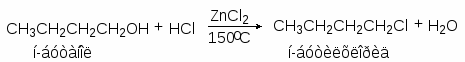
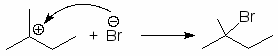
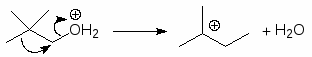
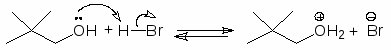
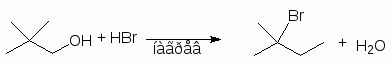
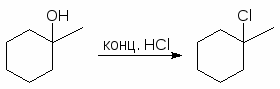
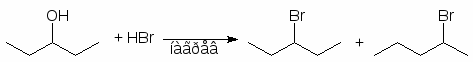
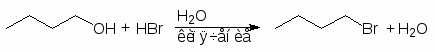
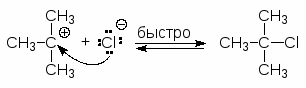
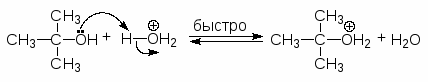
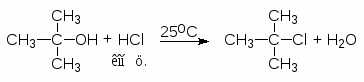
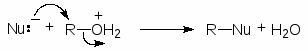 Реакции замещения гидроксильной группы
Реакции замещения гидроксильной группы
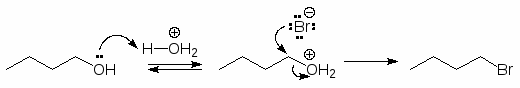
Многие важные реакции спиртов осуществляются путем атаки -атома углерода (электрофильного центра) нуклеофилом. В результате происходит разрыв связи СО и замещение гидроксильной группы. Но гидроксид-анион является настолько сильным нуклеофилом, что вытеснение его из молекулы спирта невозможно.
Nu + ROH реакция не пойдет
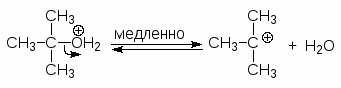
Чтобы осуществить нуклеофильное замещение гидроксильной группы в спиртах, последние необходимо модифицировать таким образом, чтобы гидроксильная группа превратилась в хорошую уходящую группу. Одним из способов такой модификации является перевод атома кислорода гидроксильной группы в оксониевую форму. Протонирование спиртов превращает плохую уходящую группу (ОН) в хорошую уходящую группу (Н2О). Протонирование приводит и к увеличению положительного заряда на атоме углерода связанном с гидроксильной группой, т.к. ОН2+ сильнее оттягивает электроны, чем ОН. Все это делает возможным прохождение с протонированными спиртами реакций SN2.
Следует только иметь в виду, что вторичные спирты часто, а третичные при этом всегда превращаются в алкены.
1.1. Получение алкилгалогенидов из спиртов и галогеноводородов
Одной из наиболее важных реакций в повседневной практике органического синтеза является замещение гидроксильной группы на галоген. Существует несколько методов замены гидроксильной группы спирта на галоген.
А. Реакции с галогеноводородами
Один из самых старых методов основан на реакции спиртов с галогеноводородами. Условия протекания реакции зависят от строения спирта и природы галогеноводородной кислоты. Наибольшей активностью обладают спирты аллильного и бензильного типов, а также третичные спирты. Они реагируют с большей скоростью, чем вторичные, а последние превосходят первичные спирты. С увеличением длины углеводородного радикала реакционная способность спиртов каждого типа понижается. Реакционная способность галогеноводородных кислот, действующих как катализатор и источник нуклеофила, падает в последовательности HI > HBr > HCl >> HF, что связано с уменьшением силы кислоты и уменьшением нуклеофильности при переходе от иодид-иона к хлорид-иону.
Иодо- и бромоводородная кислоты легко взаимодействуют со всеми спиртами. Но иодоводородная кислота способна также восстанавливать как исходные спирты, так и образующиеся иодопроизводные в углеводороды, что ограничивает ее применение.
Скорость реакции с HF слишком мала для прямого превращения спиртов в алкилфториды.
Для получения третичных алкилгалогенидов обычно достаточно насытить третичный спирт газообразным галогеноводородом при 0-10оС или обработать водной соляной, бромистоводородной или йодистоводородной кислотой в течение короткого промежутка времени при 0-20оС. Первичные спирты реагируют, в основном, по механизму SN2, а третичные - SN1.
Третичные спирты реагируют с концентрированными HCl, HBr и HI очень быстро. При смешивании третичного спирта с концентрированной соляной кислотой при обычной температуре через несколько минут образуется, нерастворимый в воде, трет-бутилхлорид. Водорастворимые низкомолекулярные первичные и вторичные спирты в этих условиях не реагируют.
(44)
-метил-2-пропанол 2-метил-2-хлорпропан
(трет-бутилхлорид)
Реакция проходит по механизму SN1:
(М 4)
Водонерастворимые третичные спирты превращают в галогенуглеводороды пропусканием газообразных галогеноводородов через их растворы в эфире или тетрагидрофуране (ТГФ).
Для получения первичных и вторичных алкилбромидов и алкилиодидов обычно требуется нагревание смеси спирта и концентрированной бромистоводородной или йодистоводородной кислоты в течение нескольких часов или пропускание сухого галогенводорода в спирт.
(45)
Первичные спирты реагируют по механизму SN2:
(М 5)
Во вторичных спиртах замещение гидроксильной группы происходит по обоим механизмам, что приводит к образованию основного и перегруппировочного продуктов. Так при реакции 3-пентанола с HBr наряду с 3-бромпентаном образуется некоторое количество 2-бромпентана:
(46)
80% 20%
Упр.9. Опишите механизм реакции:
(47)
Ответ:
(М 6)
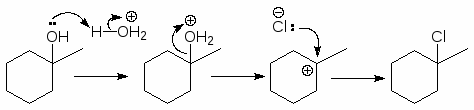
Это реакция кислотно катализируемого замещения спиртов. Она проходит по механизму SN1, характерному для третичных спиртов.
Важной характерной особенностью процессов с участием карбокатионов являются перегруппировки, и поэтому замещение гидроксильной группы спиртов на галоген под действием галогеноводородов без изомеризации осуществляется только для третичных и неразветвленных первичных спиртов.
Перегруппировки происходят и со спиртами с разветвлением у -атома углерода. При обработке неопентилового спирта бромоводородной кислотой образуется продукт перегруппировки:
(48)
2-бром-2-метилбутан
Причиной такого результата является нуклеофильная внутримолекулярная 1,2-перегруппировка (1,2-алкильныйный сдвиг):
(М 7)
Упр.10. При нагревании 3-метил-2-бутанола, насыщенного газообразным бромоводородом, в качестве единственного продукта реакции образуется 2-бром-2-метилбутан. Напишите эту реакцию и опишите ее механизм.
Упр.11. При взаимодействии неопентилового спирта с бромоводородом в качестве единственного продукта реакции образуется 2-бром-2-метилбутан. Напишите эту реакцию и опишите ее механизм.
Для получения алкилхлоридов при взаимодействии первичных спиртов с соляной кислотой используют катализатор безводный хлорид цинка. Хлорид цинка как жесткая кислота Льюиса координируется по атому кислорода, облегчая тем самым замещение гидроксильной группы:
(49)
(М 8)
Смесь соляной кислоты и хлорида цинка носит название реактива Лукаса.
Реакционная способность спиртов по отношению к реактиву Лукаса уменьшается в ряду: C6H5CH2OH > CH2=CHCH2OH > 3o > 2o > 1o.
Различие в реакционной способности между первичными (до С6), вторичными и третичными спиртами при их взаимодействии с хлооводородной кислотой лежит в основе пробы Лукаса. При взаимодействии спиртов с реактивом Лукаса галогеноалканы образуются с различными скоростями. Третичные спирты реагируют очень быстро с выделением нерастворимого в воде хлоралкана. Вторичные спирты сначала растворяются, но вскоре раствор мутнеет, и через некоторое время появляются капли хлоралкана. Растворы первичных спиртов, за исключением аллилового и бензилового, в реактиве Лукаса остаются прозрачными.
Б. Действием галогенидов фосфора
Для превращения спиртов в алкилгалогениды применяют различные три- и пентагалогениды фосфора: PBr3, PCl3, POCl3 или PI3. Последний получают из красного фосфора и йода непосредственно во время реакции:
Галогениды и оксигалогениды фосфора относятся к умеренно сильным кислотам Льюиса, а их анионы являются нуклеофилами.
(50)
Механизм:
(М 9)
Образующийся HOPBr2 далее реагирует со спиртом по аналогичному механизму, и в конечном итоге все три атома галогена принимают участие в реакции.
Замещение гидроксильной группы на галоген в этих реакциях происходит с инверсией конфигурации.
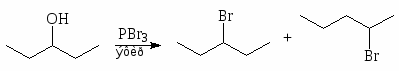
Замещение гидроксильной группы первичных и вторичных спиртов на галоген под действием трибромида фосфора и других галогенидов и оксигалогенидов фосфора происходит с перегруппировками:
(51)
(85%) (15%)
Упр.12. Напишите реакцию (R)-2-бутанола с трибромидом фосфора и опишите ее механизм.
Поскольку замещение гидроксильной группы на галоген с помощью галогенидов фосфора часто сопровождается изомеризацией и перегруппировками, эти реагенты следует применять только в простых случаях, где перегруппировка и изомеризация невозможны.
.
В. Действие квазифосфониевых солей
Гораздо более региоселективное замещение достигается при использовании квазифосфониевых солей.
При взаимодействии трифенилфосфина с галогенами образуются стабильные комплексы. Эти комплексы превращают спирты в алкилгалогениды:
(52)
(53)
Механизм:
(М 10))
Метод особенно удобен для первичных и вторичных спиртов, для которых можно ожидать изомеризации и перегруппировки.
Упр.13. Напишите реакцию неопентилового спирта с комплексом трифенилфосфина с хлором и опишите ее механизм.
Ответ.
(54)
неопентиловый спирт неопентилхлорид
Упр.14. Напишите реакцию 3-метил-2-бутанола с комплексом трифенилфосфина с бромом и опишите ее механизм.
Спирты можно превратить в хлориды или бромиды при взаимодействии с трифенилфосфином и тетрагалогенидами углерода:
(55)
Механизм этой реакции более сложен. Замещение происходит с обращением конфигурации.
Упр.15. Напишите реакции: (а) 2-пентанола с трифенилфосфином и тетрабромидом углерода, (б) гераниола с трифенилфосфином и тетрахлоридом углерода, (в) транс-2-бутен-1-ола с трифенилфосфином и тетрахлоридом углерода.

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ