Вычисление термодинамических функций индивидуального вещества H2 расчет константы равновесия реакции
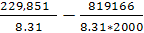 МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Воронежский государственный технический университет
Физико-технический факультет
Кафедра физики, химии и технологии литейных процессов
КУРСОВАЯ РАБОТА
по дисциплине «Физическая химия»
Тема: Вычисление термодинамических функций индивидуального вещества H2, расчет константы равновесия реакции 2MgOконд+Сграф↔ 2Mgконд+СО2.
Построение и анализ диаграммы состояния двухкомпонентной системы La—Sb.
Выполнил студент ЛП – 061 ____X_HACKER
группа подпись инициалы, фамилия
Руководитель А.Н. Корнеева
подпись инициалы, фамилия
Нормоконтроль А.Н. Корнеева
подпись инициалы, фамилия
Защищена________________Оценка______________________
2008 г
Воронежский государственный технический университет
Кафедра физики, химии и технологии литейных процессов
ЗАДАНИЕ
На курсовую работу по дисциплине
«Физическая химия»
Специальность 150104: «Литейное производство черных и цветных металлов»
Тема работы: Вычисление термодинамических функций заданного вещества H и константы равновесия заданной реакции
и константы равновесия заданной реакции
2MgOконд+Сграф↔ 2Mgконд+СО2
Построение и анализ диаграммы двойной системы La—Sb.
Содержание расчетно-пояснительной записки:
1 Вычисление термодинамических функций.
Вычисление термодинамических функций H0(T)-H0(0), S0(T), Ф0(Т), G0(T)-G0(0) для заданного вещества H
 в интервале температур 100-500К.
в интервале температур 100-500К.Описание физических и химических свойств вещества H
 , его применение.
, его применение.Расчет константы равновесия реакции 2MgOконд+Сграф↔ 2Mgконд+СО2 в интервале температур 1400 - 2400К, двумя способами и с помощью применения приведенной энергии Гиббса.
Построение и исследование диаграммы состояния двойной системы La—Sb.
Построение и исследование диаграммы состояния La—Sb по следующим пунктам:
Построить диаграмму состояния в La—Sb масс.д. и молек.д., определить тип диаграммы состояния, дать фазовый состав всех ее областей.
Установить формулы химических соединений, если таковые имеются на заданной диаграмме состояния La—Sb.
Указать температуру начала и конца кристаллизации для расплава системы, La—Sb содержащей 0,6 ат.д. Sb.
Определить природу и состав первых выпавших кристаллов из расплава, содержащего, 0,6 ат.д. Sb, а так же состав последних капель этого расплава.
По правилу рычага для системы La—Sb содержащей 0,6 ат.д. Sb, при температуре 1200oC, определить массы равновесных фаз, если было взято 50 г исходного сплава.
Найти число степеней свободы, в точках, соответствующих следующему составу системы и температуре:
Состав 0,4 ат.д. Sb, температура 1690oC
Состав 0,2 ат.д. Sb, температура 800 oC
Состав 0.8 ат.д. Sb, температура 1400oC
Нарисовать кривую охлаждения для системы, содержащей, 0,6 ат.д. Sb, и дать полное описание процесса охлаждения.
Руководитель работы:
Корнеева А.Н._________________________
Исполнитель:
Щербаков А.Е.________________________
Дата выдачи задания_____________________
Дата сдачи курсовой работы_____________
Дата защиты __________________________
СОДЕРЖАНИЕ
Задание
Содержание
1. Вычисление термодинамических функций
1.1. Вычисление термодинамических функций H0(T) - H0(0), S0(T), Ф0(T),
G0(T) - G0(0) для заданного вещества Н2 в интервале температур
100-500К.
1.2. Описание физических, химических свойств вещества H2 и его
применение.
1.3. Расчет константы равновесия реакции
2MgOконд+Сграф↔ 2Mgконд+СО2 в интервале температур 1400-2400К двумя
способами: с помощью энтропии и приведенной энергии Гиббса.
2. Построение и исследование диаграммы состояния двухкомпонентной
Системы La—Sb .
2.1. Построение и исследование диаграммы состояния La—Sb по
следующим пунктам:
2.1.1. Построить диаграмму состояния La—Sb в масс. д. и молек. д.,
определить тип диаграммы состояния, дать фазовый состав всех её областей.
2.1.2.Установить формулы химических соединений, если таковые
имеются на заданной диаграмме состояния La—Sb.
2.1.3. Указать температуру начала и конца кристаллизации
для расплава системы La—Sb, содержащей 0.6 ат. д. Sb.
2.1.4. Определить природу и состав первых выпавших кристаллов из
расплава, содержащего 0.6 ат Sb ат. д., а также состав последних
капель этого расплава.
2.1.5. По правилу рычага для системы La—Sb, содержащей 0.6 ат. д. Sb
при температуре 12000C, определить массы равновесных фаз,
если было взято 50 г исходного сплава.
Нахождение количества степеней свободы в точках,
соответствующих следующему составу системы и температуре:
Состав 0,4 ат.д. Sb, температура 1690oC
Состав 0,2 ат.д. Sb, температура 800 oC
Состав 0.8 ат.д. Sb, температура 1400oC
2.1.7. Кривая охлаждения для системы, содержащей 0.6 ат.д Sb, и полное описание процесса охлаждения.
Приложение А
Приложение Б
Приложение В
Приложение Г
Приложение Д
Список литературы
ВЫЧИСЛЕНИЕ ТЕРМОДИНАМИЧЕСКИХ ФУНКЦИЙ.
Для вычисления термодинамических функций H°(T)-H°(0), S°(T), Ф°(Т), G°(Т)-G°(0) заданного вещества H
 , в интервале температур 100-500 К с шагом 25 К используем табличные значения термодинамических функций Ср(Т), S0(100) и H0(100)-H0(0), приведенные в источнике [1]. Расчет термодинамических функций при температурах 100, 200, 300, 400, 500 К производим по формулам из источника [2]:
, в интервале температур 100-500 К с шагом 25 К используем табличные значения термодинамических функций Ср(Т), S0(100) и H0(100)-H0(0), приведенные в источнике [1]. Расчет термодинамических функций при температурах 100, 200, 300, 400, 500 К производим по формулам из источника [2]:
а) изменение энтальпии
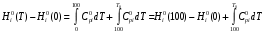 (1)
(1)
б) изменение энтропии 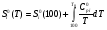 (2)
(2)
в) изменение энергии Гиббса 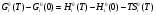 (3)
(3)
г) изменение приведенной энергии Гиббса:
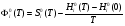 , (4)
, (4)
где:
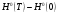 — высокотемпературная составляющая стандартной энтальпии;
— высокотемпературная составляющая стандартной энтальпии;
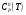 — значение стандартной теплоёмкости ;
— значение стандартной теплоёмкости ;
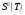 — стандартная энтропия индивидуального вещества при указанной температуре;
— стандартная энтропия индивидуального вещества при указанной температуре;
 — приведённая энергия Гиббса;
— приведённая энергия Гиббса;
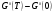 — разность стандартных энергий Гиббса при заданной температуре и при 0 К.
— разность стандартных энергий Гиббса при заданной температуре и при 0 К.
Для обеспечения точности вычисления термодинамических функций индивидуального вещества при указанных температурах с ошибкой не выше ~1%, стоградусный интервал, с которым приведены теплоемкости в источнике [1], разбивается на четыре равные части, и проводятся вычисления термодинамических функций 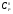 и
и 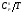 c шагом 25К, что достигается с помощью аппроксимации уравнений.
c шагом 25К, что достигается с помощью аппроксимации уравнений.
Выполнение расчетов термодинамических функций индивидуального вещества вышеизложенным образом осуществляется с помощью специальной компьютерной программы.
Значение термодинамических функций C0(T) и C0(T)/T для индивидуального вещества H приведены в таблице 1.
приведены в таблице 1.
Таблица 1
значение функций С0(Т) и С0(Т)/Т для H .
.
Т,К
С0(Т), Дж/моль*К
С0(Т)/Т
100
28.1550
0.2816
125
27.3679
0.2281
150
27.0895
0.1880
175
27.1611
0.1585
200
27.4470
0.1372
225
27.8350
0.1220
250
28.2358
0.1111
275
28.5837
0.1028
300
28.8360
0.0961
325
28.9732
0.0901
350
28.9993
0.0842
375
28.9411
0.0782
400
28.8490
0.0721
425
28.7965
0.0664
450
28.8803
0.0617
475
29.2204
0.0599
500
29.9600
0.0591
Примечание: С0(Т) – теплоёмкость вещества, рассчитывается при P=const.
Таблица 2.
Значение функций H0(T)-H0(0),S0(T),G0(T)-G0(0) для H .
.
Т,К
Н0(Т)-Н0(0), кДж/моль
S0(T), Дж/моль*К
Ф0(Т), Дж/моль*К
G0(T)-G0(0), кДж/моль
100
2.9990
100.6160
70.6260
-7.06260
200
5.7315
120.1235
91.4662
-18.29323
300
8.5517
131.4133
102.9076
-30.87229
400
11.4462
139.8283
111.2128
-44.48514
500
14.3515
146.1412
117.4382
-58.71912
Примечание:
Н0(Т)-Н0(0)—изменение энтальпии;
S0(T)—энтропия; Ф0(Т)—приведённая энергия Гиббса;
G0(T)-G0(0)—изменение энергии Гиббса.
Вывод: При вычислении термодинамических функций с помощью готовых программ мы показали, что ошибка в расчетах не превышает 1 %, в сравнении с приложением А. Из результатов вычислений видно, что, так как функция 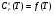 является возрастающей функцией температуры, то
является возрастающей функцией температуры, то 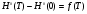 ,
, 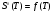 являются возрастающими функциями температуры, что и следует из законов термодинамики
являются возрастающими функциями температуры, что и следует из законов термодинамики 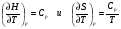 . (графики 1—3).
. (графики 1—3).
1.2 История открытия водорода. Выделение горючего газа при взаимодействии кислот и металлов наблюдали в 16 и 17 веках на заре становления химии как науки. Знаменитый английский физик и химик Г. Кавендиш в 1766 г. исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик А. Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и ее анализ, разложив водяной пар раскаленным железом. Таким образом, он установил, что «горючий воздух» входит в состав воды и может быть из нее получен. В 1787 Лавуазье пришел к выводу, что «горючий воздух» представляет собой простое вещество, и, следовательно, относится к числу химических элементов. Он дал ему название hydrogene (от греческого hydor — вода и gennao — рождаю) — «рождающий воду». Установление состава воды положило конец «теории флогистона». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году. На рубеже 18 и 19 века было установлено, что атом водорода очень легкий (по сравнению с атомами других элементов), и вес (масса) атома водорода был принят за единицу сравнения атомных масс элементов. Массе атома водорода приписали значение, равное 1.
Физические свойства. Газообразный водород может существовать в двух формах (модификациях) — в виде орто- и пара-водорода.
В молекуле ортоводорода (т. пл. −259,20 °C, т. кип. −252,76 °C) ядерные спины направлены одинаково (параллельны), а у параводорода (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны).
Разделить аллотропные формы водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно, что даёт возможность изучить свойства отдельных аллотропных форм. Молекула водорода двухатомна — Н₂. При обычных условиях — это газ без цвета, запаха и вкуса. Водород — самый легкий газ, его плотность во много раз меньше плотности воздуха. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые легкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха. [5]
Атомный номер
1
Атомная масса
1,00797 а.е.м.
Атомный объём
14,4 см3/моль
Электроотрицательность
2,2
Атомный радиус
0,79 А
Ковалентный радиус
0,32 А
Степень окисления
+1, иногда -1
Плотность
8,988Е-5 г/см3
Теплота распада
0,05868 кДж/моль
Температура кипения
-252,87 0С
Удельная теплоёмкость
14,304 Дж/г*К
Температура плавления
-255,34 0С
Температура перехода в сверхпроводящее состояние
0 К
Теплопроводность
0,1717 Вт/(моль*К) при 273 К
Теплота парообразования
0,44936 кДж/моль
Химические свойства. Электронная формула водорода 1s1. Молекулы водорода Н₂ довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия: Н₂=2Н - 432 кДж. Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция: Ca + Н2 = СаН2 и с единственным неметаллом - фтором, образуя фтороводород: F2+H2=2HF. С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении. Он может "отнимать" кислород от некоторых оксидов, например: CuO + Н₂ = Cu + Н₂0. Записанное уравнение отражает реакцию восстановления. Реакциями восстановления называются процессы, в результате которых от соединения отнимается кислород; вещества, отнимающие кислород, называются восстановителями (при этом они сами окисляются). Реакция восстановления противоположна реакции окисления. Обе эти реакции всегда протекают одновременно как один процесс: при окислении (восстановлении) одного вещества обязательно одновременно происходит восстановление (окисление) другого.
N2 + 3H2 → 2NH3
С галогенами образует галогеноводороды:
F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 → CH2 [5]
Распространенность в природе и получение. Водород широко распространён в природе, его содержание в земной коре (литосфера и гидросфера) составляет по массе 1%, а по числу атомов 16%. Водород входит в состав самого распространённого вещества на Земле — воды (11,19% водород по массе), в состав соединений, слагающих угли, нефть, природные газы, глины, а также организмы животных и растений (т. е. в состав белков, нуклеиновых кислот, жиров, углеводов и др.). В свободном состоянии водород встречается крайне редко, в небольших количествах он содержится в вулканических и других природных газах. Ничтожные количества свободного водорода (0,0001% по числу атомов) присутствуют в атмосфере. В околоземном пространстве водород в виде потока протонов образует внутренний («протонный») радиационный пояс Земли. В космосе водород является самым распространённым элементом. В виде плазмы он составляет около половины массы Солнца и большинства звёзд, основную часть газов межзвёздной среды и газовых туманностей. Водород присутствует в атмосфере ряда планет и в кометах в виде свободного H2, метана CH4, аммиака NH3, воды H2O, радикалов типа CH, NH, OH, SiH, PH и т.д. В виде потока протонов водород входит в состав корпускулярного излучения солнца и космических лучей. Обыкновенный водород состоит из смеси 2 устойчивых изотопов: лёгкого водорода, или протия (1H), и тяжёлого водорода, или дейтерия (2H, или D). В природных соединениях водорода на 1 атом 2H приходится в среднем 6800 атомов 1H. Искусственно получен радиоактивный изотоп — сверхтяжёлый водород, или тритий (3H, или Т), с мягким β-излучением и периодом полураспада T1/2 = 12,262 года. В природе тритий образуется, например, из атмосферного азота под действием нейтронов космических лучей; в атмосфере его ничтожно мало (4·10-15% от общего числа атомов водорода). Получен крайне неустойчивый изотоп 4H. Массовые числа изотопов 1H, 2H, 3H и 4H, соответственно 1,2, 3 и 4, указывают на то, что ядро атома протия содержит только 1 протон, дейтерия — 1 протон и 1 нейтрон, трития — 1 протон и 2 нейтрона, 4H — 1 протон и 3 нейтрона. Большое различие масс изотопов водорода обусловливает более заметное различие их физических и химических свойств, чем в случае изотопов других элементов. Различают лабораторные и промышленные способы получения водорода. В лабораторных условиях в настоящее время применяется: взаимодействие активных металлов с кислотами — неокислителями:
Zn + 2HCl = ZnCl2 + H2
взаимодействие алюминия (или цинка) с водными растворами щелочей:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
В промышленности: электролиз воды и водных растворов щелочей и солей:
2H2O = 2H2+ O2
2NaCl + 2H2O = H2+ Cl+ 2NaOH
пропускание паров воды над раскалённым углём при 1000 0C:
C + H2O = CO + H2
конверсия метана при 900 0C:
CH4 + H2O = CO + 3H2 [6]
Применение. Широкое применение водород нашел в химической промышленности — при синтезе аммиака, изготовления соляной и метиловой кислот, получения метилового спирта. В пищевой промышленности его используют для превращения жидких жиров в твердые (их гидрогенизации). Учитывая «невесомость» водорода, им заполняли и заполняют оболочки летательных аппаратов легче воздуха. Сначала это были воздушные шары, позднее — аэростаты и дирижабли, сегодня (вместе с гелием) — метеорологические зонды. Высокая температура горения, а в сочетании с электрической дугой она достигает 4000 0С, обеспечивает расплав даже самых тугоплавких металлов. Поэтому кислородно-водородные горелки используют для сварки и резки металлов. В цветной металлургии восстановлением водородом получают особо чистые металлы из оксидов. В космической технике отечественная ракета-носитель «Энергия» с успехом использует водород в качестве топлива. Водород используют при синтезе хлороводорода HCl, метанола СН3ОН, при гидрокрекинге (крекинге в атмосфере водорода) природных углеводородов, как восстановитель при получении некоторых металлов. Гидрированием природных растительных масел получают твердый жир — маргарин. Жидкий водород находит применение как ракетное топливо, а также как хладагент.
Одно время высказывалось предположение, что в недалеком будущем основным источником получения энергии станет реакция горения водорода, и водородная энергетика вытеснит традиционные источники получения энергии (уголь, нефть и др.). При этом предполагалось, что для получения водорода в больших масштабах можно будет использовать электролиз воды. Электролиз воды — довольно энергоемкий процесс, и в настоящее время получать водород электролизом в промышленных масштабах невыгодно. Но ожидалось, что электролиз будет основан на использовании среднетемпературной (500-600°C) теплоты, которая в больших количествах возникает при работе атомных электростанций. Эта теплота имеет ограниченное применение, и возможности получения с ее помощью водорода позволили бы решить как проблему экологии (при сгорании водорода на воздухе количество образующихся экологически вредных веществ минимально), так и проблему утилизации среднетемпературной теплоты. Однако после Чернобыльской катастрофы развитие атомной энергетики повсеместно свертывается, так что указанный источник энергии становится недоступным. Поэтому перспективы широкого использования водорода как источника энергии пока сдвигаются, по меньшей мере, до середины 21-го века.
Особенности обращения: водород не ядовит, но при обращении с ним нужно постоянно учитывать его высокую пожаро- и взрывоопасность, причем взрывоопасность водорода повышена из-за высокой способности газа к диффузии даже через некоторые твердые материалы. Перед началом любых операций по нагреванию в атмосфере водорода следует убедиться в его чистоте (при поджигании водорода в перевернутой вверх дном пробирке звук должен быть глухой, а не лающий). [6]
1.3 Расчёт константы равновесия реакции 2MgOконд+Сграф↔ 2Mgконд+СО2 в интервале температур 1400 - 2400K, двумя способами, с помощью энтропии и приведенной энергии Гиббса.
Используя справочные данные по температурной зависимости изменения энтальпии реагентов, их энтропии, приведённой энергии Гиббса рассчитываем логарифм константы равновесия lnKp реакции 2MgOконд+Сграф↔ 2Mgконд+СО2, в интервале температур 1400 - 2400K [1].
Расчёт производится двумя способами.
С использованием абсолютных значений энтропии:
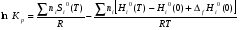 (5)
(5)
где ni – соответствующие стехиометрические коэффициенты, S°i(T) – стандартная абсолютная энтропия индивидуального вещества при данной температуре, H0i(T) – H0i(0) – высокотемпературные составляющие энтальпии индивидуального вещества, ∆fH0(0) – стандартная энтальпия образования индивидуального вещества при Т = 0 К [2].
Расчет при температуре 2000 К:
Σ ni Sio (T) = 2*S0Mg(2000)+ S0CO2(2000)- 2*S0MgO конд(2000)- S0C граф(2000)= 2*99,802+309,193-2*119,027-40,892=229,851 Дж/мольК
Σ ni [Hi0(T)- Hi0(0)+∆f Hi0(0)]=2*[HMg0(2000)- HMg0(0)+ ∆f HMg0(0)]+ [HCO20(2000)- HCO20(0)+ ∆f HCO20(0)]- 2*[HMgO0(2000)- HMgO0(0)+ ∆f HMgO0(0)]- [HC0(2000)- HC0(0)+ ∆f HC0(0)]= 2*68,200+100,825-393,142-2*(91,426-597,319)-36,703=819,166 кДж/моль
lnKp=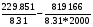 =27.65-49.29=-21.63
=27.65-49.29=-21.63
2) С помощью приведенной энергии Гиббса:
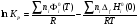 , где (6)
, где (6)
 - приведенная энергия Гиббса;
- приведенная энергия Гиббса; 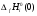 - стандартная теплота образования индивидуального вещества при Т=0 К.
- стандартная теплота образования индивидуального вещества при Т=0 К.
Σ ni Фi0 (T)= 2*ФMg0(2000)+ ФCO20(2000)- 2*ФMgO0(2000)- ФC0(2000)= 2*65.703+258.781-2*73.314-22.540=221.019 Дж/мольК
Σ ni∆f Hi0(0)= 2*∆f HMg0(0)+ ∆f HCO20(0)- 2*∆f HMgO0(0)- ∆f HC0(0)=
0-393.142+2*597.319-0=801,496 кДж/моль
lnKp=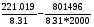 =26.6-48.3=-21.63
=26.6-48.3=-21.63
Аналогично рассчитывается константа равновесия химической реакции и для всех остальных температур из интервала 1400 -2400K; все необходимые данные находятся в таблицах приложений. Полученные результаты для всего интервала температур приведены в таблице 3.
Таблица 3.
Расчет ln Kp двумя способами в интервале температур 1400-2400K
T,K
1/T, К*106
I способ,lnKP
I способ,lnKP
Kp
1400
714
-42,85
-42,85
2.45*10-19
1500
666
-38,09
-38,09
2.86*10-17
1600
625
-33,97
-33,97
1.76*10-15
1700
588
-30,34
-30,34
6.66*10-14
1800
556
-27,11
-27,11
1.68*10-12
1900
526
-24,22
-24,22
3.03*10-11
2000
500
-24,63
-21,63
4.04*10-10
2100
476
-19,28
-19,28
4*10-9
2200
455
-17,15
-17,15
3.5*10-8
2300
435
-15,24
-15,24
2.4*10-7
2400
417
-13,34
-13,34
1.61*10-6
Используя полученный график (рисунок 4) и формулу:
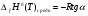 (7)
(7)
рассчитаем среднее значение теплового эффекта реакции:
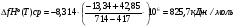
Вывод: Данная реакция является эндотермической, так как с ростом температуры увеличивается константа равновесия и равновесие смещается в сторону прямой реакции.
Вывод основан на принципе Ле – Шателье, который гласит: если на систему, находящуюся в равновесии, воздействовать извне и тем изменить условия, определяющие положение равновесия, то в системе усиливается то из направлений процесса, течение которого ослабляет влияние этого воздействия, в результате чего положение равновесия сместится в этом же направлении. [4]
2.ПОСТРОЕНИЕ И ИССЛЕДОВАНИЕ ДИАГРАММЫ СОСТОЯНИЯ ДВУХКОМПОНЕНТНОЙ СИСТЕМЫ La—Sb
2.1 Построение и исследование диаграммы состояния La—Sb в атомных и массовых долях.
2.1.1 Данная диаграмма, изображённая на рисунке 5, является двухкомпонентной системой с полной растворимостью в жидком состоянии, с отсутствием растворимости в твердом состоянии, с образованием одного устойчивого химического соединения конгруэнтного плавления и образованием трех неустойчивых химических соединении инконгруэнтного плавления, с вырожденной эвтектикой.
Фазовый состав:
I (L): жидкий расплав;
II (L + SLa): жидкий расплав + кристаллы твердого р-ра на основе компонента La;
III (L + SLa2Sb): жидкий расплав + кристаллы твердого р-ра на основе компонента La2Sb;
IV (SLa + SLa2Sb): кристаллы твердого р-ра на основе компонента La + неустойчивое химическое соединение La2Sb ;
V (L+SLa3Sb2): жидкий расплав + устойчивое химическое соединение La3Sb2;
VI (L+SLa2Sb3): жидкий расплав + устойчивое химическое соединение La3Sb2;
VII (SLa2Sb + SLa3Sb2): неустойчивое химическое соединение LaSb3+ устойчивое химическое соединение La2Sb3;
VIII (SLa3Sb2 + SLaSb): неустойчивое химическое соединение LaSb+ устойчивое химическое соединение La3Sb2;
IX (L+ SLaSb): жидкий расплав + неустойчивое химическое соединение LaSb;
X (SLaSb + SLaSb2): неустойчивое химическое соединение LaSb+ неустойчивое химическое соединение LaSb2;
XI (L+ SLaSb2): жидкий расплав + неустойчивое химическое соединение LaSb2;
XII (SLaSb2 + SSb): кристаллы твердого р-ра на основе компонента Sb + неустойчивое химическое соединение LaSb2.
Точкa эвтектики:
E1: LE1 ↔ SLa + SLa2Sb С=0 Ф=3
Переведём в массовые доли точки, соответствующие следующим атомным долям cурьмы: A=0,5 ат.д.; B=0,6 ат.д; C=0,74. Для этого воспользуемся следующеё формулой:
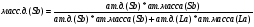
Проведём пересчёт для каждой из точек:
A: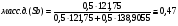
B: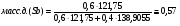
C: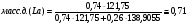
2.1.2 На данной диаграмме имеется четыре химических соединения, которые условно обозначили следующим образом: LaxSby , LazSbw , LaaSbb , LacSbd . Индексы при химических элементах соответствуют количеству атомов. А количество атомов, в свою очередь, находится из отношения атомных долей этих элементов. Ниже приведены расчёты этих индексов:
x:y=атомная доля(La):атомная доля(Sb).
LaxSby
x:y=0.33:0.67
x:y=1:2
Отсюда следует, что химическая формула данного химического соединения LaSb2.
Аналогично, находим индексы для химического соединения LazSbw:
z:w=0.6:0.4
z:w=3:2
Следовательно, химическая формула данного соединения – La3Sb2.
Для химического соединение LaaSbb
a:b=0.5:0.5
a:b=1:1
Данная формула выглядит следующим образом: LaSb
Химическое соединение LacSbd
c:d=0.33:0.67
c:d=1:2
Получили химическое соединение, в котором содержание меди и лантана находится в равных пропорциях – LaSb2.
Скомпонуем полученные результаты: La2Sb, La3Sb2, LaSb, LaSb2.
2.1.3 Температура начала кристаллизации расплава системы La—Sb, содержащей 0,6 ат.д. Sb, равна 1475С, температура конца кристаллизации равна 1110С.
2.1.4 Первые выпавшие кристаллы из расплава, содержащего 0,6 ат. д. Sb находятся в виде неустойчивого химического соединения LaSb. Составу последней капли этого расплава соответствует точка перитектики Р3, содержащая 0,74 ат.д. Sb.
2.1.5 Воспользовавшись данными, полученными в пункте 2.1.1, определим по правилу рычага для системы La - Sb, содержащей 0,6 ат.д. Sb при температуре 12000C и при массе сплава 50г массы равновесных фаз:
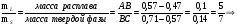
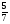 mS=mL
mS=mL
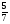 mS=mL mS=29,2г
mS=mL mS=29,2г
mS+mL =50г mL =20,8г
2.1.6 Число степеней свободы находится по правилу фаз Гиббса: С=К-Ф+1, где С - степень свободы, которая характеризует число независимых параметров, которые можно свободно изменять; Ф - число фаз системы; К - число компонентов системы.
Отсюда следует, что система, у которой:
состав 40 ат. д. Sb, температура 16900С, имеет: К=2, Ф=3, С=2-3+1=0;
состав 20 ат. д.Sb, температура 8000С, имеет: К=2, Ф=2, С=2-2+1=1;
состав 80 ат. д. Sb, температура 14000C, имеет: К=2, Ф=1, С=2-1+1=2.
2.1.7. При температуре, выше 14750C, состав системы La-Sb находится в виде расплава, Ф=1, С=2. При охлаждении до температуры 14750C расплав становится насыщенным неустойчивым химическим соединением LaSb, и начинается его кристаллизация. Система становится двухфазной, С=1. При дальнейшем охлаждении до температуры 11100C растет масса кристаллов химического соединения LaSb, состав расплава изменяется по кривой MP3, в нем увеличивается содержание сурьмы. Температуре 11100C соответствует точка перитектики P3, отвечающая составу его последних капель, здесь происходит перитектическое превращение: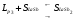 . Кристаллизация расплава заканчивается при температуре 11100C. При температуре ниже 11100C происходит охлаждение механической смеси твердых химических соединений LaSb и LaSb2, Ф=1, С=2.
. Кристаллизация расплава заканчивается при температуре 11100C. При температуре ниже 11100C происходит охлаждение механической смеси твердых химических соединений LaSb и LaSb2, Ф=1, С=2.
Приложение А
Зависимость теплоемкости Н2 от температуры
T.К
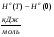
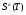
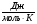

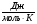

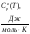
100
2,999
100,616
70,624
28,155
200
5,693
119,301
90,836
27,477
300
8,468
130,747
102,169
28,849
400
11,426
139,104
110,538
29,181
500
14,349
145,626
116,527
29,260
Приложение Б
Значение термодинамических функций для Mg.
T,К
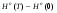
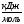
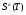
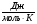
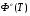
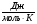
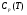
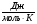
1400
47.620
87.569
55.554
34.300
1500
51.050
89.935
55.902
34.300
1600
54.480
92.149
58.099
34.300
1700
57.910
94.228
60.163
34.300
1800
61.340
96.189
62.111
34.300
1900
64.770
98.043
63.954
34.300
2000
68.200
99.802
65.703
34.300
2100
71.630
101.476
67.367
34.300
2200
75.060
103.072
68.954
34.300
2300
78.490
104.596
70.470
34.300
2400
81.920
106.056
71.923
34.300
Приложение В
Значение термодинамических функций для MgO.
T.К
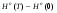
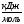
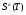
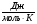

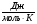
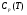
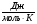
1400
58.856
99.696
57.656
52.890
1500
64.168
103.361
60.582
53.341
1600
69.524
106.818
63.365
53.793
1700
74.927
110.093
66.018
54.255
1800
80.376
113.207
68.554
54.736
1900
85.875
116.180
70.983
55.243
2000
91.426
119.027
73.314
55.783
2100
97.033
121.763
75.557
56.363
2200
102.700
124.399
77.717
56.991
2300
108.433
126.947
79.803
57.674
2400
114.237
129.417
81.819
58.416
Приложение Г
Значение термодинамических функций для CO2
T.К
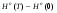
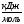
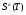
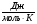

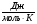
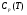
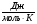
1400
65.273
288.086
241.462
57.818
1500
71.085
292.095
244.705
58.397
1600
76.950
295.880
247.787
58.898
1700
82.862
299.464
250.722
59.334
1800
88.815
302.867
253.525
59.717
1900
94.804
306.105
256.208
60.054
2000
100.825
309.193
258.781
60.354
2100
106.874
312.144
261.252
60.622
2200
112.948
314.970
263.630
60.862
2300
119.045
317.680
265.922
61.080
2400
125.163
320.284
268.133
61.278
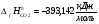
Приложение Д
Значение термодинамических функций для C.
T.К
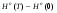
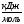
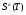
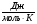

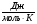
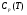
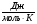
1400
21.960
32.138
16.453
23.919
1500
24.367
33.799
17.554
24.225
1600
26.802
35.271
18.619
24.464
1700
29.258
26.859
19.649
24.543
1800
31.729
38.272
20.645
24.775
1900
34.212
39.614
21.608
24.875
2000
36.703
40.892
22.540
24.957
2100
39.203
42.112
23.444
25.034
2200
41.710
43.278
24.319
25.121
2300
44.228
44.397
25.168
25.231
2400
46.758
45.474
25.991
25.379
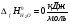
Список литературы.
Термодинамические свойства индивидуальных веществ. Т.1-4 книга вторая. Таблицы термодинамических свойств: Справочное издание / Под ред. В.П. Глушкова. – М.: Наука 1979.
Методические указания для выполнения курсовой работы по дисциплинам «Физическая химия» и «Химия». /ВГТУ; Сост. В.В. Корнеева, А.А Щетинин, Ю.П. Хухрянский, А.Н. Корнеева, 2002. 24 с.
Реми Г.Курс неорганической химии. 11-е издание, выполненное кандидатом химических наук А.И.Григорьевым .Т.1-4-М.:Мир,1972.
Коровин Н.В., Общая химия. – М.: Высшая школа, 2007.
Интернет. Сайт http://him.1september.ru.
Некрасов Б. Водород, Курс общей химии, 14 изд., М., 1962;

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ