Использование физико-химических методов в анализе лекарственных средств растительного происхождения
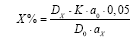
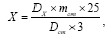 Использование физико-химических методов в анализе лекарственных средств растительного происхождения
Использование физико-химических методов в анализе лекарственных средств растительного происхождения
О.М. Маркова, В.А. Карпенко, А.С. Саушкина, Т.Т. Лихота
В настоящее время в медицинской практике все большее значение придается лекарственным средствам растительного происхождения. Широко используются такие лекарственные формы как жидкие экстракты, настойки.
Целью нашего исследования являлось применение физико-химических методов для анализа экстракта чабреца жидкого и настоек красавки и чемерицы.
Идентификацию действующих веществ настоек и экстракта проводили с помощью хроматографии в тонком слое сорбента на пластинах «Сорбфил» с люминофором. В качестве растворителей использовали системы: для экстракта чабреца-бензолэтил-ацетат-ледяная уксусная кислота (5:5:1); настойки красавки-ацетон-раствор аммиака (9:1); настойки чемерицы-хлороформ-спирт метиловый (8:2). Проявление пятен алкалоидов осуществляли с помощью реактива Драгендорфа (настойки красавки и чемерицы), флавоноидов - раствором хлорида алюминия, тимола – парами иода (экстракт чабреца). Идентификацию проводили по значениям величин Rf пятен, их окраске и в сравнении со стандартными образцами [1.2].
Для обнаружения флавоноидов в экстракте чабреца предложено также использовать DЕ-вариант дифференциальной спектрофотометрии, основанный на реакции комплексообразования флавоноидов с алюминия хлоридом, и позволяющий выделить полосу поглощения комплекса. Дифференциальный спектр экстракта чабреца по положению длинноволнового максимума поглощения совпадает со спектром лютеолина (lmax395±3нм) – доминирующего компонента флавоноидной фракции чабреца.
Для количественного определения биологически активных веществ в указанных объектах использовали различные варианты фотометрического анализа.
Содержание флавоноидов в экстракте чабреца жидкого определяли дифференциальным спектрофотометрическим DE-методом по реакции комплексообразования с хлоридом алюминия [3]. Основным преимуществом его является возможность избирательного определения флавоноидов в сложных смесях полифенольных соединений, в частности, в извлечениях из растительного сырья, без предварительного разделения. В качестве стандартного вещества предложено использовать лютеолин.
Определение проводили по следующей методике: около 1мл препарата помещали в мерную колбу вместимостью 25 мл и доводили водой до метки. В две мерные колбы вместимостью 25 мл переносили по 3 мл полученного раствора. В первую колбу прибавляли 10 мл спирта этилового 95%, 2 мл 2% раствора хлорида алюминия в спирте этиловом 95% и 0,1 мл кислоты уксусной разведенной, доводили до метки спиртом этиловым 95% и фильтровали (раствор А). Во вторую колбу добавляли 0,1 мл кислоты уксусной разведенной, доводили до метки спиртом этиловым 95% и фильтровали (раствор Б). Через 30 мин измеряли оптическую плотность раствора А при длине волны 395 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения использовали раствор Б.
Параллельно измеряли оптическую плотность раствора ГСО лютеолина, для чего в две мерные колбы вместимостью 25 мл помещали по 1 мл 0.03% раствора ГСО лютеолина и далее поступали, как указано в методике выше.
Содержание суммы флавоноидов в пересчете на лютеолин в процентах (Х) вычисляли по формуле:
где Dх - оптическая плотность испытуемого раствора; Dст - оптическая плотность стандартного раствора ГСО лютеолина; mст - масса ГСО лютеолина в граммах.
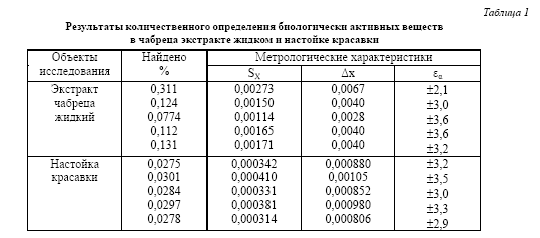
Содержание суммы флавоноидов было определено в 20 сериях экстракта, изготовленных на различных фармацевтических фабриках, и составило в пересчете на лютеолин от 0,096% до 0,311%. Фрагмент результатов анализа нескольких серий чабреца экстракта жидкого приведен в табл.1. Относительная ошибка методики при доверительной вероятности 0,95 не превышала ±3,6%.Отсутствие систематической ошибки анализа чабреца экстракта подтверждено опытами с добавками ГСО-лютеолина.
Количественное определение суммы алкалоидов настойки красавки в пересчете на атропин основание проводили экстракционно-спектрофотометрическим методом. 2 мл препарата упаривали в выпарительной чашке на кипящей водяной бане досуха, остаток смывали 2мл воды в делительную воронку вместимостью 100 мл. Прибавляли 2-3 мл раствора аммиака, экстрагировали 2 раза по 10 мл хлороформа в течение 3 минут. Хлороформное извлечение фильтровали в выпарительную чашку через фильтр с 1 г натрия сульфата безводного. Полученные хлороформные извлечения упаривали на кипящей водяной бане досуха. Сухой остаток переносили с помощью хлороформа в мерную колбу вместимостью 25 мл, доводили до метки хлороформом. 5 мл хлороформного извлечения помещали в делительную воронку, прибавляли 8 мл буферного раствора (рН 5,3-5,5), 2 мл раствора метилового оранжевого, экстрагировали 2 раза по 10 мл хлороформа в течение 3 минут. Хлороформное извлечение фильтровали в мерную колбу вместимостью 25 мл через фильтр с 1 г натрия сульфата безводного, предварительно смоченного хлороформом. Измеряли оптическую плотность полученного извлечения на спектрофотометре в кювете с толщиной слоя 10 мм при длине волны 420 нм.
Параллельно измеряли оптическую плотность раствора 0,0116% РСО атропина сульфата, приготовленного аналогично испытуемому раствору (2 мл раствора Б) помещали в делительную воронку, прибавляли 8 мл буферного раствора (рН 5,3-5,5) 2 мл раствора метилового оранжевого и далее по методике.
В качестве раствора сравнения использовали хлороформ.
Содержание суммы алкалоидов (в процентах) в препарате в пересчёте на атропин основание вычисляли по формуле:
Dx – оптическая плотность испытуемого извлечения;
Dо – оптическая плотность извлечения раствора РСО атропина основания;
аx – навеска препарата, мл;
ао – навеска РСО атропина сульфата, г;
К - коэффициент пересчета атропина сульфата на атропин основание, 0,862.
Содержание суммы алкалоидов в препарате в пересчёте на атропин основание составило от 0,028 до 0,030%. Полученные результаты количественного определения суммы алкалоидов в пересчете на атропин основание представлены в табл.1. Относительные погрешности определения находятся в пределах 3,3 – 3,9%.
В результате проведенных исследований получены достоверные результаты, которые могут быть положены в основу стандартизации экстракта чабреца и настойки красавки.
Список литературы
1. Клышев Л.К., Бандюкова В.А., Алюкина Л.С. Флавоноиды растений. - Алма-Ата: Изд-во Наука Каз. ССР, 1978.- 220 с.
2. Маркова О.М. Использование оптических и хроматографических методов для стандартизации растительного сырья и лекарственных препаратов чабреца и тимьяна. Автореф. дис. ... канд. фармац. наук.-Пятигорск,1997.- 23 с.
3. Химический анализ лекарственных растений под ред.Н.И.Гринкевича.-Москва «Высшая школа», 1983, с.175.

Нравится материал? Поддержи автора!
Ещё документы из категории медицина, здоровье:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ