Ноотропные и нормотимические препараты




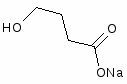
 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
УКРАИНСКИЙ ГОСУДАРСТВЕННЫЙ ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ
УНИВЕРСИТЕТ
КУРСОВАЯ РАБОТА
НАТЕМУ:
НООТРОПНЫЕ И НОРМОТИМИЧЕСКИЕ
ПРЕПАРАТЫ
г. Днепропетровск 2006 г.
Содержание
Введение 3
1. Общие положения 4
1.1 Препараты метаболического действия 4
1.2 Соли лития 6
1.2.1 Показания для назначения стабилизаторов настроения 8
1.2.2 Маниакальный синдром 9
2. История возникновения препаратов 11
2.1 Нормотимические средства 11
2.2 Ноотропные средства 14
3. Классификация препаратов 16
3.1 Классификация нормотимических средств 16
3.2 Классификация ноотропных средств 17
4. Механизм биологической активности 18
4.1 Нормотимические средства 18
4.1.1 Нейротрансмиттеры и связанные с ними теории 18
4.2 Ноотропные препараты 25
5. Методы получения. 31
5.1 Ацефен 31
5.2 Карбамазепин 32
5.3 Баклофен 33
5.4 Пикамилон 36
5.4.1 Синтетические исследования 37
5.4.2 Экспериментальная химическая часть 37
6. Методы анализа ноотропных препаратов 39
6.1 Карбамазепин [18] 39
6.1.1 Подлинность 39
6.1.2 Количественное определение 40
6.2 Ацефен 40
6.2.1 Фотометрический метод определения ацефена [21] 41
6.3 Фармакопейный анализ пиридитола (энцефабола) 42
7. Таблица препаратов 45
Терминологический словарь 49
Литература 51
Введение
Ноотропные препараты являются представителями средств, стимулирующих центральную нервную систему. Термин “ноотропы”(от греч. noos-мышление, разум, tropos-стремление) был предложен в 1972г румынским ученым Жиурджеа для изучавшейся новой группы психотропных препаратов, первый из которых был назван ноотропилом. Специфической особенностью этих препаратов является их стимулирующее влияние на интегративные функции мозга, облегчение обучаемости, улучшение памяти. Ноотропилу было в дальнейшем присвоено международное название пирацетам. Препарат нашел широкое применение для лечения различных нарушений функций центральной нервной системы, в том числе заболеваний, связанных с атеросклеротическими поражениями сосудов мозга, особенно у людей пожилого и старческого возраста, при заболеваниях нервной системы, сопровождающихся снижением интеллектуально-мнестических функций, при астенических состояниях, умственной отсталости у детей и других нервных и психических расстройствах. В поисках новых ноотропных препаратов был создан ряд “модифицированных” аналогов пирацетама (этирацетам, оксирацетам, анирацетам) [2].
В СССР ресинтез пирацетама осуществлен во ВНИХФИ им. С.Орджоникидзе. Поиски новых ноотропов в других рядах химических соединений также ведутся достаточно активно, но, главным образом, за счет открытия ноотропных свойств и реанимации ранее известных веществ [3].
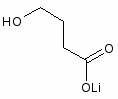
Нормотимическими препаратами являются препараты лития.
Литий – элемент из группы щелочных металлов. Соли лития предложены давно для лечения подагры и растворения почечных камней. В больших дозах литий понижает содержание в мозге серотонина. Ионы лития повышают чувствительность нейронов гиппокампа и других областей мозга к дофамина. Литий активно влияет на протекающие в мозге нейрохимические процессы, что может лежать в основе его терапевтической активности при психических заболеваниях [1].
Нормотики или тимоизолептики (в соответствии с номенклатурой J.Delay, P.Deniker)-препараты, способные нивелировать циркулярные расстройства аффективной сферы (колебания настроения) и при профилактическом применении предотвращать развитие депрессивной и маниакальной симптоматики.
Профилактика рецидивов аффективной и шизоаффективной структуры при фазнопротекающих психозах остается важнейшей задачей современной терапии психических заболеваний, поскольку речь идет о существенном сокращении числа повторных обострений и, следовательно, удержании высокого уровня социально-трудовой адаптации у наиболее сохранной части больных эндогенными психозами [6].
1. Общие положения
1.1 Препараты метаболического действия
Группа препаратов, отличающиеся строением, точкой влияния и механизмом действия. Имеют общую особенность – нормализующее влияние на процессы тканевого метаболизма в центральной нервной системе.
Эти препараты широко применяются в терапии астенических состояний разного генеза, снижениях общей активности, нарушениях памяти (травматического, инфекционного происхождения); постинсультных состояниях, комах разного генеза, интоксикациях, умственной отсталости, вегетативных дисфункциях.
В детской психиатрии применяют для терапии острых и резидуальных проявлениях органического поражения центральной нервной системы, в комплексной терапии интеллектуальной недостаточности. Некоторые препараты применяются в качестве корректоров нейролептической терапии [11].
Основным представителем группы ноотропов является пирацетам (ноотропил) – циклическое соединение -аминомасляной кислоты. В отличие от нее пирацетам способен проходить через гематоэнцефалический барьер, достигая максимума концентрации в спинномозговой жидкости через 3 часа; перод полувыведения его равен 7,5 часам.
Первым свойством пирацетама, на которое в клинике было обращено внимание исследователей, явилось повышение порога возбудимости экспериментального нистагма. Это свойство послужило основанием для применения пирацетама в качестве средства, уменьшающего головокружение. Дальнейшие наблюдения выявили влияние пирацетама на ассоциативную деятельность полушарий, т.е. обучаемость, планирование и организацию поведения на длительный срок, возможность абстрактного мышления, контроль за функционированием нижележащих отделов мозга – лимбической системы и ствола.
Пирацетам может применяться в любом возрасте, в том числе – в детской практике – при умственном недоразвитии детей и в гериатрии. Лечение пирацетамом длительное – не менее 2-3, до 6 месяцев. Не рекомендуется прием препарата во время беременности.
К положительным свойствам пирацетама следует также отнести его хорошую переносимость в старческом возрасте, большой диапазон терапевтических доз – от 400 мг до 10 г в сутки. Лишь у отдельных больных отмечаются трудность засыпания.
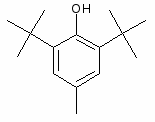
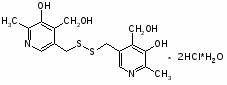
Заслуживает вниманаия также ноотропный препарат пиридитол (энцефабол, эенербол). Он обладает антидепрессивными свойствами, увеличивает двигательную и психическую активность больных и, что особенно важно, у детей.
Положительное влияние энцефабола на дыхательную функцию наблюдали у больных с боковым амиотрофическим склерозом. Наблюдения показывают, что энцефабол не влияет на симптомы, вызванные грубыми структурными изменениями, но улучшает функциональные возможности нервных клеток.
В качестве ноотропов применяются также аминалон (гамалон), пантогам, церебролизин (энцефалолизат). Эти препараты различны по химическому строению и свойствам, объединяет их способность улучшать метаболизм нервной ткани. При лечении больных аминалоном и церебролизином, по–видимому, эффект обусловлен действием комплекса аминокислот. Пантогам, по мнению, исследователей обладает более широким спектром фармакологической активности, чем пирацетам. Он снижает моторную возбудимость, упорядочивает поведение и одновременно повышает трудоспособность, умственную активность.
Особое место среди ноотропных средств занимает кавинтон. Это сильный вазоактивный препарат с выраженным ноотропным эффектом, т.е. влияющий, по мнению его авторов и на метаболизм нервных клеток.
В клинике действие кавинтона изучалось многочисленными исследователями. В соответствии с показаниями, кавинтон назначается больным с различной цереброваскулярной паталогией, сосудистыми заболеваниями глаз и ушей. Широкое применение нашел кавинтон в гериатрической практике. Кавинтон применяется как в чистом виде, так и в комбинации с гипотензивными, сердечными, антидиабетическими препаратами и т.д. Единственным, но существенным противопоказанием к назначению кавинтона является сердечная аритмия. Дозы кавинтона колеблются в пределах от 5мг до 60 мг и даже 100 мг однократно.
Наибольший эффект при лечении кавинтоном наблюдали при вертебральнобазилярной недостаточности. Вместе с тем, как показали наблюдения, проведенные в НИИ неврологии АМН СССР, кавинтон значительно улучшает психическое состояние больных. Преимущественное влияние кавинтона на серое вещество головного мозга, показанное Biro с соавт., помогает найти объяснение действию препарата на психические функции. Важным обстоятельством является повышение эффективности кавинтона при увеличении степени гипоксии.
Клиническое и клинико-физиологические исследования свидетельствуют, что ноотропные препараты могут с успехом применяться при различных неврологических синдромах.
Основными показаниями для применения ноотропов в неврологической практике являются все виды астенических состояний, травмы, нарушения мозгового крвообращения и их последствия [3].
В последнее время как эффективные корректоры расстройств сна применяют ноотропные средства, большинство среди которых является структурными аналогами ГАМК.
Фармакодинамика. Фарамакотерапевтический эффект ноотропных средств при различных нарушениях сна объясняет их неврометаболическое действие.
Ноотропные средства (пирацетам, аминалон, натрия оксибутират, фенибут, баклофен, пантогам) нормализуют метаболизм клеток ЦНС, активизируют энергетический и белковый обмен, облегчают передачу нервных импульсов, повышают стойкость мозга к гипоксии и токсических влияний. Эти свойства дают возможность применять их при любых нарушениях сна, независимо от этиопатогенетических механизмов, т.к. инсомния – это прежде всего изнурение и дезорганизация биохимических и неврофизиологических механизмов, которые обеспечивают адаптирующие функции мозга. С этой точки зрения ноотропные средства, в отличие от симптоматических снотворных (барбитуратов), являются средствами патогенетической терапии.
Защитные свойства ноотропных средств позволяют считать их препаратами выбора при инсомнии, вызванной органическим поражением нервной системы или хронической интоксикацией, когда назначение большинства снотворных средств ограничено из-за опасности тяжелых осложнений.
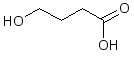
Наибольшее распространение среди ноотропных средств как снотворных имеют натрия оксибутират (натриевая соль ГОМК - - оксимасляной кислоты) и фенибута (- амино - - фенилмасляной кислоты гидрохлорид).
Оба препарата вызывают субъективное улучшение сна: увеличение продолжительности и углубления сна с тенденцией равномерного увеличения спектра основных стадий и фаз.
В отличие от других снотворных, производные ГАМК не угнетают ФШС, поэтому после отмены этих препаратов ФШС–реакции (феномен отдачи) не имеет.
Снотворному эффекту натрия оксибутирата и фенибута значительной мерой способствуют седативные, транквилизирующие и миорелаксирующие их свойства. Причем снотворный и миорелаксантный эффекты натрияоксибутирата выражены больше, чем транквилизирующие (в сравнении с фенибутом).
Оба препарата хорошо абсорбируются, легко проникают сквозь гематоэнцефалический барьер, имеют низкую токсичность и хорошую переносимость [11].
1.2 Соли лития
Применяются в комбинации с нейролептиками для лечения маниакальных и гипоманиакальных состояний у больных на маниакально-депрессивный психоз и периодическую шизофрению. Вместе с антидепрессантами эффективен при лечении легких и умеренно выраженных депрессивных эпизодов.
При регулярном приеме имеет способность предупреждать происхождение приступов (фаз) при эндогенных аффективных психозах. Под влиянием продолжительной (на протяжении 2-3 лет) терапии литием происходит сокращение продолжительности приступов и фаз, которые становятся стертыми, редуцированными, а потом практически полностью исчезают. У части больных отмечается уменьшение глубины аффективных расстройств, возрастает терапевтическая чувствительность – это позволяет значительно скорее ликвидировать приступ, используя меньшие дозы психотропных средств.
В последние годы соли лития применяются не только в терапии эндогенных психозов, но и у больных с органическими психозами, эпилепсией, при психопатиях, алкоголизме.
Наиболее распространенным препаратом этой группы является углекислая соль лития (карбонат лития). При снятии маниакальных состояний доза лития может достичь 1800-2400 мг/сутки. При этом оптимальная концентрация лития в плазме крови составляет от 0,6 до 1,2 мгекв/л или 0,8–1,2 ммоль/л. Она является достаточной для получения терапевтического эффекта и не вызывает истинных побочных явлений и осложнений [11].
В отличие от нейролептиков и транквилизаторов, обладающих депримирующим действием, от антидепрессантов, обладающих тимолептичским или тимоаналептическим влиянием, от психостимуляторов, дающих тимоэретические эффекты, нормотимики регулируют, устраняют аффективные расстройства. Патологическое повышение и понижение аффективной деятельности нивелируется до какой-то условной средней линии. Нормотимическое действие солей лития особенно хорошо прослеживается у аффективно неустойчивых психопатических личностей, в некоторых случаях эпилептических дисфорий и т. д.
До недавнего времени нормотимики были представлены лишь неорганическими солями лития (карбонат, хлорид и др.), в которых активным был лишь катион лития, а анион оставался нейтральным. Синтез оксибутирата лития с гамма-оксимасляной кислотой в качестве аниона, оказывающей определенное психотропное и антигипоксическое действие, привел к взаимному потенцированию психотропной активности обеих частей молекулы. Оксибутират лития имеет и другое важное преимущество—возможность парентерального введения.
Литий выводится из организма постепенно, в основном в течение 6 7 ч после введения. Установлено своеобразное антагонистическое соотношение ионов натрия и лития: вытеснение ионов натрия из тканей ионами лития, задержка лития в организме при уменьшении количества натрия в пище. Platman, Fiere (1970) продемонстрировали натриево-литиевую взаимосвязь на большом числе наблюдений. При уменьшении в пище жидкости и особенно поваренной соли литий задерживался в организме; при добавлении в пищу соли значительно увеличивалось выведение лития с мочой.
Независимо от терапевтических свойств механизмы действия лития делают его совершенно не похожим на другие лекарства, применяемые в психиатрии. Лечебные свойства ионов лития обусловлены непосредственно их действием, а влияние психотропных средств зависит от их метаболитов. Ионы лития сохраняют свои физические свойства в организме, не связываются с белками крови и тканей. Спустя некоторое время после приема лития устанавливается динамическое равновесие его концентрации в крови и тканях. Эти особенности фармакодинамики лития, в отличие от других психотропных средств, дают возможность врачу следить за количеством ионов лития в мозге и почках. Определяют его концентрацию в крови и в соответствии с этим корригируют дозу. Это является клиническим преимуществом лития, так как большинство лекарств назначают в стандартных дозах.
Препараты лития не рекомендуется назначать в первые 3 месяца беременности [6].
1.2.1 Показания для назначения стабилизаторов настроения
Биполярное расстройство (маниакально-депрессивная болезнь)—очень своеобразное явление в медицине, представляет собой один из наиболее трудных терапевтических вызовов. Оно характеризуется приступами мании или гипомании, перемежающимися эпизодами депрессии. Незначительное число больных (приблизительно 1%) может испытывать только периодические маниакальные состояния (так называемая униполярная мания). Риск развития биполярного расстройства оценивается в 0,5-1%, а число вновь заболевших в течение года составляет 0,01% для мужчин и 0,01 0,03% для женщин. Заболевание обычно проявляется впервые на третьем десятилетии жизни, но может развиться и позже. Последние публикации указывают, что оно может быть более распространено в подростковом возрасте, чем это считалось раньше.
Существует проблема в логике проведения научного разбора, поскольку заболевание состоит из эпизодов мании и депрессии или их сочетания. Эта проблема частично связана с тем, что депрессивная фаза фактически идентична униполярному депрессивному расстройству а обсуждение ее лечения является более сложным. Более того, у больных с биполярным расстройством сначала развивается один или несколько депрессивных эпизодов и только вслед за этим появляются маниакально-смешанные эпизоды. Таким образом, первоначальное появление депрессивного эпизода не означает обязательный диагноз униполярного депрессивного расстройства, особенно при указании в семейном анамнезе на родственников с биполярным расстройством. Биполярное расстройство является заболеванием, отличным от униполярного, и залогом успешного его лечения, включая предотвращение любой из фаз, является применение препаратов—стабилизаторов настроения. Основным подтверждением самостоятельности этого заболевания является семейный анамнез биполярного расстройства.
Депрессия может:
1. Предшествовать эпизоду гипомании или мании.
2.Смешиваться с признаками мании в рамках острого состояния (так называемый эпизод - смешанного состояния).
3. Следовать за гипоманиакальным или маниакакльным состоянием.
4. Встречаться как самостоятельный эпизод в рамках периодического течения заболевания, перемежаясь (не обязательно регулярно) с эпизодами гипомании или мании.
Эти обстоятельства имеют важное значение с точки зрения вопросов лечения, поскольку процесс терапии депрессивного состояния может провоцировать переход в маниакальную фазу или способствовать более злокачественному течению заболевания. Таким образом, при возникшем предположении или уверенности в принадлежности данного состояния к биполярному расстройству наилучшим способом его лечения является назначение стабилизаторов настроения, часто в сочетании с антидепрессантами.
Мания характеризуется состоянием повышенного или раздражительного настроения с явлениями экспансивности и некоторыми другими симптомами на протяжении определенного периода времени. Мания не ограничивается понятием эйфории, а является синдромом, который может возникать при различных заболеваниях и включать в себя эмоциональные нарушения, изменения поведения и мышления. К другим клиническим проявлениям этого синдрома обычно относят: гиперактивность, ускоренная речь (речевой напор), ускорение темпа мышления (полет идей), переоценка собственной личности, снижение потребности во сне, повышенная отвлекаемость, чрезмерное стремление к деятельности, которое может иметь для больного отрицательные социальные последствия.
Длительность острого нелеченного маниакального эпизода может составлять 4-13 месяцев (иногда и несколько дней, и несколько лет).
Гипомания является менее выраженной формой маниакального состояния, которая обычно не сопровождается различными последствиями развернутого маниакального эпизода. К тонким индикаторам гипомании могут относиться:
• Период переключения в депрессивное состояние или из него.
• Повышение деятельности (до определенной степени продуктивной).
• Повышенная восприимчивость к различным внешним факторам.
• Неустойчивость возникающей симптоматики.
• Изменение отношения к близким, друзьям и другим окружающим.
Смешанные состояния являются результатом одновременного присутствия в клиническом состоянии выраженных маниакального и депрессивного синдромов.
Ведущие проявления маниакального синдрома.
Повышенное настроение первоначально воспринимается как необычно хорошее, счастливое или веселое состояние, а позже — как выраженная эйфория. Оно часто сопровождается экспансивностью — явлением безудержного стремления к общению со всеми окружающими и вовлеченности во все окружающие обстоятельства.
Вначале маниакальный больной воспринимает свое состояние как веселое и не оценивает его как болезненное. Чаще всего это веселье воспринимается людьми, близко его знающими, как чрезмерное. В более выраженных состояниях у больных могут развиваться бредовые представления относительно собственной значимости и возможностей.
Хотя повышенное настроение и является ведущим симптомом, однако первоначально у больных может развиваться раздражительность, чаще всего проявляющаяся при столкновении больного с какими-либо препятствиями. Иными словами, клиническое состояние может резко изменится, при этом эйфория мгновенно сменяется раздражительностью и гневливостью. Такие больные обостренно реагируют на критику и мгновенно начинают спорить и возмущаться даже в ответ на самые безобидные замечания. Для таких больных характерны оскорбительные высказывания, однако они редко прибегают к физическому насилию.
Goodwin and Jamison (1990) обобщают данные 14 исследований (в общем 751 больной) о частоте встречаемости характерных аффетивных признаков в маниакальной фазе.
• Раздражительность 80%.
• Депрессивное настроение 72%.
• Эйфория 71%.
• Лабильность аффекта 69%.
• Экспансивность 60% .
Признаки психомоторного ускоре6ния часто сопровождают эмоциональное расстройство и проявляются повышенной общительностью, включая попытки возобновления старых знакомств, быструю смену одного вида деятельности на другой и/или неадекватно повышенную сексуальную активность. В связи с явлениями переоценки собственной личности, необоснованного оптимизма и утраты рассудительных оценок, такие больные могут совершать траты неадекватно больших сумм денег; беспечно относиться к вождению автомобиля и быть вовлеченными в бессмысленные предпринимательские проекты.
Речь таких больных громкая и быстрая, перенасыщена шутками, рифмами, игрой слов, колкостями, ее очень трудно прервать. Эйфория сочетается с позерством и театральными жестами. При нарастании возбуждения возникают более выраженные нарушения ассоциативного процесса, что приводит в конце концов к инкогерентности речи, которая практически не отличается речи больного в состоянии обострения при шизофрении. Преобладание в состоянии больного раздражительности находит свое отражение в речи в виде многочисленных жалоб, враждебных комментариев и злобных тирад. Goodvin и Jamison(1990) приводят частоту встречаемости поведенческих расстройств в рамках одного эпизода:
• ускорение речи 98%.
• чрезмерная разговорчивость 89%.
• чрезмерное стремление к деятельности 87%.
• уменьшение потребности во сне 81%
• гиперсексуальность 57%.
• склонность к чрезмерным тратам 55% [7].
2. История возникновения препаратов
2.1 Нормотимические средства
В 1949г. было обнаружено сильное специфическое антиманиакальное действие солей лития. Особенно обнадеживающими были результаты лечения литием больных маниакально-депрессивным психозом.
Лечебное действие солей лития реализовалось и в маниакальном состоянии, и в фазе депрессии.
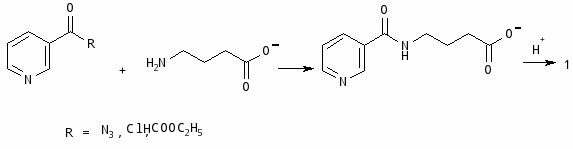
На кафедре фармакологии Одесского мединститута создан новый оригинальный препарат, представляющий собой органическое соединение никотиновой кислоты с литием (литиевая соль никотиновой кислоты - литонит). Препарат характеризуется более сильным и надежным транквилизирующим действием, чем соли лития и никотиновая кислота в отдельности [4].
Само понятие вторичной лекарственной профилактики до конца 60-х-начала 70-х годов было практически неизвестно в психиатрии. Ранее говорилось о так называемой “ поддерживающей ” или “ амбулаторной ” терапии, при которой происходит непрерывное подавление какой-либо продуктивной симптоматики. В настоящее время под вторично профилактическим действием понимают способность некоторых препаратов при длительном непрерывном приеме предотвращать наступление или значительно смягчать выраженность очередной аффектной фазы или приступа шизоаффективной структуры.
Подобные превентивные свойства усилиями датских ученых P.Baastrup и M.Schou были в середине 60-х годов впервые обнаружены у солей лития. M.Schou для обозначения этого уникального эффекта лития предложил термин “нормотимический”, т.е. выравнивающий настроение(в отличие от нейролептиков и антидепрессантов). Этим подчеркивалась бимодальность его действия – препарат, одновременно подавляя развитие симптоматики обоих полюсов и прежде всего маниакального, не вызывает инверсии фазы, а как бы “замораживает”, фиксирует состояние больных на некоем ровном, т.е. близком к эутимному, уровне [6].
Литий использовался как лекарственное средство в лечении таких заболеваний, как подагра, диабет и ревматизм, а также в качестве седативного средства, подобно бромидам, при эпилепсии с середины Х1Х столетия.
Спустя столетие были опубликованы сообщения Cade и Schou, положившие начало использованию лития в лечении биполярного расстройства.
В 40-х годах ХХ в хлорид лития использовали как заменитель пищевой соли для больных с сердечной недостаточностью.В те годы была установлена его токсичность, причем наблюдались летальные исходы [10].
В 1949 г проводились исследования по выявлению активных веществ, экскретируемых с мочой у больных с маниакальными состояниями. Мочу вводили крысам и обнаружили, что большие количества ее токсичны для мышей. Для исследования токсичности уратов использовали легкорастворимую соль мочевой кислоты. При этом бело установлено, что она оказывает седативное действие и предупреждает развитие маниакального состояния при интоксикации, вызываемой у крыс.
Австралийский врач John Cade случайно обнаружил антиманиакальные свойства этого средства, когда вводил лития урат морским свинкам. Ошибочно приняв его токсичное действие за седативное, он назначил препарат больным с маниакальным состоянием и получил положительный терапевтический результат. Также случайно обнаружил, что отмена назначений лития вызывает появление признаков обострения заболевания. Из этого он сделал вывод, что литий является эффективным профилактическим средством. Baastrup , один из сотрудников Schou, провел первое испытание профилактических свойств лития. Свойство лития снижать частоту возникновения приступов как при биполярном, так и при униполярном расстройствах затем была подтверждена в серии исследований, проведенных Hartigan и Baastrup.
Накопленный клинический опыт широкого применения солей лития привел к определенному разочарованию его итогами, и выявил ряд узких мест. Оказалось, что от 20% до 50% больных, по данным разных авторов, остаются резистентными к профилактической терапии литием. Особенно это касается больных с континуальным характером аффективных расстройств, вызванных, в частности, фармакогенным “раскачиванием” циркулярного аффекта, вследствие неоправданно массированного применения трициклических антидепрессантов, нейролептиков “биполярного действия”, резких отмен психотропных средств и т.д. Такие больные оказались крайне трудны для терапии вследствие неустойчивости состояния. Эти обстоятельства привели в конце 70-х-начале 80-х годов к определенному пересмотру показаний к профилактическому применению лития и стимулировали поиск альтернативных лекарственных средств, обладающих сходной нормотимической активностью. Подобные свойства были обнаружены у некоторых антиконвульсантов.
Первым из них при аффектных психозах французским психиатром P. A. Lambert еще в 1968 был использован дипропилацетамид (депамид). Однако резкое, повышение интереса к нормотимическому действию антиконвульсантов произошло после опубликования в 70-х годах данных японских ученых (Takezak H., Hanaoka H., 1973; Okuma T. с соавт., 1973) о профилактическом эффекте карбамазепина, который был тщательно изучен американскими исследователями (Ballenger J.C., Post R. M., 1978, 1980).
В дальнейшем число изучаемых при аффективных психозах антиконвульсантов росло, прежде всего за счет применения солей вальпроевой кислоты (Emrich H.M., с соавт. 1985; Mc Elroy S.L. c соавт.,1992 и др.), что постепенно привело к выделению нового класса психотропных средств под общим названием “нормотимики” [6].
Интересно, что такие терапевтические средства как вальпроаты (ВПА) и карбамазепин (КБЗ) (противосудорожные средства в качестве стабилизаторов настроения) применялись еще в 60-х годах.
Например, первое эмпирическое исследование карбамазепина было проведено Dehing в 1968 году. При оценке действия этого противосудорожного средства на психические функции больных эпилепсией он отметил свойство подавлять агрессивность.
ВПА были использованы в качестве стабилизатора настроения Lambert и сотр. в 1966г. Положительные результаты проведенного ими испытания были повторены в ряде открытых и контролированных клинических исследований в США и других странах. К настоящему времени применение этих препаратов как стабилизаторов настроения при лечении острых маниакальных состояний лучше изучено, чем применение с этой целью лития [7].
В последние годы тимостабилизирующий эффект был обнаружен также у блокаторов кальциевых каналов (Gitlin M. J., 1987; Prien R.F., Gelenberg A.J.,1989; Пантелеева Г.П. с соавт., 1995; Снедкова Л.В.,1996 и др.) [6].
В итоге можно отметить, что, хотя с литием и связывается переворот в терапии биполярного расстройства, его узкий терапевтический индекс, многочисленные побочные свойства и недостаточная эффективность у значительной части больных биполярным расстройством привели к расширенному использованию альтернативных способов терапии, включая: другие противосудорожные средства (напр. ламотриджин, габапентин); антагонисты кальциевых канальцев (напр. верапамил, нимодипин); новые атипичные антипсихотические препараты; холиномиметики (напр., лецитин).
Табл. 1. Хронологическая таблица нормотимических препаратов
Год
Событие
Серед. 19 в.
Литий используется как лекарственное средство в лечении подагры, диабета, ревматизма.
Серед. 20 в.
Опубликованы сообщения Cade и Shou об использовании лития в лечении биполярного расстройства.
40-е г. 20 в.
Хлорид лития ипользуется как заменитель пищевой соли для больных с сердечной недостаточностью.
1949г.
Проводятся исследования по выявлению активных веществ экскретируемых с мочой у больных с маниакальным состоянием.
Серед. 60 –х г.
Превентивные свойства обнаружены у солей лития датскими учеными Baastrup и Shou
1966 г.
ВПА использована в качестве стабилизатора настроения (Lambert и др.)
1968 г.
Проведено первое эмпирическое исследование карбамазепина (Dehing); при аффективных психозах использован дипропилацетамид (франц. Психиатр Lambert).
70-80г.
Пересмотр показаний к профилактическому применению лития и поиск альтернативных лекарственных средств.
1987г.
Тимостабилизирующий эффект обнаружен у блокаторов кальциевых каналов (Gitlin).
2.2 Ноотропные средства
Ноотропная концепция возникла в начале 70-х годов и ее отцами являются C.Giurgea и V.Skondia (фирма ИСВ, Бельгия), которую разработали и внедрили первый препарат этой группы – пирацетам. По их определению ноотропы являются средствами, активирующими высшую интегративную деятельность мозга и восстанавливающими нарушенные функции высшей нервной деятельности.
Открытие этих веществ было в значительной степени случайным. Осуществляя поиски новых гипноседативных средств в конце 60-х годов в лабораториях фирмы “ИСВ” было синтезировано несколько соединений циклической ГАМК и среди них соединение ИСВ-6215 2-оксо-1-пирролидон-ацетамид (пирацетам). Синтезированные вещества обладали в эксперименте слабой гипоседативной активностью и не оказывали обычных эффектов психотропных препаратов. Однако, в клинике было отмечено, что пирацетам улучшает у больных процессы обучения и память, и одновременно с этим показано, что пирацетам избирательно улучшает транскаллозальные вызванные потенциалы, что и послужило первым звеном ноотропной концепциии(Giurgea, Moyersoons,1972).
Таким образом, ноотропы, как и многие другие психотропные препараты, были открыты в клинике и в электрофизиологических исследованиях.
В настоящее время исследования в области ноотропных препаратов развиваются очень активно, и эта новая группа заняла прочное место среди других психотропных веществ. Так, если десятилетие 50-х годов определило развитие нейролептиков, 60-х антидепрессантов, 70-х транквилизаторов, то 80-е годы определяют развитие ноотропных препаратов [3].
Изучение механизма действия ноотропных средств тесно смыкается с открытием центральной медиаторной роли -аминомасляной кислоты (ГАМК). Эта аминокислота была обнаружена в тканях мозга животных и человека (Робертс, Франкель) в 1950 году, а в 1960 году было показано, что она играет роль “медиатора”, тормозящего передачу возбуждения в нервных окончаниях центральной нервной системы.
Вслед за открытием ГАМК было обнаружено наличие в центральной нервной системе и (других органах) специфических ГАМК-ергических рецепторов. Сведения о ГАМК и ГАМК-рецепторах стали привлекать к объяснению механизма действия лекарственных средств и на основе этих данных создавать новые центральнодействующие лекарственные средства.
В начале 60-х годов -аминомасляную кислотуначали применять под названием “гаммалон” или препарат называется “аминалон” в качестве нейротропного средства. Высокой активности в связи с плохой проницаемостью через гематоэнцефалический барьер препарат не проявил и широкого применения не получил. Но исходя из структуры ГАМК в 70-х годах был создан синтетический препарат пирацетам и ставший “родоначальником” новой группы психотропных препаратов – “ноотропов” [2].
К принципу модификации молекул фармакологически активных соединений прибегают практически сразу после открытия каждого нового лекарственного средства. Как правило, стоит лишь появиться новому ценному лекарственному средству, особенно новому по действию и химической структуре, как тут же синтезируются его модифицированные аналоги. Например, за первым ноотропным препаратом пирацетамом появились: этирацетам, оксирацетам, анирацетам, прамирацетам.
Оригинально задуманным является созданный в институте (организован в Москве 1936 г. Всесоюзный научно-исследовательский витаминный институт (ВИИПИ) ноотропный препарат пантогам (кальциевая соль гомопантотеновой кислоты), молекула которой включает остаток -аминомасляной кислоты (ГАМК).
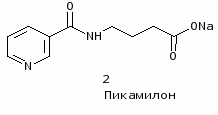
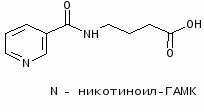
В последнее время институтом совместно с институтом фармакологии Российской академии медицинских наук создан другой оригинальный ноотропный препарат пикамилон (натриевая соль N-никотиноил-- аминомасляной кислоты), содержащий остаток ГАМК. Под руководством профессора В.И. Гунара разработаны промышленные методы синтеза и освоено промышленное производство пантогама и пикамилона. Пикамилон разработан совместно с витаминным институтом (ИПО “Витамины”) (Р.С.Мирзоян, В.М.Копелевич) [2].
Теоретически аспектом проблемы и изучению различных производных ГАМК, пирацетама и его производных посвящены работы Л.Х. Алликляте, Р.У. Островская, К.С. Раевский, Г.И.Ковалев.
В институте фармакологи АМН СССР получены нейрофармокологические данные о наличии в мозге рецепторов пирацетама. Также в институте фармакологии АМН СССР подробно изучено действие натрия оксибутирата и лития оксибутирата. Эти и другие препараты (пантогам) нашли широкое применение в медицине.
Табл. 2.Хронологическая таблица ноотропных препаратов
Год
Событие
1950
В тканях мозга животных и человека обнаружена аминокислота, связанная с механизмом действия ноотропов, - ГАМК.
1960
Показана роль ГАМК-“медиаторов”, тормозящего передачу возбуждения в нервных окончаниях ЦНС.
Начало
60-х
ГАМК применяют под названием “гаммалон” или “ аминалон”.
Конец
60-х
Бельгия, фирма “ИСВ” синтезировано несколько соединений циклической ГАМК, среди них – пирацетам.
Начало
70-х
Возникла ноотропная концепция (C.Giurgea, V. Skondia, фирма “ИСВ”, Бельгия).
1976
ВНИИ неврологии АМН СССР проведено успешное лечение пирацетамом больных с острыми нарушениями мозгового кровообращения.
3. Классификация препаратов
3.1 Классификация нормотимических средств
По классификации, разработанной Машковским (издание 1994г) такого класса как “нормотимики” отдельно он не выделяет. В первую группу лекарственных средств, действующих преимущественно на центральную нервную систему – психотропные лекарственные средства он включил препараты лития.
В последнем издании Машковский выделил отдельную группу–нормотимические препараты, которую составляют такие лекарственные средства:
Лития карбонат
Микалит
Лития оксибутират [1].
Кроме этой классификации существуют и другие, в которую включены препараты, не содержащие литий, но обладающие сходным лечебным эффектом.
В настоящее время к препаратам нормотимического действия относятся:
1. соли лития (карбонат, глюконат, сульфат, хлорид, цитрат, оксибутират, пролонгированные препараты лития);
2 производные карбамазепина
а) карбамазепин (финлепсин, тегретол, стазепин),
б) окскарбазепин (трилептал);
3 производные вальпроевой кислоты (все указанные ниже соединения имеют общий механизм действия, обусловленный уровнем вальпроата в плазме крови);
а) соли вальпроевой кислоты:
- натриевая (депакин, конвулекс, вальпарин, ацедипрол, эвериден, энкорат, апилепсин),
- кальциевая (конвульсофин),
- магниевая (дипромал)
б) дипропилацетамид (депамид),
в) дивальпроекс натрия (депакот);
4. блокаторы кальциевых каналов, верапамил (финоптин, изоптин), нифедипин (адалат, коринфар) и дилтиазем (кардизем).
Некоторые авторы отмечают нормотимические свойства также у фенитоина (дифенин, дилантин), клоназепама (ривотрил), клонидина (клофелин), ацетазоламида (диамокс), L-тироксина и лиотиронина, активаторов ГАМК-ергической системы (в том числе числе баклофена), клоргилина (ингибитора МАО типа А), бупропиона и ряда других препаратов. Обращает на себя внимание, что большинство указанных средств в той или иной степени обладают противосудорожной активностью. Вместе с тем, их нормотимическое действие при аффективных психозах в настоящий момент нельзя признать полностью доказанным и оно нуждается в дальнейшей клинической верификации [6].
3.2 Классификация ноотропных средств
Ноотропные средства делят на такие группы:
Производные пиролидона (пирацетам – ноотропил, этирацетам, анирацетам, оксирацетам, прамирацетам, дипрацетам, ролзирацетам и др.)
Производные ГАМК (аминалон – гаммалон,натрия оксибутират, феннибут, пантогам, пикамилон и др.).
Невропептиды и их аналоги (синактен – депо, тиролиберин и меланостатин, пироглютамил, дипептиды, мелатонин, вазопрессины и окситоцин и др.).
Цереброваскулярные средства (сермион - ницерголин; винпоцетин – кавинтон; винкапан – девинкан; стугерон – цинаризин; пентоксифилин – трентал, агапурин; ксантинола никотинат – компламин и др.).
Производные пиридоксина (пиритинол – энцефабол, гутимин и др.).
Антиоксиданты (мексидол, ионол, берлитион, кислота никотиновая, токоферола ацетат и др.).
Препараты разных групп (этимизол, калия оротат, энальбин, церебролизин, актовегин, солкосерил, растительные препараты – жидкие экстракты, настойки женьшеня, эхинацеи, лимонника, танакан, мемоплант, антихолинэстеразные – галантамин и др., м-холиномиметики, препараты аминокислот – глутаминовая, глицин и др.)
Производные диметиламиноэтанола: диметиламиноэтанол, диманол ацеглюмат, меклофеноксат, эуклидан и др [12].
4. Механизм биологической активности
4.1 Нормотимические средства
4.1.1 Нейротрансмиттеры и связанные с ними теории
Конкретный механизм действия стабилизаторов настроения не известен, но научные исследования концентрируются на следующих направлениях:
•Классические нейромедиаторы (например, норадреналин и серотонин), которые участвуют в формировании аффективных расстройств.
•Клеточные процессы, включающие как классическое взаимодействие между лигандом и рецептором, так и другие механизмы (например, С протеины, система вторичных мессенджеров).
•Модулирующее взаимодействие между отдельными нейротрансмиттерными системами, нейромодуляторами и наследственными факторами.
•Роль циркадных ритмов в патофизиологических процессах.
Доказано, что стабилизаторы настроения взаимодействуют с несколькими нейротрансмиттерами, включая катехоламинергические, индоламинергические, холинергические и систему -аминомасляной кислоты. Хотя полученные на сегодня данные имеют несколько противоречивый характер, считается, однако, что эти препараты влияют как на постнейронные, так и на пренейронные рецепторы, а также на пострецепторную активность (систему вторичных мессенджеров) этих нейротрансмиттеров. Тем не менее точный механизм их действия на биологические субстраты, участвующие в формировании эмоциональных расстройств, остается неясным.
Катехоламины
В процессе терапии литием происходит сокращение числа адренергических рецепторов. Это соответствует теории подавления норадренергической активности, но не вписывается в полной мере в существующие представления о патофизиологии маниакального состояния. Литий также подавляет повышенную чувствительность дофаминовых рецепторов, что соответствует представлению о повышении чувствительности катехоламиновых рецепторов у больных маниакальным состоянием.
Литий блокирует высвобождение тиреоидного гормона, потенцирующего чувствительность -норадренергических рецепторов. Этот факт был использован при формулировании представления о том, что чрезмерное повышение тиреоидной активности предшествует развитию маниакального приступа и что антиманиакальный эффект лития как минимум частично связан с антитиреоидным действием. Карбамазепин также может снижать значение ряда показателей тиреоидной функции.
Другой подход был связан с исследованием такого вещества, как клонидин, который стимулирует 2-норадренергические пресинаптические рецепторы, участвующие в активации системы отрицательной обратной связи. Это в конечном счете ведет к нейтрализации тирозингидроксилазы, фермента, ограничивающего уровень выработки катехоламинов, что вызывает замедление синтеза и высвобождения норадреналина. Действие этого вещества наступает достаточно быстро и проявляется в основном в области локус церелиус, месте основной концентрации норадренергических нейронов в ЦНС. Таким образом, с его помощью можно быстро подавить продукцию норадреналина.
Индоламины
Литий способен ускорять высвобождение серотонина путем ускорения процесса обратного захвата триптофана, а также усиления активности постсинапических серотонинергических рецепторов (т. е. он действует как агонист серотонина).
Холинергическая система
Доказано, что литий увеличивает содержание холина в эритроцитах, но значение этих данных остается неясным. Такое действие может соответствовать теоретическим представлениям об изменении холинергически-адренергического равновесия при аффективных расстройствах.
Согласно этой теории, при маниакальном состоянии возникает относительная недостаточность в холинергической активности по отношению к норадренергической активности, а при депрессии – противоположное соотношение. Эти результаты стали обоснованием назначения холиномиметических препаратов (например, физостигмина) при лечении острого маниакального состояния. Так, однократная в/в дозировка физостигмина в течение одного часа вызывает переключение маниакального состояния в депрессивное.
Гамма-аминомасляная кислота (ГАМК)
ГАМК является в ЦНС основным ингибитором нейротрансмиттеров. Кроме того, ее действие проявляется и в истощении катехоламинергической системы. ВПА, КБЗ и литий вызывают повышение активности ГАМК.
Система вторичных мессенджеров
Взаимодействие лития с системой вторичных мессенджеров, в частности с фосфоинозитидным циклом, может вызывать истощение запасов свободного инозитола и влиять на внутриклеточное действие кальция. Такой антагонист, как верапамил, снижает активность кальциевых канальцев и тем самым уменьшает внутриклеточную концентрацию Са-(2+), что делает его потенциальным антиманиакальным средством, хотя практическое значение действия этого вещества остается неясным. Литий может действовать также па G-протеины, аденилатциклазу и протеинкиназу изоэнзимов типа С, которые являются составными элементами системы нейрональной передачи сигнала. Регулирующее действие лития на экспрессию генов в ЦНС может играть важную роль в способности этого препарата оказывать долгосрочное действие на устойчивость настроения.
Мембранная и катионная гипотезы
При аффективных расстройствах наиболее часто обнаруживают нарушения активности натрия и кальция. В ряде исследований Dubovsky и др. измеряли внутриклеточную концентрацию ионов кальция у больных биполярным расстройством в маниакальном и депрессивном состояниях. Они обнаружили у четырех больных в маниакальном состоянии и у пяти больных в депрессивном состоянии снижение среднего значения внутриклеточной концентрации кальция в отличие от семи здоровых лиц, у которых в анамнезе не было указаний на аффективные устройства. Обнаружение этого феномена в тромбоцитах и лимфоцитах подкрепляет предположение о нарушении гомеостатических механизмов поддержания уровня концентрации кальция в клетке (например, нарушения клеточной мембраны, активности G- белков и др.)
Это может указывать на вероятность этого феномена не только в клетках периферических тканей, но и в тканях нервной системы.
Антагонисты кальция (например, верапамил, нимодипин) могут также блокировать действие дофамина, серотонина и эндорфинов через их влияние на механизм переноса натрия и кальция. Таким образом, они могут действовать как потенциальные антиконвульсанты. Подобное действие может одновременно быть и антиманиакальным.
Основой в других исследованиях аминных нейротрансмиттеров и нейроэндокринных функций при аффективных расстройствах стали клеточные механизмы ионного транспорта. Литий и антагонисты кальция блокируют поступление кальция внутрь клетки, а также мобилизацию его внутриклеточного запаса и тем самым тормозят электрическую активность в нейронах и стабилизируют их мембраны. Меltzeг говорит о специфическом макромолекулярном комплексе, состоящем из натрий-калиевых и кальциевых насосов, ионных канальцев и анкирина, содержание которого меняется при аффективной патологии [7].
Попытки выяснения патогенетических механизмов действия нормотимических препаратов как на нейрофизиологическом, так и на биохимическом уровнях не привели к сколько-нибудь определенным результатам. Воздействие препаратов на норадренергическую или серотонинергическую системы весьма противоречиво, чтобы объяснить сходство их нормотимического действия.
Наиболее часто в последнее время нормотимический эффект связывают с воздействием на ГАМК-ергическую систему. Известно, что периферические ГАМК-ергические рецепторы принимают участие в регуляции активности кальциевых каналов и функциональной стабилизации клеточных мембран. Оказалось, что высокие дозы карбамазепина и солей вальпроевой кислоты, подобно солям лития, снижают метаболизм ГАМК путем ингибирования ее трансаминазы в гиппокампе, базальных ганглиях и коре головного мозга. ГАМК же является пресинаптическим модулятором дофаминергических нейронов, чем, соответственно, и тормозит гипотетический пусковой механизм циркулярных фаз.
Кроме антидофаминергического эффекта, определенным сходством нормотимики обладают во влиянии на холинергическую систему. Было высказано предположение, что эти препараты прерывают нейрональную передачу за счет подавления натрий-проводимости на уровне клеточной мембраны и регулирования переноса через нее моновалентных катионов.
Помимо активного влияния на основные нейромедиаторные системы, центральное действие связано также с влиянием на бензодиазепиновые и опиатные рецепторы, с подавлением активации аденилатциклазы циклического аденозин- и гуанизинмонофосфатов и целым рядом других механизмов. Этим, наверное, можно объяснить широкий спектр показаний к применению солей лития и антиконвульсантов с нормотимической активностью. Помимо эпилепсии, карбамазепин, в частности, с успехом используется для лечения состояний паники, обсессивно-фобических расстройств, агрессивности, невралгии черепно-мозговых нервов, мигреней, спинной сухотке, фантомных болях, парестезиях при рассеянном склерозе и т.д.
Основываясь на известной общности нормотимического и противосудорожного эффектов антиконвульсантов, Ваllenger, Post R.М, (1983) распространили теоретическую модель амигдалярного киндлинга ("зажигания"), описанную при развитии экспериментального судорожного синдрома, на возникновение аффективных нарушений. Этот феномен объясняет развитие пароксизмальных проявлений существованием длительных, строго периодичных, подпороговых, неспецифических раздражении мозговых структур, которые в конце концов приводят к понижению судорожного порога и запуску саморазвивающейся в дальнейшем пароксизмальной активности. Действие антиконвульсантов выражается в блокаде этого механизма. При аффективных психозах подобные явления развиваются вследствие неспецифических раздражений (в том числе, в виде "бытового стресса") в лимбических структурах и миндалевидном комплексе мозга, что, в конечном итоге, истощает ингибирующий потенциал ГАМК-ергической системы.
Не вдаваясь в дальнейшие подробности, можно утверждать - нормотимики затрагивают большинство биологических и нейромедиаторных систем организма, что требует повышенной ответственности и внимания врача, рекомендующего их длительный прием.
На клиническом уровне все нормотимические препараты, помимо способности нивелировать аффективные циркулярные колебания, обладают отчетливым антиманиакальным эффектом. Антидепрессивное действие при лечебном и, в меньшей степени, при профилактическом применении выражено значительно слабее. Имеются также данные, что все они оказывают минимальное регулирующее или замедляющее влияние на биологические ритмы в целом, в том числе - на циркадианный. Это, в частности, обнаруживается в нормализации ритма "сон - бодрствование", нарушенного у больных с фазовыми проявлениями. Интересно, что другие психотропные средства, прежде всего трициклические антидепрессанты, а также женские гормональные препараты типа эстрадиола, действуют в протиположном направлении и способны ускорять биологические ритмические процессы, в том числе и фазовые.
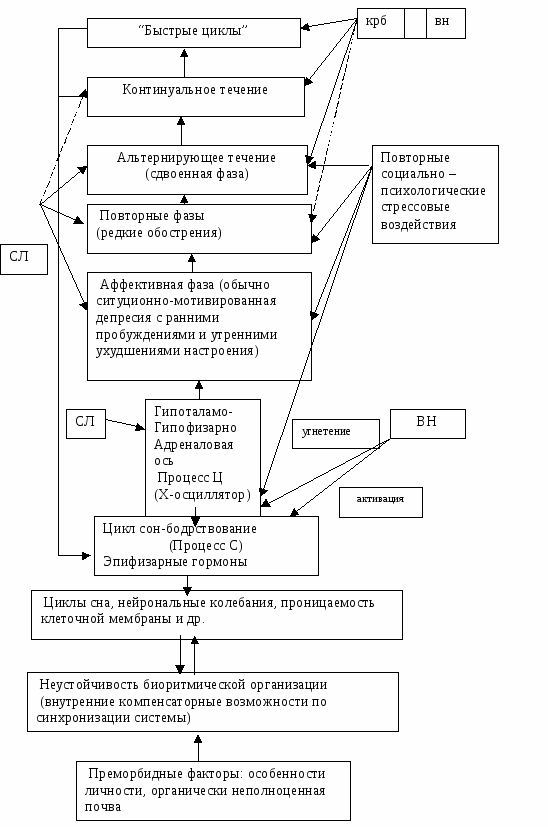
Полученные в ходе клинических и полисомнографических исследований данные позволили предложить хронобиологическую модель развития неблагоприятного континуального течения фазнопротекающих эндогенных психозов и нормотимического (профилактического) эффекта, в основе которой лежит идея системного расстройства биоритмической организации организма и, прежде всего, десинхронизации циркадианного ритма с циклом "сон -бодрствование" (см. рис1).
Главным звеном модели является взаимодействие между циркадианными ритмами и циклом "сон - бодрствование", которые, в соответствии с получившей широкое распространение схемой А.А. Borbely (1982), отражают два различных, находящихся в реципрокных отношениях, процесса.
Первый из них (процесс Ц) жестко контролируется циркадианным осциллятором, ритмическая активность которого мало зависит от внешних влияний, и интимно связан с гипоталамо-гипофизарно-адреналовой осью; он регулирует активность и ультрадианное распределение парадоксальной фазы сна, а также, как известно, температурный, кортизоловый и некоторые другие ритмы.
Другой процесс (процесс С) регулируется гомеостатически, т. е. более подвержен влиянию факторов внешней среды и связан с другой нейроэндокринной системой - эпифизарной; он контролирует основные характеристики непрерывности сна и выполняющий анаболические функции медленноволновый сон.
Именно этот процесс, эволюционно несущий адаптивную функцию, играет важную роль в формировании резерва компенсаторных возможностей по стабилизации биоритмической организации, поскольку сдерживает активность процесса Ц и гасит чрезмерный размах его колебаний.
Основным полисомнографическим параметром, отражающим взаимодействие процессов, является латентный период парадоксальной фазы сна, который одновременно связан с началом никтогемерального цикла и ультрадианным распределением парадоксальной фазы.
Постепенно тяжесть и частота депрессий возрастают, и появляются первые маниакальные состояния, которые, в соответствии с континуальной моделью Н. Сourt (1972), представляют собой лишь более тяжелый, по сравнению с депрессией, уровень аффективного поражения и часто развиваются компенсаторно через инверсию фазы.
Рис 1. Хронобиологическая модель развития неблагоприятного течения биполярного фазнопротекающего психоза и нормотимического эффекта солей лития (СЛ), карбамазепина(КРБ) и вальпроата натрия(ВН).
После более или менее длительного типичного биполярное течения, при котором биоритмическая система сохраняет еще способность периодически возвращаться к естественному состоянию, наступает качественно новый этап спонтанного непрерывного течения. Развитие заболевания становится совершенно автономным, подчиняясь только внутренним законам порочного круга, что произошло вследствие полного истощения компенсаторных возможностей биоритмической системы и длительного существования патологических связей между ее различными уровнями. Развивается устойчивое рассогласование не только циркадианных, но и ультра- и инфрадианных ритмов. Первое, в частности, проявляется в перераспределении парадоксальной фазы на первые часы сна, быстроте ее возникновения и усилении цикличности. Второе – в появлении быстрой цикличности, развитие которой, как показали результаты нашего исследования, еще больше (вероятно, по типу обратной связи) подавляет процесс С, замыкая тем самым порочный круг.
Предложенная хронобиологическая модель позволяет объяснить различия в действии нормотимических препаратов. Полученные данные свидетельствуют, что соли лития непосредственное угнетающее воздействие оказывают процесс Ц, замедляя все контролируемые им циркадианные ритмы. При этом соли лития, естественно, оказываются эффективными на начальных этапах заболевания, когда воздействие стрессовых факторов и резкая стимуляции кортикотропной активности играют важную роль в развитии очередной фазы. Восстановление нормальной активности процесса С происходит вторично при длительном применении. Этим, вероятно, можно объяснить тот клинический факт, что для проявления своего стабилизирующего нормотимического эффекта солям лития необходим достаточно большой светлый промежуток между фазами. Его отсутствие не дает возможности солям лития успеть активировать процесс С, т. к. каждая новая фаза сопровождается расторможением процесса Ц.
Карбамазепин, напротив, оказывает первичное стимулирующее влияние на процесс С, недостаточность которого отмечается при аффективных психозах и, особенно, при быстрой цикличности. В этом смысле, по сравнению с солями лития, препарат обладает более патогенетическим действием. Угнетение процесса Ц происходит вторично. Эти механизмы хорошо объясняют клинические особенности эффективности карбамазепина, в частности, более широкий спектр его действия на различные формы фазнопротекающих психозов и его способность обрывать континуальное течение, которое по нашей модели развивается вследствие дополнительного угнетения процесса С.
Безусловно, предложенная хронобиологическая модель развития неблагоприятного течения биполярных фазнопротекающих психозов не претендует на всеобъемлющую универсальность и отражает лишь одну из сторон патогенеза. Тем не менее, она позволяет синтезировать большое число разнородных клинико-биологических фактов и по-новому взглянуть на патогенез заболевания в его продольном сечении и механизмы профилактического действия нормотимических средств [6].
4.2 Ноотропные препараты
Появление ноотропов и выделение их в качестве самостоятельного класса психотропных средств явилось одним из самых последних достижений психофармакологии. При исследовании в 1972 году первого препарата этой группы — пирацетама (Гиургиа К., 1976) обнаружил его способность положительно воздействовать на клетки коры головного мозга (неокортикальные структуры) и облегчать транскаллозальные межполушарные и кортико-субкортикальные связи. Следствием этого явилась способность препарата активизировать высшую интегративную деятельность мозга, в том числе улучшать процессы обучения и восстанавливать нарушенные мнестические и когнитивные функции. Для обозначения этих свойств он предложил термин "ноотропный", т.е. адресующийся к высшим корковым функциям мозга.
В последующем выяснилось, что главной чертой этой группы препаратов является их способность стимулировать нейрометаболические процессы в организме, оказывать антигипоксический эффект, т.е. продуцировать энергию в условиях гипоксии (усиливать утилизацию глюкозы) и, следовательно, защищать клетки мозга от ее разрушительного воздействия (церебропротекторное действие), а также и повышать общую устойчивость организма к действию экстремальных факторов.
Механизм достижения этого эффекта может быть различным. У одних препаратов он реализуется преимущественно путем воздействия на ГАМК-ергическую систему - пирацетам (ноотропил, пирабене, ойкамид), анирацетам (драгонол), пантогам, фенибут, оксибутират натрия, фентропил, нооглютил, дипептиды пирролидинкарбоновых кислот, пикамилон, бемитил, аминалон (гаммалон), цереброл или путем стимуляции метаболизма в других нейромедиаторных системах мозга - меклофеноксат (аналукс, церутил, люцидрил, ацефен), мефексамид (тимодин, мефексадин, пернейрон), модафинил, адрафинил (олмифон), деманол, деанол (клережил), тонибрал, ципроденат (актебрал), пирисуданол (надекс, ментис), бифемелан (алнерт), левокарнитин, цереброкраст, пиритинол (пиридитол, энцефабол, энербол), церебролизин; в том числе активации центральных холинергических процессов, например, вследствие обратимой блокады холинэстеразы (такрин, амиридин и др.) или прямого центрального холинопозитивного эффекта (ареколин, цитихолин, холиналфосцерат, деанол и др.); у других - посредством вазотропного действия. Ангиопротекторы, оказывая позитивное гемодинамическое влияние, включая улучшение реологических свойств крови, усиливают мозговой кровоток, потребление нервными клетками кислорода, утилизацию глюкозы и накопление АТФ в мозге. К ним относятся алколоиды спорыньи (дигидроэрготамин) дигидроэрготоксин, сермион, вазобрал и др.), производные барвинка и ксантина (винпоцетин, компламин трентал, винкапан винкамин), нафтидрофурил, циннаризин, флунаризин, гидергин, нимодипин, инстенон и др. У третьих, нейрометаболический эффект оказывается частью их неспецифического усиления метаболических процессов в организме в целом, т.е. общего активирующего и адаптогенного действия - витамины (аскорбиновая кислота, витамины группы В); антиоксиданты препараты, ингибирующие свободнорадикальные реакции перикисное окисление липидов (альфатокоферол – витамин Е, мексидол, идебенон, эмоксипин, убихинон); аминокислоты (глутаминовая, аспаргиновая, метионин); анаболические стероиды; некоторые гормоны, особенно синтетические тиролиберины, аналоги тиреотропинрелизинггормона (ТRH) (либерол, пиладокс, эзотирелин, азетирелин и др.) и "мнемотропные гормоны" (АКТГ, семакс, вазопрессин); тиоловые противоядия (унитиол, дикаптол); антагонисты кальция (нимодипин, никардипин, верапамил и др.); фосфорные препараты (димефосфан и др.); глюкоза; оротовая кислота, цитохром Ц, АТФ и другие препараты. К этой группе примыкает S-аденозилметионин (гептрал) - естественный кофермент реакций трансметилирования.
Все эти средства обладают в той или иной степени выраженности центральным антигипоксическим влиянием и поэтому в широком плане могут рассматриваться как нейрометаболические стимуляторы. Большинство из них с успехом применяется в различных областях медицины, поскольку имеют сложный, поливалентный механизм действия. В психиатрической практике к церебропротекторам или ноотропам относят более узкую группу препаратов. Среди них в настоящее время у нас в стране наибольшее распространение получили пирацетам, аминалон, пиритинол, пантогам, пикамилон, фенибут, ацефен, бемитил и церебролизин.
Фармакологическая систематика современных ноотропных средств значительно затруднена из-за отсутствия четких представлений о механизмах их действия на нейрохимические процессы. Например, классический представитель этой группы - пирацетам, наряду с неоднозначным влиянием на ГАМК - ергическую систему, стимулирует высвобождение ацетилхолина, а также повышает синтез дофамина и норадреналина в мозге.
В отличие от других классов психотропных средств, глобальное терапевтическое действие ноотропов можно определить как антигипоксическое или нейрометаболическое.
А.И. Нисс (1984) выделил 12 параметров клинической активности нейрометаболических стимуляторов:
1. Психостимулирующее действие (влияние на апатию, гипобулию, аспонтанность, бедность побуждений, психическую инертность, психомоторную заторможенность).
2. Антиастеническое действие (влияние на слабость, вялость, истощаемость, явления психической и физической астении).
3. Седативное (транквилизирующее) действие (влияние на раздражительность, эмоциональную возбудимость).
4. Антидепрессивное действие (влияние на снижение настроения).
5. Действие, повышающее уровень бодрствования, ясность сознания (влияние на состояние угнетенного и помраченного состояния).
6. Антиэпилептическое действие (влияние на эпилептическую пароксизмальную активность).
7. Ноотропное действие (влияние на задержку развития или нарушения высших корковых функций, уровень суждений и критических возможностей, укрепление кортикального контроля субкортикальных уровней активности).
8. Мнемотропное действие (влияние на память, обучаемость).
9. Адаптогенное действие (влияние на толерантность к различным экзогенным факторам, в том числе медикаментам).
10. Вазовегетативное действие (влияние на головную боль, головокружение, вегетативную неустойчивость при церебрастенических синдромах).
11. Антипаркинсоническое действие (влияние на эстрапирамидные паркинсонические расстройства - гипокинето-гипертонический синдром).
12. Антидискинетическое действие (влияние на экстрапирамидные дискинетические расстройства).
Антиастеническое, вегето-стабилизирующее, повышающее уровень сознания и адаптогенное действия в той или иной степени присущи всем представителям этого класса препаратов, остальные эффекты, в том числе, ноотропный, более избирательны.
В последнее время ноотропные свойства были обнаружены у транквилизатора мебикара (Макарчиков Н.С. с соавт., 1994) и новых отечественных препаратов - димефосфана (Менделевич Ю.М., Акберова С.А., 1994), мексидола, семакса, фентропила, нооглютила и дипептидов пирролидинкарбоновых кислот (Воронина Т.А., 1995., Островская Р.У. с соавт., 1995 и др.) [6].
1. Пирацетам (ноотропил). 2-Оксо-1 –пирролидинилацетамид. Пирацетам усиливает синтез нуклеиновых кислот и белков в организме, что приводит в конечном итоге к мощному усилению анаболизма не только в клетках нервной системы, но и в волокнах скелетной мускулатуры, клетках печени и т.д. В результате усиления синтеза белков ускоряется течение восстановительных и адаптивных реакций организма, повышается физическая работоспособность. Повышается энергетический потенциал клеток за счет усиления синтеза АТФ и повышается их устойчивость к различным неблагоприятным факторам: интоксикации, кислородному голоданию, высоким температурам и т.д. Ускоряется синтез фосфолипидов, принимающих участие в формировании клеточных мембран и нормализующих холестериновый обмен. Пирацетам оказывает благоприятное воздействие на структуру митохондрий - основных энергетических субъединиц клетки, что лежит в основе значительного повышения выносливости и аэробной производительности.
В медицине препарат назначают для восстановления нервно-психической деятельности и работоспособности после черепно-мозговых травм, инсультов, интоксикаций, нервно-психических срывов и т.д. Препарат не только малотоксичен, но в терапевтических дозах оказывает дезинтоксикационное действие, способствует выведению токсических веществ из организма. Пирацетам достаточно эффективен при депрессиях, сопровождающихся вялостью, апатией, снижением настроения и работоспособности.
Пирацетам вызывает быстро наступающее увеличение энергетического потенциала клетки, активирует аденилаткиназу, повышая скорость оборота аденилнуклеотидов, увеличивает активность ферментов дыхательной цепи. Уже при однократном введении препарата в дозе 100 мг/кг имеет место стимуляция синтеза РHК; в пробирочных экспериментах показано повышение скорости включения меченого лейцина в белок и меченого уридина в РHК. Показана способность препарата предотвращать характерное для старения снижение активности полирибосомального аппарата, ответственного за синтез протеина и нуклеинов.
Описанные эффекты пирацетама в отношении скорости синтеза РHК могут составить одну из причин благоприятного влияния пирацетама на процессы обучения. В этом отношении определенное сходство с пирацетамом проявляет предшественник пиримидиновых нуклеотидов - оротовая кислота. Четких данных о влияниях, оказываемых на скорость синтеза белка и РHК другими ноотропами, в литературе не имеется. Однако способность значительно повышать энергетический потенциал клетки для некоторых из них изучена довольно подробно. Особый интерес в этом отношении представляют производные аповинкамовой кислоты (винкамин, кавинтон). Препараты этой группы, применяемые в клинической практике с целью избирательного улучшения мозгового кровообращения и некоторого антиагрегационного эффекта, повышают устойчивость мозга к гипоксии также за счет, непосредственного воздействия на мозговой метаболизм. При анализе патогенеза тех заболеваний, которые принято считать объектом воздействия ноотропов, становится очевидным, что значительную часть показаний к их применению составляют состояния, в развитии которых важную роль играет дефицит доставки энергетических субстратов. Роль гипоксического фактора в развитии острых нарушений кровообращения мозга совершенно очевидна. В патогенезе постепенно нарастающих органических поражений головного мозга в пожилом возрасте, которые встречаются в геронтопсихиатрии, также играет важную роль циркуляторная гипоксия; при этом наряду с атеросклерозом, поражающим все большее число церебральных сосудов, кислородная недостаточность мозга усугубляется за счет нарастания агрегации тромбоцитов, частого сочетания церебрального атеросклероза с ишемической болезнью сердца, легочной недостаточностью, склонностью к спазмированию сосудов вследствие недостаточной пластичности нервной системы.
Способность пирацетама уменьшать обусловленные гипоксическими воздействиями нарушения за счет своего биоэнергетического действия составляет основу положительного клинического эффекта пирацетама при всех этих разнообразных по происхождению состояниях. Это означает, в свою очередь, что различные модели гипоксических состояний могут быть использованы в эксперименте для прогнозирования ноотропной активности препаратов и что некоторые из соединений, проявляющих четкую и избирательную антигипоксическую активность, могут оказаться потенциальными ноотропами [17].
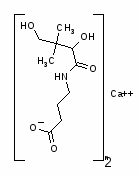
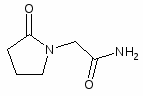
2. Пантогам. Кальциевая соль D-(+)-a,y, диокси-b-b-диметилбутирил-аминомаслянаякислота.
Пантогам (П) является производным пантотеновой и гамма-аминомасляной кислот. Фармакологические свойства пантогама являют собой симбиоз эффектов пантотеновой и гамма-аминомасляной кислот (гамма-аминомасляная кислота является тормозным медиатором ЦНС). Пантогам резко понижает основной обмен, вызывает значительную прибавку массы тела, повышает синтез ацетилхолина и как следствие мышечную силу. Под влиянием пантогама улучшается энергетический обмен, увеличиваются в размерах митохондрий, повышается общая выносливость.
Пантогам усиливает процессы торможения в ЦНС, уменьшает потребность организма в кислороде и энергетических субстратах. П усиливает синтез нуклеиновых кислот и белка, повышает содержание в организме стероидов. По анаболическому действию пантогам превосходит пантотеновую кислоту, обладая помимо анаболического, еще противосудорожным и гипотензивным свойствами.
Психоэнергизаторы - относительно новая группа лекарственных веществ. Все препараты данной группы способны повышать силу и подвижность нервных процессов, умственную и физическую работоспособность.
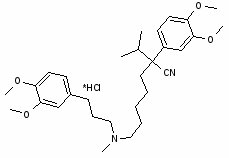
1. Ацефен (Центрофеноксин). b-Диметиламиноэтилового эфира пара-хлор-фенокси-уксусной кислоты гадрохлорид.
Ацефен был открыт при разработке стимуляторов роста растений. В основе анаболического и психостимулирующего действия ацефена лежит его способность повышать содержание холина в головном мозге и периферических нервных структурах, что приводит к усилению деятельности холинергетических структур. При этом повышается скорость проведения нервного импульса по нервным стволам, усиливается синтез ацетилхолина. Ацефен в высшей степени благоприятно воздействует на липидный обмен, усиливая синтез фосфолипидов мозга, мембран нервных клеток и печени. Данный механизм лежит в основе значительного улучшения памяти на фоне применения ацефена. Ацефен снижает содержание в клетках мозга липофусцина, который является "пигментом старения", тем самым оказывая "омолаживающее" действие на ЦНС.
Антигипоксанты - класс соединений, повышающих устойчивость организма к недостатку кислорода. Из этой группы препаратов внимание привлекает аксибутират натрия, как препарат, обладающий значительным анаболическим действием.
Оксибутират натрия. Натриевая соль γ-оксимасляной кислоты
Оксибутират натрия является исключительно сильным антигипоксантом, защищающим организм от кислородного голодания в разряженной атмосфере, при больших физических нагрузках, при тяжелых сосудистых заболеваниях и поражениях дыхательного аппарата. Антигипоксические свойства оксибутирата связаны с его способностью активизировать бескислородное окисление энергетических субстратов и уменьшать потребность организма в кислороде. Кроме того, оксибутират натрия сам способен расщепляться с образованием энергии, запасаемой в виде АТФ. Благодаря всем этим свойствам, оксибутират натрия является на сегодняшний день самым эффективным средством для развития выносливости.
Анаболическое действие оксибутирата выражается в усилении синтетических процессов в организме и замедлении процессов катаболизма. В результате хронического ведения оксибутирата натрия значительно повышается содержание в крови соматотропного гормона, а также картизола, значительно снижается содержание молочной кислоты. Под действием оксибутирата происходит гипертрофия митохондрий и мышечных волокон, увеличивается количество гликогена в мышцах и в печени.
Оксибутират натрия обладает выраженным адаптивным и антистрессовым действием, в малых дозах вызывает легкую заторможенность с элементами эйфории, в средних - сон, а в больших дозах - наркоз. Оксибутират является мощным средством для неспецифической адаптации ко всем экстремальным воздействиям.
В медицине оксибутират натрия используется как успокаивающее, противосудорожное, наркозное средство, а так же в качестве снотворного. В реанимационной практике оксибутират широко используется как средство повышающее неспецифическую адаптацию и выживаемость тяжелых больных [17].
5. Методы получения.
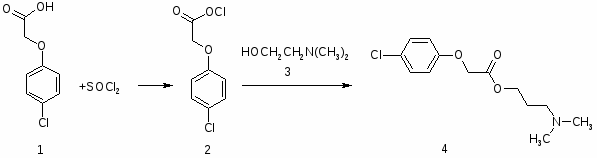
5.1 Ацефен
Ацефен (4) образуется при взаимодействии хлорангидрида п хлор феноксиуксусной кислоты (2) с диметиламиноэтанолом (3) в среде хлороформа или дихлорэтана с последующим переводом диметил миноэтилового эфира п-хлорфеноксиуксусной кислоты в его гидрохлорид (4).
1. -Диметиламиноэтиловый эфир п-хлорфеноксиуксусной кислоты
К кипящему раствору 0,318 кг (1,7 мол) (1) и 1 мл пиридина в 1,2 л безводного дихлорэтана при перемешивании за 30—40 минут прибавляют 0,325 кг тионилхлорида. Реакционную массу кипятят 4 часа и упаривают в вакууме. Полученный технический (2) растворяют в 340 мл безводного дихлорэтана и приливают в течение 1 часа 0,19 кг (2,13 мол) (3) (т. кип. 132 136°, содержание влаги не выше 0,8%). Смесь кипятят 2 часа, оставляют на 15 часов, после чего выливают на 0,2 кг льда и 1 л воды, перемешивают и отстаивают 30 минут. Слой дихлорэтана отделяют, а к водному слою, содержащему (4), добавляют 3,8 л хлорбензола и смесь охлаждают до 5°. При перемешивании к смеси прибавляют 70 г едкого натра в виде 40% водного раствора до рН 11,0-12.0 в водном слое, раствор основания (4) в хлорбензоле отстаивают и сушат сульфатом натрия. Высушенный раствор отделяют от сульфата натрия, перемешивают с 40 г угля в течение 1 часа и фильтруют.
2. Гидрохлорид -диметиламиноэтилового эфира п-хлорфеноксиуксусной кислоты (IV)
К раствору основания (4) в хлорбензоле, нагретому до 50°, прибавляют 250 мл 18-22% раствора хлористого водорода в безводном спирте (по конго). Смесь оставляют на 20 часов при температуре 2-3°, кристаллы (4) отфильтровывают и промывают дихлорэтаном. Получают 0,3 кг (4), т. пл. 133 135°, которые перекристаллизовывают из 3 л безводного дихлорэтана. Выход (4) 0,25 кг (50% на I), т. пл. 156-158°.
Фармакопейный ацефен может быть также получен при перекристаллизации технического (4) из спирта (1:1) [14].
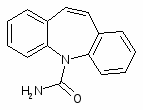
5.2 Карбамазепин
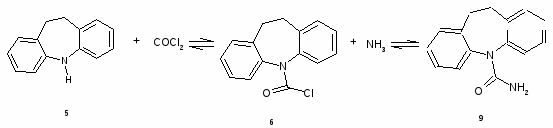
10,11-Дигидро-5-хлоркарбонил-5Н-дибенз[b,f]азепин (6)
185 г (0,9 моля) 95% иминодибензила (5) растворяют при нагревании в 1500 мл толуола и при 90-95С пропускают через барбатер слабый ток фосгена в течение 3-3,5 ч, затем азотом отдувают избыток фосгена и хлористый водород в течение 2 ч. К раствору прибавляют 14 г активированного угля, кипятят в течение 20 мин, отфильтровывают уголь, промывают 50 мл горячего толуола, фильтрат упаривают до 1/3 объема, охлаждают до 0С, через 4 ч отфильтровывают осадок, промывают 2*40 мл холодного толуола, сушат при 50-60°С и получают 194,4 г кристаллов с т.пл. 121-123°С. Фильтрат упаривают, обрабатывают аналогично активированным углем и выделяют дополнительно 14,2 г кристаллов с т. пл. 119-121°С. Всего получают 208.6 г (90%) (6) (т. пл 121-123°С).
10,11-Дигидро-5-карбамоил-5Н-дибенз[b,f]азепин (9)
Через смесь 38,5 (0,15 моля) (6), 430 мл метанола, 50 мл воды при перемешивании и температуре 57-59°С пропускают ток аммиака в течение 1,5 ч, прибавляют 2 г активированног угля, кипятят в течение 15 мин, фильтруют и фильтрат упаривают досуха. К остатку прибавляют 400 мл воды, кипятят при перемешивании в течение 1 ч, охлаждают 20°С, отфильтровывают осадок, промывают 10 мл спирта, сушат при 75°С в течение 4 ч и получают 32,7 г вещества с т. пл. 198—205 °С. Осадок перекристаллизовывают из 320 мл метанола с 2 г активированного угля и получают 30,3 г (85.35%) (9) в виде бесцветных кристаллов с т. пл. 205 206,5°С (206—208°С).
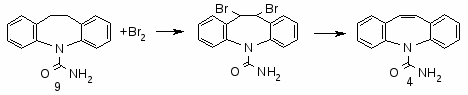
5-Карбамоил-5Н-днбенз[b,f]азепим (4)
Смесь 19,3 г (0,075 моля) (9), 8 мл хлорбензола нагревают до 145°С и при перемешивании при 145-150°С прибавляют по каплям 14,4 г (0,09 моля) брома под слой реакционной массы в течение 1.5 ч с такой скоростью, чтобы холодильник не окрашивался парами брома. Затем перемешивают реакционную массу в течение 2 ч при температуре 150—155°С для завершения дегидробромирования, охлаждают до 90 °С, прибавляют 45 мл метанола, реакционную массу с выпавшим осадком охлаждают до 5°С, отфильтровывают осадок и промывают 2*10 мл метанола. 23,9 г полученной 75% пасты (2) загружают в автоклав емкостью 0,165 л, прибавляют 102 мл метанола, 28,3 мл (0,376 моля) 25% NН4ОН, нагревают при 75-85°С и перемешивании в течение 5 ч, охлаждают до 20°С. выгружают в одногорлую круглодонную колбу, автоклав промывают 50 мл горячего метанола и промывной раствор прибавляют к основной реакционной массе. Смесь кипятят с 4 г активированного угля в течение 30 мин, отфильтровывают уголь, промывают 10 мл кипящего метанола, из фильтрата отгоняют при 64—66°С 150 мл метанола, к остатку прибавляют 20 мл дистиллированной воды, смесь нагревают до кипения и кипятят в течение 1 ч, затем реакционную массу охлаждают до 15°С, осадок отфильтровывают промывают 2*25 мл дистиллированной воды, сушат при 75—80°С в течение 8-10 ч и получают 14,5 г (4) с т. пл. 184—186°С, что составляет 81,87% от теоретического, считая на (6).
Полученные 14,5 г технического карбамазепина (4) загружают в одногорлую круглодонную колбу с обратным холодильником, прибавляют 60 мл спирта, нагревают до растворения осадка, прибавляют 2 г активированного угля, кипятят в течение 30 мин, отфильтровывают уголь, промывают 2*5 мл горячего спирта, фильтрат охлаждают и выдерживают при 0°С в течение 4 ч.
Выпавший осадок отфильтровывают, промывают 2*5 мл холодного спирта, сушат в вакуум-сушильном шкафу при 65-70 °С и получают 10,7 г фармакопейного карбамазепина (4) с т. пл. 190—191,5°С. После упаривания маточного раствора и кристаллизации получают еще дополнительно 1,1 г (4) с т. пл. 189.5—191,5°С. Общий выход (4) 11,8 г, что составляет 66,7% от теоретического, считая на (6), или 60%, считая на исходный (5) [13].
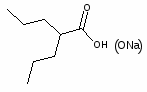
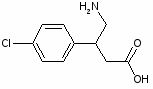
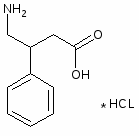
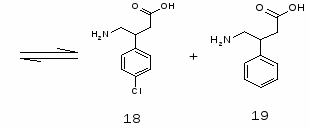
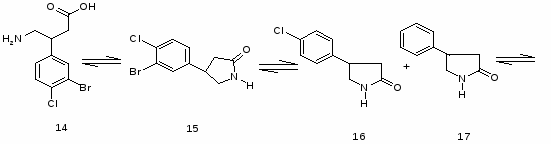
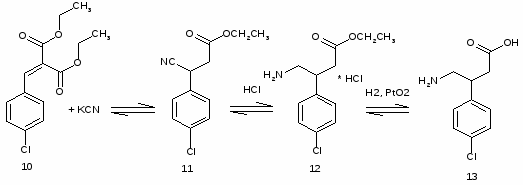
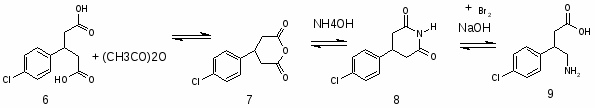
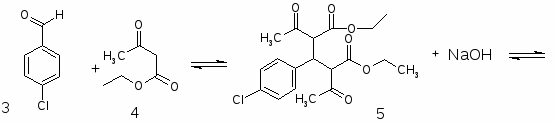
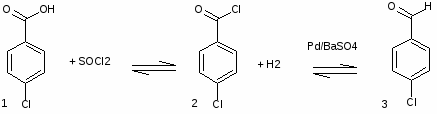
5.3 Баклофен
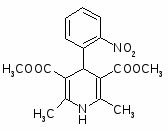
При обработке 4-ClC6H4COOH (1) и посредством SOCl2 образуется 4 ClC6H4COCl (2). Восстановлением (2) по Розенмунду получен 4 ClC6H4CHO (3), конденсация которого с АсCH2COOEt (4) приводит к 4 ClC6H4CH[CH(Ac)COOEt]2 (5). При щел. гидролизе (5) образуется 4 ClC6H4CH(CH2 COOН)2 (6), который при кипячении с Ас2О циклизуется в соответствующий ангидрид (7). Реакция (7) с конц. NH4OН приводит к
4-ClC6H4CHCH2 CONНCOCH2(8)
При обработке (8) посредством Br2 в NaOH образуется 4 ClC6H4CH(CH2 COOН) CH2NH2 (9).
Реакция 4-ClC6H4CH=C(COOEt) 2 (10) с КСN приводит к 4 ClC6H4CH(CH2COOEt)СN (11), при гидрировании которого образуется 4 ClC6H4CH(CH2 COOEt)CH2NH2 (12). К-тным гидролизом (12) превращен в 4-ClC6H4CH(CH2COOОН)CH2NH2 (13). При возгонке 4 Cl 3 BrC6H3CH(CH2COOОН)CH2NH2 (14) образуется 4 (3 бром 4хлорфенил) 2 пирролидон (15).
При восстановлении (15) посредством Н2 над Pd/C получена смесь 4 (4 хлор-3-Н-фенил)-2-пирролидона (16) и 4 (3,4 Н2 фенил) 2 пирролидона (17).
Кислотный гидролиз смеси (16) и (17) приводит к смеси:
4-Cl-3-Н-C6H3CH(CH2COOH)CH2NH2(18) и 3,4 Н2C6H3CH(CH2COOH)CH2NH2 (19).
Раствор 29,1 ммоля (27,3мкюри) (1) в 35 мл SOCl2 кипятят 5ч, р-ритель отгоняют, следы SOCl2 удаляют отгонкой с ГК и получают 5,3 г (2), который используют без очистки на след. стадии.
29,1ммоля (2) гидрируют в слабом токе Н2 в смеси 50 мл ксилола, 0,35г 5% Pd/BaSO4 и 0,021 мл р-ра хинолин-сера до прекращения выделения HCl (70-75С, 28 ч), Кт отфильтровывают, фильтрат упаривают и получают 6,9 г неочищ(3). К р-ру 29,1 ммоль (3)в 4 мл сп.+58,4 ммоль (4) и 1,28 мл пиперидина, выдерж-т 16 ч, прибавляют 50 мл ГК, охлаждают до 0°С и отфильтровывают (5), выход 65%, т. пл. 152-4°С.
Р-р 7,25 г (18,9 ммоля) (5) в 50 мл диоксана прибавляют к смеси 30 мл сп. и 31 г 50% NaOH (100°С, 3ч), выдерживают (100°С, 1ч), охлаждают, орг. р-ритель отгоняют, водн. р-р подкисляют 35 мл конц HCl (0°С), осадок отфильтровывают и получают 3,8 г (6), т. пл. 161-3°С.
Кипятят 3,8 г (6) в 20 мл Ас2О (1ч), р-ритель отгоняют, остаток р-ряют в 5 мл бзл. и высаживают (7) посредством ГК (0°С), получают 3,4 г (7), т. пл. 127-129°С.
К 3,4 г (15,1 ммоля) (7) постепенно прибавляют 15 мл конц. NH4OH (0°С), нагревают (70°С, 0,5 ч), р-ритель отгоняют, остаток нагревают(185°С, 1ч, масляная баня) и получают (8).
15,1 ммоля (8) р-ряют в 16 мл воды, содержащей 0,7 г NaOH (50°С), охлаждают (10-15°С) прибавляют раствор 3,3 г NaOH в 16 мл воды, затем 1,35 мл Br2, выдерживают (20°С, 4 ч), обрабатывают углем, упаривают в вакууме до 20 мл, нейтрализуют до рН 6,5-7 разб. HCl (1:1), осадок отфильтровывают, р-ряют в 15 мл 1н. NaOH, нейтрализуют 1н. HCl до рН 6,5-7, осадок отфильтровывают, сушат в вакууме (25°С/0,01) и получают 1,55г (9) (уд. акт. 4,4 мкюри/ч); из маточного р-ра выделено дополнительное количество (9), общий выход 8,1 мкюри (30%,считая на (1). К р-ру 0,603 г (49,6 кюри) КСN в 1 мл воды прибавляют раствор 2,32 г (9) в 22 мл сп., нагр т (70°С, 16 ч, N2), охлаждают (0°С), осадок отфильтровывают, к фильтрату прибавляют 1,6 мл 1н HCl и отгоняют р-ритель. Остаток растворяют в эф., пром-т водой и из орг. слоя выделяют 71,8% (11), т. кип. 140°С/0,05.
Р-р 1,63 г (11) в смеси 11 мл сп. и 0,75 мл 10н. HCl гидрируют над 0,06г PtO2 (20°С, 7 ч), Кт отфильтровывают, фильтрат упаривают, остаток обрабатывают эф. и получают 1,46 г ХГ (12), к-рый кипятят 16 ч с 17 мл 5н. HCl, охлаждают, р-ритель удаляют лиофилизацией, остаток кристаллизуют из смеси сп.-эф. и получают 1,1 г ХГ (13). Выделение и очистку (13) проводят аналогично соединению (9). Получают 19,5 мкюри (13) (39%, считая на КСN).
0,5 г (14) трижды возгоняют (250°С/0,1-0,5) и получают 0,392 г (15), т.пл. 129-32°С/бзл).
Смесь 0,275 г (15), 0,1 г NaОAc, 0,06 г 10% Pd/C и 10мл EtOCH2CH2OH замораживают жидким N2, с-му вакуумируют, заполняют 190 кюри Н2, смесь гидрируют при 20°С (24 мин), избыток Н2 адсорбируют на уране, с-му продувают N2, смесь фильтруют, фильтрат подвергают лиофильной сушке. Остаток раств-т в 10 мл МеОН и вновь лиофилизуют (3 раза). Остаток р-ряют в 10 мл ЭА2 прибавляют 2 мл воды, органический слой отд-т, а водн. экстрагируют 30 мл ЭА, объединенные орг. экстракты пром-т 30 мл воды. Половину полученного раствора лиофилизуют, остаток нагревают в ампуле в 3 мл 6н.HCl(100°С, 2,5 ч), р-ритель отгоняют и хроматографией на СГ в с-ме втор.ВuOH-AcOH-вода (67:10:23) выделяют (18) (3,2 кюри) и (19) (2,4 кюри).
Очистка (18) рехроматогрфией на СГ приводит к 2,03 кюри (18) (уд. радиоакт. 9,38 кюри/ммоль), к-рый хранят в виде р-ра в указанной смеси при пониженной температуре [15].
5.4 Пикамилон
ГАМК плохо проникает в мозг и для практического повышения ее уровня в мозге необходима инъекция в дозе 3 г/кг (29,1 ммоль/кг). Одним из факторов, который препятствует ГАМК проходить через биологические барьеры, является ее высокая полярность, связаная с цвиттерионной структурой этой аминокислоты, поэтому одно из направлений создания новых ноотропных средств на основе молекулы ГАМК состоит в получении ее аналогов и производных с более низкой полярностью, которые были бы способны проходить через ГЭБ и действовать на ГАМК – рецепторы. Среди различных теоретически возможных вариантов получения таких веществ был выбран путь, состоящий в химическом связывании аминогруппы ГАМК с веществами – носителями, которые являются постоянными метаболитами организма человека и хорошо проникают в мозг. В качестве таких носителей использовались природные органические кислоты, включая витамины и их предшественники, полученные при этом соединения обладали разнообразной фармакологической активностью. Выбор никотиновой кислоты в качестве носителя был сделан по следующим причинам: наличие реакционноспособной карбоксильной группы определяет возможность связывания с концевой 2 - группой ГАМК с образованием амида, что значительно снижает основность и, как можно было ожидать, сделает молекулы менее полярной и более проницаемой для ГЭБ; никотиновая кислота обладает ценными фармакологическими свойствами, малотоксична, содержится в мозговой ткани и проникает в мозг, в то же время ее самостоятельный лечебный эффект относительно невысок. Поэтому и возникла идея сочитания никотиновой кислоты и ГАМК в одной молекуле, которое могло бы привести к веществу, проходящему через ГЭБ, с более высокой фармакологической активностью по сравнению с активностью его компонентов. Реализация такого предположения и привела к синтезу -никотиноил-ГАМК (1), экспериментальное изчение которой и подтвердило эффективность такого подхода. Первоначальные исследования показали, что полученное вещество проникает в мозг и оказывает депримирующее влияние на центральную регуляцию мозгового кровообращения. В результате дальнейших широких исследований на основе натриевой соли никотиноил-ГАМК (2) был создан новый ноотропный препарат пикамилон.
5.4.1 Синтетические исследования
Принципиально амид никотиновой кислоты и ГАМК модет быть получен ацилированием ГАМК различными производными никотиновой кислоты в присутствии основания. Первый синтез соединения (1) был осуществлен в 1970 г. конденсацией азида никотиновой кислоты и ГАМК в щелочной среде при комнатной температуре и приводил к целевому продукту с выходом 50%. Однако этот метод имеет ряд существенных недостатков, связаных с получением азида никотиновой кислоты, являющегося неустойчивым веществом, склонным к разложению со взрывом.
Реакцией хлорангидрида никотиновой кислоты с натриевой солью ГАМК в водном растворе получают амид (1) с выходом 30 %. Низкий выход обусловлен, по-видимому, тем, что в условиях реакции Шоттен – Баумана в водной среде хлорангидрид достаточно быстро гидролизуется, а применение органических растворителей было затруднено из-за низкой растворимости в них исходных веществ. Аналогичные результаты получены и при использовании смешаного ангидрида никотиновой и угольной кислот.
5.4.2 Экспериментальная химическая часть
Получение -никотиноил-ГАМК (1).
К раствору 0,75 г ГАМК и 0,74 г гидрата окиси натрия в 10 мл воды при 0-5С прибавляют небольшими порциями 1 г хлоргидрата хлорангидрида никотиновой кислоты. После полного прибавления смесь перемешивают в течение 1 часа при 5 С и оставляют нагреваться на воздухе до 20С. Раствор подкисляют концентрированной соляной кислотой до рН 3,0-3,5, выпавший осадок отфильтровывают, промывают холодной водой и сушат в вакууме. Выход 38%, т.пл. 213-214С. Найдено, %: C 57.68, H 5.76, N 13.46. Вычислено, %: C 57.43, H 5.82, N 13.12.[22]
6. Методы анализа ноотропных препаратов
6.1 Карбамазепин [18]
6.1.1 Подлинность
Можно применять либо испытание А, либо испытания Б, В и Г.
А. Проводят испытание, как описано в разделе «Спектрофотометрия в инфракрасной области спектра» (т. 1, с. 45). Инфракрасный спектр, полученный с испытуемым веществом без предварительной его обработки, соответствует спектру, полученному со стандартным образцом карбамазепина СО, или спектру сравнения карбамазепина.
Б. Смотри тест, описанный ниже под заголовком «Посторонние примеси». Основное пятно, которое дает раствор В, соответствует по положению, внешнему виду и интенсивности пятну, которое дает раствор Г.
В. Небольшое количество испытуемого вещества подвергают воздействию ультрафиолетового излучения с длиной волны 365 нм; появляется интенсивное синее свечение.
Г. Нагревают 0,1 г испытуемого вещества с 2 мл азотной кислоты (1000г/л) ИР на водяной бане в течение 3 мин; появляется оранжево-красная окраска.
Температурный интервал плавления. 183-193°С.
Тяжелые металлы. Используют 0,1 г испытуемого вещества для приготовления раствора, описанного в разделе «Испытания на тяжелые металлы», методика 3 (т. 1, с. 136); определяют содержание тяжелых металлов методом А (т. 1, с. 137); не более 10 мкг/г.
Сульфатная зола. Не более 1,0 мг/г.
Потеря при высушивании. Высушивают до постоянной массы при 105°С; потеря не более 5,0 мг/г.
Кислотность или щелочность. Растирают 1,0 г испытуемого вещества с 20 мл свободной от диоксида углерода воды Р в течение 15 мин и фильтруют. К 10 мл фильтрата добавляют 0,1 мл раствора фенолфталеина в этаноле ИР и титруют раствором гидроксида натрия (0,01 моль/л), не содержащим карбонатов, ТР; требуется не более 0,5 мл для получения розовой окраски. Добавляют 0,15 мл раствора метилового красного в этаноле ИР и титруют соляной кислотой (0,01 моль/л) ТР; требуется не более 1,0 мл для получения красной окраски.
Посторонние примеси. Проводят испытание, как описано в разделе «Тонкослойная хроматография» (т. 1, с. 92), используя в качестве сорбента силикагель Р6, а в качестве подвижной фазы смесь 86 объемов толуола Р и 14 объемов метанола Р. Наносят на пластинку отдельно по 2 мкл каждого из 5 растворов в смеси равных объемов этанола (~750 г/л) ИР и хлороформа Р, содержащих (А) 0,050 г испытуемого вещества в 1 мл, (Б) 0,050 мг иминодибензила Р в 1 мл, (В) 5,0 мг испытуемого вещества в 1 мл, (Г) 5,0 мг карбамазепина СО в 1 мл и (Д) 5,0 мкг карбамазепина СО в 1 мл. После извлечения пластинки из хроматографической камеры, дают ей высохнуть на воздухе, сбрызгивают раствором дихромата калия ИРЗ и оценивают хроматограмму при дневном свете. Любое пятно, которое дает раствор А, кроме основного пятна, не должно быть более интенсивным, чем пятно, которое дает раствор Б. Затем нагревают пластинку 15 мин при 140°С и оценивают хроматограмму в ультрафиолетовом свете (254 нм). Любое дополнительное пятно, которое дает раствор А, не должно быть более интенсивным, чем пятно, которое дает раствор Д.
6.1.2 Количественное определение
Растворяют около 0,1 г испытуемого вещества (точная навеска) в достаточном для получения 100 мл количестве этанола (~750 г/л) ИР. Разводят 10 мл раствора до 100 мл тем же растворителем, и снова разводят 10 мл раствора до 100 мл этанолом (~750г/л) ИР. Измеряют поглощение слоя в 1 см полученного раствора при максимуме около 285 нм. Рассчитывают количество С15Н12N2О в испытуемом веществе путем сравнения со стандартным образцом карбамазепина СО, исследованного одновременно и аналогичным образом. В правильно откалиброванном спектрофотометре поглощение эталонного раствора должно быть 0,49_+0,02.
6.2 Ацефен
Количественное определение ацефена на основе его реакции с фосфорновольфрамовой кислотой.
Разработана методика фототурбидиметрического определения ацефена с помощью фотоэлектроколориметра ФЭК-56-М (при синем светофильтре и рабочей длине кюветы 10 мм).
Для выбора оптимальных условий готовят 1% раствор фосфорно-вольфрамовой кислоты (реактив) и 0,1% раствора аминосоединения. Критерием оптимизации служит величина светопогашения. Как показали экспериментальные данные, на величину светопогашения, а следовательно, на выход продуктов реакции существенное влияние оказывают концентрация реактива, наличие органических добавок (этанол). Кроме этого, для успешного проведения фотометрического анализа необходимы стабильность продуктов реакций во времени и воспроизводимость радиусов частиц. Поэтому изучили влияние вышеуказанных факторов на выход и устойчивость вольфрамофосфата исследуемого препарата во времени. Оптимальными являются условия: 1 мл этанола, 3 мл 1% раствора фосфорновольфрамовой кислоты, время 5 минут (табл.3).
Изучен состав продуктов осадочных реакций оптическим вариантом физико-химического анализа в растворе. Использован метод изомолярных серий, основанный на определении отношения изомолярных концентраций реагирующих веществ, отвечающего максимальному выходу образующегося соединения. В точке, отвечающей стехиометрическому составу образующегося соединения, наблюдается максимальное значение величины светопогашения. Состав вольфрамофосфатов аминосоединений подтвержден методом отношения наклонов. Установлено, что фосфорновольфрамовая кислота взаимодействует с исследуемым препаратом в соотношении 1:3 и не противоречит литературным данным по образованию подобных соединений. В оптимальных условиях строят калибровочные графики.
Таблица 3.Данные оптимальных условий реакции аминосоединений с реактивом
Аминосоединение
Реактив
мг/25 мл
Этанол
мл
Время
мин
Ацефен
3
1
5
В мерную колбу емкостью 25 мл переносили 0,1, 0,2…1,0 мл 0,1% водного раствора препарата, прибавили 1 мл этанола, 3 мл реактива, довели водой до метки, и спустя 5 мин, измеряли величину светопогашения с помощью фотоэлектроколориметра.
При количественном определении ацефена в субстанции точную навеску его (около 0,05 г) помещают в мерную колбу емкостью 50 мл, растворяют препарат в воде и водой доводят до метки. В мерную колбу вместимостью 25 мл вносят 0,4 мл полученного раствора и анализируют аналогично построению калибровочного графика. Концентрацию ацефена рассчитывают с помощью углового коэффициента. Проводят 8 параллельных анализов препарата и полученные данные математически обрабатывают. Данные опытов представлены в табл. 4.
Относительная погрешность анализа равна 1,52% [20].
Табл. 4. Результаты анализа ацефена
Взято,
мг
Найдено,
мг
Найдено,
%
Метрологические характеристики
0,40
0,405
101,25
0,40
0,410
102,50
Х=99,84
0,40
0,390
97,50
S=0,64
0,40
0,395
98,75
a=1,52
0,40
0,400
100,00
А=1,52
0,40
0,405
101,25
Δ=99,84+_1,52
0,40
0,400
100,00
0,40
0,390
97,50
6.2.1 Фотометрический метод определения ацефена [21]
Описан фотометрический метод определения диметиламиноэтиловогоэфира n-хлорофеноксиуксусной кислоты (I), основанный на превращении этого вещества в гидроксамовую кислоту и последующем определении в виде окрашенного комплекса с Fe(3+).
К 4мл водного раствора пробы (0,05-5мг/мл) прибавляют 1мл раствора 27,6г NH2OH5*HCl в 100мл воды и 1мл раствора 25г NaOH в 100мл воды, оставляют на 5минут при определении I. Затем к 1мл смеси прибавляют 1мл 2н HCl и 0,5мл 0,37М раствора FeCl3 в 0,1н HCl и измеряют ОП раствора при 490Нм. Окраска устойчива 30 минут. Продукты разложения I определению не мешают.
6.3 Фармакопейный анализ пиридитола (энцефабола)
Состав и форма выпуска: таблетки покрытые оболочкой желтого цвета, 100 мг, №50, №100. действующее вещество: пиритинола гидрохлорид – 100 мг; суспензии для внутреннего применения, 4 г. флакон 200 мл, №1.
Действующее вещество: пиритинола гидрохлорид – 4 г.
Белый или белый со слегка мутноватым оттенком кристаллический порошок. Легко растворим в воде, мало растворим в спирте.
Фармакологические свойства
Энцефабол - ноотропный препарат. Улучшает патологически сниженные обменные процессы в мозговой ткани, что обусловлено повышением усвоения и метаболизма глюкозы, обмена нуклеиновых кислот, а также с повышением высвобождения ацетилхолина и активации холинергических процессов. Энцефабол стабилизирует клеточные мембраны и улучшает их функцию за счет подавления активности лизосамальных ферментов и предотвращение образования свободных радикалов. Энцефабол улучшает реалогические свойства крови: повышает эластичность эритроцитов и текучесть крови, увеличивает содержание АТФ в мембране ретроцитов. При применении энцефабола усиливается кровоток и повышается потребление кислорода в ишемизированных зонах мозга, а также активируется обмен глюкозы в участках, где ранее определялись ишемические повреждения. На ЭЭГ усиливается альфа-ритм при одновременном снижении тета-и дельта-ритмов. Энцефабол способствует повышению умственной работоспособности, улучшению памяти, повышению способности к обучению.
После приема внутрь препарат быстро абсорбируется из пищеварительного тракта. Биодоступность составляет всреднем 85% (76-93%). Время достижения максимальной концентрации после приема внутрь 100 мг энцефабола составляет 30-60 минут. Связывание с белками плазмы крови – 20-40%. Быстро метаболизируется в печени с образованием фармакологически активных метаболитов. Выводится в основном с мочей в виде метобалитов; около 5% - с калом. Наибольшая часть дозы выводится уже в первые 4 часа после приема. За первые сутки выводится около 74% дозы. Период полувведения составляет в среднем 2,5 часа. После многократных приемов внутрь комуляции препарата в организме не наблюдается. Препарат проникает через ГЭБ. Пиритинол и его метаболиты накапливаются преимущественно в сером веществе мозга. Перитинол проникает через плацентарный барьер, в значительном количестве в грудное молоко.
Показания
Симптоматическая терапия деменции, обусловленная органическими причинами (первичная дегенеративная деменция, деменция сосудистого генеза), при наличии таких проявлений, как нарушения памяти, мышления, снижение концентрации внимания, повышенная утомляемость, дефицит побуждений и мотиваций, аффективные нарушения; посттравматическая энцефалопатия; состояние после перенесенного нарушения мозгового кровообращения, энцефалита, интоксикации.
Применение
Дозу устанавливают индивидуально с учетом тяжести заболевания и реакции пациента на лечение. Средняя доза для взрослых составляет 200 мг – 2 таблетки по 100 мг или 10 мл суспензии (2 столовые ложки). Кратность назначения – 3 раза в сутки.
Детям в зависимости от показаний назначают в суточной дозе 50-30 мг; кратность приема – 3 раза в сутки.
Клиническое улучшение может наблюдаться через 2-4 недели, однако оптимальный эффект проявляется через 6-12 недель. В некоторых случаях продолжительность курса лечения может превышать 12 недель. Препарат принимают во время или после еды. Таблетки проглатывают целиком, запивая жидкостью. Пациентам с нарушениями сна, а также детям при повышенной возбудимости не рекомендуется принимать препарат вечером.
Противопоказания
Абсолютные – повышенная чувствительность к перитинолу, к фруктозе (для препарата в форме суспензии); относительные – выраженные нарушения функций печени и / или почек; выраженные изменения состава периферической крови; диффузные болезни соединительной ткани; миостения; пузырчатка; повышенная чувствительность к пеницилламину.
Особые указания
У пациентов с ревматоидным артритом и другими хроническими заболеваниями суставов наблюдается повышенная чувствительность к соединениям в состав которых входит SH – группа, в том числе к пиритинолу. У этих пациентов повышен риск возникновения реакций гиперчувствительности и нарушений функций печени, возможны протеинурия, иногда – нефротический синдром; редко – эозинофелия, тромбоцитопения, лейкопения (в отдельных случаях вплоть до агранулоцитоза), повышенное содержание в крови антинуклиарных антител; в отдельных случаях – отслоение ногтей, одышка, мышечная слабость, парестезия, полимеозит, холестаз, гепотит, гематурия, появление в крови LE-клеток, аутоиммунный гипогликемический синдром; при применении суспензии возможны реакции гиперчувствительности на алкил-4-гидроксибензоата (парабены), входящие в ее состав; в отдельных случаях – артралгия, плоский лешай, пемфегоидные реакции, выпадение волос. При лечении этого контингента больных необходим систематический контроль общего анализа крови, мочи, функционального состояния печени, иммунологических показателей.
Назначение энцефабола в период кормления грудью возможно только по строгим показаниям. В специальных ограниченных клинических испытаниях по применению перитинола у беременных и новорожденных повреждающее действие и какие –либо побочные эффекты препарата не выявлены. Однако решение о применении пиритинола в период беременности и кормления грудью следует принимать только после тщательной оценки его терапевтической целесообразности.
Взаимодействия
Энцефабол усиливает побочные эффекты пеницилламина, препаратов золота и сульфосалозинов.
Передозировка
Случаи отравления энцефабола неизвестны. При развитии возбуждения в результате передозировки проводят симптоматическое лечение.
7. Таблица препаратов
№
Структура
Название и синонимы
Систематическое название
Метод получения
Анализ
(ссылки)
Ноотропные препараты
1.
Пирацетам
(ноотропил(П)), пирамем(Б), Euvifor, Nootropil, Normabrain, Pyramem.
2-Оксо-1-пирролидинилацетамид
2.
Аминалон
(гаммалон, Ганеврин(П), Apogamma, Encefalon, GABA, Gamarex, Gammalon, Gammaneuron, Gammar, Gammasol, Mielogen, Mielomade.
-Аминомасляная кислота
3.
Натрия оксибутират
(Natrium oxybuticum, Oxybate sodium)
Натриевая соль -оксимасляной кислоты
4.
Фенибут
-Амино--фенил-масляной кислоты гидрохлорид
5.
Баклофен
(Лиоресал, Lioresal, Baclon)
4-амино-3-(пара-хлорфенил)-масляная кислота
15
6.
Пантогам
(Calcium homopantothenat, Hopaten)
Кальциевая соль D-(+)-, -диокси-, -диметилбутирил--аминомасляной кислоты, или кальциевая соль D-(+)-гомопантотеновой кислоты
7.
Пиридитол
(Энцефабол, Biocephalin, Bonifen, Cefalogen, Cervitalin, Cogitan, Dipiridol, Enbol, Encephabol, Encefort, Enerbol, Estisol, Neurotin, Neuroxin, Piritinol, Pyrithioxin, Pyritinol, Tonobrein
Бис-(2-метил-3-окси-4-оксиметил-5-метилпиридил)-дисульфида дигидрохлорид
8.
Ацефен
(Аналукс(П), Церутил(Г), Analux, Centrophenoxine, Cerutil, Claretil, Clofenoxine, Meclofenoxati Hidrochloridum, Meclofenoxate Hidrochloride, meclon, Mexazine, Nisantol, Proseril, Ropoxyl).
-Диметил-
аминоэтилового эфира пара-хлор феноксиуксусной кислоты гидрохлорид
14
20
9.
Рифатироин
(Тиролиберин)
Пироглутамил-гистидил-пролинамид(трипептид)
10.
Дибунол
(Ионол, Бутилокситолуол).
2,6-Ди-трет-бутил-4-метилфенол
Нормотимические препараты
1.
Li2CO3
Лития карбонат
(Lithium carbonicum)
2.
Лития оксибутират
Лития -оксибутират
3.
Карбамазепин
(Финлепсин (Г), Стазепин(П), Тегретол (Ю), Amisepin, Carbagretil, Carbazep, Carbamazepin, Finlepsin, Mazetol, Neurotol, Tegretal, Tegretol, Stazepin.
5-Карбамоил-5Н-дибен(b,f)азепин
13
18
4.
Вальпроевая кислота, вальпроат натрия
(Депакин, Конвулекс, Конвульсофин, Convulex, Depaken, Depakene, Depakin, Deprakine, Epilim, Ergenyl, Labazene, Orfinil, Propymal, Valporate sodium
2-Пропилвалериановая кислота и ее натриевая соль
5.
Верапамил
(Верпамид, Изоптин (Ю), Финоптин, Фаликард (Г), Cordilox, Dilacoran, Falicard, Finoptin, Ikacor, Isopine, Isoptin, Manidon, Vasolan, Verpamil, Verapamilhydrochlorid.
5-[(3,4-Диметоксифенэтил)-метиламино]-2-(3,4-диметоксифенил)-2-изопропилвалеронитрила гидрохлорид
6.
Фенигидин
(Коринфар (Г), Адалат, Нифедипин, Adalat, Adarat, Corinfar, Nifedipinum, Nifelat, Phenigidinum, Procardia.
2,6-Диметил-4-(2’-нитрофенил)-1,4-дигидропиридин-3,5-дикарбоновой кислоты диметиловый эфир
Терминологический словарь
Гериатрия - медицинская дисциплина, занимающаяся изучением особенностей заболеваний у лиц пожилого и старческого возраста и их лечением.
Геронтология – наука, изучающая биологические механизмы и процессы, обуславливающие и сопровождающие старение живых существ, а также способы замедления старения и увеличения продолжительности жизни.
Гиперкинез – тип расстройств, характеризующийся избыточными непроизвольными движениями.
Синдром астенизации – синдром, появляющийся в результате атрофии мышц и увеличения количества жировой ткани, нарушаются обменные процессы, изменяется состояние центральной нервной системы. Выражается быстрой утомляемостью, эмоциональной неустойчивостью, обидчивостью, склонностью к конфликтам.
Парез – частичная утрата произвольных движений. Развивается при заболеваниях головного и спинного мозга, а также периферических нервов.
Аффективные расстройства – расстройства, связанные с нарушением настроения. Их разделяют на маниакальные и депрессивные состояния.
Для маниакальных состояний характерно повышенно радостное настроение, стремление к деятельности, ускорение темпа мышления.
Для депрессивного состояния типично пониженное, тоскливое настроение, замедление мышления.
Дисфория – периодические расстройства настроения – состояние тоскливой злобности, придирчивости, беспокойства, агрессивности или приподнятости, оживления, веселости. Замещают судорожный припадок, разряжают скопившееся болезненное напряжение, и называют психическими эквивалентами эпилепсии.
Катаракта – помутнение хрусталика глаза, который приводит к ухудшению зрения.
Шизофрения – психическая болезнь с тенденцией к хроническому течению. Причина болезни неизвестна, нередко отмечается наследственная передача.
Атаксия – тип двигательного расстройства, при котором нарушается координация движений.
Серотонин – медиатор, выделяющиеся при торможении всех отделов центральной нервной и периферической системы, суживает сосуды и угнетает центральную нервную систему.
Микседема – состояние, развивающееся в результате снижения или полного выпадения функции щитовидной железы. Может возникать в результате нарушений внутриутробного развития или внутриутробной инфекции, реже в результате воспаления щитовидной железы, ее травмы.
Гипотензивные средства – лекарственные вещества, понижающие артериальное давление. Снижают тонус кровеносных сосудов, что ведет к их расширению и, т. о., к уменьшению артериального давления.
Гипотензия, гипотония – термины, используемые в биологии и медицине для обозначения пониженного уровня давления жидкости (крови, лимфы) в сосудах и снижения напряжения мышц.
Глюкокортикоиды – гормоны коры надпочечников, влияющие прежде всего на углеводный, белковый и жировой обмен: гидрокортизон, кортизон и кортикостерон.
Абстиненция – состояние, возникающее в результате резкого прекращения введения веществ, вызывавших наркоманическую зависимость.
Астенический синдром – состояние, проявляющееся повышенной утомляемостью и истощаемостью, ослаблением или утратой способности к продолжительному физическому и умственному напряжению.
Генез – происхождение какой – либо структуры в онтогенезе или филогенезе.
Дисфункция – нарушение функции системы, органа или ткани организма, выражающееся неадекватностью реакции на действие раздражителей.
Вегетативный – относящийся к вегетативной нервной системе.
Гематоэнцефалический барьер – (гемато + аналит.encephalon – головной мозг) гистогематический барьер между кровью, с одной стороны, и цереброспинальной жидкостью и нервной тканью с другой.
Вертебрально – базилярная недостаточность – недостаточность кровообращения в системе позвоночных и базилярной артерий, возникающая при их стенозе с недостаточностью коллатерального кровообращения, аномалиях развития артерий, при остеохондрозе шейного отдела позвоночных; характеризуется преимущественно симптомокомплексом повторных преходящих нарушений кровообращения в стволе головного мозга (системным головокружением, атаксией при ходьбе).
Инсомния – (бессонница, ансомния, агрипния, диссомния) – расстройство сна, проявляющееся нарушением засыпания, прерывистым, поверхностным сном или преждевременным пробуждением.
Гипоманиакальное состояние (гипомания) – состояние, характеризующееся легко выраженными признаками маниакального синдрома в форме оптимистически – радостного настроения, повышенного самочувствия, стремления к деятельности, в некоторых случаях сопровождается повышением трудоспособности.
Дофамин (окситирамин) – биологически активное вещество из группы пирокатехинаминов, представляющее собой продукт декарбоксилирования 3-4-диоксифенилаланина; возможный медиатор центральной нервной системы.
Гипобулия – состояние психики, характеризующееся снижением желаний и побуждений к деятельности.
Литература
Машковский М.Д, Лекарственные средства,-Вильнюс:1994г.
Машковский М.Д, Лекарства ХХ века, - М.:1998г
Фармакология ноотропов: сборник трудов под редакцией А.В.Вальдмана. 1989г. Статья “Экспериментальная психофармакология ноотропов, Т.А. Воронина”
Максимович Я.Б, Гайденко А.И, Прописывание, несовместимость и побочное действие лекарственных средств, - К.:1988г.
Машковский М.Д, Фармакология и токсикология, - М.:1988г.
Мосолов С.Н, Основы психофармакотерапии, - М.:1996г.
Филипп Дж. Яничак, Джон М. Дэвис, Шелдон Х. Прескорн, Фрэнк Дж. Айд Мл, Принципы и практика психофармакотерапии, - К.:1999г.
Машковский М.Д, Лекарственные средства, - М.:2000г. Часть1.
Гусев Е.И, Дробышева Н.А, Никифоров А.С, Лекарственные средства в неврологии, - М.:1998г
Лоуренс Д. Р, Бенитт П.Н, Клиническая фармакология, - М.:1991г. Том 2.
Влох І.Й., Михняк С.І., Сувало Б.П, Довідник з терапії психічних захворювань
Фармакологія под. ред. І. С.Чекмана, К.:Вища школа, 2001.
В.П. Шамшин, В.Г. Воронин, Синтез карбамазепина и его антиалкагольное действие // Химко-фармацевтический журнал. – 1987,-т21, -№6.- с 711-716.
А..Г. Байчиков, М.В.Рубцов, Синтетические химико-фармацевтические препараты, - М.:Медицина, 1971.
Синтез углерод – 14- и меченой тритием 4-амино-3-(4-хлорфенил) бутановой кислоты (Баклофена).Kung W., Faigle J.W.,”J.Labelled Compounds and Radiopharm.”, 1983, 20, №2, 213 – 231
16. Популярная медицинская энциклопедия, – М.:Советская Энциклопедия,1979. – 704 с.
17. http://powerlifting.nm.ru/sait/farma/steroid/nootoropil.htm
18. Международная фармакопея , 1981. Т 3.
19. Энциклопедический словарь медицинских терминов, М.:Советская энциклопедия, 1983.
20. Быкова В.В, Количественное определение сиднофена и ацефена на основе их реакций с фосфовольфрамовой кислотой// Исследование лекарственных веществ и обеспечение ими населения. - Свердловск: 1983. - с 79-82.
21. Метод определения некоторых ЛВ, содержащих сложноэфирные группировки. Bajgar I, Patocka I, Vachek I. “Cs. farm.», 1974, 23. - №9 – с.370-372.
22. Копилевич В.М. и др. А.с.325232 СССР// Открытия. – 1972-№3.

Нравится материал? Поддержи автора!
Ещё документы из категории медицина, здоровье:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ