Методические указания к выполнению контрольных работ для студентов заочной формы обучения специальностей

 Государственное образовательное учреждение
Государственное образовательное учреждение
высшего профессионального образования
«ПЕТЕРБУРГСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПУТЕЙ СООБЩЕНИЯ
МИНИСТЕРСТВА ПУТЕЙ СООБЩЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ»
Кафедра «Инженерная химия и естествознание»
Х И М И Я
Методические указания
к выполнению контрольных работ
для студентов заочной формы обучения
специальностей
ПТМ, ПТЭ, МТ, СЖД, ПГС, ВиВ, УПП, ЭУС, ЭУТ
Часть 2
САНКТ-ПЕТЕРБУРГ
2006
ХИМИЯ РАСТВОРОВ
Раствором называется термодинамически устойчивая гомогенная система переменного состава, состоящая из двух или более компонентов.
Компонентом называется химически однородная часть системы, способная существовать вне ее.
В дальнейшем все рассмотрения будут касаться двух компонентных растворов, состоящих из растворителя и растворенного вещества.
Тот компонент, который сохраняет свое агрегатное состояние, принимается за растворитель.
Если оба компонента сохраняют свое агрегатное состояние, то за растворитель принимается тот компонент, которого больше.
Согласно Д.И. Менделееву, образование раствора протекает в три стадии:
Дробление растворяемого вещества до отдельных молекул. Эта стадия требует энергетических затрат и ее тепловой эффект (ΔH1) положителен.
Сольватация. Процесс взаимодействия молекул растворяемого вещества с молекулами растворителя. Если растворитель вода, то этот процесс называется гидратация. На этой стадии энергия выделяется и ее тепловой эффект (ΔH2) отрицателен.
Диффузия сольватированных (гидратированных) молекул растворяемого вещества в толщу растворителя. На этой стадии тепловой эффект отсутствует.
Таким образом, тепловой эффект растворения складывается из двух величин (ΔH1 и ΔH2) и может быть как положительным, так и отрицательным в зависимости от соотношения первых двух стадий растворения т.е.:
ΔHраств = ΔH1 + ΔH2 1.1
Растворимость
Мерой растворимости вещества служит величина, называемая растворимость и обозначаемая Р. Ее определяют следующим образом: растворимость (Р) есть число грамм вещества способного раствориться в 100 граммах растворителя. Растворимость меняется с изменением температуры. Если ΔHраств >0, то с повышением температуры растворимость растет. Если ΔHраств <0, то с повышением температуры растворимость уменьшается.
С точки зрения растворимости все растворы делятся:
разбавленные, когда растворенного вещества в растворе меньше чем его растворимость;
насыщенные, когда количество растворенного вещества совпадает с его растворимостью;
пересыщенные, когда растворенного вещества в растворе больше чем его растворимость.
Как известно, все вещества растворяются по-разному:
Вещество считается хорошо растворимым или просто растворимым, если его растворимость больше или равна 1 (
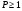 ).
).Вещество считается малорастворимым, если
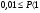 .
.Вещество считается трудно растворимым, если
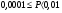 .
.Вещество считается нерастворимым, если.
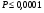 .
.
Способы выражения концентрации.
Однако, выше приведенные классификации растворов не дают количественной меры содержания вещества в растворах, особенно в разбавленных. Поэтому вводят понятие концентрации раствора.
Концентрацией раствора называется количество растворенного вещества, содержащегося в определенном объеме или массе раствора или растворителя.
Наиболее употребительными являются следующие способы выражения концентрации растворов:
1. Массовая доля. Она показывает отношение массы растворенного вещества к массе раствора. Если массовая доля выражена в процентах, то на практике ее называют процентной концентрацией. Она показывает, сколько грамм растворенного вещества содержится в 100 граммах раствора и обозначается - %
2. Моляльная или моляльность. Она показывает, сколько молей растворенного вещества приходится на килограмм растворителя. Чаще всего ее обозначают m и она имеет размерность М/кг или М/1000г.
3. Молярная или молярность. Она показывает, сколько молей растворенного вещества содержится в 1-ом литре раствора. Ее обозначают М и она имеет размерность М/л.
4. Нормальная или нормальность. Она показывает, сколько моль эквивалентов растворенного вещества содержится в литре раствора. Ее обозначают Н и она имеет размерность Моль Эквивалент/л (МЭ/л).
5. Мольная доля. Она показывает долю молекул данного сорта от общего количества молекул раствора. Ее обозначают xi . Индекс 1 всегда относится к растворителю. Сумма всех мольных долей раствора равна 1, т.е.:
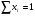 . 1.2
. 1.2
Однако, часто вместо xi для обозначения мольной доли используется Ni.
В случаях, когда способ выражения концентрации явно не указан, то исполь-зуется моляльность.
Закон эквивалентов для растворов имеет вид:
V1*C1=V2*C2 1.3
Где: V1,V2-объемы 1-го и 2-го растворов, соответственно,
С1,С2-нормальные концентрации 1-го и 2-го раствора, соответственно.
Пример 1. Сколько миллилитров 0,3Н раствора NaCl надо прибавить к 150 мл 0,16Н раствора AgNO3, чтобы осадить все находящееся в растворе серебро в виде AgCl?
РЕШЕНИЕ. Обозначим неизвестный объем раствора NaCl через x и составим пропорцию: x * C1 = V2 * C2;
X * 0,3 = 150 * 0,16;
X = 150 * 0,16/0,3 = 80 мл
Пример 2. Какова молярность 6Н раствора Al2(SO4)3?
РЕШЕНИЕ. 6Н концентрация означает, что в 1000 мл раствора содержится 6 моль эквивалентов Al2(SO4)3. Моль эквивалентная масса Al2(SO4)3 = (мольная масса)/(3*2), т.е. один моль эквивалент Al2(SO4)3 в шесть раз меньше его мольной массы. Следовательно, если в 1000 мл раствора содержится 6 моль эквивалентов Al2(SO4)3, то это соответствует 1 М концентрации ( 1 молю в 1000мл раствора).
Пример 3. Сколько миллилитров H2SO4 с концентрацией 14,35%,имеющей плотность d = 1,14 мл, потребуется для приготовления 250 мл 0.1Н раствора?
РЕШЕНИЕ. 0,1Н концентрация означает, что в 1000 мл раствора содержится 0,1 моль эквивалент H2SO4, а в 250 мл – 0,025 моль эквивалента:
1000 мл – 0,1 Э
250мл - x x = 250 * 0,1/1000 = 0,025, т.к моль эквивалентная масса H2SO4 98:2 = 49 г/моль, масса H2SO4 будет 49 * 0,025 = 1,225 г. 14,35%-ная концентрация означает, что в 100 граммах раствора содержится 14,35 г H2SO4:
100 г – 14,35 г H2SO4
x г – 1,225 г
x = 1,225 * 100/14,35 = 8,54 г.
Плотность раствора d = 1,1 г/мл, следовательно, 8,54 г соответствуют 8,54/1,1 = 7,76 мл.
Пример 4. Сколько граммов Ca(OH)2 надо взять для приготовления300 г 25%-го раствора?
РЕШЕНИЕ. Необходимо приготовить 25%-ный раствор, т.е. по определению процентной концентрации, в 100 г раствора должно содержаться 25 г Ca(OH)2. Тогда в 300 г раствора должно содержаться (300 * 25) / 100 = 75 г Ca(OH)2 и соответственно 225 г воды.
Пример 5. Сколько грамм H2SO4 потребуется для приготовления 5 л 0,3 М раствора ?
РЕШЕНИЕ. По определению молярной концентрации, в 1 л раствора должно содержаться 0,3 моля H2SO4, тогда в 5 л : 0,3 * 5 = 1,5 моля, что составляет 98 * 1,5 = 147 г H2SO4, где 98 г/моль – мольная масса H2SO4.
ОТВЕТ: 147 г H2SO4 потребуется для приготовления 5 л 0,1М раствора.
Пример 6. Какова мольная доля (x2) 10% раствора КОН ?
РЕШЕНИЕ. В 100 граммах раствора содержится 90 грамм Н2О и 10 грамм КОН. Количество молей воды (n1) = 90/18 =5, количество молей КОН (n2) = 10/56=0.1786, где 18 и 56 молекулярные массы Н2О и КОН, соответственно. Число молекул воды в 100 граммах такого раствора =n1*NA, число молекул КОН =n2*NA, где NA –число Авогадро. Тогда общее число молекул в 100 граммах такого раствора = (n1 + n2)*NA и, следовательно, 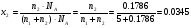
Пример 7. Чему равна моляльность, молярность, нормальность и мольные доли 48% раствора H2SO4, плотность которого d=1.38 г/см3 ?
РЕШЕНИЕ. Допустим, что имеется 1 литр такого раствора. Тогда его масса = 1000*1.38=1380 г. Масса H2SO4(m2) в этом растворе составляет m2 = 1380*0.48=662.4 г, а масса воды m1 =1380-662.4=717.6 г. определим, какая масса H2SO4 приходится на 1000 г воды. Для этого решим пропорцию:
662.4 г H2SO4 приходится на 717.6 г воды
X г H2SO4 приходится на 1000 г воды
Откуда X=923.077 г. Разделив это число на молекулярную массу H2SO4, мы получим моляльность раствора, т.е.: 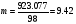 М/кг. Для определения молярности нужно массу H2SO4 разделить на величину ее молекулярной массы, т.е.
М/кг. Для определения молярности нужно массу H2SO4 разделить на величину ее молекулярной массы, т.е. 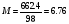 М/л. так как МЭH2SO4 =
М/л. так как МЭH2SO4 =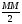 , то нормальность получим, умножив молярность на 2, т.е.
, то нормальность получим, умножив молярность на 2, т.е. 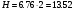 МЭ/л. для нахождения мольных долей, определим сначала число молей воды (n1) и H2SO4 (n2): очевидно,
МЭ/л. для нахождения мольных долей, определим сначала число молей воды (n1) и H2SO4 (n2): очевидно, 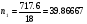 , а
, а 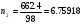 , тогда (см. пример 6)
, тогда (см. пример 6) 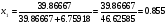 03,
03, 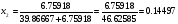
В дальнейшем, для разбавленных растворов будет использоваться, в основном, молярность, а не моляльность, поскольку для разбавленных растворов эти величины достаточно близки друг к другу.
Свойства растворов
Все растворы обладают некоторыми свойствами, которые практически зависят только от соотношения числа частиц компонентов раствора и не зависят от природы частиц. Общие свойства раствора – это свойства идеального раствора.
Идеальным называется раствор, образованный компонентами, имеющими строго одинаковые размеры частиц и строго одинаковую энергию межмолекулярного взаимодействия.
Основными законами, описывающими свойства растворов, являются: закон Генри, законы Рауля (1-й, 2-ой, 3-ий), осмотический закон Вант-Гоффа. Следует отметить, что эти законы выполняются только для разбавленных растворов.
Все растворы независимо от агрегатного состояния обладают способностью к диффузии. Диффузией называется свойство вещества равномерно распределяться по всему предоставленному ему объему. Скорость диффузии (скорость выравнивания концентрации по объему) в газах велика, в твердых телах при обычных температурах диффузия длится годы. В растворах диффузия протекает за десятки часов, для небольших порядка литра объемов раствора.
Если в сосуд налить концентрированный раствор, а сверху добавить чистый растворитель, то начнется процесс диффузии, как растворителя, так и растворенного вещества до полного выравнивания концентрации по всему объему.
Можно создать условия, когда диффузия идет только по растворителю. Для этого разделим раствор и чистый растворитель пленкой, через которую могут проходить только молекулы растворителя. Такие пленки называются полупроницаемыми мембранами.
Процесс односторонней диффузии растворителя через полупроницаемую мембрану называется осмосом.
При односторонней диффузии растворителя в раствор, объем последнего начинает увеличиваться, что влечет за собой увеличение гидростатического давления, которое препятствует диффузии растворителя. При некотором давлении наступает равновесие: сколько молекул растворителя проникло в раствор, столько же выталкивается из него увеличившимся давлением.
Равновесное давление раствора, препятствующее диффузии растворителя через полупроницаемую мембрану, называется осмотическим давлением.
Осмотический закон Вант-Гоффа.
Вант-Гофф показал, что для разбавленных растворов независимо от природы растворителя и растворенного вещества математическое выражение для осмотического давления имеет вид:
Росм = CRT 1.4
где: Росм – осмотическое давление, С – молярная концентрация раствора, Т – абсолютная температура, R – универсальная газовая постоянная. При этом, если концентрация имеет размерность М/л, то осмотическое давление получается в КПа.
Осмотический закон Вант-Гофф сформулировал так:
Осмотическое давление разбавленных идеальных растворов численно равно тому давлению, которое оказывало бы растворенное вещества, если бы при данной температуре оно занимало объем раствора и находилось в газообразном состоянии. Схема осмоса приведена на рис.1.
Рис.1 Схема осмоса через полупроницаемую мембрану. 1 – полупроницаемая мембрана, 2 – растворитель, 3 – раствор. а – начальное состояние системы, б – конечное.
Закон Генри.
Этот закон определяет растворимость летучих веществ (газов) и формулируется: при данной температуре концентрация растворенного газа пропорциональна его парциальному давлению. Математическое выражение этого закона имеет вид:
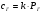 1.5
1.5
где: СГ – концентрация газа в растворе, РГ его парциальное давление, к – константа Генри, зависящая от природы растворителя и газа.
Следствия из закона Генри:
Объем растворенного газа не зависит от давления. Действительно, пусть в каком-то объеме растворителя (Vр-тель) при температуре Т и давлении Р растворилось n молей газа. Объем растворившегося газа VГ равен
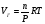 . Из закона Генри следует, что
. Из закона Генри следует, что 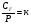 , но
, но 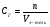 , откуда
, откуда 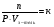 и
и 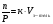 . При постоянной температуре Vз-тель =const, а значит n/P=const и VГ =const·RT не зависит от давления. Поэтому растворимость газа в жидкостях характеризуют отношением объема газа к объему растворителя – обычно числом миллилитров газа, растворяющихся в 1 л растворителя.
. При постоянной температуре Vз-тель =const, а значит n/P=const и VГ =const·RT не зависит от давления. Поэтому растворимость газа в жидкостях характеризуют отношением объема газа к объему растворителя – обычно числом миллилитров газа, растворяющихся в 1 л растворителя.при растворении смеси газов растворимость каждого из них пропорциональна его парциальному давлению в газовой фазе.
Эти следствия справедливы лишь для разбавленных растворов, а также, если газ или смесь газов находятся при сравнительно низком давлении и подчиняется законам идеального газа.
1-й закон Рауля.
Общим для всех жидких растворов свойством является понижение давления насыщенного пара компонентов по сравнению с соответствующими характеристиками чистых веществ. Количественно связь между концентрацией летучего вещества в идеальном растворе и давлением его пара над раствором выражается законом Рауля:
При постоянной температуре давление насыщенного пара компонента идеального раствора пропорционально его мольной доле в растворе.
Математическое выражение этого закона имеет вид:
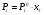 1.6
1.6
где: Pi – парциальное давление летучего компонента над раствором, 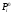 - давление насыщенного пара чистого компонента,
- давление насыщенного пара чистого компонента, 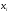 - мольная доля компонента.
- мольная доля компонента.
В случае, когда растворяется нелетучее вещество, то математическое выражение закона Рауля можно представить в виде:
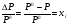 1.7
1.7
где: Р0 и Р – давление пара растворителя над чистым растворителем и раствором, соответственно; 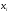 - мольная доля растворенного вещества (см. рис.2).
- мольная доля растворенного вещества (см. рис.2).
2-ой и 3-ий законы Рауля
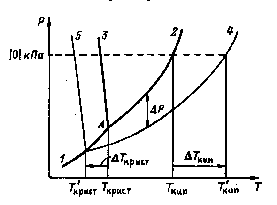
Понижение давления пара растворителя над раствором приводит к изменениям температур кипения и кристаллизации растворов. Отметим, что любая жидкость кипит тогда и только тогда, когда давление ее паров равняется внешнему. Любая жидкость кристаллизуется тогда и только тогда, когда давление ее паров равно давлению над твердой фазой.
Рассмотрим эти изменения на примере системы, состоящей из нелетучего растворенного вещества и растворителя, в которой не происходит образования твердых растворов при кристаллизации. Например, раствор сахара или NaCl в воде.
Вид диаграммы состояния такого рода систем в координатах Р, Т приведен на рис.2. на этой диаграмме различия между линиями 2 и 4, 3 и 5 утрированно велики.
Вблизи тройной точки (А на рис.2) диаграмма состояния любой системы, приведенная на рис.2, представляется тремя пересекающимися линиями: 1 – линия равновесия твердое – газ, 2 – линия равновесия жидкость – газ, 3 – линия
Рис.2 Р-Т диаграммы для растворителя и раствора.
равновесия жидкость – твердое. На этом же рисунке приведены линии соответствующих равновесий для раствора: 4 – линия равновесия жидкость – газ, 5 – линия равновесия жидкость – твердое. Поскольку в системе отсутствуют твердые растворы, то линия равновесия твердое – газ для раствор совпадает с таковой для чистого растворителя. Так как 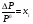 и не зависит от температуры, то при увеличении Р0 увеличивается и ΔР, поэтому линии 2 и 4 с ростом температуры расходятся.
и не зависит от температуры, то при увеличении Р0 увеличивается и ΔР, поэтому линии 2 и 4 с ростом температуры расходятся.
Линия 4 пересекает линию 1 при такой температуре, которая обязательно лежит ниже тройной точки А, следовательно, температура кристаллизации растворителя из раствора (линия 5) всегда ниже, чем для чистого растворителя.
При повышении температуры давление пара растворителя над раствором растет и, когда оно достигнет внешнего давления, раствор кипит. Поскольку давление пара растворителя над раствором всегда ниже, чем для чистого растворителя, то равенство давлений пара и внешнего будет достигнуто при более высокой, чем для чистого растворителя, температуре. Следовательно, температура кипения раствора всегда выше, чем для чистого растворителя.
2-й закон Рауля рассматривает из изменения температуры кипения раствора относительно чистого растворителя, математическое выражение его имеет вид:
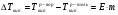 1.8
1.8
где: 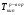 ,
, 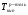 - температуры кипения раствора и растворителя, соответственно, Е – эбулиоскопическая постоянная (для воды Е=0,52), m – моляльная концентрация раствора.
- температуры кипения раствора и растворителя, соответственно, Е – эбулиоскопическая постоянная (для воды Е=0,52), m – моляльная концентрация раствора.
3-й закон Рауля рассматривает изменения температуры кристаллизации раствора относительно чистого растворителя, математическое выражение его имеет вид:
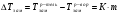 1.9
1.9
где 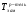 ,
, 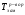 - температуры замерзания (кристаллизации) растворителя и раствора, соответственно, К – криоскопическая постоянная (для воды К=1,86), m – моляльная концентрация раствора.
- температуры замерзания (кристаллизации) растворителя и раствора, соответственно, К – криоскопическая постоянная (для воды К=1,86), m – моляльная концентрация раствора.
2-й и 3-й законы Рауля можно сформулировать совместно:
Повышение (понижение) температуры кипения (кристаллизации) раствора относительно чистого растворителя пропорциональны его моляльной концентрации.
Следствия из 2-го и 3-го законов Рауля:
раствор любого твердого (нелетучего) вещества, в отличие от чистого растворителя, не имеет постоянной температуры кипения. Действительно, при кипении такого раствора испаряется растворитель, что влечет за собой увеличение концентрации раствора. Последнее приводит к увеличению температуры кипения.
раствор любого твердого (нелетучего) вещества, в отличие от чистого растворителя, не имеет постоянной температуры кристаллизации, поскольку в первую очередь кристаллизуется растворитель, что приводит к росту концентрации и, как следствие, к понижению температуры кристаллизации раствора.
Пример 8. При какой температуре начнет кипеть и замерзать раствор неэлектролита, содержащий 0,3 моля вещества в 100 г воды? К = 1,86, Е = 0,52.
РЕШЕНИЕ. С начала определим моляльную концентрацию раствора. Она равна (см. определение моляльности) 0,3/0,1 = 3 m. Далее вычислим изменения температур кипения и замерзания раствора по формулам 1.8 и 1.9:
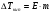 = 0,52*3 = 1,56
= 0,52*3 = 1,56
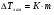 = 1,86*3 = 5,58
= 1,86*3 = 5,58
и, наконец, определим температуры кипения и замерзания раствора по шкале Цельсия, для этого воспользуемся теми же формулами 1.8 и 1.9:
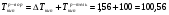 ˚С
˚С
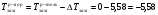 ˚С
˚С
Пример 9. Чему равно осмотическое давление раствора неэлектролита, содержащего 0,1 М в 100 мл воды при 20˚С ?
РЕШЕНИЕ. Сначала определим молярную концентрацию раствора Она, очевидно, равна 1 М. Затем определим температуру в абсолютной шкале Кельвина, она равна 20+273 = 293˚К. после этого по формуле 1.4 вычислим осмотическое давление:
Росм = CRT =1*8,3143*293 = 2436,0899 ≈2436 КПа.
Растворы электролитов.
При изучении законов Рауля и Вант-Гоффа скоро выяснилось, что многие вещества дают отклонения от этих законов, причем всегда в положительную сторону. Вант-Гофф даже ввел поправочный коэффициент i, который он назвал изотонический. К тому же растворы таких веществ проводят электрический ток. Поэтому такие растворы назвали растворами электролитов. Электролит – вещество, раствор или расплав которого проводит электрический ток. Таким образом, для растворов электролитов законы имеют вид:
Росм = iCRT 1.10
где: Росм – осмотическое давление, i – изотонический коэффициент, С – молярная концентрация раствора, Т – абсолютная температура, R – универсальная газовая постоянная.
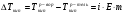 1.11
1.11
где: 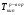 ,
, 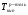 - температуры кипения раствора и растворителя, соответственно, i – изотонический коэффициент, Е – эбулиоскопическая постоянная (для воды Е=0,52), m – моляльная концентрация раствора.
- температуры кипения раствора и растворителя, соответственно, i – изотонический коэффициент, Е – эбулиоскопическая постоянная (для воды Е=0,52), m – моляльная концентрация раствора.
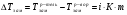 1.12
1.12
где 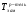 ,
, 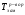 - температуры замерзания (кристаллизации) растворителя и раствора, соответственно, i – изотонический коэффициент, К – криоскопическая постоянная (для воды К=1,86), m – моляльная концентрация раствора.
- температуры замерзания (кристаллизации) растворителя и раствора, соответственно, i – изотонический коэффициент, К – криоскопическая постоянная (для воды К=1,86), m – моляльная концентрация раствора.
Чтобы объяснить эти факты, Сванте Аррениус предположил, что электролиты в растворе под действием растворителя распадаются на ионы. Этот процесс он назвал электролитической диссоциацией, т.е. ApBq→pA+ + qB-. Однако, такой подход приводит к тому, что изотонический коэффициент должен быть целочисленным, что противоречит опытным данным. Тогда он предположил, что наряду с процессом электролитической диссоциации идет обратный процесс, названный им процессом электролитической ассоциации, т.е. pA+ + qB- →ApBq. Так как в растворе эти процессы протекают одновременно, то устанавливается равновесие:
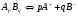 1.13
1.13
В качестве характеристики этого равновесия Аррениус ввел степень электролитической диссоциации α, которую определил так:
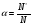 , где N* - число молекул электролита, распавшихся на ионы, N – исходное число молекул электролита. α меняется от 0 до 1 или от 0% до 100%. Степень диссоциации электролита зависит от его концентрации и природы как электролита, так и растворителя.
, где N* - число молекул электролита, распавшихся на ионы, N – исходное число молекул электролита. α меняется от 0 до 1 или от 0% до 100%. Степень диссоциации электролита зависит от его концентрации и природы как электролита, так и растворителя.
Связь между α и i имеет для электролита ApBq вид:
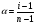 1.14
1.14
где: α – степень электролитической диссоциации, i –изотонический коэффициент, n – число ионов, на которые распадается электролит (для электролита ApBq n=p+q).
Таким образом, по величине осмотического давления или по температурам кипения и замерзания раствора электролита можно определить его степень диссоциации, сравнив экспериментальные величины с рассчитанными по формулам для идеальных растворов неэлектролитов. Однако, определенную таким образом степень диссоциации называют кажущейся степенью диссоциации. Причины этого будут рассмотрены ниже.
Пример 10. Раствор, содержащий 0,85 г ZnCl2 в 125 г воды, замерзает при –0,23оC. Определить кажущуюся степень диссоциации, если Kкр =1,86.
РЕШЕНИЕ. Находим моляльную концентрацию m соли в растворе. Поскольку мольная масса ZnCl2 = 65 + 35,2 = 136 г/моль, то m = (0,85 * 1000):(136 * 125) = 0,05 моль/кг; определим понижение температуры замерзания: tзам = Kкр * m = 1,86 * 0,05 = 0,093оC; сравним найденное tзам с экспериментальным:
i = tзам.эксп./tзам = 0,23/0,093 = 2.47.
Теперь находим кажущуюся степень диссоциации: = (i – 1)(n – 1), для ZnCl2 (Zn2+ + 2Cl-) n = 3, = (2,47 – 1)(3 – 1) = 0,735.
Дальнейшее развитие теория растворов электролитов получила после появления фундаментальных работ по сольватации, согласно которым процесс электролитической диссоциации протекает с образованием сольватированных (гидратированных) ионов. Например, процесс диссоциации HNO3 в воде будет протекать следующим образом:
HNO3 + (n+m)H2O H+·nH2O + NO3-·mH2O.
Однако, в дальнейшем, для упрощения записей вода будет опущена.
Электролитическая диссоциация зависит от растворителя: одно и тоже вещество в одном растворителе диссоциирует хорошо, а в другом - плохо. Например, NaI в воде диссоциирует нацело, а в ацетоне – очень плохо. Поэтому, в дальнейшем, рассматривать будем только водные растворы электролитов.
Все водные растворы электролитов по степени диссоциации можно разбить на три группы:
Сильные электролиты, степень диссоциации которых α>0,3 (α>30%). К ним относятся все растворимые соли, кроме солей Hg, все щелочи, и ряд кислот, например: H2SO4, HNO3, HCl, HBr, HI, HClO3, HClO4, HMnO4, H2CrO4, H2Cr2O7. Отметим, что, несмотря на то, что AgOH не существует, он бы был сильным электролитом.
электролиты средней силы, степень диссоциации которых 0,03<α≤0,3 (3%<α≤30%). К ним можно отнести H2SO3, H3PO4, HF.
слабые электролиты, степень диссоциации которых α≤0,03 (α≤3%). К ним относятся все нерастворимые основания, все органические электролиты, например уксусная кислота (СН3СООН), NH4OH, H2CO3, HClO, HCN, H2S, H2SiO3, HNO2, H2O.
Закон разбавления Оствальда.
Диссоциация сильных электролитов в водных растворах протекает нацело. Остальные электролиты диссоциируют обратимо и, следовательно, к их процессу диссоциации может быть применен закон действия масс. Так, например, для процесса диссоциации уксусной кислоты
CH3COOH CH3COO- + H+
константа равновесия, которую для процессов диссоциации называют константой диссоциации КД, будет равна:
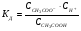 1.15
1.15
Константа диссоциации зависит от природы растворителя и электролита, а также от температуры, и не зависит от концентрации раствора.
Поскольку степень диссоциации электролита зависит от его концентрации, выясним эту зависимость. Для этого рассмотрим процесс диссоциации уксусной кислоты. Допустим, имеется раствор уксусной кислоты, концентрация которого равна С, а степень электролитической диссоциации – α. Тогда число продиссоциированных молекул уксусной кислоты будет равно α·С, а концентрации аниона и катиона одинаковы и равны α·С. равновесная концентрация нераспавшихся молекул уксусной кислоты будет равна (1-α)С. Подставив эти величины в выражение для константы диссоциации, получим:
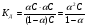 1.16
1.16
Это уравнение известно как закон разбавления Оствальда.
Для слабых электролитов α«1 и (1-α)≈1. Тогда
КД≈α2С и 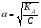 1.17
1.17
Следовательно, для любого электролита можно задать такую концентрацию, когда степень электролитической диссоциации будет больше 0,3 (30%). Поэтому электролиты по силе сравнивают при одинаковой концентрации, чаще всего при 0,1Н.
Для более сложных электролитов таких, как, например, Н3РО4 процесс диссоциации протекает по стадиям (ступенчато):
1-ая стадия (ступень)
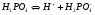
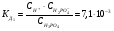 .
.
Если 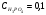 m, то, как можно рассчитать, используя закон разбавления Оствальда и значение КД, α≈0,1 (10%).
m, то, как можно рассчитать, используя закон разбавления Оствальда и значение КД, α≈0,1 (10%).
2-ая стадия (ступень)
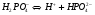
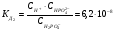 .
.
Допустим, что существует соединение 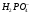 , тогда при его концентрации 0,1 m α≈0,002 (0,2%).
, тогда при его концентрации 0,1 m α≈0,002 (0,2%).
3-ая стадия (ступень)
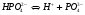
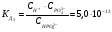 .
.
Как правило, для такого рода электролитов отношение значений предыдущей константы диссоциации к последующей (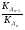 ) равно примерно 105.
) равно примерно 105.
Сильные электролиты.
Как уже упоминалось выше, сильные электролиты в растворе диссоциируют нацело, что приводит к высокой концентрации ионов в растворе. Поэтому свойства таких растворов будут существенно зависеть от степени взаимодействия входящих в их состав ионов как друг с другом, так и с полярными молекулами растворителя. Из-за взаимного притяжения разноименных и отталкивания одноименно заряженных ионов каждый произвольно выбранный ион будет окружен в среднем по времени противоположно заряженными ионами, как в ионных кристаллах. Однако, из-за энергии теплового движения ионов, которая в растворах значительно выше, чем в кристаллах, ионы, взаимодействующие с выбранным центральным ионом, располагаются в виде сферы, которая называется ионная атмосфера. Ионные атмосферы обладают следующими особенностями:
1 - в их состав входят как катионы, так и анионы, с преобладанием ионов противоположных по знаку центральному.
2 - суммарный заряд ионной атмосферы равен заряду центрального иона и противоположен по знаку.
3 - все ионы в растворе равноправны, поэтому каждый из них является центральным и одновременно входит в состав ионной атмосферы другого иона.
4 - за счет теплового движения ионы, входящие в состав ионной атмосферы, постоянно меняются местами с ионами, находящимися за ее пределами, т.е. ионная атмосфера носит статистический характер.
С увеличением концентрации электролита радиус ионной атмосферы уменьшается, что приводит к возрастанию вероятности существования ионных пар, так называемых ионных двойников и тройников, отличие которых от молекул заключается в большей длине связи и наличия взаимодействующих с ионной парой молекул растворителя. Одновременно меняется и сольватация.
Таким образом, с увеличением концентрации приводит к возрастанию близкодействующих сил химической связи. Поэтому с ростом концентрации увеличивается различие в свойствах растворов электролитов одинаковой концентрации, но разного химического состава и, следовательно, законы идеальных растворов для растворов электролитов оказываются неприменимыми.
Чтобы можно было пользоваться законами для идеальных растворов в случае растворов электролитов, Льюис в 1907 г. ввел представление об эффективной концентрации, которую он назвал активностью. Активность (а) связана с концентрацией простым соотношением:
a = γC 1.18
где γ – коэффициент активности, С – концентрация.
Коэффициент активности учитывает все виды взаимодействия частиц в растворе, приводящие к отклонению его свойств от свойств идеального раствора. Так как коэффициент активности учитывает также степень диссоциации электролита, то их применяют и при описании свойств растворов слабых электролитов.
Если в уравнения, отражающие законы Рауля, Вант-Гоффа и др., вставить активность вместо концентрации, то эти уравнения остаются справедливыми и для растворов электролитов любой силы.
Коэффициенты активности вычисляют по экспериментальным данным. Для этого измеряют какое-либо из свойств раствора, например температуру кипения, и определяют коэффициент активности как частное от деления экспериментальной величины на теоретически рассчитанную по законам идеальных растворов:
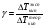 1.19
1.19
где: γ – коэффициент активности, 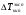 - экспериментальная величина,
- экспериментальная величина, 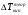 - теоретическая величина.
- теоретическая величина.
Приведенный метод позволяет определить лишь значения средних коэффициентов активности электролита. В настоящее время не существует методов, позволяющих определять коэффициенты активности отдельных ионов. При необходимости расчета этих величин принимают, что средний коэффициент активности электролита представляет собой среднее геометрическое коэффициентов активности образующих его ионов. Так для электролита AnBm
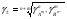 1.20
1.20
Коэффициенты активности зависят от природы растворителя и растворенного вещества, от концентрации раствора и температуры. В таблице 1 приведены экспериментальные средние коэффициенты активности некоторых электролитов.
Табл.1. Средние коэффициенты активности электролитов при 298˚К.
m
 для электролитов
для электролитов
(М/кг)
NaCl
NaOH
KOH
HCl
H2SO4
CaCl2
0,001
0,966
0,966
0,966
0,966
0,830
0,840
0,01
0,904
0,900
0,900
0,904
0,544
0,580
0,1
0,778
0,776
0,800
0,796
0,265
0,518
0,5
0,681
0,693
0,730
0,758
0,154
0,448
1,0
0,657
0,679
0,760
0,809
0,132
0,500
2,0
0,668
0,700
0,890
1,010
0,128
0,792
5,0
0,874
1,060
1,670
2,380
0,208
5,89
10,0
-
3,180
6,050
-
0,559
43,0
Как видно из табл.1, коэффициенты активности по мере разбавления раствора стремятся к единице, а с ростом концентрации могут достигать больших величин.
В разбавленных растворах при концентрации меньше 0,1 m коэффициенты активности зависят в основном от заряда иона и концентрации и мало зависят от природы электролита. Эта закономерность известна в теории растворов как правило ионной силы. Согласно этому правилу ионы одинаковой зарядности при одной и той же ионной силе имеют одинаковые коэффициенты активности.
Ионной силой раствора называется полусумма произведений концентраций всех ионов раствора на квадрат их заряда:
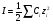 1.21
1.21
где: I – ионная сила, Ci – концентрация иона, zi – заряд иона.
Правило ионной силы позволяет рассчитать коэффициенты активности отдельных ионов в разбавленных растворах. Коэффициенты активности ионов уменьшаются с увеличением ионной силы раствора и заряда иона (Табл.2).
Табл.2. коэффициенты активности ионов в водных растворах при 298˚К.
ионы
Коэффициенты активности для ионной силы
0,001
0,005
0,01
0,02
0,05
0,1
Однозарядные
0,966
0,927
0,902
0,872
0,826
0,786
Двухзарядные
0,843
0,693
0,605
0,505
0,369
0,278
Трехзарядные
0,798
0,638
0,544
0,439
0,297
0,203
Если вместо концентраций пользоваться активностями ионов, то и константа диссоциации для сильных электролитов имеет смысл. Так, например, для диссоциации серной кислоты:
1-ая стадия
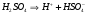
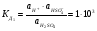 .
.
2-ая стадия
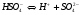
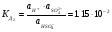 .
.
В дальнейшем коэффициенты активности и , соответственно, активность будут применяться только в самых необходимых случаях, поскольку коэффициенты активности однозарядных ионов в разбавленных растворах не сильно отличаются от единицы.
Правила написания ионных уравнений
При составлении уравнений реакций в растворах в ионной форме нужно придерживаться следующих правил:
все сильные электролиты пишутся в полностью диссоциированном виде.
при наличии в растворе электролитов разной силы, более сильный пишется в полностью диссоциированном виде, более слабый – в молекулярной (недиссоциированной) форме.
все мало растворимые и нерастворимые вещества пишутся в молекулярной (недиссоциированной) форме.
Условия протекания реакций в растворах до конца
Реакции в растворах идут до конца, если в результате реакции образуется:
более слабый электролит;
осадок;
газообразное вещество;
комплексное соединение.
Вода. Водородный показатель.
Вода является слабым электролитом. Процесс диссоциации воды имеет вид:
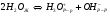 1.22
1.22
где 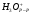 - гидратированный ион гидроксония,
- гидратированный ион гидроксония, 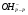 - гидратированный ион гидроксила.
- гидратированный ион гидроксила.
Обычно этот процесс записывают в предельно краткой форме:
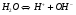 1.23
1.23
где Н+ - ион водорода, ОН- -ион гидроксила.
Константа диссоциации воды при 22˚С равна 1,8*10-16.
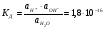 1.24
1.24
Учитывая, что при этой температуре на ионы распадается примерно одна из 108 молекул воды, активности в этом уравнении могут быть заменены на концентрации и из-за незначительности взаимодействия активность нераспавшихся молекул воды можно считать равной общей концентрации воды, которая равна 1000/18=55,5 m. При этих допущениях получим:
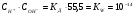 1.25
1.25
Отсюда
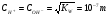 .
.
Величину КW называют ионным произведением воды, и она сохраняет свое значение, как и всякая константа, в любых растворах, содержащих воду.
Константа равновесия КW сильно зависит от температуры. Эта зависимость и концентрации ионов приведены в табл.3.
Табл.3. зависимость КW от температуры.
Т˚ К
273
293
295
298
323
353
373
КW*1014
0,11
0,68
1,0
1,11
5,55
25,1
55,0
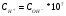
0,34
0,78
1,0
1,05
2,44
5,02
7,4
Однако, в случаях растворов электролитов, более строго использовать не концентрации, а активности ионов:
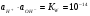 1.26
1.26
В соответствии с теорией электролитической диссоциации ионы водорода (Н+) являются носителями кислых свойств, а ионы гидроксила (ОН-) – основных. Поэтому раствор будет нейтральным, когда 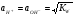 , кислым, когда
, кислым, когда 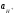 >
>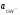 и щелочным, когда
и щелочным, когда 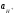 <
<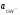 .
.
Характеристикой кислотности (щелочности) среды служит водородный показатель или рН.
Водородный показатель или рН есть отрицательный десятичный логарифм активности ионов водорода в растворе:
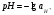 1.27
1.27
Аналогично можно ввести и гидроксильный показатель или рОН:
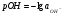 1.28
1.28
Очевидно, что при 295°K, рН+рОН=14. В кислой среде рН<7, а рОН>7; в нейтральной – рН = рОН = 7 и в щелочной - рН>7, а рОН<7.
Поскольку KW зависит от температуры, в дальнейшем все процессы будут рассматриваться при температуре 295-298°K.
Пример 11. рН раствора равен 6. определите соответствующие активности (концентрации) ионов водорода и гидроксила этого раствора.
РЕШЕНИЕ. По формуле 1.27 находим активность (концентрацию) ионов водорода. Она равна 10-6m. Далее по формуле 1.25 находим активность (концентрацию ионов гидроксила. Она равна 10-14/10-6 = 10-8 m.
Теория кислот и оснований.
Первую теорию кислот и оснований предложил Аррениус на основании теории электролитической диссоциации. По Аррениусу кислотой является водородсодержащий электролит, дающий в водном растворе ион водорода, а основанием – гидроксидсодержащий электролит, дающий в водном растворе ион гидроксила. Электролиты, дающие в зависимости от условий в водных растворах ионы Н+ или ОН-, были названы амфотерными.
Однако, эта теория неприменима к взаимодействиям, не сопровождающимися диссоциацией на ионы. Так, например, аммиак, реагируя с безводной HCl, дает соль NH4Cl, а в водном растворе проявляет свойства основания, не имея гидроксильной группы.
Более общая протонная теория кислот и оснований была предложена Бренстедом и Лоури, применимая как к водным, так и неводным растворам. По этой теории кислота – это вещество, способное отдать протоны (донор протонов), а основание – вещество, способное принять протоны (акцептор протонов). Соотношение между кислотой и основанием можно представить схемой:
Основание + протон кислота
Основание и кислоту, связанные данным соотношением, называют сопряженными. Взаимодействие между кислотой и основанием по этой теории имеет вид:
Кислота1 + основание1 кислота2 + основание2 1.29
Например, реакцию между аммиаком и фтористым водородом можно представить уравнением:
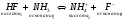 .
.
В зависимости от партнера то или иное вещество может выступать как кислотой, так и основанием. Например, вода по отношению к аммиаку является кислотой, а по отношению к HF – основанием:
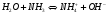
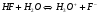
кислота основание кислота основание
Произведение растворимости
Как упоминалось выше, растворимость веществ в воде различна. Однако абсолютно нерастворимых веществ в природе не существует. Любое вещество, хотя бы в ничтожной степени, обладает растворимостью. Рассмотрим равновесие между твердым осадком трудно растворимой соли AgCl и ее ионами в водном растворе:
AgClтв Ag+ + Cl-
Константа равновесия имеет вид:
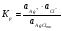 1.30
1.30
Активность твердой фазы величина постоянная и выражение 1.30 преобразуют к виду, называемому произведением растворимости (ПР):
ПРAgCl = 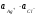 1.31.
1.31.
В общем случае для трудно растворимого электролита ApBq произведение растворимости имеет вид:
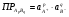 1.32.
1.32.
Произведение растворимости, как и растворимость, зависит от температуры.
Хотя ПР при данной температуре величина постоянная, растворимость вещества может меняться в зависимости от ряда условий:
присутствие в растворе электролита, не имеющего общих ионов с осадком. В этом случае растворимость увеличивается из-за изменения коэффициентов активности в сторону понижения.
присутствие в растворе электролита, имеющего общий ион с осадком. В этом случае растворимость, как правило, резко уменьшается.
присутствие в растворе вещества, способного образовывать комплексные соединения с ионами трудно растворимого вещества. В этом случае растворимость, как правило, резко возрастает.
Пример 12. Определите растворимость PbCl2 в его насыщенном растворе и в растворе 0,1 m NaCl. 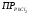 =1.6*10-5 .
=1.6*10-5 .
РЕШЕНИЕ. Обозначим растворимость, выраженную в моляльностях, через x, тогда для насыщенного раствора 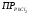 =x*(2x)2 = 4x3, так как PbCl2 Pb2+ + 2Cl-. Отсюда
=x*(2x)2 = 4x3, так как PbCl2 Pb2+ + 2Cl-. Отсюда 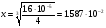 ≈ 0.016 m. В случае раствора NaCl
≈ 0.016 m. В случае раствора NaCl 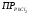 будет иметь вид:
будет иметь вид: 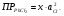 , причем активность ионов хлора определяется NaCl и она равна (см.табл.2) 0,786*0,1=0,0786. тогда
, причем активность ионов хлора определяется NaCl и она равна (см.табл.2) 0,786*0,1=0,0786. тогда 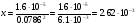 m.
m.
Гидролиз.
Любую соль можно, в принципе, получить по реакции нейтрализации, взяв соответствующие основание и кислоту. При этом катион соли может быть остатком как сильного, так и слабого электролита. То же самое относится и к аниону соли. Таким образом, соль может быть образована:
сильным основанием и сильной кислотой, например NaCl
сильным основанием и слабой кислотой, например Na2CO3
слабым основанием и сильной кислотой, например AlCl3
слабым основанием и слабой кислотой, например (NH4)2CO3.
При растворении солей в воде в последних трех случаях происходит процесс, получивший название гидролиз соли. Определение этого процесса будет приведено ниже.
Рассмотрим процессы, протекающие при растворении соли, образованной сильным основанием и слабой кислотой (Na2CO3).
Вначале соль, как сильный электролит, полностью распадется на ионы:
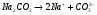 1.33.
1.33.
Одновременно происходит диссоциация воды:
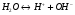 1.34.
1.34.
Поскольку угольная кислота слабый электролит, то ее остаток (ион 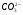 ) стремится вернуться в недиссоциорованную форму, захватывая ион водорода, что усиливает диссоциацию воды. При этом происходит подщелачивание среды (рН>7).
) стремится вернуться в недиссоциорованную форму, захватывая ион водорода, что усиливает диссоциацию воды. При этом происходит подщелачивание среды (рН>7).
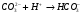 1.35.
1.35.
Сумма 1.33 – 1.35 дает уравнение гидролиза соли:
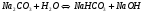 1.36
1.36
или в сокращенной ионной форме:
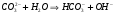 1.37.
1.37.
Это 1-ая стадия гидролиза карбоната натрия. По второй стадии, представленной уравнениями:
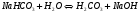 1.38
1.38
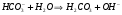 1.39
1.39
процесс практически не идет, так как накопившийся избыток ионов гидроксила запускает реакцию 1.37 в обратном направлении.
Аналогично происходит процесс растворения соли, образованной слабым основанием и сильной кислотой. Только в этом случае происходит связывание ионов гидроксила катионом, являющимся остатком слабого основания. Среда в этом случае подкисляется (рН<7). Например, для AlCl3 имеем:
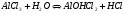 1.40
1.40
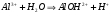 1.41.
1.41.
Для этой соли возможно протекание гидролиза по второй стадии:
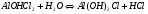 1.42
1.42
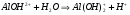 1.43.
1.43.
И по третьей:
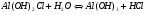 1.44
1.44
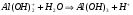 1.45
1.45
Однако гидролиз по второй, а тем более по третьей стадии не протекает из-за протекания реакции 1.41 в обратном направлении при накоплении избытка ионов водорода в растворе.
Для соли, образованной слабым основанием и слабой кислотой все происходит немного иначе из-за того, что в растворе присутствуют как остаток слабого основания, так и остаток слабой кислоты. В этом случае происходит одновременной связывание как ионов водорода, так и ионов гидроксила, что приводит к полному нарушению ионного равновесия воды. рН среды близок к 7. например, для (NH4)2CO3 имеем:
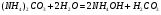 1.46
1.46
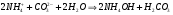 1.47.
1.47.
Это пример так называемого полного гидролиза. Полный гидролиз можно осуществить, если к раствору соли, образованной слабым основанием и сильной кислотой, добавить эквивалентное количество раствора соли, образованной сильным основанием и слабой кислотой. Например:
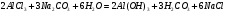 1.48
1.48
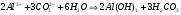 1.49.
1.49.
Теперь приведем определение гидролиза.
Гидролиз есть процесс взаимодействия соли и воды, сопровождающийся нарушением ионного равновесия воды.
На практике часто возникает необходимость расчета рН раствора соли после гидролиза, а также степени гидролиза (h).
Степень гидролиза есть отношение числа молей соли, подвергшихся гидролизу к исходному числу молей соли в растворе.
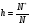 1.50
1.50
где N* - число молекул, подвергшихся гидролизу; N – исходное число молекул соли.
Для карбоната натрия (1.37) константа равновесия имеет вид:
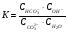 1.51
1.51
Учитывая постоянство активности воды, 1.51 преобразуется к виду:
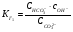 1.52.
1.52.
Это есть выражение для константы гидролиза карбоната натрия. Если его умножить и разделить на 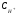 , то получим:
, то получим:
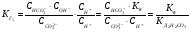 1.53.
1.53.
Таким образом, можно утверждать, что константа гидролиза по первой стадии связана с константой диссоциации слабого электролита по последней стадии. Однако, как можно показать, для соли, образованной слабым основанием и слабой кислотой, эта взаимосвязь имеет вид:
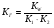 1.54
1.54
где: KW –ионное произведение воды, К1 и К2 – константы диссоциации слабого основания и слабой кислоты, соответственно.
Связь степени гидролиза и константы гидролиза, как легко показать, имеет вид аналогичный закону разбавления Оствальда:
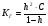 1.55.
1.55.
При h«1 КГ ≈ h2∙C, и h ≈ √КГ/С. 1.56
Таким образом, при разбавлении раствора гидролиз усиливается. Если надо подавить гидролиз, то нужно или концентрировать раствор, или добавить соответствующий сильный электролит: кислоту для соли, образованной слабым основанием и сильной кислотой, и щелочь для соли, образованной сильным основанием и слабой кислотой.
С повышением температуры гидролиз усиливается за счет, в основном, усиления диссоциации воды.
Пример 13. Напишите уравнения реакции гидролиза Cr(NO3)3. определите реакцию среды (по значению рН), напишите выражение для константы гидролиза и определите направление смещения равновесия при: разбавлении, добавление в систему ионов водорода, добавление в систему гидроксид-ионов, нагревании.
РЕШЕНИЕ. Соль образована слабым основанием (Cr(OH)3 нерастворим) и сильной кислотой. Следовательно, гидролиз будет происходить по катиону и в ионном и молекулярном виде уравнения имеют вид:
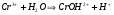 .
.
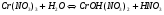 .
.
Выражение для константы гидролиза имеет вид:
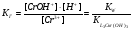
Поскольку при гидролизе образуется избыток ионов водорода, то реакция среды будет кислая (рН<7). Равновесие сместится вправо при разбавлении, нагревании и добавлении в систему ионов гидроксила. При добавлении в систему ионов водорода равновесие сместится влево.
Пример 14. Определите значение рН 0,1 m раствора Na2CO3 .
РЕШЕНИЕ. Соль образована сильным основанием и слабой кислотой. Следовательно, гидролиз будет происходить по аниону, реакция среды будет щелочная (рН>7), и в ионном и молекулярном виде уравнения имеют вид:
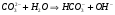
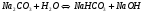
Определим значение константы гидролиза по выражению 1.53:
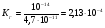 .
.
Далее определим степень гидролиза, воспользовавшись выражениями 1.55 и 1.56:
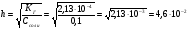 . Тогда концентрация ионов гидроксила будет равна h·C = 4.6·10-3, а концентрация ионов водорода будет равна (см. выражение 1.25) 2,17·10-12 и рН = 11,66.
. Тогда концентрация ионов гидроксила будет равна h·C = 4.6·10-3, а концентрация ионов водорода будет равна (см. выражение 1.25) 2,17·10-12 и рН = 11,66.
Амфотерность
Амфотерными называются электролиты, дающие при диссоциации в воде в зависимости от условий ионы водорода (Н+) или гидроксила (ОН-).
Примерами амфотерных электролитов могут служить как растворимые в воде (аминокислоты), так и нерастворимые (гидраты окислов некоторых элементов).
Для аминокислот и некоторых других органических электролитов причиной амфотерности является наличие, по крайней мере, двух различных функциональных групп, одна из которых проявляет кислотные свойства, а другая - основные.
Для гидратов окислов причина амфотерности другая. В их составе всегда можно выделить группировку:
Э-О-Н, 1.57
где Э – элемент, О - кислород, Н – водород.
В зависимости от соотношения энергий связи О-Н и О-Э, могут реализоваться три варианта:
энергия связи О –Н прочнее, чем для связи Э – О
энергия связи О –Н примерно такая же как и для связи Э –О
энергия связи О –Н слабее, чем для связи Э –О
В первом случае гидрат окисла является основанием, в третьем – кислотой, а во втором проявляет амфотерные свойства.
В начале любого периода всегда реализуется первый вариант, и все гидраты окислов являются типичными основаниями. В конце любого периода реализуется третий вариант, и все гидраты окислов являются типичными кислотами. Где-то ближе к середине периода ( в разных периодах это происходит по разному) реализуется второй вариант.
Для второго периода это происходит уже у Ве, в третьем – у Al, в четвертом – у Zn, Ga и Ge, в пятом у In и Sn, в шестом у Pb.
Однако существует и другая возможность, реализующаяся у переходных элементов. Для тех из них, которые могут реализовать несколько валентных состояний, в низших валентных состояниях реализуется первый вариант, а в высших, когда валентность элемента 5 и выше, реализуется третий вариант. В средних же валентных состояниях они проявляют амфотерные свойства. В первой вставной декаде амфотерные свойства проявляют Ti и V, в четырех валентном состоянии, Cr, в трех валентном состоянии, Mn, в четырех валентном состоянии. У элементов второй и третьей вставных декадах явного проявления амфотерных свойств не обнаружено.
Соответственно этому амфотерные гидроксиды в кислой среде выступают в качестве оснований, а в щелочной – кислот. Однако взаимодействие амфотерного гидроксида со щелочью дает разные продукты в зависимости от того, проводится ли реакция в растворе или путем сплавления (в твердом виде). Формы получающихся продуктов (анионы) приведены в таблице 4 в общем виде.
Табл. 4.
Формы анионов амфотерных гидроксидов при взаимодействии со щелочами.
Валентное
Форма существования аниона:
состояние
элемента
в растворе
в твердом виде
Э(II)
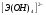
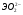
Э(III)
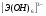
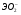
Э(IV)
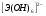
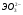 мета,
мета,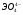 орто
орто
Пример 15. Напишите уравнения реакций взаимодействия Al(OH)3 с растворами H2SO4 и NaOH в молекулярной и ионной форме.
РЕШЕНИЕ. Уравнения взаимодействия с серной кислотой имеют вид:
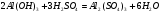
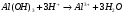
Взаимодействие с NaOH протекает так:
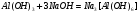
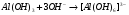
Жесткость природных вод
Природная вода всегда в той или иной степени минерализована. В природной воде всегда, в том или ином количестве, присутствуют следующие ионы: 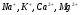 ,
, 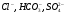 . Соли кальция и магния, содержащиеся в воде, придают ей жесткость.
. Соли кальция и магния, содержащиеся в воде, придают ей жесткость.
Жесткой называется вода, при кипячении которой образуется осадок.
Жесткость измеряется в миллимольэквивалентах на литр (мМЭ/л) и обозначается Ж. Для выше приведенных ионов, величина миллимольэквивалента составляет 23 мг, 39,1 мг, 20,04 мг, 12,15 мг, 35,45 мг, 61,02 мг, 48,03 мг, соответственно. При оценке жесткости воды эти цифры можно округлить до целых, кроме иона хлора, для которого берется 35,5, и, соответственно, имеем 23, 39, 12, для иона хлора смотрите выше, 61, 48.
В природных водах жесткость обуславливают , в основном, катионы кальция и магния. Поэтому общая жесткость можно определить по выражению;
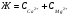
где: 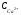 и
и 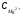 - концентрации ионов кальция и магния в мМЭ/л, соответственно
- концентрации ионов кальция и магния в мМЭ/л, соответственно
Ж – жесткость природной воды.
Эту жесткость называют общей и обозначают ЖО.
Общая жесткость состоит из двух видов: жесткость карбонатная (временная) и жесткость некарбонатная (постоянная). Первую обозначают ЖК, а вторую – ЖНК.
Карбонатная жесткость связана с присутствием в воде гидрокарбонатов кальция и магния, а некарбонатная жесткость обусловлена наличием в воде солей сильных кислот этих катионов.
При кипячении жесткой воды гидрокарбонаты разлагаются по схемам:
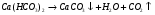
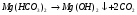
Поэтому карбонатную жесткость и называют временной, а некарбонатную – постоянной, поскольку соли сильных кислот при кипячении не разлагаются.
С точки зрения опасности, наличие в воде ионов Mg2+ более опасно из-за их гидролиза, который усиливается при нагревании:
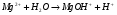
Появление в воде избытка ионов водорода может привести к разрушению технологического оборудования.
Концентрация гидрокарбонатов в природных водах оказывает влияние на жесткость. С этой точки зрения, природные воды можно разделить на два вида:
1. 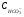 ≥ ЖО =
≥ ЖО = 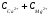

2. 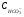 < ЖО =
< ЖО = 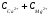
Для воды 1-го вида вся жесткость будет жесткостью карбонатной (ЖК), а некарбонатная жесткость (ЖНК) равна нулю и карбонатная жесткость меньше или равна концентрации ионов гидрокарбоната:
ЖО = ЖК, ЖНК = 0, 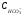 ≥ ЖК.
≥ ЖК.
Для воды 2-го вида общая жесткость раскладывается на два компонента: жесткость карбонатная (ЖК) и жесткость некарбонатная (ЖНК), карбонатная жесткость равна концентрации ионов гидрокарбоната, а некарбонатная жесткость находится по разности между общей жесткостью и карбонатной:
ЖО = ЖК + ЖНК; ЖК = 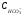 , ЖНК = ЖО - ЖК
, ЖНК = ЖО - ЖК
Способы устранения жесткости.
Процесс устранения жесткости получил название умягчение воды. для умягчения воды в народном хозяйстве, в основном, используются реагентные методы. Наиболее часто применяющиеся из них следующие:
1. Известковый метод. Сущность этого метода состоит в переводе катионов кальция и магния в трудно растворимые соединения с использованием извести. При этом протекают следующие реакции:
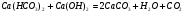
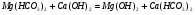
Как видно из написанных выше реакций этот метод устраняет только кальциевую карбонатную жесткость, а магниевую – переводит в кальциевую. Поэтому для устранения магниевой жесткости нужно добавлять избыток извести, чтобы связать образующуюся кальциевую жесткость из магниевой.
2. Содовый метод. Сущность этого метода состоит в переводе катионов кальция и магния в трудно растворимые соединения с использованием кальцинированной соды. При этом протекают следующие реакции, написанные в ионном виде:
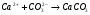
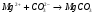
В этом методе происходит устранение как карбонатной, так и некарбонатной жесткости, но он более дорогой, чем известковый. Поэтому на практике его применяют редко, а используют содово-известковый метод.
3. Содово-известковый метод. При его использовании для устранения некарбонатной жесткости в воду добавляется сода, а для устранения карбонатной – известь в избытке, необходимом для устранения магниевой составляющей карбонатной жесткости. Протекающие реакции приведены в методах, описанных выше.
4. Фосфатный метод. Для умягчения воды в этом методе используют чаще всего тринатрицйфосфат (Na3PO4·12Н2О). Протекающие при этом реакции можно представить следующими ионными уравнениями:
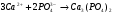
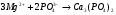
Наряду с реагентными методами для умягчения воды применяют и метод ионного обмена. Сущность метода состоит в следующем. Природные, искусственные и синтетические материалы, способные к обмену входящих в их состав ионов на ионы контактирующего с ними раствора, называются ионитами. Иониты, содержащие подвижные катионы, способные к обмену, называются катионитами, а обменивающие анионы – анионитами. Наиболее часто применяются для устранения жесткости воды синтетические иониты.
Основу синтетического ионита составляют полимерные углеводородные цепи с пространственной трехмерной структурой, которые содержат ионогенные (активные) группы. Активные группы вводятся в полимер или непосредственно при его получении, или при последующей химической обработке. Для придания полимеру трехмерной структуры кроме основного исходного мономера в реакционную смесь вводят непредельный углеводород, сшивающий линейные макромолекулы полимера мостиками между собой.
Катиониты по химической природе представляют собой полимерные кислоты или их соли. Рабочей формой катионита может быть кислотная, когда обменивающимися ионами будут ионы Н+ (Н-катионит), или солевая, например натриевая, когда способными к обмену будут ионы Na+ (Na-катионит).
Аниониты являются полимерными основаниями или их солями. Рабочей формой анионита может быть основная, когда способными к обмену ионами анионита будут ионы ОН- (ОН-анионит), или – солевой, когда обменивающимися ионами будут, например, ионы Cl- (Cl-анионит).
Наиболее важной технологической характеристикой служит рабочая (динамическая) емкость. Она определяется количеством ионов (мЭ/л или Э/м3), поглощенных определенным объемом набухшего ионита в процессе фильтрования до момента появления этих ионов в растворе, выходящем из фильтра.
Na-катионирование. Умягчение воды в этом случае происходит в результате замены в эквивалентном количестве ионов Ca2+ и Mg2+ на ионы Na+ катионита:
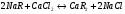
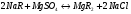
Н-катионирование. Сущность этого метода состоит в том, что ионы Н+ катионита обмениваются на содержащиеся в растворе ионы Ca2+ и Mg2+. В обработанной воде появляется эквивалентное количество свободных кислот:
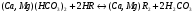
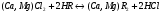
Для устранения избыточной кислотности в обработанную воду добавляют гидроксид натрия.
Пример 16. Чему равна общая, карбонатная, некарбонатная жесткость воды, если в 3 литрах ее содержится 0,240 г Mg2+, 0,60 г Ca2+ и 0,813 г HCO3-.
РЕШЕНИЕ. Определяем количество ионов Ca2+, Mg2+ и HCO3- в мг * экв/л, учитывая, что
ЭMg2+ = 24/2 = 12мг, ЭCa2+ = 40/2 = 20 мг, ЭHCO3- = 61/1 = 61 мг;
[Mg2+] = 0,240 г = 240 мг = 240/3 * 12 = 6,7 мэкв/л;
[Ca2+] = 0,60 г = 600 мг = 600/3 * 20 = 10 мэкв/л;
[HCO3-] = 0,183 г = 183 мг = 183/3 * 61 = 1 мэкв/л;
[Ca2+] + [Mg2+] = 6,7 + 10 = 16,7 мэкв/л,
т.к. [Ca2+] + [Mg2+] >[HCO3-], то
Жо = [Ca2+] + [Mg2+] = 16,7 мэкв/л;
Жк = [HCO3-] = 1 мэкв/л;
Жнк = Жо – Жк =16,7 – 1 = 15,7 мэкв/л.
Пример 17. На устранение жесткости 3 л воды пошло 0,318 г Na2CO3. Вычислить общую жесткость воды.
РЕШЕНИЕ. На 3 литра воды пошло 0,318 г Na2CO3, на 1 л – x г Na2CO3.
x = 0,318/3 = 0,106 мг.
Так как эквивалентная масса ЭNa2CO3 = 106 / 2 = 53 мг, 106 мг/л составят 106 / 53 = 2мэкв/л.
Ответ : общая жесткость воды равна 2 мэкв/л
ВАРИАНТЫ КОНТРОЛЬНОГО ЗАДАНИЯ № 1
Номер варианта
Определить нормальность и молярность раствора соли по процентной концентрации(%) и плотности раствора(d).
Определить температуру кипения и замерзания водного раствора соли, если дана кажущаяся степень диссоциации
Кэб = 0,52,
Ккр = 1,86
Написать уравнения реакций гидролиза солей, если они воз-можны. Написать выражение для константы гидролиза и определить реакцию среды (по значению рН), направление смещения равновесия при разбавлении, добавлении в систему ионов водорода, добавлении в систему гидроксид-ионов, нагревании
Определить все виды жесткости (общую, карбонатную, некарбонатную), если дано А – объем воды (л), В – количество ионов магния (г), С – количество ионов кальция (г), D – количество ионов HCO3- (г)
%
Соль
d, г/см3
1
2
3
4
5
6
7
121
8,7
MgCl2
1,07
Раствора, содержащего 7,1г Na2SO4 в 100 г воды;
= 0,9
(NH4)2SO4; Zn(NO3)2; KCl
A = 3, B = 1,2 , C = 0,2 , D = 0,61
122
5
CaCl2
1,06
40% -го раствора Na2SO4;
= 0,8
Na2SO3; Al(NO3)3; K2SO4
A = 6, B = 0,62 , C = 0,12 , D = 0,366
123
10
Mg(NO3)2
1,153
Раствора, содержащего 14,2 г Na2SO4 в 1000 г воды; = 0,8
NH4Cl; K2SO3; NaNO3
A = 8, B = 0,096 , C = 0,16 , D = 0,976
124
8,7
MgCl2
1,07
Раствора, содержащего 33,2 г BaCl2 в 1000 г воды; = 0.85
Na2CO3, K2SO4, Pb(NO3)2
A = 2, B = 0,048 , C = 0,08 , D = 1,22
125
10,7
Ca(NO3)2
1,09
Раствора, содержащего 58,5 г NaCl в 1000 г воды; = 0,8
K2SO3; Fe(NO3)2;NaCl
A = 8, B = 0,96 , C = 0,16 , D = 48,8
126
5,7
Mg(NO3)2
1,04
30%-го раствора NaCl;
= 0,9
K3PO4; FeCl3; KNO3
A = 4, B = 0,096 , C = 0,12 , D = 0,488
127
15
Mg(NO3)2
1,108
Раствора, содержащего 87,75 г NaCl в 1000 г воды; = 0,9
Ni(NO3)2; Na2SO4; AlCl3
A = 2, B = 0,024 , C = 0,04 , D = 0,244
128
11
MgSO4
1,115
Раствора, содержащего 58,5 г NaCl в 1000 г воды; = 0,8
AgNO3; Na2CO3;CaCl2
A = 4, B = 0,48 , C = 0,2 , D = 0,61
129
7
MgSO4
1,05
10%-го раствора Na2SO4;
= 0,9
NH4NO3; K2SO3;BaCl2
A = 5, B = 0,06 , C = 0,1 , D = 0,305
1
2
3
4
5
6
7
130
10,5
CaCl2
1,08
Раствора, содержащего 29 г NaCl в 500 г воды; = 0,8
Na3PO4; AlCl3; NaCl
A = 0,5, B = 0,012 , C = 0,04 , D = 0,244
131
5
MgSO4
1,05
Раствора, содержащего 2 моля Na2SO4 в 500 г воды ; = 0,9
Na2SiO3; KCl; Fe2(SO4)3
A = 12, B = 0,12 , C = 0,24 , D = 0,732
132
5
CaCl2
1,05
Раствора, содержащего 14,2 г Na2SO4 в 500 г воды; = 0,8
Al2(SO4)3; Na2SO4; K2SiO3
A = 4, B = 1,2 , C = 2 , D = 6,1
133
2
CaCl2
1,03
Раствора, содержащего 1,36 г Na2SO4 в 1000 г воды; = 0,9
KNO3; K3PO4; Al(NO3)3
A = 10, B = 0,6 , C = 0,1 , D =6,1
134
20
MgCl2
1,2
Раствора, содержащего 14,5 г NaCl в 500 г воды; = 0,8
Pb(NO3)2; CH3COONa; Na2SO4
A = 20, B = 0,24 , C = 0,2 , D = 0,61
135
10
CaCl2
1,1
20% -го раствора Na2SO4;
= 0,85
CH3COOK; CuSO4; NaCl
A = 2, B = 0,024 , C = 0,04 , D = 0,366
136
30
CaCl2
1,3
30% -го раствора CaCl2;
= 0.9
ZnCl2; K2SO3; NH4COOH
A = 4, B = 0,096 , C = 0,08 , D = 1,22
137
4
MgSO4
1,06
Раствора, содержащего 1,36 г Na2SO4 в 500 г воды; = 0,85
MgCl2; Na2CO3; NH4Cl
A = 1, B = 0,048 , C = 0,08 , D = 1,22
138
6
CaCl2
1,05
Раствора, содержащего 71 г Na2SO4 в 250 г воды; = 0,9
NH4NO3; K2SO3; Cu(NO3)2
A = 3, B = 0,036 , C = 0,06 , D = 1,83
139
8
MgSO4
1,08
10%- го раствора NaCl;
= 0,8
K2SiO3; NH4Cl; Na2SO4
A = 2, B = 0,12 , C = 0,08 , D = 0,976
140
6,3
Ca(NO3)2
1,2
Раствора, содержащего 2 моля NaCl в 500 г воды; = 0,9
ZnCl2; K2CO3; NaCl
A = 5, B = 1,2 , C = 0,4 , D = 1,22
141
2
CaSO4
1,02
Раствора,содержащего58,5 г NaCl в 1000 г воды; = 0,9
CaCl2; Na2SiO3; Mg(NO3)2
A = 7, B = 0,42 , C = 0,14 , D = 2,562
142
8
CaCl2
1,05
40%-го раствора Na2SO4;
= 0,8
KCN; Fe2(SO4)3; NH4Cl
A = 3, B = 0,48 , C = 0,12 , D = 0,366
143
8
MgCl2
1,05
Раствора, содержащего 14,2 г Na2SO4 в1000 г воды; = 0,8
Pb(NO3)2; BaCl2; FeCl2
A = 5, B = 0,6 , C = 0,3 , D = 0,61
144
5
CaCl2
1,05
Раствора, содержащего 33,28 г BaCl2 в 1000 г воды; = 0,8
K2CO3; NaCl; Al2(SO4)3
A = 6, B = 0,216 , C = 0,12 , D = 1,83
1
2
3
4
5
6
7
145
5
MgCl2
1,1
Раствора, содержащего 58,5 г NaCl в 1000 г воды; = 0,8
ZnSO4; AlCl3; KCl
A = 6, B = 0,144 , C = 0,12 , D = 1,83
146
7
CaCl2
1,05
30%-го раствора CaCl2;
= 0,9
(NH4)2SO3; K3PO4; Na2SO4
A = 7, B = 0,21 , C = 0,14 , D = 2,135
147
20
CaCl2
1,1
Раствора, содержащего 87,75 г NaCl в 1000 г воды; = 0,9
NaCN; Al2(SO4)3; K2SO4
A = 8, B = 0,096 , C = 0,24 , D = 1,22
148
5,7
Mg(NO3)2
1,04
Раствора, содержащего 58,5 г NaCl в 1000 г воды; = 0,8
NiCl2; K2CO3; BaCl2
A = 3, B = 0,072 , C = 0,06 , D = 1,83
149
11
MgSO4
1,115
Раствора, содержащего 29 г NaCl в 500 г воды; = 0,9
CH3COONa; Pb(NO3)2; Na2SO3
A = 5, B = 0.36 , C = 0,3 , D = 0,61
150
15
Mg(NO3)2
1,108
10%-го раствора Na2SO4;
= 0,9
KCN; ZnCl2; K2CO3
A = 1, B = 0,072 , C = 0,06 , D = 1,83
ДИСПЕРСНЫЕ СИСТЕМЫ.
Общая характеристика дисперсных систем.
Дисперсные системы – многофазные гетерогенные системы, в которых одна фаза – непрерывная (дисперсная среда), другие – раздроблены и распределены в первой (эти фазы - дисперсные).
Величина, обратная диаметру (а) частицы дисперсной фазы, называется дисперсностью (или степенью дисперсности): D = 1/а. По степени дисперсности все дисперсные системы разделяются на две группы:
грубодисперсные системы, а> 1000 нм;
коллоидные системы (золи), а = 1÷1000 нм;
истинные растворы, а<1 нм.
Дисперсные системы классифицируются также по агрегатному состоянию дисперсной фазы эмульсии и дисперсионной среды. Так, к аэрозолям (когда дисперсионная среда газообразная) относятся туманы (жидкая дисперсная фаза), дымы и пыли (твёрдая фаза). К лиозолям (с жидкой дисперсионной средой) относятся пены (или газовые эмульсии), обычные эмульсии и суспензии. К твёрдым золям относятся твёрдые пены, твёрдые эмульсии и твёрдые суспензии.
Характерной особенностью дисперсных систем является большая удельная поверхность и, как следствие, - большая поверхностная энергия. Удельная поверхность – это отношение суммарной поверхности частиц к их массе (м 2/г).
Диспесные системы являются термодинамически неустойчивыми. Понижение поверхностной энергии может быть достигнуто за счёт поглощения (адсорбации) поверхность частиц, каких – либо ионов или молекул.
По степени взаимодействия дисперсной фазы с дисперсионной средой коллоидные системы делятся на лиофобные и лиофильные (от греческих слов “лиос” – жидкость, “фобо” - ненавижу, “фило” - люблю). Частицы лиофобных систем практически не взаимодействуют с молекулами дисперсионной среды. В лиофильных системах значительное количество дисперсионной среды связывается дисперсной фазой. Если дисперсионной средой является вода, коллоидные системы называются соответственно гидрофобными и гидрофильными. К гидрофобным золям относятся, например, золи золота, серебра, сернистого мышьяка, йодистого серебра и т. д. К лиофильным золям относятся золи кремниевой кислоты, гидроксида алюминия, а также растворы высокомолекулярных соединений – белков, агара, желатина, крахмала и др.
Методы получения дисперсных систем
Всякое вещество можно получить в дисперсной системе, если создать для этого Необходимые условия. Получить вещество в коллоидном состоянии можно двумя противоположными способами: диспергированием (раздроблением) макрочастиц или конденсацией атомов или молекул. Чтобы получившиеся коллоидные частицы не слипались, необходим стабилизатор в виде ионов, молекул неорганических веществ, поверхностно – активных органических соединений или высокомолекулярных соединений. Последние, адсорбируясь, на поверхности коллоидных частиц, снижают их свободную поверхностную энергию и делают частицу устойчивой.
Для диспергирования можно применять механическое дробление или ультразвуковые колебания. Так, твёрдые и жидкие тела измельчают на коллоидных мельницах, действующих по принципу удара, трения или вибрации.
Если распылять металлы в электрической дуге од водой или в органических жидкостях, то вначале металл испаряется до атомов, а затем происходит конденсация атомов до коллоидных частиц.
Такой метод их получения называется дисперсионно – конденсационным. При конденсационных методах создаются условия для соединения атомов, молекул или ионов в коллоидные частицы. Этого можно достичь охлаждением паров, пересыщением растворов или химическими реакциями получения нерастворимых веществ. Примерами конденсации могут служить образование водного тумана в воздухе или получение золя хлорида натрия при прибавлении спиртового раствора хлористого натрия к эфиру, в котором хлорид натрия не растворяется. К образованию золей приводят следующие реакции:
2H2 S + O 2 = 2S +2H2 O (золь серы)
t0
FeCl3 + 3H2O = Fe(OH)3 + 3HCl (золь гидроксида железа)
Na2SiO3 +2H2O = H2SiO3 +2NaOH (золь кремниевой кислоты)
AgNO3 + KI = AgI + KNO3 ( золь йодида серебра)
Для получения высокодисперсных систем в жидких средах пользуются также методом пептизации. Это один из дисперсионных методов. При пептизации свежеобразованный осадок слипшихся коллоидных частиц под действием стабилизатора снова переходит в коллоидный раствор. Если взять, например, свежеосаждённый и быстро промытый осадок гидроксида железа, прибавить к нему раствор хлорного железа или соляной кислоты, то при перемещении осадок перейдет в раствор, т. е. образуется золь.
Методы очистки коллоидных растворов
Очистить коллоидный раствор от электролитов и органических веществ можно с помощью диализа, электродиализа и ультрафильтрации. При этом используются полупроницаемые мембраны из целлофана, коллодия, пергамента и других материалов. Через поры мембран проходят ионы электролитов и молекулы низкомолекулярных органических веществ, но не могут пройти коллоидные частицы. Низкомолекулярные частицы через мембрану диффундируют в воду. Электродиализ позволяет многократно ускорить очистку золя. При этом золь отделяется от воды мембранами так, чтобы можно было в воде разместить два электрода, к которым подключается постоянное напряжение из расчётов 20...50 В/см.
Ультрафильтрация – это фильтрование коллоидного раствора через полупроницаемую мембрану, укреплённую на твёрдой пористой подкладке в специальной воронке. Процесс ведётся при разряжении снизу или повышением давления сверху. Золь при этом периодически разбавляется водой.
Строение коллоидных частиц (мицелл)
Образование коллоидных частиц рассмотрим на примере реакции образования золя йодистого серебра: AgNO3 + KI = AgI + KNO3. AgI - нерастворимое вещество, поэтому может образовывать золь. Ядро коллоидной частицы образуют микрокристаллики, состоящие из m ионов Ag+ и m ионов I-, т.е. mAgI.
В случае избытка йодистого калия на поверхности ядра будут адсорбироваться ионы I-, которые могли бы увеличить размер ядра и которые имеются в избытке (ионов Ag+ в растворе не остаётся). На ядре адсорбируются n ионов I- и некоторое количество (n – x) катионов K+ из раствора, уменьшающих большой отрицательный заряд ионов йода. Этот слой ионов nI-(n-x)K+ называется адсорбционным. Недостающие для ионной электрической компенсации ионы калия (xK+) могут легко диффундировать от коллоидной частицы в раствор (это диффузный слой). Итак, формула мицеллы: {mAgInI-(n-x)K+}-xxK+. Устойчивая частица в фигурных скобках – гранула, имеющая в данном случае заряд “-x”. Ионы йода в данном случае обеспечивают отрицательный заряд гранулы и называются, поэтому потенциалопределяющими: ионы калия называются противоионами. Если взять избыток AgNO3, то формула мицеллы будет другой: {mAgInAg+(n-x)NO3-}+xXNO-3. Здесь гранула имеет положительный заряд. Эти заряды гранул препятствуют слипанию коллоидных частиц, что придаёт золям агрегативную устойчивость.
Процесс слипания дисперсных частиц называется коагуляцией. Золи могут быть скоагулированы добавлением электролитов. Коагулирующее действие оказывает ион противоположного знака по отношению к заряду гранулы. Это действие оказывается тем сильнее, чем выше заряд иона. Тут действует правило Шульце – Гарди: минимальная концентрация электролита, вызывающая коагуляцию золя (так называемый “порог коагуляции “), обратно пропорциональна шестой степени заряда иона, ответственного за коагуляцию, т.е. или катиона, или аниона. Коагулирующие ионы попадают в адсорбционный слой и уменьшают заряд гранулы. Силы отталкивания гранул уменьшаются, и коллоидные частицы начинают слипаться.
Устойчивость золей может быть повышена путём прибавления к ним небольших количеств высокомолекулярных соединений (ВМС). Молекулы ВМС адсорбируются на поверхности коллоидных частиц, образуя гелеобразные плёнки, защищающие частицы от возможного слипания.
При коагуляции некоторые золи способны создавать из коллоидных частиц пространственные сетки, образуя твёрдообразные не текучие структурированные системы, называемые гелями. Некоторые гели (например гели цементных растворов) под влиянием механических воздействий могут переходить в золь (или пластичную, текучую систему), который через некоторое время вновь переходит в гель. Такое явление называется тиксотропией . Гели цементных растворов, кремниевой кислоты и некоторые другие называются хрупкими. Теряя воду, они не уплотняются, т.е подвергаются синерезису. Это явление называется также “старением” геля.
В заданиях по теме “Дисперсные системы” требуется:
1.Составить формулу мицеллы золя (графа С), полученного при взаимодействии вещества (графа А) с избытком вещества (графа В) (см. таблицу ниже). Для этой мицеллы указать потенциалопределяющие ионы, противоионы, заряд гранулы. Для этого указать электролит, наиболее эффективно вызывающий его коагуляцию. Предлагаемые электролиты: KNO3, CaCl2, Al2(SO4)3, Na3PO4. Выбор объяснить.
2.Дать определение, описание и объяснение величинам, явлениям и процессам, приведённым в графе 5.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Номер варианта
А
В
С
Величины, явления, процессы
1
2
3
4
5
151
KI
AgNO3
AgI
Дисперсная система. Гранула. Суспензия
152
Na2S
FeCl2
FeS
Электрокинетический потенциал. Гель. Мицелла.
153
AlCl3
NaOH
Al(OH)3
Степень дисперсности. Агрегативная устойчивость золей. Удельная поверхность
154
NaBr
AgNO3
AgBr
Коагулят. Силикагель. Поверхностная энергия.
155
FeCl3
NaOH
Fe(OH)3
Коллоидная система (золь). Кинетическая устойчивость золей. Диффузия.
156
K2S
MnCl2
MnS
Электроосмос. Поверхностно – активное вещество. Адсорбация.
157
Na2SiO3
HCl
H2SiO3
Грубодисперсная система. Аэрозоль. Абсорбация.
158
ZnSO4
Na2S
ZnS
Защитные коллоиды. Коагуляция. Лиофобные и лиофильные золи.
159
Ca(NO3)2
Na2SO4
CaSO4
Дисперсная фаза. Правило Шульце – Гарди. Пептизация.
160
KCl
AgNO3
AgCl
Активный (активированный) уголь. Порог коагуляции. Диализ.
161
Cd(NO3)2
Na2S
CdS
Дисперсная среда. Тиксотропия. Электродиализ
162
Pb(NO3)
K2S
PbS
Ультрафильтрация. Седиментация. Броуновское движение.
163
BaCl2
Na2SO4
BaSO4
Эмульсия. Строение коллоидных частиц. Гель.
164
CuCl2
Na2S
CuS
Мицелла. Сорбция. Агрегативная устойчивость золей.
165
SnCl2
KJ
Sn(OH)2
Суспензия. Электрофорез. Кинетическая устойчивость золей.
166
AgNO3
KI
AgI
Удельная поверхность. Коагулянт. Мицелла.
167
FeCl2
Na2S
FeS
Диффузия. Синерезис эластичных гелей. Гранула.
168
NaOH
AlCl3
Al(OH)3
Поверхностная энергия. Дис-персная система. Силикагель.
1
2
3
4
5
169
AgNO3
NaBr
AgBr
Адсорбция. Электрокинетический потенциал.
170
NaOH
FeCl3
Fe(OH)3
Адсорбция. Степень дисперсности. Поверхностно – активное вещество.
171
MnCl2
K2S
MnS
Лиофильные золи. Коагулянт. Правило Шульце – Гарди.
172
HCl
Na2SiO3
H2SiO3
Лиофобные золи. Коллоидная система (золь). Коагуляция.
173
Na2S
ZnSO4
ZnS
Дисперсионные методы получения дисперсных систем. Электроосмос. Сорбция.
174
Na2SO4
Ca(NO3)2
CaSO4
Конденсационные методы получения дисперсных систем. Защитные коллоиды. Гель.
175
AgNO3
KCl
AgCl
Пептизация. Грубодисперсная система. Порог коагуляции.
176
Na2S
Cd(NO3)2
CaSO4
Оптические свойства дисперсных систем. Активный (активированный) уголь. Коагулянт.
177
K2S
Pb(NO3)2
PbS
Диализ. Дисперсная фаза. Тиксотропия.
178
Na2SO4
BaCl2
BaSO4
Электродиализ. Дисперсионная среда. Строение коллоидных частиц.
179
Na2S
CuCl2
CuS
Броуновское движение. Ультрафильтрация. Синерезис эластичных гнлей.
180
NaOH
SnCl2
Sn(OH)2
Мицелла. Эмульсия. Электрофорез.
ВЯЖУЩИЕ СИСТЕМЫ (ЦЕМЕНТЫ)
К вяжущим относятся дисперсные системы, состоящие из избытка твёрдого порошка и жидкости затворения (смешения), которые способны в течение ограниченного времени – минут, часов, суток – самопроизвольно превращаться в прочное камневидное тело – искусственный камень.
Как следует из термодинамического описания химических процессов (разд. 1), самопроизвольно в стандартных условиях происходят процессы, в том числе и камнеобразование, для которых ∆G0298 <0.
Для того чтобы затвердевание системы произошло, необходимо выполнение определённых условий (условий М. М. Сычёва).
1. Химическая реакция между порошком твёрдого и жидкостью должна заканчиваться обязательным образованием комплексного соединения – гидрата, т.е. продукта, содержащего ионы соединения, образующего твёрдый порошок, и молекулы воды.
2.Отношение твёрдого (Т) к жидкости (Ж) должно быть равно или больше критической величины (а): Т/Ж >= а. Такое отношение может достигать двух – трёхкратного значения.
3.Скорость взаимодействия порошка и жидкости не должна быть ни мгновенной, ни слишком большой (техническое условие).
Для того чтобы осуществилось условие 1 – образование гидратов, надо, чтобы между катионом (акцептор А) порошка твёрдого вещества и молекулами воды, являющимися донорами электронных пар (донор Д), была возможность взаимодействия по донорно-акцепторному механизму:
H2O↑↓ + A = A ↑↓ OH2
Донор Д Акцептор А Гидрат
Кроме способности катиона и молекул воды образовывать химическую связь, при образовании гидратов следует учитывать отношение размеров катиона и аниона; если отношение приближается к единице, то молекулам воды не хватает физического места в структуре соли, гидрат не образуется и твердение не происходит.
Гидратообразование (комплексообразование) обуславливает возможность проявления дисперсной системой вяжущих свойств в зависимости от положения в таблице Д. И. Менделеева, оно увеличивается в пределах подгруппы снизу вверх, а по периоду – справа налево. В таком же направлении изменяется вяжущая способность системы в зависимости от катиона соли. Количественной оценкой вяжущей способности системы является показатель прочности при сжатии (под прочностью понимается сопротивление системы разрушению).
Выделим две классификации вяжущих – по положению в таблице Д. И. Менделеева и по эксплуатационным свойствам.
По первой классификации в соответствии с принадлежностью к семейству катиона – акцептора, обеспечивающего твердение, вяжущие системы (цементы) можно разделить на s- , p-, d- цементы. Например, кристаллогидрат CaSO4∙2H2O обеспечивает получение s-цемента, т. к. кальций – s-элемент; Zn3(PO4)2∙4H2O лежит в основе получения d-цемента; т. к. цинк - d-элемент; Al2(SO4)3 ∙18H2 O – p-цемент, т. к. Al – p-элемент.
Классификация по положению в таблице Д. И. Менделеева позволяет, во – первых, прогнозировать проявление вяжущего свойства как свойства электронных аналогов s-, p- и d- элементов; во-вторых, химическая классификация позволяет прогнозировать прочность химической связи в гидратах, а следовательно, и прочность вяжущих систем на их основе в направлении роста энергии орбиталей – акцепторов d > p > s при прочих равных условиях – степени дисперсности, величине Т/Ж, температуре, давлении. В- третьих, она позволяет предвидеть клеящую способность системы, или иначе, адгезионные свойства, например, p- и d-цементы должны обладать более высокой клеящей способностью (адгезией), чем s-цементы, т.к. энергия p- и d-орбиталей выше, чем энергия s-орбиталей.
Четвёртая особенность этой классификации состоит в том, что она позволяет прогнозировать механические свойства полученных искусственных камней. Более гибкие, гантелевидное направленности в пространстве, например р–орбитали, характерные для р-цементов, будут способствовать более “гибкой” структуре материала – искусственного камня, т.е.более высокой прочности при изгибе.
Вторая классификация вяжущих систем на растворимости гидратов в воде и на соответствующей растворимости искусственных каменных материалов. Можно выделить две группы вяжущих: воздушные, кристаллогидраты которых и, следовательно, искусственные камни растворимы в воде, и гидравлические, кристаллогидраты которых и, следовательно, затвердевший материал на их основе в воде не растворимы. К воздушных вяжущих относятся сульфатные, хлоридные, нитратные s-, p- и d-цементы, а также силикатные и алюминатные ns1-цементы (1 главная подгруппа), к гидравлическим - силикатные, алюминатные и фосфатные s-, p- и d-цементы. Наибольшее применение в строительной практике из воздушных вяжущих имеют гипсовые, магнезиальные и гашёная известь, гидратация и твердение которых протекает по реакциям, осуществляющимся в системе из избытка порошка (Т) и недостатка жидкости затвердения (Ж) (Т/Ж~2÷3) и приводящим, поэтому к возникновению камня.
При гидратации и твердении гипсовых вяжущих исходная система состоит из порошка CaSO40,5H2O (полуводный гипс) и воды, отношение количества воды к порошку ~ 0,3… 0,5, т.е. воды, примерно в 2...3 раза меньше. Эта система затвердевает в камень благодаря самопроизвольной экзотермической реакции перехода полуводного гипса в двуводный:
CaSO4∙0,5H2O + 1,5H2O = CaSO4∙2H2O, ∆H < 0
порошок
Исходная паста → Гипсовый камень
Уже через один-два часа гипсовая система имеет прочность при сжатии порядка (35...55)∙105 Па.
Гипсовая вяжущая система – s-цемент, т.к. кальций s-элемент. Из электронных аналогов подобных свойством обладают сульфаты бериллия и магния, а сульфаты стронция и бприя не образуют гидратов и искусственного камня вследствие особенностей их геометрического строения, т.е., как уже отмечалось, вяжущая способность уменьшается при движении по подгруппе сверху вниз.
Кроме s-элементов, искусственные камни образуются из сульфатов на основе p-элементов, например гидратов сульфата алюминия, и d-элементов, например гидратов сульфатов железа, никеля, кобальта, цинка, меди.
Сульфаты можно заменить на хлориды. Хлоридные вяжущие системы образуют кальций и его электронные аналоги - магний, стронций, барий, а также p-элементы, например алюминий и d-элементы, например никель, кобальт.
Если взять порошок оксида магния MgO (каустический магнезит) и смешать (затворить) с раствором соли хлорида магния MgCl2, то камень формируется (при условии избытка порошка твёрдого – оксида магния) благодаря самопроизвольной экзотермической реакции образования комплексного гидроксохлорида магния:
5MgO + MgCl2 + 12H2O = MgCl2∙5Mg(OH)2∙7H2O, ∆H<0
порошок
Исходная паста Магнезиальный камень
Прочность магнезиального камня выше, чем гипсового. Магнезиальная вяжущая система также является s-цементом; электронные аналоги магния дают подобные вяжущие свойства по группе сверху вниз – это значит, что прочность при прочих равных условиях в пределах группы падает.
Известковая вяжущая система состоит из порошка оксида кальция (негашёная известь) и воды; взаимодействие происходит по следующей экзотермической реакции (гашение извести).
CaO + H2O = CaO∙H2O, ∆H<0
Порошок
Со временем в присутствии углекислоты воздуха происходит карбонизация гидроксида кальция по реакции Ca(OH)2 + CO2 = CaCO3 + H2O. Прочность материала при этом увеличивается.
Наибольшее применение в качестве гидравлического вяжущего находят порошки силикатов и алюминатов кальция, которые либо специально получены на цементных заводах, либо составляют побочные продукты производства (отходы). На цементных заводах России и большинства других стран чаще всего получают портландцемент – порошок, состоящий из искусственно полученных силикатов и алюминатов кальция, а также алюмоферрата кальция, соли более сложного состава, и гипса. При соблюдении условий Сычёва система из этого порошка и воды способна превращаться в прочное камневидное тело, устойчиво существующее и на воздухе, и в воде.
В табл. 1 представлен примерный процентный состав веществ (минералов), из которых состоит портландцементный порошок, их названия, формулы написания и уравнения химических реакций, лежащих в основе возникающей прочности системы. Приведённые в табл. 1 реакции, обеспечивающие в последующем прочность до 1000∙105 Па, - это реакции гидратации, т.е. присоединения молекул воды к безводным исходным солям. Подобно тому, как в процессах электрохимии происходит превращение энергии химических реакций в электрический ток, в вяжущих системах происходит превращение части энергии химической реакции гидратации в механическую прочность полученного искусственного камня, одной из оценок которой является прочность затвердевшей системы при сжатии.
Реакции гидратации (камнеобразования) (табл.1) идут самопроизвольно с понижением внутренней энергии системы в целом. Кроме того, эти реакции продолжаются годами, т.е. на самом деле искусственные камни “живые”.
Системы из силикатов и алюминатов аналогов кальция в соответствующих условиях также проявляют вяжущие свойства, закономерно убывающие при движении в пределах подгруппы сверху вниз.
К гидравлическим вяжущим относятся и фосфатные системы, например цинкофосфатная, которая состоит из порошка оксида цинка и жидкости затворения H3PO4, затвердевающих в камень при выполнении условий Сычёва:
3ZnO + 2H3PO4 + H2O = Zn3(PO4)2∙4H2O
порошок жидкость камень
В условиях окружающей среды искусственные камни (вяжущие системы) вступают в самопроизвольные реакции с соответствующими окружающей среде и могут разрушаться. В основе разрушения искусственного камня лежат химические реакции, приводящие к понижению внутренней энергии системы в целом (∆ G реакций коррозии отрицательно). Чаще всего встречаются следующие виды коррозии: магнезиальная, углекислотная, сульфатная.
Магнезиальная коррозия – это взаимодействие Ca(OH)2, получаемого в искусственном камне по реакции (1) из табл. 2 и солей магния из морских и почвенных вод:
Ca(OH)2 + MgCl2 = Mg(OH)2↓ + CaCl2
Углекислотная коррозия происходит под воздействием углекислого газа воздуха по реакции:
Ca(OH)2 + 2CO2 = Ca(HCO3)2
и приводит к образованию растворимого гидрокарбоната кальция, который в последующем вымывается из цементного камня.
Сульфатная коррозия камня обязана реакции образования эттрингита:
C3A∙6H2O + 3CaSO4 + 27H2O = C3A3∙CaSO4∙33H2O,
эттрингит
который имеет больший объём, чем исходные фазы, и в данном случае его образование вызывает разрушение камня подобно тому, как замерзание воды разрушает ёмкость сосуда, в котором она находится.
С п и с о к л и т е р а т у р ы
1. Б у т т Ю.М. и др. Химическая технология вяжущих материалов/Ю.М. Бутт, М.М.Сычёв, В.В.Тимашов. – М.: Высшая школа, 1980.
2. К у з н е ц о в а Т. В. и др. Физическая химия вяжущих материалов/Т.В.Кузнецова, И.В.Кудряшов, В.В.Тимашов. – М.: Высшая школа, 1989.
3. Справочник по химии цемента/Под ред. В.В.Волконского и Л.Г.Судакиса. – Л.: Стройиздат, 1980.
4. Вяжущие системы% Программированный химический тренажёр/Сост. Л.Б. Сватовская, Л.Г.Лукина, И.Н.Степанова. – Л.: ЛИИЖТ,1988.
С в а т о в с к а я Л. Б. Инженерная химия. Ч. 1. – СПб: ПГУПС, 1994
Соединения (минералы)
Реакция с водой, обеспечивающая отвердение в камень
Энергетические характеристики процесса гидратации, кДж/моль
Название
Формула полная и сокращённая
∆H0298
∆G0298
1.Трёхкальциевый силикат, или алит
3CaO∙SiO2, C3S
C3S + (n+1)H2O = C2S∙nH2O + Ca(OH)2
C2S∙nH2O – гидросиликат кальция, комплексная соль.
~ -80,0
-49,0
2.Двухкальциевый силикат, или белит
2CaO∙SiO2, C2S
C2S + nH2O = C2S∙nH2O
-23,0
-10,0
3.Трёхкальциевый алюминат
3CaO∙Al2O3, C3A
C3A + 6H2O = C3A∙6H2O - гидроалюминат кальция
В присутствии CaSO4∙2H2O
C3A + 3CaSO4∙2H2O + 27H2O = C3A∙3CaSO4∙33H2O – сложный продукт – гидросульфоалюминат кальция, или эттрингит
-239
-167
4.Четырёхкальциевый алюмоферрит
4CaO∙Al2O3∙Fe2O3, C4A F
C4A F + (m + 6)H2O = C3A∙6H2O + CP∙mH2O – гидроферрит кальция
-
-
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Номер
вари-
анта
Определить, возможно, ли самопро-
извольное осуществление реакции в стандартных условиях; экзо-
или эндотермической является
данная реакция, при каких усло-
виях осуществление реакции приведет к образованию искусственного камня
Определить, к какому виду (s-,
p- или d-цементу) относится искусственный камень,получен-
ный на основе кристаллогидратов; укажите донор и акцептор электронных пар
Дать ответ на теоретический вопрос
1
2
3
4
181
CaSO4*0,5H2O+1,5H2O=CaSO4*2H2O
MgCl2*6H2O; FeSO4*7H2O
Виды вяжущих
182
CaBr2+6H2O=CaBr2*6H2O
CaSO4*2H2O; Zn3(PO4)2*4H2O
Условия искусственного камнеобразования
183
CaCl2+6H2O=CaCl2*6H2O
C2S*2H2O; CoCl2*6H2O
Состав портландцемента
184
C3S+3H2O=C2S*2H2O+Ca(OH)2
C3A*6H2O; NiSO4*7H2O
Виды коррозии цемента
185
C2S+2H2=C2S*2H2O
AlPO4*3H2O; CaCl2*4H2O
Функции эттрингита при гидратации цемента и при коррозии цемента
186
C3A+6H2O=C3A*6H2O
CS*H2O; FePO4*H2O
Способ борьбы с коррозией
187
MnCl2+4H2O=MnCl2*4H2O
CS*H2O; FePO4*H2O
Что называется вяжущей системой?
188
FeSO4+7H2O=FeSO4*7H2O
Mg3(PO4)2*8H2O; CS*H2O
Классификация цементов по принадлежности катиона к семействам
189
Na2SO4+10H2O=Na2SO4*10H2O
NiSO4*7H2O; Mg3(PO4)2*H2O
Воздушные и гидравлические вяжущие
190
CaO+H2O=Ca(OH)2
Fe3(PO4)2*8H2O; AlCl3*6H2O
Природа химической связи в кристаллогидратах
191
Na2CO3+10H2O=Na2CO3*10H2O
CaSO4*2H2O; CrPO4*6H2O
Термодинамические условия самопроизвольности протекания процессов твердения
192
CaHPO4+2H2O=CaHPO4*2H2O
Mg3(PO4)2*3H2O; Co(NO3)2*6H2O
Условия проявления системой вяжущих свойств
193
Zn(NO3)2+2H2O=Zn(NO3)2*2H2O
Fe3(PO4)2*H2O; CaCl2*4H2O
Гидратационные процессы клинкерных минералов
1
2
3
4
194
Zn(NO3)2+6H2O=Zn(NO3)2*6H2O
MgSO4*7H2O; Fe(PO3)3*5H2O
Химические реакции коррозии цементного камня
195
AlCl3+6H2O=AlCl3*6H2O
Cr(PO3)3*9H2O; MgBr2*6H2O
Состав портландцемента
196
CuCl2+2H2O=CuCl2*2H2O
C3A*6H2O; FePO4*2H2O
Условия искусственного камнеобразования
197
CuSO4+5H2O=CuSO4*5H2O
CaPO4*2H2O; CS*H2O
Состав портландцемента
198
CaCl2+6H2O=CaCl2*6H2O
C2S*2H2O; Cu3(PO4)2*3H2O
Виды коррозии цемента
199
NiSO4+7H2O=NiSO4*7H2O
Cr(PO4)3*5H2O; CaSO4*2H2O
Функции эттрингита при гидратации цемента и при коррозии цемента
200
CaBr2+6H2O=CaBr2*6H2O
FePO4*H2O; C2A*6H2O
Способ борьбы с коррозией
201
MnCl2+4H2O=MnCl2*4H2O
AlCl3*6H2O; Zn3(PO4)2*4H2O
Что называется вяжущей системой?
202
CaSO4*0,5H2O+1,5H2O=CaSO4*2H2O
CS*H2O; Mg3(PO4)2*3H2O
Классификация цементов по принадлежности катиона к семействам
203
C3A+6H2OC3A*6H2O
AlPO4*2H2O; CoCl2*6H2O
Воздушные и гидравлические вяжущие
204
FeSO4+7H2O=FeSO4*7H2O
CaCl2*6H2O; Fe(PO3)3*5H2O
Природа химической связи в кристаллогидратах
205
C3S+3H2O=C2S*2H2O+Ca(OH)2
CrPO4*6H2O; C2S*2H2O
Термодинамические условия самопроизвольности протекания процессов твердения
206
Na2CO3+10H2O=Na2CO3*10H2O
CaSO4*2H2O; CaPO4*2H2O
Условия проявления системой вяжущих свойств
207
C2S+2H2O=C2S*2H2O
C3A*6H2O; NiSO4*7H2O
Гидратационные процессы клинкерных минералов
208
CaCl2+6H2O=CaCl2*6H2O
Zn3(PO4)2*4H2O; CS*H2O
Химические реакции коррозии цементного камня
209
CaSO4*0,5H2O+1,5H2O=CaSO4*2H2O
FeSO4*7H2O; AlPO4*2H2O
Состав портландцемента
210
CaO+H2O=Ca(OH)2
Mg(PO4)2*H2O; CaSO4*2H2O
Условия искусственного камнеобразования
Таблица вариантов контрольной работы
Номер
вари-
анта
Номера задач,
относящихся
к данному заданию
Номер
вари-
анта
Номера задач,
относящихся
к данному заданию
1
121 151 181
51
141 171 201
2
122 152 182
52
142 172 202
3
123 153 183
53
143 173 203
4
124 154 184
54
144 174 204
5
125 155 185
55
145 175 205
6
126 156 186
56
146 176 206
7
127 157 187
57
147 177 207
8
128 158 188
58
148 178 208
9
129 159 189
59
149 179 209
10
130 160 190
60
150 180 210
11
131 161 191
61
121 151 181
12
132 162 192
62
122 152 182
13
133 163 193
63
123 153 183
14
134 164 194
64
124 154 184
15
135 165 195
65
125 155 185
16
136 166 196
66
126 156 186
17
137 167 197
67
127 157 187
18
138 168 198
68
128 158 188
19
139 169 199
69
129 159 189
20
140 170 200
70
130 160 190
21
141 171 201
71
131 161 191
22
142 172 202
72
132 162 192
23
143 173 203
73
133 163 193
24
144 174 204
74
134 164 194
25
145 175 205
75
135 165 195
26
146 176 206
76
136 166 196
27
147 177 207
77
137 167 197
28
148 178 208
78
138 168 198
29
149 179 209
79
139 169 199
30
150 180 210
80
140 170 200
31
121 151 181
81
141 171 201
32
122 152 182
82
142 172 202
33
123 153 183
83
143 173 203
34
124 154 184
84
144 174 204
35
125 155 185
85
145 175 205
36
126 156 186
86
146 176 206
37
127 157 187
87
147 177 207
38
128 158 188
88
148 178 208
39
129 159 189
89
149 179 209
40
130 160 190
90
150 180 210
41
131 161 191
91
121 151 181
42
132 162 192
92
122 152 182
43
133 163 193
93
123 153 183
44
134 164 194
94
124 154 184
45
135 165 195
95
125 155 185
46
136 166 196
96
126 156 186
47
137 167 197
97
127 157 187
48
138 168 198
98
128 158 188
49
139 169 199
99
129 159 189
50
140 170 200
100
130 160 190
ПРИЛОЖЕНИЕ I
Некоторые константы и величины
Число Авогадро А= 6,022*1023 частиц / мль
Постоянная Планка  h =6,62*10-34 Дж*К-1
h =6,62*10-34 Дж*К-1
Постоянная Больцмана 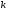 б=1,3805*10-23Дж*К-1
б=1,3805*10-23Дж*К-1
Универсальная газовая постоянная R=8,3143Дж*К-1*моль-1
Масса электрона mе=9,110*10-31кг=5,48580*10-4а.е.м.
Масса протона mр=1,673*10-27кг=1,007276 а.е.м.
Боровский радиус а0=5.292*10-11м.
Атомная единица массы (а.е.м.)=1,66-27 кг
Скорость света с=2,998*108 м*с-1
Давления (стандартные условия) Р=1,013*105Н*м-2 (1,013*10-5 Па)=760 мм рт. ст.
Абсолютный нуль Т0=-273,15 0С
Элементарный электрический заряд е=1,602189*10-19Кл
Число Фарадея F=9,64846*104Кл*моль-1
Соотношение между некоторыми единицами
в различных системах.
Величина
Единица измерения
Эквивалент в СИ
Энергия, работа
Эквивалент (эВ)
1,60219*10-19Дж
Калория (кал)
4,1868 Дж
Эгр
10-7 Дж
Длина
Микрон или микрометр (мкм)
1*10-6м
Нанометр
1*10-9м
Ангстрем
1*10-10м
Давление
Миллиметр ртутного столба (мм рт. ст.)
133.322 Па
Значения газовой постоянной в
различных единицах измерения
Единица
Дж/моль*К
эрг/моль*К
л*атм/моль*К
кал/моль*К
кгс*м/моль*К
1
2
3
4
5
6
R
8,3143
8,3143*107
0,082057
1.98725
0,8478
ПРИЛОЖЕНИЕ II
Электроотрицательность по Полингу
s – и р – электроны
Н
2,20
Li
0.98
Be
1.57
B
2.04
C
2.55
N
3.04
О
3.44
F
3.98
Na
0.93
Mg
1.31
Al
1.61
Si
1.90
P
2.19
S
2.58
Cl
3.16
K
0.82
Ca
1.10
Ge
2.01
Ge
2.01
As
2.18
Se
2.58
Cl
3.16
Rb
0.82
Sr
0.95
In
1.78
Sn
1.96
Sb
2.05
Te
2.1
I
2.66
Cs
0.7
Ba
0.9
Tl
1.8
Pb
1.8
Bi
1.9
Po
2.0
At
2.2
Fr
0.7
Ra
0.9
d - элементы
Sc
1.3
Ti
1.5
V
1.6
Cr
1.6
Mn
1.5
Fe
1.8
Co
1.8
Ni
1.8
Cu
1.9
Zn
1.6
Y
1.2
Zr
1.4
Nb
1.6
Mo
1.8
Tc
1.9
Ru
2.2
Rh
2.2
Pd
2.2
Ag
1.9
Cd
1.7
La
1.1
Hf
1.3
Ta
1.5
W
1.7
Re
1.9
Os
2.2
Ir
2.2
Pt
2.2
Au
2.4
Hg
1.9
Для f – элементов принимается 1,2
Стандартные энтальпии образования  Н0298, энтропии
Н0298, энтропии
S0298 и энергии Гиббоса  G0298 К (25 0С)
G0298 К (25 0С)
Вещество
 Н0298
Н0298
S0298, Дж/(моль*К)
 G0298, кДж/моль
G0298, кДж/моль
Al (к)
AlCl3 (к)
AlCl3*6H2O(к)
Al2O3(к)
BaCO3(к)
ВаО (к)
Вr2(ж)
С (графит)
3СаО*Аl2O3 (к) (С3А)
3СаО*Аl2O3*6H2O (к) (С3А*6Н2О)
СН4 (г)
С2Н4 (г)
C2H4 (г)
С3Н8
н-С4Н10 (г)
изо-С4Н10 (г)
С5Н12 (г)
С6Н14
С6Н14 (ж)
С7Н16 (г)
С7Н16(ж)
С8Н18 (г)
С6Н12О6 (к)
СН3ОН (ж)
С2Н5ОН (ж)
н-С3Н7ОН (ж)
изо-С3Н7ОН (ж)
н-С5Н13ОН (ж)
СаВr2 (к)
СаВr2*6Н2О (к)
СаСl2 (к)
СаСl2*6Н2О (к)
СаСО3 (к)
СаНРО4 (к)
СаНРО4*2Н2О (к)
СаО
Са(ОН)2 (к)
СаSO4*0,5Н2О (к)
СаSO4*2Н2О (к)
Сl2 (г)
Сl2O (г)
СlО2 (г)
СО (г)
СО2 (г)
СS2 (г)
2СаО*SiO2 (к) (С2S)
2CaO*SiO2*2H2O (к) (С2Ы*2H2O)
3CaO*SiO2 (к) (С3S)
Cu (к)
СuCl2 (к)
СuCl2*2H2O (к)
СuSO4 (к)
СuSO4*5H2O (к)
СuO (к)
F2 (г)
Fe (к)
FeO (к)
Fe2O3 (к)
Fe3O4 (к)
FeSO4 (к)
FeSO4*7H2O (к)
Н2 (г)
HBr (г)
HCl (г)
HF (г)
HI (г)
H2O (г)
Н2О (ж)
Н3РО4 (р)
Н2S (г)
I2 (г)
MgCO3 (к)
MgO (к)
MnCl2м (к)
MnCl2*4H2O (к)
N2 (г)
Na2CO3
Na2CO3*1H2O (к)
Na2SO4 (к)
Na2SO4*1OH2O (к)
NH3 (ж)
Ni (к)
NiO (к)
NiSO4 (к)
NiSO4*7H2O (к)
N2O (г)
NO (г)
N2O3 (г)
NO2 (г)
N2O4 (г)
O2 (г)
OF2 (г)
Pb (к)
Р (к)
PBr3 (г)
PBr5 (ж)
PCl3 (г)
PCl5 (г)
PF3 (г)
PF5 (г)
PbO (к)
PbO2 (к)
S (к)
Sn (к)
SnO (к)
SnO2 (к)
SO2 (г)
SO3 (г)
SnCO3 (к)
SnO (к)
Zn (к)
ZnO (к)
0
-704,2
-2693
-1676,0
-1219,0
-558,1
0
0
-3556,4
-5550,6
-74,9
52,3
-89,7
-103,8
-126,2
-131,6
-146,4
-167,2
-189,8
-187,8
-224,4
-208,5
-1273,0
-238,6
-277,6
-307,0
-302,3
-306,1
-674,9
-2507,9
-795,0
-2599,6
-1207,0
-1815,6
-2405,2
-635,5
-986,6
-1577,8
-2024,0
0
76,6
105,0
-110,5
-393,5
115,3
-2308,5
-3140,8
-2968,3
0
-215,6
-818,6
-770,9
-2279,4
-162,0
0
0
-264,8
-822,2
-1117,1
-929,5
-3016,0
0
-34,1
-91,8
-270,9
26,6
-241,8
-285,8
-1288,3
-21,0
62,4
-1113,0
-601,8
-481,2
-1687,4
0
-1131.0
-4083,5
-1384,6
-4324,2
-46,2
0
-239,7
-873,5
-2977,4
82,0
90,3
83,3
33,5
9,6
0
25,1
0
0
-132,0
-184,0
-287,0
-366,0
-956,5
-1593,0
-219,3
-276,6
0
0
-286,0
-580,8
-296,9
-395,8
-1216,4
-590,4
0
-350,6
28,3
109,3
318,2
50,9
112,0
70,3
152,3
5.74
205,5
404,8
186,2
219,4
229,5
269,9
310,1
-
348,9
388,4
295,9
427,8
328,5
466,7
-
126,8
160,7
192,9
179,9
254,8
130
304,7
113,6
285,1
88,7
111,5
189,6
39,7
76,1
130,6
194,3
222,9
266,2
257,0
197,5
213,7
237,8
167,4
171,2
168,7
33,2
108,1
190,6
109,0
300,0
42,6
202
27,2
60,8
87,4
146,2
121,0
409,1
130,5
198,6
186,8
173,7
206,5
188,7
70,1
-158,1
205,7
260,6
65,7
26,9
118,2
311,5
199,9
136.4
564,7
149,5
591,9
192,6
29,9
38,0
103,6
378,9
219,9
210,6
307,0
240,2
303,8
205,0
247,0
64,8
41,1
438,0
240,2
311,7
364,5
272,6
296,0
66,2
74,9
31,9
51,6
56,5
52,3
248,1
256,7
97,1
54,4
41,6
43,6
0
-628,6
-2262,8
-1582,0
-1139,0
-528,4
0
0
-3376,5
-5015,6
-50,8
68,1
-32,9
-23,5
-17,2
-
-8,4
-0,3
-4,3
8,1
1,1
16,5
-919,5
-166,2
-174,8
-173,1
-182,5
-
-656,1
-2118,9
-750,2
-2198,9
-1127,7
-1682,4
-2156,2
-604,2
-896,8
-1437,8
-1798,7
0
94,2
122,3
-137,1
-394,4
65,1
-2193,2
-3335,9
-2784,3
0
-171,4
-660,1
-661,8
-1879,9
-129,9
0
0
-244,3
-704,3
-1014,2
-825,6
-2512,0
0
-51,2
-94,8
-272,8
1,8
-228,6
-237,3
-1142,6
-33,8
19,4
-1029,3
-569,6
-440,4
-1426,0
0
-1047.5
-3424,3
-1266,8
-3642,9
-16,7
0
-211,6
-763,8
-2463,3
104,1
86,6
140,5
51,5
98,4
0
42,5
0
0
-155,7
-175,7
-260,5
-305,4
-935,7
-1517,2
-189,1
-218,3
0
0
-256,9
-519,3
-300,2
-371,2
-1137,6
-559,8
0
-320,7
ПРИЛОЖЕНИЕ 5
Электронные потенциалы
Уравнение электродного процесса
Стандартный потенциал при 250 С, В
Уравнение электродного процесса
Стандартны потенциал при 250 С,
Li++е-=Li
-3,045
Co2++2e-=Co
-0.277
Rb++e-=Rb
-2,925
Ni2++2e-=Ni
-0,250
K++e-=K
-2,924
Sn2++2e-=Sn
-0,136
Cs++e-=Cs
-2,923
Pb2++2e-=Pb
-0,126
Ca2++2e-=Ca
-2,866
Fe3++3e-=Fe
-0,037
Na++e-=Na
-2,714
2H++2e-=H2
-0
Mg2e++2e-=Mg
-2.363
Bi3++3e-=Bi
0,215
Al3++3e-=Al
-1,663
Cu2++2e-=Cu
0,337
Ti2++2e-=Ti
-1,630
Cu++e-=Cu
0,520
Mn2++2e-=Mn
-1,179
Hg22++2e-=2Hg
0,788
Cr2++2e-=Cr
-0,913
Ag++e-=Ag
0,799
Zn2++2e-=Zn
-0,763
Hg2++2e-=Hg
0,850
Cr3++3e-=Cr
-0,744
Pt2++2e-=Pt
1,188
Fe2++2e-= Fe
-0,440
Au3++3e-= Au
1,498
Cd2++2e-Cd
-0,403
Au++e-= Au
1,692
2H2O+2e-=H2+2OH-
-0,828
O2+2H2O+4e-=4OH-
0,401
NO3-+1OH++8e-= NH4++3H2O
0,870
O2+4H++4e-=2H2O
1,228
NO3-+2H++e-= NO2++H2O
0,780
SO42-+8H++6e-=S+4H2O
0,357
NO3-+4H++3e-= NO++2H2O
0,957
SO42-+1OH++8e-=H2S+4H2O
0,300
ПРИЛОЖЕНИЕ 6
Произведение растворимости (ПР) труднорастворимых
веществ при 250С
Вещество
ПР
Вещество
ПР
AgBr
5,3*10-13
Fe(OH)3
6,3*10-38
AgCN
1,4*10-16
FeS
5*10-18
AgCl
1,78*10-10
HgI2
~10-26
Ag2 CrO4
1,1*10-12
HgS
1,6*10-52
Ag2Cr2 O7
1*10-10
K3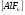
1,6*10-9
AgI
8,3*10-17
KClO4
1,1*10-2
Ag3PO4
1,3*10-20
K3
4,3*10-10
Ag2S
2*10-50
Li2CO3
4,0*10-3
Al(OH)3
1*10-33
Mg(OH)2
6,0*10-10
AuCl3
3,2*10-25
Mg3(PO4)2
1*10-13
BaCO3
4,0*10-18
Mn(OH)2
5*10-14
BaClO4
1,2*10-10
(NH4)2IrCl6
3*10-5
BaMnO4
2,5*10-10
Na3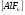
4,1*10-10
Ba3(PO4)2
6,0*10-39
Ni(CN)2
3*10-23
BaSO4
1,1*10-10
Ni(OH)2
1,3*10-16
BiI3
8,1*10-19
NiS
1*10-24
Bi2S3
1*10-97
PbCO3
7,5*10-14
CaCO3
4,8*10-9
PbCl2
1,6*10-5
CaCrO4
7,1*10-4
PbClO4
1,8*10-14
CaF2
4,0*10-11
PbI2
1,1*10-9
Ca3(PO4)2
2,0*10-29
Pb(OH)2
1,0*10-15
Cd(OH)2
2,6*10-14
PbS
2,5*10-27
CaSO4
2,5*10-5
PbSO4
1,6*10-8
CdS
1,6*10-28
PtBr4
3*10-41
Co(OH)2
6,8*10-6
PtCl4
8,0*10-29
CoS
4,0*10-21
Sb2S3
1,6*10-93
Cr(OH)3
1,3*10-7
Sn(OH)2
5,0*10-26
CuCN
3,2*10-20
Jh(OH)4
1*10-50
CuCl
1,2*10-6
TlCl
1,7*10-4
CuI
1,1*10-12
Tl2S
5,0*10-21
Cu(OH)2
2,2*10-20
Tl2SO4
4*10-3
(CuOH)2CO3
1,7*10-34
Zn(CN)2
2,6*10-13
CuS
6,3*10-36
Zn(OH)2
1,2*10-17
Cu2S
2,5*10-48
ZnS
1,6*10-17
Fe(OH)2
8*10-16
РАЗРАБОТАЛИ канд. техн. наук С.Г Герке., канд. хим. наук Н.П.Чибисов.

Нравится материал? Поддержи автора!
Ещё документы из категории разное:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ