Рост бактерии Basillus subtilis и биосинтез нуклеозида инозина на высоко-дейтерированной среде
 РОСТ БАКТЕРИИ Basillus subtilis И БИОСИНТЕЗ НУКЛЕОЗИДА ИНОЗИНА НА ВЫСОКО-ДЕЙТЕРИРОВАННОЙ СРЕДЕ.
РОСТ БАКТЕРИИ Basillus subtilis И БИОСИНТЕЗ НУКЛЕОЗИДА ИНОЗИНА НА ВЫСОКО-ДЕЙТЕРИРОВАННОЙ СРЕДЕ.
@2006 г. О. В. МОСИН
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова, 117571.
Изучена возможность биосинтетического получения дейтерий-меченного инозина путём выделения из культуральной жидкости штамма- продуцента Bacillus subtillis. Метод получения инозина основан на использовании в качестве источника ростовых факторов при культивировании штамма-продуцента гидролизатов дейтерированной биомассы факультативных метилотрофных бактерий Brevibacterium methylicum, полученных со среды, содержащей 98 об.% 2Н2O и 2 об.% С2Н3О2Н. Приведены экспериментальные данные по росту штамма B. subtilis и биосинтезу инозина на среде, приготовленной из 99,9 ат.% 2Н2О и гидролизатов биомассы метилотрофных бактерий. Анализ степени дейтерированности инозина был проведён с использованием масс-спектрометрии FAB. Полученные результаты свидетельствуют о высокой степени включения дейтерия в инозин (62,5 % атомов водорода в углеродном скелете молекулы замещены на дейтерий).
Ключевые слова: Bacillus subtillis. - Тяжёлая вода. - Дейтерий-меченный инозин. - Масс-спектрометрия.
ВВЕДЕНИЕ
В настоящее время культивирование штаммов-продуцентов на тяжелой воде, открывает все новые возможности для получения широкого круга биологически активных соединений (БАС), в т.ч. нуклеозидов, меченных дейтерием [1-3]. В связи с этим перспективны биотехнологические процессы, в которых для роста на тяжелой воде используют штаммы продуценты нужных БАС, устойчивые к присутствию максимальных концентраций 2Н2O.
Основной трудностью при биосинтезе изотопно-меченных нуклеозидов является недостаток соответствующих ростовых субстратов. Начиная с первых экспериментов Катца с соавт. по адаптации и выращиванию клеток Chlorella на тяжелой были разработаны среды на основе экстрактов дейтерий-меченной биомассы микроводорослей как источников ростовых субстратов для культивирования других штаммов-продуцентов БАС [4]. Однако метод получения высокодейтерированных субстратов, хорошо апробированный на микроводорослях в лабораторных условиях, все же не находит широкого практического применения вследствие ряда трудностей, связанных, в частности, с адаптацией и культивированием микроводорослей в тяжелой воде, аппаратурной громозкостью технологической схемы, использованием фотореакторов и т.п.
Другими альтернативными источниками дейтерий-меченных соединений могут служить метилотрофные бактерии, интерес к которым все возрастает благодаря успешному развитию технологии химического синтеза метанола [5]. Усваиваемость биомассы метилотрофов клетками эукариот составляет 85-99 % [6], а производительность метилотрофов, измеренная по уровню конверсии метилового спирта достигает 50% [7]. Как было показано нами раннее, метилотрофные бактерии могут быть достаточно быстро и легко адаптированны к тяжелой воде [8-10]. В связи с этим, практический интерес представляет разработка на основе гидролизатов биомассы метилотрофов меченных сред для культивирования различных штаммов-продуцентов БАС, в частности нуклеозидов.
Целью данной работы было исследование принципиальной возможности использования гидролизатов биомассы метилотрофных бактерий для получения инозина, высокомеченного дейтерием.
УСЛОВИЯ ЭКСПЕРИМЕНТА.
В работе использовали безводные соли марки “х.ч.”(РФ), белково- витаминный концентрат дрожжей (Пензенский завод, РФ), 2Н2О (99,9% 2Н) и С2Н3О2Н (97,5 % 2Н), полученные из Российского научно-исследовательского центра “Изотоп” (Санкт-Петербург, РФ).
Бактериальные штаммы. Объектом исследования служил мутантный штамм B. subtilis, способный продуцировать и выделять инозин в культуральную жидкость при росте на среде, содержащей в качестве ростовых факторов сухую дрожжевую биомассу, полученную на углеводородах. Штамм был получен из коллекции культур ГКПМ Российского научно-исследовательского центра генетики и селекции промышленных микроорганизмов.
B. subtillis был предварительно адаптирован к росту на тяжёлой воде путём рассева на среде, приготовленной на основе 99,9 ат. % 2Н2О и использован в качестве продуцента инозина при ферментации. Отобранный штамм проявлял высокую жизнеспособность и стабильность по признаку инозинообразования при многократном пассивировании на агаризованных (2%-ный агар) средах. Штамм поддерживали на агаризованной среде, содержащей 2Н2O.
В качестве источника ростовых факторов при культивировании штамма-продуцента инозина использовали штамм факультативных метилотрофных бактерий B. methylicum, полученный в работе [8].
Сырую биомассу B. methylicum, полученную в полностью дейтерированной среде dM9 [11] автоклавировали в 0,5 н. растворе 2 HCl (в 2H2O) при 08 ати в течении 30 мин.
Экстракцию липидов проводили смесью хлороформ-метанол (2:1) по методу Блайя и Дайера [12].
Гидролиз белка проводили в 6 н. 2 HCl (в 2H2O) (24 ч, 110 0С) [13].
Культивирование B. subtilis. Для получения посевного материала использовали среду следующего состава (в % по весу): глюкоза 2; пептон 2; бакто-витаминный концентрат дрожжей 2; NaCl 0,25.
Культивирование B. subtilis проводили на среде, приготовленной на основе 99,9 ат.% 2Н2О (dFM-среда), содержащей (в % по весу): глюкоза 12; автоклавированная биомасса метилотрофных бактерий B. methylicum 2,5; NH4NO3 3; MgSO4 2; мел 2.
Среды стериллизовали при 0,8 ати. в течении 30-40 мин, рН доводили до 7,0-7,2 с помощью гидроокиси калия. Посевной материал выращивали в колбах Эрленмейера объемом 250 мл (с наполнением средой не более 20 мл) в условиях интенсивной аэрации при 30-320С. После суток посевной материал переносили в ферментационную среду в количестве 5-10 об.%. и культивировали в течении семи суток как при выращивании посевного материала.
Выделение инозина. Клетки отделяли от культуральной жидкости на центрифуге Т-24 (Германия) (10 000 об/мин., 10 мин.). Супернатант концентрировали при 10 мм рт ст до объёма, в два раза меньше исходного. Белки удаляли, осаждая их метанолом при -40 С, осадок отделяли центрифугированием (10 000 об/мин, 10 мин). К супернатанту добавляли 1 г активированного угля и выдерживали реакционную смесь при -4 0С в течении суток. Десорбцию инозина проводили 50 %-ным раствором спирта в 25 %-ном растворе аммиака, десорбант лиофилизовали. Полученный продукт дважды промывали ацетоном, сушили при 500 С. Инозин перекристаллизовывали из метанола.
Тонкослойную хроматографию (ТСХ) инозина осуществляли на пластинках “Silufol UV- 254”(Чехо-Словакия) в системе: н-бутанол-уксусная кислота-вода, 2:1:1. Инозин идентифицировали по поглощению в УФ свете.
Содержание инозина в культуральной жидкости определяли на приборе “Beckman DU-6” (США) в пробах культуральной жидкости, объемом 10 мкл при помощи стандартной калибровочной кривой (249 нм). Элюцию пятен проводили дистиллированной водой.
Аминокислотный анализ белковых гидролизатов проводили на приборе “Biotronic LC 50001” (ФРГ), 230 x 3,2 мм, рабочее давление 50-60 атм, скорость подачи буфера 18,5 мл/ч, нингидрина 9,25 мл/ч.
Уровни включения дейтерия в аминокислоты белка были исследованы методом масс-спектрометрии электронного удара на приборе “MB-80A” (Hitachi, Япониня) после модификации аминокислот в метиловые эфиры дансиламинокислот по методике, указанной в работе [8].
Масс-спектры инозина получены на приборе “MB-80A” (Hitachi, Япония) на глицериновой матрице, при потенциале 5 кВ и ионном токе 0,6-0,8 мА.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ.
Получение дейтерий-меченного инозина. Для получения дейтерий-меченного инозина использовали мутантный штамм B. subtillis (предварительно адаптированный к росту на среде, содержащей максимальные концентрации 2Н2O путём рассева), который вследствие нарушения метаболических путей регуляции биосинтеза пуриновых нуклеотидов продуцирует и выделяет до 20 г инозина на 1 л культуральной жидкости. Иcследуемый штамм проявлял максимальную продуктивность по признаку инозинообразования на богатых ферментационных средах, содержащих в качестве источника углерода и энергии глюкозу (10-12 % от веса), а в качестве источника ростовых факторов и дополнительного источника азота белково-витаминный концентрат (БВК) дрожжей. Ввиду высокой стоимости дейтерий-меченных субстратов, и их малой доступности, было необходимо найти наиболее подходящий природный источник, из которого их можно легко выделять. В качестве такового использовали факультативные метилотрофные бактериии B. methylicum, которые весьма удобны для наработки высокодейтерированных БАС [см. например 8, 9]. Данный штамм метилотрофных бактерий, характеризовался устойчивым ростом и высокими выходами биомассы на среде, содержащей 98 об.% 2Н2О и 2 об.% С2Н3О2Н (см. диаграмму). Именно поэтому мы использовали гидролизаты его биомассы для культивирования штамма продуцента инозина.
При разработке рецептуры питательной среды учитывалось, что метилотрофные бактерии при росте на метаноле способны синтезировать большое количество полноценных белков (до 50% веса сухого вещества) [14], а также некоторое количество полисахаридов (до 10%) [15], причем эта способность сохраняется при росте на средах, содержащих тяжелую воду и дейтеро-метанол. Поскольку продуцент инозина является полиауксотрофным штаммом, нуждающимся для роста в тирозине, гистидине и аденине, было необходимо получать их из гидролизатов биомассы метилотрофных бактерий. Для этого проводили два метода гидролиза биомассы: 1. автоклавирование биомассы метилотрофных бактерий в 0,5 н. растворе 2НCl (в 2Н2O) (30 мин, 08 ати). 2. гидролиз биомассы в 6 н. 2НCl (в 2Н2O) (24 часа, 110 0С). В предварительных экспериментах было показано, что по-первому варианту гидролиза биомассы реализуется гораздо большая питательность суспензии метилотрофных бактерий по-сравнению с гидролизом в 6 н. 2Н2Сl. Поэтому мы отдали предпочтение этому методу проведения гидролиза биомассы.
Количественный и качественный состав аминокислот биомассы метилотрофных бактерий B. methylicum, а также степени дейтерированности аминокислот показаны в таблице. Как видно из данных таблицы, показателем, позволяющим надеяться на высокую эффективность включения дейтерия в синтезируемый продукт служит максимальный уровень дейтерированности аминокислот суммарного белка этих бактерий.
ТАБЛИЦА.
Аминокислотный состав метилотрофных бактерий B. methylicum, полученных в полностью дейтерированной среде dM9 и их уровни дейтерированности.
Аминокислота
Содержание в белке, %
Уровни дейтерированости, %
Глицин
9,69
90,0
Аланин
13,98
97,5
Валин
3,74
50,0
Лейцин
7,33
49,0
изолейцин
3,64
49,0
фенилаланин
3,94
95,0
Тирозин
1,82
92,8
Серин
4,90
86,6
треонин
5,51
не определяли
метионин
2,25
не определяли
аспарагиновая кислота
9,59
66,6
глутаминовая кислота
10,38
70,0
Лизин
3,98
58,9
Аргигин
5,27
не определяли
гистидин
3,72
не определяли
Экспериментально разработанный способ получения дейтерий-меченного инозина представлен на схеме. Его основные этапы: наработка дейтерированной биомассы метилотрофных бактерий B. methylicum путем культивирования бактерий в полностью дейтерированной среде dM9; выделение фракции общих белков биомассы и их гидролиз; ферментация базового штамма B. subtilis на среде, приготовленной на основе 99,9 ат% 2Н2О и гидролизатов биомассы метилотрофных бактерий; выделение инозина, включая его адсорбцию активированным углем, десорбцию спиртово-аммиачным (1:1) раствором и последующую кристаллизацию инозина из метанола. Чистоту полученного инозина контролировали методом тонкослойной хроматографии (ТСХ), используя в качестве сравнения хроматографически чистые стандарты нуклеозидов. ТСХ инозина, выделенного из культуральной жидкости, показала наличие в анализируемом образце единственного пятна с Rf = 0,51, соответствующего по подвижности чистому инозину.
Изучение ростовых и биосинтетических характеристик B. subtilis. При изучении роста штамма B. subtillis и уровня накопления инозина в КЖ использовали следующие среды:
1). Ферментационная среда (FM-среда), приготовленная стандартно на обычной воде.
2). Ферментационная среда, приготовленная из 99,9 ат.% 2Н2O (dFM-среда) и содержащяя дейтерий-меченную биомассу метилотрофных бактерий, выделенную, соответственно из среды dМ9.
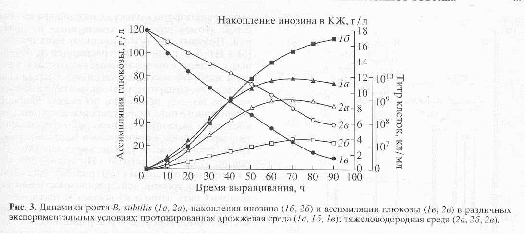
Кривые, отражающие динамику роста, ассимиляции глюкозы и накопление инозина в культуральной жидкости штаммом B. subtilis в условиях протонированной среды и среды, содержащей тяжелую воду и гидролизаты биомассы метилотрофных бактерий, представлены на рис.3. Сравнивая данные по росту штамма на протонированной и dFM-среде, можно заключить, что рост B. subtilis на dFM-среде (рис.3) слабо ингибируется дейтерием, поэтому выход биомассы, продолжительность лаг-фазы и длительность времени клеточной генерации при переносе клеток B. subtillis со стандартной на дейтерированную среду в целом изменяются незначительно. Как видно из рис.3, при росте штамма на среде, содержащей обычную воду уровень накопления инозина в культуральной жидкости достигал величины 18,3 г/л после пяти суток культивирования. Вместе с тем, биосинтез инозина на dFМ-среде, был снижен в 4,6 раз по-сравнению с исходным штаммом на протонированной среде (рис.3). Такие низкие уровни секреции инозина на dFM-cреде коррелируют со степенью конверсии глюкозы в этих условиях. Как видно из рис.3, кривая конверсии глюкозы на полностью дейтерированной среде имеет меньший угол наклона, чем на среде с обычной водой, что свидетельствует о том, что при росте на 2Н2O глюкоза расходуется менее эффективно. Вместе с тем мы не исключаем, что все эти вышеназванные эффекты могут возникать не вследствие ингибирования дейтерием биосинтеза , а в результате неэквивалентной замены БВК на биомассу метилотрофных бактерий. Предметом дальнейших исследований будет разработка и оптимизация сбалансированных по ростовым факторам сред на основе биомассы метилотрофных бактерий.
Полученные данные в целом подтверждают устойчивое представление о том, что адаптация к 2Н2О является фенотипическим явлением, поскольку адаптированные к тяжелой воде клетки возвращаются к нормальному росту и биосинтезу в протонированных средах после некоторого лаг-периода. В то же время обратимость роста на 2Н2O и Н2O средах теоретически не исключает возможности того, что этот признак стабильно сохраняется при росте в Н2О, но маскируется при переносе клеток на дейтерированную среду. Можно предположить, что клетка реализует лабильные адаптивные механизмы, которые способствуют функциональной реорганизации работы жизненно-важных систем в 2Н2O. Нам представляется выбор бактерий в качестве модельных объектов для этих целей наиболее целесообразным, так как прокариоты как организмы, стоящие на более низких ступенях развития живого,наиболее лабильны в генетическом аспекте и тем самым быстрее реагируют и приспосабливаются к изменчивым факторам среды. Для того чтобы сделать более конкретные выводы о природе и механизме адаптации клеток к тяжелой воде, необходимы экспериментальные данные по физиологии и биохимии адаптированных клеток.
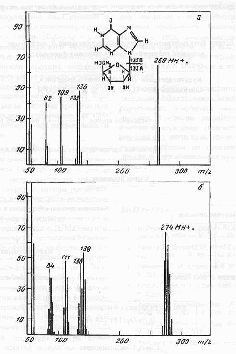
Исследование степени дейтерированности инозина. Масс-спектр полученного инозина приведен на рис. 4, б относительно контрольного (а) (немеченный инозин). Как видно из рис. 4, присутствие в масс-спектре дейтерированного образца пика, соответствующего катионизированному молекулярному иону инозина МН+. с m /z 274 (вместо m/z 269 в контрольных условиях), а также пиков характерных фрагментов рибозы [C5H9O4]+с m /z 136 (вместо m/z 133) и гипоксантина [C5H4ON4]+ 138 (вместо m/z 136) подтверждает, что степень дейтерированности инозина составляет 5 атомов из 8 детектируемых по скелету молекулы (62,5 % относительно общего количества атомов водорода в молекуле). Из пяти включенных в инозин атомов дейтерия, три локализуются в рибозной части молекулы, и два атома дейтерия - в гипоксантиновом остатке. Кроме этого, в масс-спектрах инозина детектируются пики с m/z 82 и 109, которые соответствуют продуктам распада гипоксантина.
Рис. 4
При анализе степени дейтерированности инозина учитывались следующие аспекты. Во-первых, вследствие того что протоны (дейтероны) в С’1-С’5 положениях рибозной части молекулы инозина могли происходить из глюкозы, авторы предположили,что характер биосинтетического включения дейтерия в рибозной части молекулы инозина определяется в основном функционированием ряда процессов гексозомонофосфатного ГМФ-шунта, связанных непосредственно с ассимиляцией глюкозы и других сахаров. Во-вторых, многочисленные обменные процессы и внутримолекулярные перегруппировки, происходящие с участием 2Н2O также могли приводить к специфическому включению метки по определенным позициям в молекуле инозина.Такими доступными позициями в молекуле инозина признаны прежде всего гидроксильные протоны -ОН и протоны при гетероатомах -NH (последние могут обмениваться на дейтерий в 2Н2O за счет кето-енольной таутомерии). Три атома дейтерия в рибозном остатке молекулы инозина могли происходить за счет функционирования многочисленных реакций ГМФ-шунта, два атома дейтерия в гипоксантине также могли синтезироваться de novo.
Преимущества разработанного метода получения высокодейтерированного инозина заключаются в следующих аспектах:
-1. В способности штамма B. subtilis к росту и биосинтезу инозина на среде, содержащей максимальные концентрации тяжелой воды.
-2. Замене необходимых для роста бактерий субстратов на гидролизаты дейтерий-меченной биомассы метилотрофных бактерий Brevibacterium methylicum. При последующих ферментациях в качестве источника ростовых факторов можно использовать ту же дейтерий-меченную биомассу метилотрофных бактерий, либо биомассу самого штамма-продуцента, содержащую в своем составе соединения, которые могут служить источниками углерода и ростовых факторов.
-3. В отсутствие большого количества отходов: согласно схеме дейтерий-меченная биомасса штамма продуцента, предварительно гидролизованная в 2НCl возвращается в цикл в качестве ростовых факторов.
-4. В высокой степени изотопного обогащения дейтерий-меченного инозина.
Таким образом, проведенные исследования подтвердили эффективность данного подхода для препаративного получения высокодейтерированного инозина. Согласно разработанной схеме можно получить несколько граммов дейтерий-меченного инозина с 1 литра культуральной жидкости. Аналогичные подходы по препаративному получению других дейтерий-меченных нуклеозидов в настоящее время активно изучаются.
ЛИТЕРАТУРА.
1. Lawrence P. McIntosh and Frederic W. Dahlquist //Quarterly Reviews of Biophysics. - 1990. - V.23. - N.1. - P.1-38.
2. Girishchandra B. Patel, G. Dennis Sprott, and Irena Ekiel. // Appl. and Environ. Microbiology. - 1993. - V.59. - No.4. - P.1099-1103.
3. LeMaster , D.M., and J.E. Cronan.// J. Biol. Chem. - 1982. - V.257. - P.1224-1230.
4. Katz J. and Crespi H.L. // Pure Appl. Chem. - 1972. - V.32. - P. 221-250.
5. Anthony C.// The biochemistry of methylotrophs. - London.:Acad. Press. - 1982. - P.430-500.
6. John Colby, Howard Dalton. // Ann. Rev. Microbiol. - 1979. - V.33. - P.481-517.
7. Webster. I.// Biotechnol. and Bioengeneery.- 1983. - V.25. - C.31-50.
8. Мосин О.В., Карнаухова Е.Н., Пшеничникова А.Б.,Складнев Д.А., Акимова О.Л. // Биотехнология. - 1993. - N.9. - С.16-20.
9. Егорова Т.А., Мосин О.В., Еремин С.В., Карнаухова Е.Н.,Звонкова Е.Н., Швец В.И. // Биотехнология. - 1993. -N.8. - С.21-25.
10. Karnaukhova E.N., Mosin O.V., Reshetova O.S.Biosynthetic production of stable isotope labelled amino acids, using methylotroph Methylobacillus flagellatum. // Amino Acids. - 1993. - V.5. - No.1. - P.125.
11. Миллер Дж. // Эксперименты в молекулярной генетике.- М.:Мир, -1976. - С.393.
12. Karnaukhova E.N., Reshetova O.S., Semenov S.Y., Skladnev D.A., Tsygankov Y.D. // Amino Acids. - 1994. - V.6. - P.165-176.
13. Bligh E.G., Dyer W.J. // Can. J. Biochem. Physiol. - 1959. - V.37. - N.8. - P.911-918.
14. Грачева И.М., Гаврилова Н.Н., Иванова Л.А. //Технология микробных белковых препаратов, аминокислот и жиров. - М.:Пищевая пром-ть, -1980. - С.291-295.
15. Зорина А.В, Бабусенко Е.С. Химический состав биомассы метилотрофных бактерий, современные проблемы биотехнологии микроорганизмов. // Тезисы докл. молодых ученых. - Рига.,1987. -С.35-40.
О. V. MOSIN
Мoscow State Academy of Fine Chemical Technology named after М.V. Lomonosov, 117571.
THE GROWTH OF BACTERIUM OF Basillus subtilis AND BIOSYNTHESIS OF INOSINE ON HIGHLY DEUTERATED MEDIUM.
The possibility for biosynthetic preparation of deuterated inosine obtained from the culture medium of inosine-producing strain B. subtilis was described. The method is based on using the deutero-compounds of facultative methylotrophic bacterium Brevibacterium methylicum obtained from the completely deuterated medium containing 98 v/v% 2Н2O и 2 об. v/v% С2Н3О2Н as a source of growth factors by cultivation of inosine-producing strain. The data on growth of strain of B. subtilis and biosynthesis of inosine on highly deuterated medium containing maximum concentratioms of 2H2O and deutero-compounds extracted from methylotrophic bacteria were described. The evaluation of deuterium enrichment of inosine was carried out using mass-spectrometry FAB. The data obtained testified to a high efficiency of deuterium incorporation into inosine (62,5 % hydrogen atoms are substituted with deuterium in molecule of inosine)

Нравится материал? Поддержи автора!
Ещё документы из категории биология:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ