Водень в шаруватих матрицях

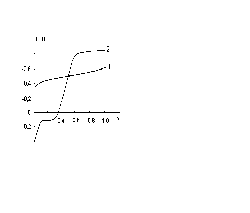
 Міністерство освіти і науки України
Міністерство освіти і науки України
Чернівецький національний університет
Імені Юрія Федьковича
Кафедра електроніки і енергетики
Реферат
Водень в шаруватих матрицях
Чернівці
2006
План
1. Загальна характеристика шаруватих кристалів А3В6
2. Ітеркаляція та інтеркаляти: основні методи та характеристики процесу
3. Водневі інтеркалянти
1. Загальна характеристика шаруватих кристалів групи А3 В6
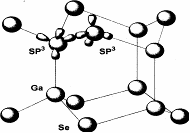
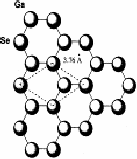
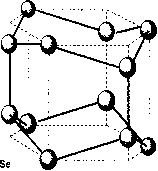
Шаруваті кристали зустрічаються в природі у вигляді мінералів, крім того, їх отримують синтетичним шляхом. Особливої уваги заслуговують халькогеніди складу А3B6, завдяки цікавим фізико-хімічним властивостям та можливостям широкого практичного застосування. Серед сполук цього класу, із яких тільки сульфід алюмінію нестійкий на повітрі, сульфід бору існує лише в газовій фазі, інші дев'ять стійкі в повітрі тверді речовини і складають наступні під групи кристалографічних аналогів: сполуки із структурою типу сульфіду галію, в яку кристалізуються GaS, GaSe, GаТе, ІnSе, ІnS та сполуки із структурою типу ТiS, ТiSе, і ІnSе. Телурид талію не має структурних аналогів серед матеріалів типу A3B6.Характер напівпровідникових властивостей обох підгруп сполук А3B6 відрізняється мало чим, але структурні особливості та деякі відмінності зв'язку між атомами вносять відмінності в ряд їх параметрів. В шаруваті структури кристалізуються GaS, GaSе, GaTe, ІnS і ІnSе, які складаються із стопки окремих шарів. Кристалографічна структура та атомне упорядкування всередині шарів однієї з цих сполук - GaSе показане на рисунках 1.1, 1.2.
Кожний одиничний шар складається із чотирьох щільно упакованих атомних площин у послідовності В-А i А-В (Gа, Іn, B, S, Se, Te). На рисунку 1.1. б) зображена проекція розміщення атомів в площині шару, а на рисунку 1.1. а) будова шару. Усередині кожного такого шару атоми мають ковалентний зв'язок такий, що кожен атом А (катіон) оточений тетраедром, який утворюють три атоми В (аніони) і другий атом-катіон. Атоми А мають тетраедричну координацію sр3, а атоми В - пірамідальну s3 із заповненою s2 оболонкою. Між окремими шарами в кристалах із структурою GaS існує зв'язок типу ван-дер-ваальса, що робить їх близькими з кристалами молекулярного типу. Окремі молекули в таких кристалах в дійсності слабо незалежні одна від одної і можуть розглядатися як димери із зв'язком метал-метал. При цьому слід відмітити, що геометричні характеристики їх викликають дещо інше просторове розташування атомів, ніж у GaS, без змін шаруватості структури або зв'язків між атомами. У цих сполук з'являються структурні модифікації.
Встановлена здатність шаруватих напівпровідників типу А3В6 до інтеркаляції катіонами лужних, лужноземельних металів, аніонами галогенів, а також органічними комплексами. Вплив інтеркаляції воднем на властивості моноселеніду галію і має як науковий інтерес, так і практичне значення: акумулятори водню, водневі фільтри, каталізатори,:електроди для паливних елементів та батарей.
Особливістю шаруватих кристалів є велика кількість у них власних структурних дефектів упаковки, таких як гвинтові дислокації. Можливими причинами виникнення цих дефектів можуть бути, наприклад, присутність неконтрольованих домішок у вихідній сировині, утворення в процесі росту двох близько розташованих центрів кристалізації, котрі знаходяться на одній грані кристалу і деформують один одного, а також механічна деформація
.
а) б)
Рисунок.1.1 - Кристалографічна структура GaSe. а)будова шару, в)проекція розміщення атомів в площині шару
Рисунок 1.2 - Атомне впорядкування в шарі GaSe
Наявність гвинтових дислокацій обумовлює дві яскраві риси структур шаруватих кристалів: політипізм і одномірне структурне розупорядкування. Дефекти упаковки грають дуже важливу роль у визначенні фізичних властивостей кристалів. У шаруватих кристалах такі дефекти упаковки приводять до шунтування шарових пакетів і маскування правдивої анізотропії фізичних властивостей, одномірної локалізації носіїв заряду, тощо.
Доступні для інтеркалювaння місця в напівпровідникових квазі-двомірних моноселенідах індію і галію знаходяться в областях ван-дер-ваальсових зв'язків, що утворюють гратку певної симетрії.
Так як вказані матеріали відносяться до структурних класів із щільною упаковкою, неважко пересвідчитися, що на одну молекулярну одиницю матриці - "господаря" приходиться одне октаедричне і два тетраедричних місця для втіленого "гостя" в міжшаровому просторі. Вочевидь, що в незмінній матриці граничне заповнення "гостьових" позицій відповідає значенню х=3. Однак, існує багато випадків інтеркаляції, яка приводить до значної зміни матриці.
2. Інтеркаляція та інтеркалати:основні методи та характеристики процесу
Інтеркальовані сполуки, як клас речовин, на відміну від інших груп хімічних сполук, обумовлених постійністю складу, структури та зв'язків, характеризуються загальним принципом реакції, тобто процесом інтеркалювння. У ході цієї реакції частки - "гості" дифундують у напрямку від поверхні в об'єм твердого тіла, займаючи там "гостьові" позиції. Важливим параметром такого процесу є температура, при якій відбувається реакція. Зазвичай, вона знаходиться в проміжку від 200 до 600 К, тому що при більш високих температурах стабільність матриці як правило порушується, а при нижчих температурах енергетичний активаційний бар'єр для дифузії часток - "гостей" може інгібітувати цю реакцію. Значне число отриманих при інтеркалюванні сполук, особливо з молекулярними "гостями", є метастабільними фазами, які іншими методами синтезувати не можна. У відповідності із структурними характеристиками, гратки- "господарі" схематично можна розділити на три різні групи одновимірні, що містять структурні елементи ланцюгового типу; двовимірні, утворені структурними елементами шаруватої матриці(гостьові позиції знаходяться в енергетичній щілині ван-дер-ваальса, розташованій між сусідніми шарами); тривимірні - 3^, з сотовою матрицею. У випадку одно - і двовимірних систем взаємодія між нейтральними структурними елементами матриці є слабкою, і тому в шаруватих або в ланцюгових твердих тілах можуть розміститися досить великі частки - "гості". Саме це обумовлює інтерес до дослідження процесів інтеркалювння, в першу чергу, граток - "господарів" із шаруватою структурою, так як вони характеризуються високою стійкістю матриці при помірних обмеженнях щодо розмірів часток -"гостей".
Частки - "гості", що інтеркалюють у ґратки шаруватих халькогенідів можна розділити на три групи: одноатомні частки: - s-, р-, або елементи періодичної таблиці Менделєєва; молекули - як органічні, так і неорганічні; комплекси катіон-розчинник - "конструкції" з полярними молекулами, які сольватують інтеркалюючі катіони. На кінетику реакції впливають як властивості самої ґратки - "господаря", так і властивості часток -"гостей". Зменшення розмірів часток впроваджуваної речовини як правило сприятливо впливає на швидкість реакції. Збільшення ефективного діаметра знижує швидкість реакції, незважаючи на сприятливі термодинамічні параметри. Тип і концентрація дефектів у гратці -"господарі" в значній мірі залежить від умов синтезу і від наступної обробки, наприклад, відпалу. Іноді навіть невеликі зміни стехіометрії приводять до погіршення реакційної здатності до інтеркалювння, тому що надлишкова кількість металу випадає в міжшарову щілину ван-дер-ваальса. Якщо швидкість реакції інтеркалювання досить висока, можна спостерігати макроскопічне розшарування монокристалів аж до повного їх руйнування. При повільній керованій реакції можна отримати інтеркальовані кристали задовільної якості.
В даний час неможливо наперед бути впевненим, зможуть дані частки -“гості” інтерпелювати у ґратки певного халькогеніду, чи ні. Це залежить не тільки від взаємодії ґратки - "господаря" і часток - "гостей", але і від кінетики масопереносу. Більшість інтерпольованих сполук були отримані методом проб і помилок.
Спочатку схеми моделей механізму протікання реакції інтеркалювання були розроблені для графіту, пластинчастих силікатів і дихалькогенідів перехідних металів на основі макроскопічних оптичних досліджень. Головне припущення полягало в тому, що впровадження протікає за допомогою дифузії через ребра шарів, причому спочатку реагують при поверхневі шари, а на наступних етапах - шари в об'ємі моно кристалу. Механізм утворення шаруватих інтеркальованих сполук. Дослідження інтеркалатів у більшості випадків мали на меті проаналізувати склад, і на основі рентгенівських вимірів визначалася між-шарова відстань. Однак через обмежену точність на основі цих даних можна зробити помилкові висновки, особливо у випадку молекулярних часток -"гостей". Здійснювались також спроби, у найпростіших випадках, одержати дані щодо структурного розташування молекул - "гостей" на основі геометричних факторів, що включають розміри молекул і виміри між шарових відстаней.
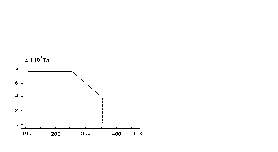
Протон є найбільш простою “гостьовою” частинкою, що може бути інтеркальована в шаруваті гратки - “господарі”. Займаючи місце в середині ряду електровід’ємностей, водень може істотньо модефікувати напівпровідникові властивості InSe та GaSe. Наявність інтеркаляції воднем встановлювали хімічним аналізом, що ґрунтується на потенціометричному титруванні з застосуванням іон селективних електродів. Спостережуваний зсув рівноважних потенціалів після інтеркалювання InSe та GaSe в від’ємну область (рисунок 1.3) пов’язаний з отриманням сполук впровадження змінного складу НхInSe та НхGaSe в області 0,10 < x < 0,21;0,38 < x < 0,41; та 0 < x < 0,11; 0,21 < x < 0,59 відповідно. Горизонтальні ділянки діаграм, що характеризуються незалежністю потенціалу від значення х, відповідають двофазній системі інтеркалат–інтеркалянт.
Рисунок 1.3 - Залежність рівноважного електродного потенціалу від складу для сполук НхInSe (1) та НхGaSe (2).
Процес інтеркалювання шаруватих нанопорошків протонами описується реакцією:
ШН + хН+ + хе– =НхШН
Тоді зміна енергії Гіббса в даній реакції може бути представлена у вигляді:
∆Gр=∆Gутв(НхШН)─ ∆ Gутв(ШН)─ ∆ Gутв(хН++хе-)
де: ∆ Gр=─neFE
тут: ne─ кількість електронів, що приймають участь в реакції; F─ число Фарадея; Е─ рівноважний електродний потенціал. Тоді вільна енергія утворення протонних інтеркалатів буде мати вигляд:
∆Gутв(НхШН)= ∆ Gр+∆Gутв(ШН)+ ∆ Gутв(хН++хе-)
Результати проведених розрахунків представлені в таблиці 1.1, в якій також приведені дані для зміни ентальпії, враховані на основі вимірів температурної залежності електродних потенціалів.
Таблиця 1.1.
Склад
х
∆Gр, кДж/моль
∆Gутв,
кДж/моль
∆H,
кДж/моль
НхInSe
0,1
0,2
0,5
0,6
6,657
23,060
26,920
28,849
106,458
90,005
86,195
84,266
50,847
34,444
30,584
28,655
НхGaSe
0,1
0,3
0,4
0,5
0,6
0,7
-30,489
-22,770
-6,368
36,567
39,462
42,356
191,853
184,134
167,732
124,797
121,902
119,008
116,746
109,027
92,635
49,690
46,795
43,901
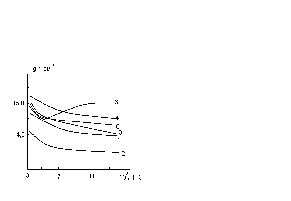
Унікальність протону, зумовлена відсутністю у нього електронної хмаринки і, таким чином, малими силами відштовхування при наближенні до нейтральних або заряджених частинок, призводить до того, що його рухливість велика навіть в твердих тілах. Так як інтеркалювання приводить до впровадження іонів в області слабких ван-дер-ваальсових зв'язків кристалів, в таких матеріалах слід очікувати зростання коефіцієнта дифузії. Підтвердження цьому отримане шляхом вимірювання потенціостатичних кривих включення, результат обробки яких в координатах lg i- lg дав значення коефіцієнта дифузії для InSe, рівне 6,910-4 см2/с. Вивчення явищ переносу в протонних інтеркалатах показало, що зміна с, та с в залежності від ступеня інтеркаляції немонотонний характер. Зростання х в НхInSe та НхGaSe приводить до пониження рухливості, особливо в температурній області рідкого азоту. При x > 0,3 залежність n(Т) набуває квазіступеневого характеру з послідуючою появою екстремуму (рисунку 1.4) а (Т) та (Т)–осциляційного виду.
Рисунок 1.4 - Температурна залежність n для НхInSe: 1-х = 0; 2-х = 0,05; 3- х = 0,15; 4-х = 0,35; 5-х = 0,55; 6-х = 0,95.
Проведене вивчення спектрів поглинання показало, що край власного поглинання зміщується в ІЧ - область. Спектри ІЧ - поглинання інтеркалатy НхInSe свідчать про значне зменшення пропускання по всій глибині забороненої зони, а в спектрах НхGaSe в області 0,3 < x < 0,7 виявлена смуга поглинання з максимумом при h 1.3 еВ. Розрахунки концентраційно-концентраційних флуктуацій водню в НхGaSe дозволяють отримати квазіступеневий характер n(T) пов'язати з ймовірним утворенням міні зон.
Методами твердотільної (широких ліній) та радіоспектроскопії високої роздільної здатності проведені дослідження стану водню, електрохімічним методом впровадженого в монокристали GaSe в широких концентраційному та температурному діапазонах. Вимірювання проводились на модернізованому радіоспектрометрі РН-2310 при = 60 МГц та частотах модуляції 1 лГц, 127 Гц. Дані результати представлені на рисунку 1.5 та на рисунку 1.6.
Рисунок 1.5 - Спектр ПМР сполуки впровадження НхGaSe
Рисунок 1.6 - Температурна залежність півширини “широкої” спектральної компоненти.
В спектрі ПМР інтекалатів можна відмітити “вузьку” та “широку” компоненти, причому подібні спектри спостерігаються лише в температурному інтервалі від 130 до 379 К, нижче якого зникає “вузька”, а вище і “широка” компоненти. Форма “вузької” компоненти, а також її концентраційний та температурний генезиси стали предметом досліджень. Форма “широкої” компоненти лінії свідчить про те, що за її виникнення відповідає “зв’язаний” стан домішки, подібно до того, як це має місце в гідридах перехідних металів. Подібно гідридам металів, при температурі 230 К на кривій (рисунку 1.6). Спостерігається злам, а при 370 К - різке звуження лінії до ширини її “вузької” компоненти.
Зроблений висновок, що при електрохімічному інтеркалювання GaSe воднем відбувається не тільки між шарове впровадження домішки, але й гідрування пакетів GaSe. При Т = 230 К відбувається плавне звуження лінії за рахунок реорієнтації атомів інтеркалянту (визначена енергія активації Еа = 11 ккал/моль), а при 370 К - вихід інтеркалянту з структури шарів в об’єм щілини та його інтенсивна деінтеркаляція з кристалу. Причому, як показало багатократне циклювання поблизу температури переходу, процес виходу водню з структури шару в міжшаровий простір є зворотнім (без врахування деінтеркаляції). Термостимульовану деінтеркаляцію водню з HxGaSe можна схематично зобразити так
Зворотність процесу між першими двома стадіями пояснюється незначною різницею вільної енергії інтеркалянту в структурі шару та в проміжку.
Шаруваті інтеркальовані сполуки вперше були отримані взаємодією графіту з літієм, однак систематичне їх вивчення розпочалося після виходу в світ робіт, присвячених літієвим акумуляторам та високотемпературній надпровідності. З тих пір отримано цілий ряд сполук інтеркалювання - шаруватих кристалів дихалькогенідів, трихалькогенідів, халькогенофосфатів і оксигалогенидів перехідних металів.
3. Водневі інтеркалянти
Відмінною ознакою шаруватих кристалів перед іншими матеріалами є те, що в них мають місце різні типи хімічного зв'язку по різним кристалографічним напрямкам (як правило ковалентний або іоно-ковалентний зв'язок в шаровому пакеті та ван-дер-ваальсівський зв'язок між ними). Шаровий пакет таких сполук складається з декількох атомних моношарів.
Ми знаємо, що інтеркалянти в загальному аспекті представляють собою не стехіометричні сполуки. В області концентраційних значень існування - х - їх фазовий стан може бути або однофазним, або являти собою почергові сегменти співіснування різних фаз - так званих двофазних областей, які, крім усього, можуть бути розділені однофазними інтервалами. Під фазою сполукою інтеркалювання слід розуміти стан системи "господар-гість", який однозначно описується сукупністю параметрів, в яку входять: хімічний склад, структура, спосіб "розквартирування" симетрія "гостьовою" підсистем.
"Рухаючись" по концентраційному чи температурному інтервалах спостерігати цілий ряд фазових переходів: неперервних, першого, другого і 2,5 родів. Для їх експериментального виявлення та встановлення природи найчастіше використовують методи калориметрії, рентгенофазового аналізу та спектроскопії електродного потенціалу. Найбільш універсальним і доступним е останній, бо для першого характерна невисока точність і відносна складність експериментальних методик (не говорячи уже про те, що він повинен "співпрацювати" з другим), а рентгеноструктурні дослідження не "працюють" в аморфних інтеркальованих системах, а також у випадках, коли ретикулярна електронна густина впроваджених атомів значно менша від такої в матеріалі -"господар!" (легкі атоми в каркасі з важких елементів). В таких випадках на рентгенограмах практично не видно фазових переходів, пов'язаних із зміною стану "гостьової підсистеми, якщо при цьому не змінюється положення важких атомів. Зрозуміло, що для остаточного визначення фазового стану, природи фазових переходів необхідно у взаємодоповнюваності використовувати зазначені способи, тим більше, що метод спектроскопа електродного може, строго кажучи, тільки вказувати на області можливих фазових переходів певного типу чи точок впорядкування, тобто особливості на дх/дV є необхідною, але не обов'язково достатньою умовою.
Однією з найважливіших задач теорії інтеркаляції е встановлення зв'язку між властивостями підсистем "господаря" і "гостя" та фазовими характеристиками їх "співжиття". На жаль, на нинішній день ще недостатньо накопичено експериментальних даних для однозначної відповіді на це запитання. Можна лише припускати, що проглядається кореляція між силою зв'язку "господар" - "гість", характером взаємодії "гість" -"гість" та фазовим станом інтеркалату. Так, при слабкій взаємодії впроваджених атомів між собою і з шарами кристалічної матриці а також при високих ступенях вільності коливального руху "гостей" найчастіше при нормальних умовах постерігається однорідний фазовий склад. Наприклад, LiхТiS2 (0 < х < 1); СuхТiS2 (0 < х < 0,7); графiт, інтеркальований електрохімічно Н2SО4, НСlО4, НВF4, Н2Р2. В багатьох випадках збільшення концентрації впроваджених "гостьових" компонентів приводить до переходу від однофазної системи до двофазних. Так, для LixMo6S8 i LixMo6Se8 в інтервалі 0 < х <1 параметри плавно змінюються з х, що вказує на те, що матеріал знаходиться в одній фазі. В цих концентраційних областях дуже добре "працює" модель "решіткового газу". В інтервалі 1 < х < 4 для LixMo6Se8 встановлено чотири фази: дві ромбоедричні, ромбоедрична з несумірною деформацією і триклінна. Ще вужча область х - існування однофазної системи спостерігається в оксидах, в яких "гостьові" позиції "викладені" атомами кисню, слабше зв'язаними з атомами шару ніж халькоген чи галоген. Той же самий літій в літій-марганцевих шпінелях LiMn2O4 в більшій області - х - існування сполуки Li1+хMn2O4 (хm=1,25) приводить до співіснування кубічної і тетрагональної фаз при 0,1 < х < 0,8;. Ці ж фази співіснують і в літій-залізних шпігелях LiFe5O8, доповнюючи співіснування фаз впорядкованими і розупорядкованими іонами літія і заліза. Ще більшу різноманітність фазових станів демонструє водень, впроваджений у V2O5. Метод спектроскопії електродного потенціалу вказує на існування в системі H2xV2O5 у відносно неширокій області 0 < х < 1,7 аж п'яти різних двофазних областей. При переході в ряду лужних металів Li до Na, К, Rb, Сs, що характеризуються більшою відновною силою, спостерігається тенденція і до звуження областей існування однорідної фазової системи. Не схильні утворювати однорідні фазові системи при інтеркалюванні сильно поляризуючі іони водню та срібла. В дихалькогенідах перехідних металів з -Н чи Аg спостерігається існування двофазних областей, що чергуються з однофазними. Так, для сполуки інтеркалювання AgxTiS2 (0 < х < 0,4) є три однофазних області: 0,05 < х < 0,09; 0,1 < х < 0,21 і 0,31 < х < 0,42. В проміжкових інтервалах х виникають двофазні гетерогенні суміші, а при х > 0,42 третя фаза співіснує з металічним сріблом. Для AgxNbS2 (0 < x < 0,76) спостерігаються два концентраційні інтервали, в яких фазовий склад однорідний: 0,22 < х < 0,30 та 0,55 < х < 0,76. При всіх інших х співіснують дві фази. Електрохімічно інтеркальовані моноселеніди індію і галію літієм мають однорідний фазовий склад, а Ві2Sе3 - ні. Аніони галогенів в цих структурах розбивають концентраційну х - вісь на почергові однофазні та гетерофазні ділянки.
Фазові переходи в системі "господар-гість" можуть відбуватися не тільки при зміні ступеня інтеркаляції (х), але і при зміні температури, тиску і т.п. Наприклад, методами "Х-ray absorbtion" встановлено, що в графіті, інтеркальованому молекулами - брому існує три структури: рідиноподібна (Т > 373 К), несумірна (Т > 350 К) і сумірна (Т < 350 К). існують думки, що модель однокомпонентної двовимірної рідини в анізотропному зовнішньому полі адекватно описує структуру системи інтеркальованого графіту.
Для повнішої характеристики систем -"господар-гість" необхідно ввести такий параметр, як хm - максимальне "гостьове" навантаження. Він позначатиме, яку максимальну кількість "гостьових" структурних одиниць можна впровадити на одну формульну одиницю матеріалу -"господаря". При х > хт буде співіснування фаз інтеркалянт - інтеркалянт, де останній, локалізуючись на поверхні, вестиме до різкого зменшення різниці електродних потенціалів "господар-гість" - "гість". зауважимо, що під х (як і хт) слід розуміти параметр процесу інтеркалювання, а тому в областях співіснування фаз його не слід ототожнювати зі стехіометричним коефіцієнтом певної фази, бо в двофазних областях при зміні х склад кожної фази залишається сталим, а змінюється тільки її кількість. Аналізуючи літературні дані, можна бачити дуже широкий інтервал значень.хт:від сотих долей - при інтеркалюванні NbSe2 молекулами ТСТQ, до 6 - 8 – при впровадженні іонів літія у ванадіеві оксиди(V6О13). Нещодавно було виявлено сполуку, яка відноситься до підкласу шаруватих силікатів формули Mg3Si4O10(OH)2 xm (по літію) для якої перевищує 20. Природньо, слід чекати, що в одинакових умовах хт повинно бути обернено пропорційне розміру “гостьових” частинок, хоч насправді строгої відповідності немає, а існує тільки загальна тенденція. Наприклад, для дисульфіду танталу досягнуте значення хт в сполуках інтеркалювання з воднем, літієм, n октадециламіном становить відповідно 0,87; 3; 0,66. В останньому випадку виявлено значне розширення кристалічної гратки, компенсація роботи якого пов'язана з величиною хт. З вищесказаного можна стверджувати, що хm в даній області температур визначається такою його величиною, яка в сукупності з іншими параметрами мінімізує енергосистеми "господар-гість". Цікавим і важливим є те, що існують свідчення,які вказують на залежність величини хт від способу отримання одного і того ж виду сполуки інтеркалювання. Цей факт, а також явна залежність максимального "гостьового" навантаження від температури синтезу до сьогоднішнього дня практично не вивчались, хоч вони і становлять значний інтерес для кращого розуміння феномену інтеркаляції.
Одним з "наріжних" параметрів, що описує сполуки інтеркалювання доповнюючи її фазові характеристики і вказуючи на характер зв'язку є зарядовий стан "гостьової" підсистеми. Більше того, можна допустити і снування безпосереднього зв'язку останнього з деякими особливостями фазового стану. Процеси передачі заряду від інтеркалянту до матриці чи навпаки в багатьох випадках е рушійною силою інтеркаляції і визначають фізико - хімічні властивості сполук інтеркалювання взагалі і конкретних фаз зокрема. При утворенні інтеркалатів теля досягнення рівноважного стану "гостьова" підсистема може бути нейтральною, додатньо чи відє'мно зарядженою. Відповідно, "гостьові" компоненти не обмінюються зарядом з матрицею, а виступають донорами чи акцепторами електронів. Одна і та ж "гостьова" частинка в різних матеріалах - "господарях" по різному проявляє свою здатність до обміну зарядами. Наприклад, атоми літія з чітко вираженими донорними властивостями, повністю іонізовані при хт в графіт (С6Li), де передача електронів графеновим шарам становить один електрон на один атом літія, в той час як для LixTiS2 повна іонізація "гостьової" підсистеми зберігається лише до х = 0,8, а при подальшому рості ступеня інтеркаляції літій залишає деяку густину s - електронів. Передача, електронів донорами шарам матриці характерна для металічних і напівметалічних фаз, а для напівпровідників і діелектриків ситуація може бути набагато складнішою особливо якщо буде зніматися виродження енергетичних рівнів впровадженої частинки. Як правило, при інтеркалюванні дихалькогенідів перехідних металів, іодидів свинцю і вісмуту відповідно Li, Fe, Co, Ti та донорними органічними молекулами відбувається передача електронів на рівні металічних атомів матриці, компенсуючи їхній додатній заряд, а величина цього переносу залежить від відновлюючої здатності інтеркалянту, яка спадає в ряду Fe, Ni, Co, Ti. Крім відновлюваної здатності інтеркалянту, ступінь іонізації "гостьової" підсилення може визначатися місцем локалізацією компонентів, як це спостерігається при інтеркалюванні CdPS2 фероценом. Вид і величина передачі заряду визначатимуть умови мінімізації енергії системи "господар - гість". Шаруваті кристали характеризуються сильною анізотропією механічних та електронних характеристик, зумовлених специфікою їх структури. Найбільш прийнятним методом зміни та керування властивостями шаруватих кристалів являється метод інтеркалювання (інтеркаляції), який на відміну від легування є легковідтворюваним та технологічним. З допомогою даного методу можна отримати інтеркалати шаруватих сполук із відтворюваними параметрами та використовуючи процеси інтеркаляція - деінтеркаляція ціленаправлено керувати їх властивостями.
Реакція інтеркалювання (інтеркаляції) представляє собою обернене впровадження рухомих частинок у гратку твердого тіла, причому в ході реакції впровадження атоми вихідної кристалічної ґратки не піддаються об'ємній трансляції за виключенням невеликого локального зміщення. Основна концепція реакції інтеркаляції може бути описана наступним виразом:
хА + □х [2] Ах[Z]
Виходячи з вищенаведеного виразу, реакція інтеркаляції проходить за рахунок топотактичного поглинання об'єктів впровадження (А) граткою твердого тіла [2], в якій є в наявності незаповнені вузли ґратки (П). Наявність в сполуках А3В6 “міжшарового” простору із слабким ван-дер-ваальсівським зв'язком забезпечує існування двохмірної множини незаповнених октаедричних та тетраедричних положень гратки, які можуть бути зайняті різними інтеркалюючими домішками.
Розрізняють три методи інтеркалювання: хімічний, метод термодифузії та електрохімічний. При використанні хімічного методу інтеркалюємі кристали безпосередньо занурюються в розчин інтеркалянта. Метод термодифузії або термічний метод реалізовується шляхом нагрівання зважених сумішей елементів (інтеркалянтів) разом із шаруватими кристалами у відкачаних кварцевих трубках на протязі декількох днів при температурі ~ 800°С. Електрохімічний метод може бути використаний для інтеркаляції органічних речовин: водню, лужних металів, галогенів та ін. В залежності від виду впровадженої домішки інтеркалюємий зразок анодно або катодно поляризують. Для здійснення даного методу монокристал приводиться в контакт з електролітом.
Література
Чарная Е.В., Барвинников С.В. Эволюция NaNO3 в пористых матрицах. ФТТ, 2004, т.46, в.12, С. 2224 - 2228.
Андриевский Р.А. Наноматериалы: концепция и современные проблемы. Рос. хим. ж. 2002, Т.XLVI, №5, С.50 - 55.
Физикохимия ультрадисперсных систем: Сб. трудов V Всерос. конф. под ред. В.В.Иванова. Екатеринбург: УрО РАН, 2001.

Нравится материал? Поддержи автора!
Ещё документы из категории физика:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ