Характеристика алкадієнів












АЛКАДІЄНИ
1. Номенклатура. Класифікація
Назви алкадієнів утворюються як похідні від назв відповідних алканів при заміщенні суфікса -н закінченням -дієн, після якого через дефіс зазначаються локанти, тобто номери атомів карбону, з яких починаються подвійні звязки. При цьому головний ланцюг нумерують таким чином, щоб до нього входили обидва подвійних звязки, а атоми карбону, сполучені подвійними звязками, одержали найменші номери.
Для деяких алкадієнів користуються тривіальною номенклатурою, наприклад:
CH3
CH2=CH-CH=CH2 CH2=C-CH=CH2 CH3-CH=CH-CH=CH2
Бутадієн-1,3 2-Метилбутадієн Пентадієн-1,3
(дивініл) (ізопрен) (піперилен)
Залежно від взаємного розміщення подвійних звязків алкадієни поділяються на три групи:
-ізольовані, в яких подвійні звязки в ланцюгу розділені одним чи декількома sp3-гібридизованими атомами карбону:
>C=CH-(CH2)n-CH=C<, де n = 1,2,3…;
Ізольовані алкадієни виявляють хімічні властивості, подібні до звичайних алкенів з тією лише різницею, що у реакцію може вступати не один, а два подвійних звязки незалежно один від одного;
-кумульовані алкадієни, в яких обидва подвійні звязки знаходяться поруч і належать одному атому карбону, наприклад:
СН2=С=СН2
Пропадієн (ален)
Цю групу алкадієнів часто називають аленовими вуглеводнями за першим членом гомологічного ряду; аленові вуглеводні є нестійкими сполуками, вони швидко ізомеризуються в алкіни, тому не мають самостійного значення;
-спряжені алкадієни, в яких подвійні звязки розділені лише одним -звязком С-С:
>C=CH-CH=C<.
Саме спряжені алкадієни мають найважливіше значення в органічному синтезі.
2. Електронна будова спряжених алкадієнів
Спряжені сполуки з почерговим розміщенням подвійних і одинарних звязків між атомами карбону в ланцюгу відрізняються за хімічними властивостями від інших ненасичених вуглеводнів, що зумовлюється наявністю електронного ефекту спряження.
Спряження – це виникненя єдиної π-електронної хмари внаслідок перекривання негібридизованих рZ-орбіталей атомів карбону, які одночасно утворюють подвійні та одинарні звязки С-С.
Найпростішим спряженим алкадієном є бутадієн-1,3, в якому всі чотири атоми карбону перебувають у sp2-гібридизованому стані і складають -скелет молекули (рис.1). Причому осі sp2-гібридизованих орбіталей знаходяться на одній площині, а негібридизовані рz-орбіталі кожного атома карбону перпендикулярні до площини -скелета і паралельні одна відносно одної. Це створює умови їх взаємного перекривання не тільки між атомами С1-С2 і С3-С4, але й частково між С2-С3. Завдяки такому боковому перекриванню чотирьох рz-орбіталей утворюється єдина -електронна хмара – так зване ,-спряження звязків, при якому -електрони вже не належать окремим звязкам, а делокалізуються по спряженій системі в цілому.
Делокалізація електронної густини – це її розподілення по всій спряженій системі, по всіх звязках і атомах.
Рисунок 1 – Утворення спряженої системи в молекулі бутадієну-1,3: жирним пунктиром показане перекривання негібридизованих рz-орбіталей над і під площиною -скелета
Делокалізація -електронів супроводжується виділенням енергії. Оскільки спряжені системи мають менший запас енергії, вони виявляють більшу стійкість порівняно з ізольованими алкадієнами. Енергія, що вивільняється за рахунок спряження, називається енергією делокалізації, або енергією спряження; для бутадіну-1,3 вона складає 15кДж/моль.
У результаті утворення спряженої системи довжини звязків частково вирівнюються і стають меншими, ніж довжина одинарного звязку в алканах (0,154нм), але більшими, ніж довжина подвійного звязку в алкенах (0,133нм):
Н Н
Н 0,137 нм С 0,146 нм С
С С 0,137 нм Н
Н Н
Схематично ефект спряження та вирівнювання довжин звязків зображують стрілками чи крапками:
СН2===СН---СН===СН2
СН2 СН СН СН2
3. Ізомерія алкадієнів
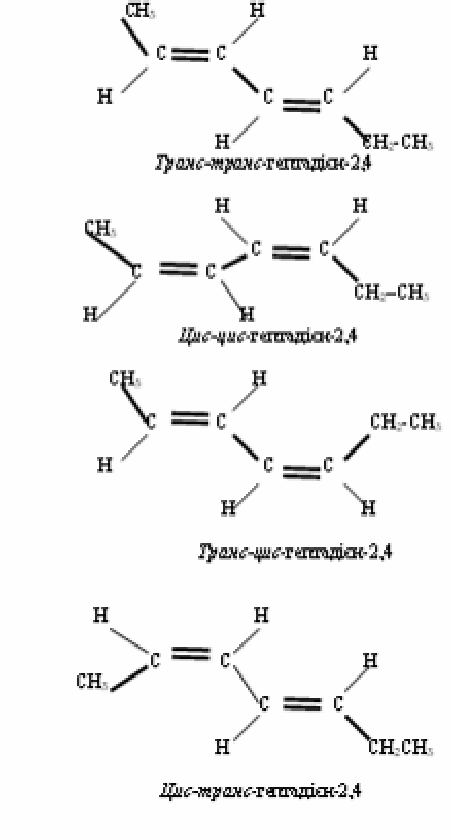
Алкадієни здатні виявляти структурну і просторову (геометричну) ізомерію. Наприклад, для складу С7Н12 ізомери можуть відрізнятися різним положенням як подвійного звязку і бокових радикалів, так і різним просторовим розташуванням вуглецевого ланцюга.
Приклади структурних ізомерів:
СН2=СН-СН-СН=СН–СН3 СН3-С=СН-СН=СН-СН3
СН3 СН3
3-Метигексадієн-1,4 2-Метилгексадієн-2,4
Просторові ізомери гептадієну–2,4
4. Фізичні властивості
За звичайних умов тільки ізомери С4Н6 перебувають у газовому стані, ізопрен – рідина, решта дієнових вуглеводнів є рідинами чи твердими речовинами залежно від довжини і розгалуженості вуглецевого скелета. Всі вони малорозчинні у воді, але добре розчиняються в органічних розчинниках.
5. Хімічні властивості спряжених алкадієнів
Для алкадієнів найбільш характерними є реакції електрофільного приєднання АЕ, однак на відміну від алкенів наявність спряженої системи дає деякі особливості в реакціях АЕ. Це зумовлює можливість одержання двох продуктів. Один з них отримується за рахунок приєднання за місцем будь-якого подвійного звязку – такий шлях реакції позначають терміном 1,2-приєднання. А інший продукт утворюється внаслідок приєднання до крайніх атомів С, що складають спряжену систему, – так зване 1,4-приєднання. Переважний напрямок проходження реакції залежить від умов її проведення та природи реагентів.
І Реакції електрофільного приєднання АЕ.
1 Гідрування при використанні паладієвого каталізатора проходить за 1,2-положенням. Якщо гідрування проводять за допомогою водню у момент його виділення (наприклад, внаслідок дії натрієм на спирт), то реакція проходить переважно за 1,4-положенням. На першій стадії утворюються алкени:
+Н2 [Pd]
------------------- CH3-CH2-CH=CH2
1,2-Приєднання Бутен-1
СН2=СН-СН=СН2---–
Бутадієн-1,3
+Н2 (2С2Н5ОН +2Na)
-----------------------CH3-CH=CH-CH3.
1,4-Приєднання Бутен-2
При надлишку водню відбувається повне гідрування з утворенням алканів:
Pt
СН2=СН-СН=СН2+ 2Н2(надл.)-------- CH3-CH2-CH2-CH3.
Бутадієн-1,3 Бутан
2 Галогенування. Залежно від будови дієнового вуглеводню, природи галогену і умов проведення реакцій можуть утворюватися різні продукти. Найчастіше приєднання стехіометричної кількості (1:1) хлору Cl2 приводить до приблизно однакового виходу 1,2- і 1,4-дихлоралкенів, а при бромуванні переважає 1,4-продукт.
1,4-Приєднання
------------------- CH2-CH=CH-CH2
СН2=СН-СН=СН2 + Hal2--- Нal Нal
Дивініл 1,4–Дигалогенбутен–2
1,2-Приєднання
-------------------- CH2-CH-CH=CH2
Нal Нal
3,4-Дигалогенбутен–1
При надлишку галогену утворюються тетрагалогеналкани:
СН2=СН-СН=СН2 + 2Br2 (надл.) H2Br-CHBr-CHBr-CH2Br.
Дивініл 1,2,3,4- Тетрабромбутан
3 Гідрогалогенування. Приєднання галогеноводнів підлягає тим самим закономірностям. Якщо реакція проходить за 1,2-положенням, то діє правило Марковникова:
1,4-Приєднання
----------------------- CH3-CH=CH-CH2Br
1-Бромбутен-2
СН2=СН-СН=СН2 + HBr---
Дивініл 1,2-Приєднання
------------------------- CH2=CH-CHBr-CH3
3-Бромбутен-1
1,4-Приєднання
----------------- CH3-CH2-CHBr-CH2Br
1,2-Дибромбутан
СН2=СН-СН=СН2 + 2HBr----
Дивініл (надл.) 1,2-Приєднання
------------------- CH3-CHBr-CHBr-CH3
2,3-Дибромбутан
4 Гіпогалогенування на відміну від попередніх реакцій АЕ проходить переважно у 1,2-положенні згідно із правилом Марковникова:
- + 1,2-
CH2=CH-CH=CH2 + HO-Br ----- CH2Br-CH(OH)-CH=CH2
Дивініл 4- Бромбутен-1-ол-3
ІІ Синхронні (молекулярні) реакції
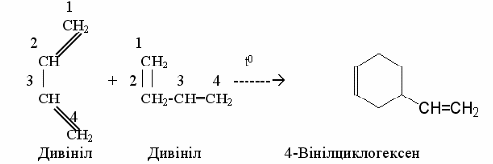
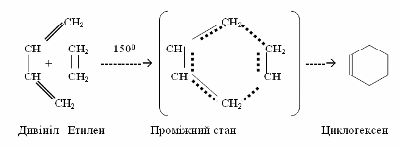
Прикладом синхронних реакцій, при яких розрив хімічних зв’язків проходить одночасно в обох вихідних речовинах, є синтез Дильса-Альдера – нагрівання дієнових вуглеводнів з алкенами чи іншими сполуками, які містять один подвійний звязок >C=C< у ланцюгу. Цей процес широко використовується для одержання шестичленних циклів.
ІІІ Ди- і полімеризація
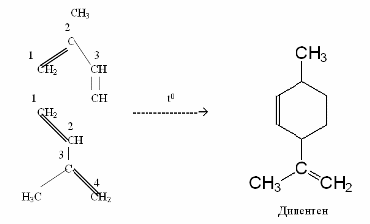
1Димеризація - це сполучення двох молекул алкадієну,
причому одна з молекул реагує за 1,2-, а інша – за 1,4-положенням, наприклад:
Таким чином можна одержувати штучні терпени, наприклад, дипентен:
2 Полімеризація. Алкадієни легко піддаються полімеризації з утворенням каучукоподібних полімерів.
Приєднання молекул мономеру одна до одної може проходити як за 1,2-, так і за 1,4-положенням – залежно від умов проведення реакції та природи каталізатора.
Al(C2H5)3 TiC
n CH2=CH-CH=CH2 ------------------- (-CH2-CH=CH-CH2-)n
Дивініл Бутадієновий каучук
ІV. Окиснення
1 Реакція Вагнера приводить до багатоатомних спиртів
[O] CH2-CH-CH-CH2
CH2=CH-CH=CH2 ------------
KMnO4, H2O OH OH OH OH
Дивініл Бутантетрол-1,2,3,4
2 Сильні окисники руйнують подвійні звязки:
[O] CH2-CH-CH-CH2
CH2=CH-CH=CH2 ------------
KMnO4, H2O OH OH OH OH
Дивініл Бутантетрол-1,2,3,4
3 Озонування (реакція Гарієса) дозволяє встановити будову вихідного алкадієну за складом продуктів, що утворилися, наприклад
O O
CH2=C-CH=CH2 + 2О3 –> CH2 C–CH CH2
O––O O––O
CH3 CH3
Ізопрен Озонід ізопрену
2H2O
–––––––––> 2HCHO + CH3-C-CHO + 2H2O2
(Zn)
O
Метаналь 2-Оксопропаналь
(формальдегід)
6. Одержання алкадієнів
Завдяки великому промисловому значенню алкадієнів розроблено багато способів їх добування.
1 Ступеневе дегідрування бутану та ізопентану над
змішаним каталізатором – оксидом хрому (ІІІ) на оксиді алюмінію:
t0, kat t0, kat
СН3-СН2-СН2-СН2 ––––– CH3-CH2-CH=CH2 –––––
–H2 –H2
––––––> CH2=CH-CH=CH2.
2Реакція Лебедєва – одночасне дегідрування і дегідратація етанолу:
4400C
2СН3-СН2-ОН ––––––– CH2=CH-CH=CH2 + 2H2O + H2.
ZnO/Al2O3
Лабораторні способи
-дегалогенування віцинальних тетрагалогеналканів за допомогою цинку чи магнію:
CH2Br-CHBr-CHBr-CH2Br +2 Zn CH2=CH-CH=CH2 +2 ZnBr2.
1,2,3,4-Тетрабромбутан Дивініл
-дегідрогалогенування 1,4-дигалогеналканів спиртовим розчином лугу:
CH2Br-CH2-CH2-CH2Br+2КОН(спирт.)
1,4-Дибромбутан ––––>CH2=CH-CH=CH2+2KBr+ 2H2O.
Дивініл
-дегідратація -гліколів (двоатомних спиртів з гідроксильними групами в 1,4-положеннях):
СН2-СН2-СН2-СН2 t0
––––––––– CH2=CH-CH=CH2 + 2H2O.
OH OH H2SO4(к)
Бутандіол-1,4
7. Застосування алкадієнів
Алкадієни (ізопрен, дивініл) використовуються для одержання синтетичних каучуків.
Натуральний каучук – високоеластичний матеріал природного походження, який одержують із латексу – соку каучуконосних рослин (гевея, гваюла, кок-сагиз, тау-сагиз та ін.) - при дії на нього коагулянтом – оцтовою кислотою.
За складом і будовою натуральний каучук являє собою ізопреновий полімерний ланцюг із цис-конфігурацією, при якій всі однакові групи (у даному випадку –СН2–) розміщені з одного боку від подвійного звязку. Такий полімер називається стереорегулярним:
---СН2 СН2---
С===С
СН3 Н n
Макромолекула натурального каучуку складається у середньому з 250 елементарних ланок, а молекулярна маса коливається у межах 150000-500000.
Для надання каучуку міцності та стійкості до зношування, перепадів температур, дії розчинників і агресивних хімічних реагентів, його піддають вулканізації – нагріванню із сіркою (вулканізатор) у суміші з наповнювачем (найчастіше це сажа), внаслідок чого ланцюги нормальної будови зшиваються у сітчасті тривимірні макромолекули. Вулканізований каучук називають гумою. Гума містить значно менше подвійних звязків, ніж каучук, оскільки частина їх руйнується при взаємодії із сіркою (рис. 2).
Якщо вміст сірки досягає 32%, подвійних звязків не залишається, окремі ланцюги фіксуються сульфідними містками, а каучук перетворюється на ебоніт –– тверду речовину з іншими властивостями.
Натуральний каучук – дефіцитний дорогий продукт, тому розроблені способи добування синтетичних каучуків із заданими властивостями. Для цього застосовують процес сополімеризації – сумісної полімеризації алкадієнів з іншими ненасиченими сполуками, які можна розглядати як похідні етилену: з вінілхлоридом СН2=СНСl, стиреном СН2=СН-С6Н5, акрилонітрилом СН2=СН-CN.
Наприклад, сополімер бутадієну і стирену – бутадієнстиреновий каучук, який завдяки великій міцності та стійкості до зношування використовується для виробництва автомобільних шин. Схема сополімеризації:
n CH2=CH-CH=CH2 + n CH2=CH ---
C6H5
Бутадієн-1,3 Стирен
С6Н5
–––––> (-CH2-CH=CH-CH2-CH-CH2-)n
Бутадієнстиреновий каучук (БСК)
Із галогенопохідних дієнових вуглеводнів також одержують цінні види каучуків, наприклад, хлоропреновий каучук, який має високу світло- і термостійкість, а також стійкість до дії розчинників, бензинів, олій, тому на його основі виробляють бензопроводи, шланги для нафтопромислів тощо.
n CH2=CH-C=CH2 ------- (-CH2–CH=C-CH2- )n
Cl Cl
2-Хлорбутандієн-1,3 Хлоропреновий каучук
(хлоропрен)
СH3 S H3C S H3C
…--CH2—C—CH—CH2—CH2—C==C—CH2—CH2––C––CH––CH2—…
H3C S CH3 H3C S
…--CH2—C—CH — CH2—HC ==C—CH–– CH2— CH==C—CH—CH2–…
S S
Рисунок 2 – Схема утворення сітчастої структури внаслідок вулканізації натурального каучуку (пунктиром показані межі елементарних ланок)

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ