Имидазол. Его строение и свойства
1. Введение
Актуальность работы. Центральное положение в современной синтетической органической химии занимают исследования связанные с развитием методов направленного синтеза сложных органических молекул с целью получения физиологически активных веществ с избирательным действием. В связи с постоянно возрастающей потребностью получения новых биологически активных соединений, изучение химических свойств реакционноспособных субстратов на основе азотсодержащих гетероциклических соединений является одной из актуальных задач современной синтетической органической химии. К числу таких реакционноспособных субстратов следует отнести замещенные диазолкарбимины. Производные на основе замещенных 1,1’-диазолкарбиминов могут быть использованны для синтеза 1,5-дизамещенных тетразолов.
Цель работы. Разработка методов синтеза N-алкилзамещенных 1,1’-диазолкарбиминов. Изучение взаимодействия диазолкарбимина с йодистым метилом. Исследование физико-химических и спектральных свойств синтезированного соединения.
Научная новизна. Разработан метод синтеза N-алкилбис(азолил-1)метаниминов, основанный на взаимодействии 1,1’-диазолкарбиминов с йодистым метилом. Впервые синтезирован N-метилбис(имидазолил-1)метанимин, который может быть использован для синтеза 1,5- дизамещенных тетразолов. Для обсуждения возможных направлений реакции осуществлен квантово-химический расчет молекул.
Практическая ценность работы. Разработан метод синтеза N-метилбис(имидазолил-1)метанимина. Установлены физико-химические характеристики полученного соединения.
2. Обзор литературы
2.1. Имидазол. Его строение и свойства
К классу имидазолов принадлежит ряд природных и синтетических соединений, обладающих физиологической активностью. Сам имидазол проявляет слабое физиологическое действие и является сравнительно мало токсичным. Но степень физиологического действия и его направленность в значительной степени определяются природой заместителя.
Химия всех соединений, которые содержат остаток имидазола
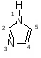
Может быть объединена под общим названием химии имидазолов.
Имидазол был впервые получен Дебу (1858 год). Из продуктов реакции глиоксаля с аммиаком Дебу выделил соединение нового типа и назвал его глиоксалином [1].
Имидазол (1,3 – диазол, глиоксалин), имеет бесцветные кристаллы с моноклинной решеткой, хорошо растворяется в воде, этаноле, бензоле, плохо – в углеводородах. Молекулы имеют плоскую конфигурацию и ассоциированы благодаря водородным связям [2]. Для имидазола характерна прототропная таутомерия, вследствие чего положения 4 и 5 равноценны [3].
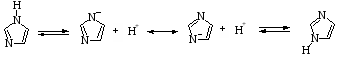
Имидазол обладает ароматическими свойствами. Для того чтобы получить представление о некоторых свойствах и реакционной способности имидазола, необходимо рассмотреть основные резонансные структуры и их участие в общей структуре. Относительная высокая кислотность имидазольного ядра может быть объяснена наличием в резонирующей системе неподеленной пары электронов, принадлежащей атому азота группы – NH. Это приводит к образованию некоторого положительного заряда на азоте, что, очевидно, способствует протонизации.
Если происходит образование соли, то анион стабилизируется посредством резонанса. Резонанс способствует также уменьшению электронной плотности на другом атоме азота и, таким образом уменьшению его основности. Однако если образуется соль, то вследствие резонанса происходит стабилизация катиона и повышается основность [1]. Можно считать, что положительный заряд не фиксирован на одном из атомов азота, поскольку изомерные 1,4 – и 1,5 – диметилимидазолы с йодистым метилом образуют один и тот же катион.
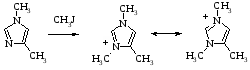
Алкильные группы, действуя как электронодонорные группы, увеличивают электронную плотность у атома азота, обладающего основными свойствами, и тем самым увеличивают основность.
Атом N – 1 обуславливает кислотность. По атому N – 1 легко образуются также N – арил -, N – алкил -, N – ацилпроизводные. Атом N – 3 основный центр, по которому протекает протонирование и комплексообразование. Наличие атомов N двух типов способствует электрофильному замещению в положения 4 и 5, нуклеофильному – в положение 2. Карбоксилирование имидазола протекает в положения 4 и 5, металлирование N – алкил – и N – арилпроизводных – в положение 2. Имидазол устойчив к действию большинства окислителей и восстановителей: не окисляется HNO3, H2CrO4, KMnO4, но расщепляется под действием пероксидов [2].
2.2. Реакции алкилирования
Алкилирование – введение алкильной группы в молекулу органического соединения, а также получение алкильных производных химических элементов. В зависимости от того, к какому атому присоединяется алкильная группа, различают C -, O -, N -, S – алкилирование. Наиболее часто в качестве алкилирующих агентов используют алкилгалогениды, алкены, спирты. Катализаторы – минеральные (H2SO4, HF) и апротонные (AlCl3, BF3) кислоты. Механизм алкилирования наиболее подробно изучен на примере C – и O – алкилирования. Реакции с участием алкилгалогенидов, спиртов протекает, например, для ароматических соединений, следующим образом:
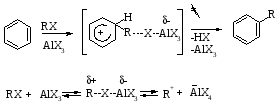
где X – галоген, R – алкильная группа.
Поскольку третичные алкилгалогениды ионизируются легче всего, вторичные – труднее, а первичные практически не ионизируются, вероятность образования соответствующих карбкатионов уменьшается в том же ряду [2].
2.3. Алкилирование имидазолов
В общем виде, не принимая во внимание механизм процесса непосредственного введения заместителей в имидазольное кольцо, реакцию можно представить как простую замену водородного атома NH – группы каким – либо радикалом R:
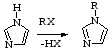
Однако N – замещение в имидазольном ядре далеко не так просто. Следует учитывать, что имидазол может вступать в реакцию алкилирования в зависимости от условий, а иногда и параллельно, в форме основания (SE2 и SE2| - механизмы), аниона (SE2 cB - механизм) или в форме сопряженной кислоты (SE2 cA - механизм).
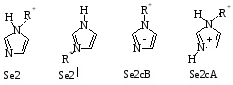
Классический метод получения N – алкилимидазолов состоит в реакции между гетероциклом и йодистым алкилом в запаянной трубке при 100 – 150°С. В этих условиях реакция протекает преимущественно через атом азота - 3 (SE2| - механизм):
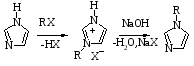
Если бы процесс останавливался на стадии образования галоидгидрила N – замещенного, этот метод мог бы дать теоретическое количество алкилимидазола. На самом деле при алкилировании имидазола в нейтральной среде выход N – замещенного в лучшем случае достигает 50%. Наиболее благоприятные результаты дает алкилирование имидазолов в присутствии основных агентов. Повышение нуклеофильности атомов азота в анионе имидазола позволяет проводить алкилирование при более низкой температуре [4].
3. Экспериментальная часть
3.1 Исходные вещества для синтеза 1,1'-карбимидоилдиимидазола
Для синтеза 1,1'-карбимидоилдиимидазола цианопроизводного ароматического азотсодержащего гетероцикла использовались следующие соединения: имидазол, бензол, бромциан. Перед использованием бензол очищали по стандартной методике.
3.2. Исходные вещества для изучения взаимодействия 1,1' карбимидоилдиимидазола с йодистым метилом
1,1'-Карбимидоилдиимидазол синтезировали взаимодействием имидазола с бромцианом по методике [5]. Йодметил и триэтиламин использовались без дополнительной очистки.
3.3. Очистка растворителей.
Технический бензол встряхивают несколько раз по 20 – 30 минут отдельными порциями с концентрированной серной кислотой(10% от объема бензола). После отстаивания отделяют нижний кислотный слой. Обработку ведут до тех пор, пока кислотный слой не останется бесцветным или слабо окрашенным в желтый цвет, а проба на тиофен станет отрицательной. Очищенный бензол промывают 2 раза водой, 10% - раствором NaOH, снова водой, а затем высушивают безводным хлоридом кальция и перегоняют, собирая фракции пи температуре 80 - 81°C [6].
3.4. Физико-химические исследовании
ИК спектры синтезированного соединения регистрировали на спектрофотометре ИКС-29 в KBr. Тонкослойную хроматографию проводили на пластинах Silufol UV-254. Температуру плавления определяли на ТОП-1. Упаривали на роторном испарителе ROTADEST(Made in Hungary).
3.5. Синтез 1,1'-карбимидоилдиимидазола
К раствору имидазола (0,500 г; 7,34*10-3 моль) в 50 мл безводного бензола прибавили раствор бромциана (0,260 г; 2,45*10-3 моль) в 20 мл безводного бензола. Смесь кипятили 1 час. Выпавший осадок гидробромида имидазола отфильтровали. Фильтрат упарили до 10 мл и охладили во льду. Закристаллизовавшийся продукт отфильтровали и сушили. Выход составил 0,110г (89%). Температура плавления 103 - 104°C.
3.6. Синтез N-метилбис(имидазолил-1)метанимина.
1,1’-Карбимидоилдиимидазол (0,110 г; 6,8*10-4 моль), растворяли в бензоле (2 мл), к полученному раствору добавляли йодистый метил (0,015 мл; 6,8*10-4 моль) и триэтиламин (0,094 мл; 6,8*10-4 моль). Реакционную смесь выдерживали при комнатной температуре в течение 1 часа. Отфильтровывали выпавший осадок N-метилбис(имидазолил-1)метанимина. Температура плавления 140°C. Выход 0,091г (76%).
4. Обсуждение результатов.
В работе было показано, что взаимодействие бромциана с H-формой молекулы азола (1:2) в среде безводного апротонного растворителя приводит к образованию 1-цианазола. В тоже время реакции трехкратных избытков азолов с бромцианом в аналогичных условиях не останавливается на стадии 1 - циазолов, а идут дальше с образованием 1,1'-карбимидоилдиимидазола [7].Синтез этого соединения проводили взаимодействием имидазола с бромцианом в среде безводного бензола при температуре 80°C в течение 1 часа. Реакция протекает по следующей схеме:
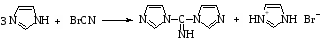
Выход продукта составляет 89%.
Чистота полученного соединения контролировалась методом тонкослойной хроматографии на пластинах Silufol UV-254 в системе тетрагидрофуран (ТГФ). В ИК-спектре полученного соединения наблюдаются полосы поглощения 3300 см-1, что соответствует валентным колебаниям N-H связи имино группы. Изучение кинетики и механизма реакции нуклеофильного присоединения по C=N связи эфиров циановой кислоты показало, что такие нуклеофилы как спирты, фенолы и ароматические амины взаимодействуют с цианатами по тримолекулярному механизму присоединения с образованием шестичленного переходного состоянии [8-9]:
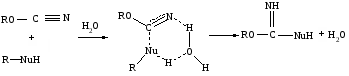
Химические свойства N – цианазолов во многом аналогичны свойствам арилцианатов, поэтому нами предложен механизм образования 1,1' карбимидоилдиимидазола, в котором имидазол является и реагентом, и катализатором данной реакции:
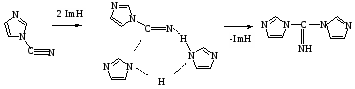
где Im – имидазолил-1.
Полученный 1,1'-карбимидоилдиимидазол, представляет собой белое, кристаллическое вещество с температурой плавления 104°C.
Реакцию алкилирования диазолкарбиминов изучали на примере алкилирования 1,1'-карбимидоилдиимидазола йодистым метилом в присутствии основания триэтиламина в среде неполярного апротонного растворителя (бензола). Реакция протекает по следующей схеме:
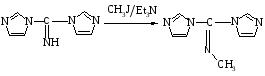
Реакция алкилирования может протекать как по эндоциклическому атому азота имидазола (N-3), так и по экзоциклическому атому азота имино-группы. Из литературы известно, что алкилирование имидазолов протекает в условиях более жестких, чем условия в которых мы проводим данную реакцию [1]. Кроме того квантово-химический расчет по методу MNDO показывает значительно большую π-электронную плотность на атоме азота имино- группы.
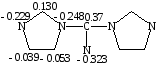
Рис.1. Молекулярная диаграмма молекулы 1,1 карбимидоилдиимидазола, рассчитанная по методу MNDO
Из сказанного следует ожидать, что алкилирование пойдет исключительно по атому азота имино-группы. ИК – спектры полученного соединения подтверждают образование N-метилбис(имидазолил-1)метанимина. Так как в ИК-спектре полученного соединения отсутствует полоса поглощения соответствующая валентным колебаниям NH- связей имино-группы, но при этом сохраняются колебания связи C=N.
Предполагаемый нами механизм алкилирования аналогичен SN2 процессу: 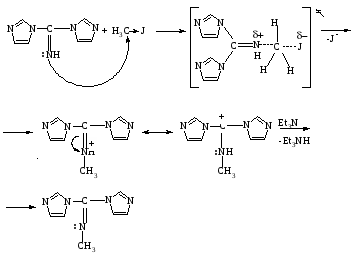
Полученное вещество белое, кристаллическое с температурой плавления 140°C.
Исследовав N-метилбис(имидазолил-1)метанимин методом ИК-спектроскопии, получены следующие результаты [10]: по характеристическим полосам поглощения отдельных классов органических соединений в инфракрасной области спектра можно судить, что полоса поглощения 3090 см-1 соответствует валентным колебаниям ароматических C-H связей; полоса поглощения 2900 см-1 соответствует валентным колебаниям алкильной группы (CH2); полоса поглощения 1640 см-1 соответствует валентным колебаниям группы N=C, а полоса 3300 – 3240 см-1 соответствующая валентным колебаниям иминно-группы (=NH), не наблюдается. Из данных результатов следует, что реакция алкилирования 1,1'-карбимидоилдиимидазола прошла по экзоциклическому атому азота.
5. Выводы
1. Исследована реакция алкилирования 1,1'-карбимидоилдиимидазола.
2. Впервые получено соединение N-метилбис(имидазолил-1)метанимин.
3. Исследованы физико-химические характеристики полученных соединений.6. Список использованных источников
1. Эльдерфильд. Гетероциклические соединения. т. 5, С. 161 – 241.
2. Химическая энциклопедия.// Советская энциклопедия. М.: 1990 г., т. 1 – 2.С. 92,120.
3. Э. Шиппер, А. Дэй .Имидазолы и конденсированные имидазолы.
4. Успехи химии имидазолов //Журн.орган.химии. 1966 г., №2, С. 201 – 362.
5. Ferris J. P., Huany C.-H. N-Cyanoimidazole and diimidazole imine: warter-soluble condensing agents for the formation of the phosphodiester bond. // Nucleosides&Nucleotides. 1989. V. 8. №3. P. 407-413
6. А.Вайсбергер, Э. Проскауэр, Дж. Риддик, Э.Тупс. Органические растворители// Ино. Литерат., М. – 1958.
7. Пурыгин П.П., Паньков С.В. Синтез N – циазолов // Ж.Орг.Х. 1995 .т 31. Вып. 6.С. 934 – 936.
8. Glatt H. H., Bacaloglu J., Ky T.T., Boeriuc C., Bacaloglu R., Graubaum H. Structur und Reaktivitat heterosubstituerter Nitrile. XXIV. Kinetik und Mechanismus der Reaktion von o – Phenilendiamin mit Arylcyanaten.// I. Prakt. Chem. 1980. Bd. 322.№6 S. 1053 – 1062.
9. Negoumy E., Bacaloglu R.,Ostrogovich G., Kinetik und Mechanismus der Addition sekundarer aliphanischer Amine an Arilcyanate. //I. Prakt. Chem. 1977. Bd.319.№3. S. 494 – 500.
10. Беллами Л. ИК спектры сложных молекул.// Ино. Литература. 1963. С.375-390.

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ