Конспект урока на тему "Систематика органических соединений"
предельные
непредельные
Алканы
Циклоалканы
Алкены
этиленовые
Диеновые
Алкины
ацетиленовые
Ароматические
бензол
Общая формула
CnH2n+2
CnH2n
CnH2n
CnH2n-2
CnH2n-2
CnH2n-6
название
ан
цикло
ен
диен
Ин
отличительный признак,
строение УВ
−
Замкнутая цепь
=
= =
≡

вид гибридизации
SP3
SP3
SP2
SP2
SP
SP2
характеристика
химической связи
<109028'
0,154нм
154нм
<1200
134нм
<1200
134нм
<1800
120 нм
<1200
140нм
изомеры для n=5, названия
По углеводородному скелету
По углеводородному скелету
межклассовая изомерия
( с алкенами)
1.Изомерия по углеводородному скелету.
2. По положению кратной связи.
3. Межклассовая изомерия
( с циклоалканами)
3. Пространственная изомерия ( цис и транс изомеры)
1.Изомерия по углеводородному скелету.
2. По положению кратной связи.
3. Межклассовая изомерия
( с алкинами)
1.Изомерия по углеводородному скелету.
2. По положению кратной связи.
3. Межклассовая изомерия
( с диеновыми)
1.Изомерия по углеводородному скелету.
Химические свойства
1 Н2С
CH4 +2О2 → СО2 +2Н2О
2 Н2С
![]()
3.Реакции дегидрирования:
2СН4 150?°С' С2Н2+ ЗН2
4. В присутствии катализаторов окисляются
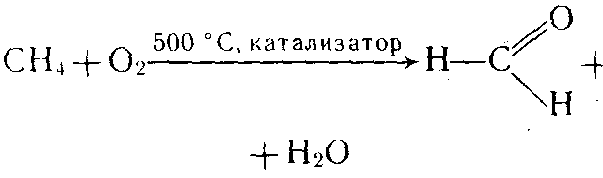
5. разложения СН4→ С+2Н2
6. начиная с бутана изомеризуются
СН3 — СН2—СН2 — СН3→
СН2—СН—СН3,
│
СН3
СН2 +О2
СН2
→ СО2+Н2О
Вступают в реакцию присоединения
С4Н8+Н2→ С4Н10
С4Н8+Br2→С4Н8Br2
1. горение,
С2Н4 + 3О2→2СО2 +2Н2О
2. присоединения:
а) Н2
СН2=СН2 + Н2 → СН3–СН3
б) галогенами(Br2, Сl2, I2)
СН2=СН2 + Br2 → СН2 Br –СН2 Br в) галогеноводородами
СН2=СН2+HBr →СН3-СН2Br
г) водой
СН2=СН2+H2O→СН3-СН2OH
этанол
3. полимеризации
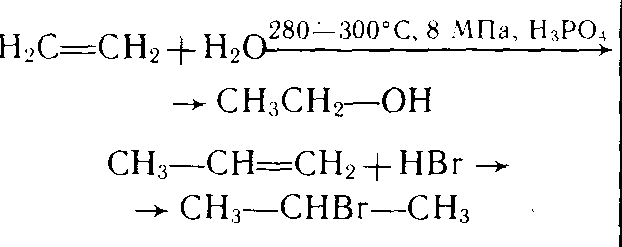
4. окисление с КМпО4
СН2=СН2 + [O] + H2O → CH2–CH2 ( этиленгликоль)
l l
OH OH
5.Реакция дегидрирования:
СН2=СН2 → СН≡СН+Н2
Горят
2С4Н6+11О2→8СО2+6Н2О
2. присоединения:
а) Н2
CH2=CH-CH=CH2+H2→
CH3–СH =CH–CH3
CH3–СH =CH–CH3+H2→
CH3–СH2 −CH2–CH3
б) галогенами Br2,Сl2, I2)
CH2=CH-CH=CH2+Br2 → CH2Br–СH =CH–CH2Br
CH2Br–СH =CH–CH2Br+Вr2
→CH2Br–СHBr−CHBr-CH2Br
в)галогеноводородами
CH2=CH−CH=CH2+HBr→
CH2Br–СH =CH–CH3
CH2Br–СH =CH–CH3 +HBr→
CH2Br–СH Br-CH2-CH3
г) водой
3. полимеризации
nCH2=CH−CH=CH2→
(−CH2–СH =CH–CH2−)n
Алкины
1. горение,
2С2Н2+5O2→4СO2 +2Н2О;
2. присоединения:
а) Н2
HCCH+H2→ H2C=CH2
H2C=CH2+H2→ H3C-CH3
б) галогенами
HCCH+Br2 →HCBr=CHBr HCBr=CHBr +Br2 → HCBr2CBr2H
в)галогеноводородами
HCCH+HBr→H2C=CHBr
H2C=CHBr +HBr → H3C−CBr2
г) водой Ацетилен образует альдегид, его гомологи – кетоны (реакция М.Г. Кучерова): 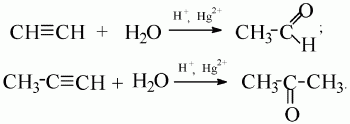
3. полимеризации
3НCCH →С6H6
НCCH + НCCH → Н2C=CHCCH
4. окисление с КМпО4 3C2H2+8KMnO4+4H2O→8KOH
+3HOOC-COOH + 8MnO2
Ароматические углеводороды Бензол
1. горение
2С6Н6 + 15О2→12СО2 + 6Н2О
2. присоединения:
а) Н2
С6Н6+3H2→ С6Н12
б) галогенами
С6Н6+3Cl2→ С6Н6Cl6
3. замещения :
а) галогенами, С6Н6+Br2→ С6Н5Br
б) азотной кислотой
С6Н6+HNO3 → С6Н5NO2+H2O
4. окисление с КМпО4
( для толуола )
С6Н5CH3+H2O+ КМпО4→
С6Н5COOH + 8MnO2+ KOH
Получение
В промышленности алканы выделяют из продуктов переработки нефти и попутных нефтяных газов
В лаборатории:
а) метан получают при нагревании прокаленного ацетата натрия с твердым гидроксидом натрия СН3СООNa+NaОН→СН4↑+Na2СО3
б) этан и другие алканы с более длинной углеродной цепью получают взаимодействием галогенопроизводных алканов с активными металлами
2СН3-СН2-Cl+2Na→ C4H10+2NaCI
Из алканов:
С2Н6 → СН2=СН2 +Н2
Из спиртов:
С2Н5ОН →СН2=СН2 +Н2О
Из галогенопроизводных алканов:
СН2Br−СН2Br+Zn→ CH2=CH2 +ZnBr2
Дегидрированием и дегидратацией этилового спирта при пропускании паров спирта
450ºС;ZnO,Al2O3
2CH3CH2OH →CH2=CH-CH=CH2+H2 +2H2O
kat, t
CH3 – CH(CH3) – CH2 – CH3 → CH2 = C(CH3) – CH = CH2+ 2H2
2СН4®С2Н2 + 3Н2
СаС2+2Н2О →Са(ОН)2+Н2↑
С6Н14→С6Н6 + Н2
С6Н12→С6Н6 +3Н2
3С2Н2→С6Н6
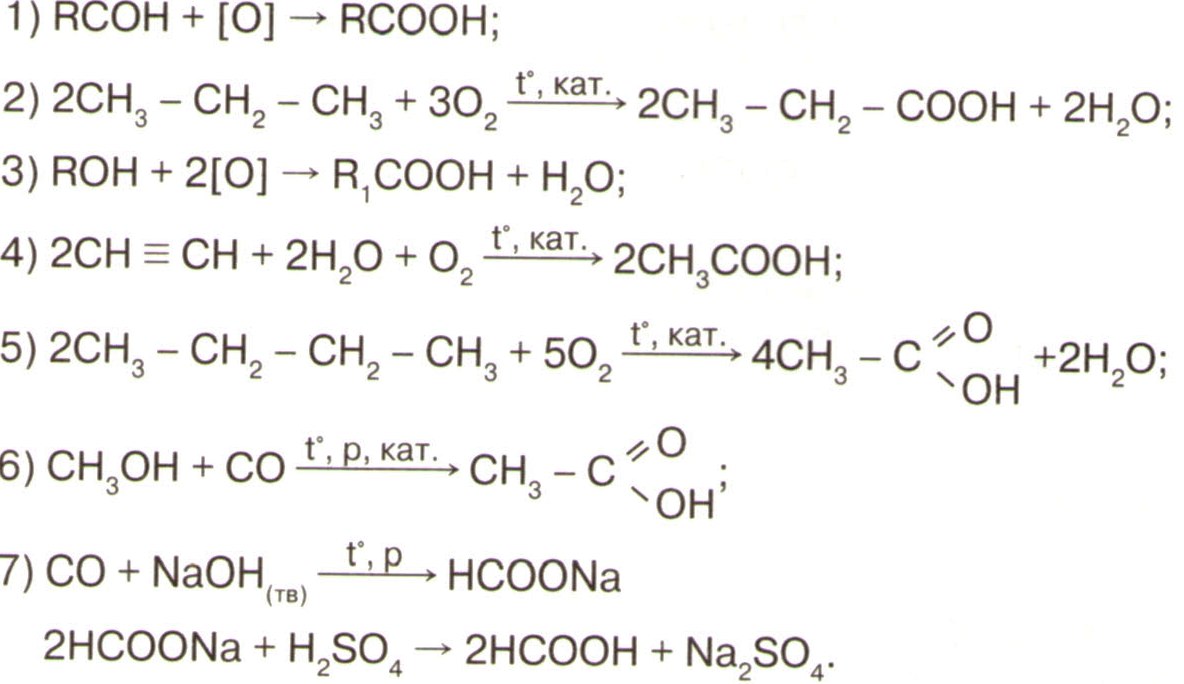
Спирты
Альдегиды
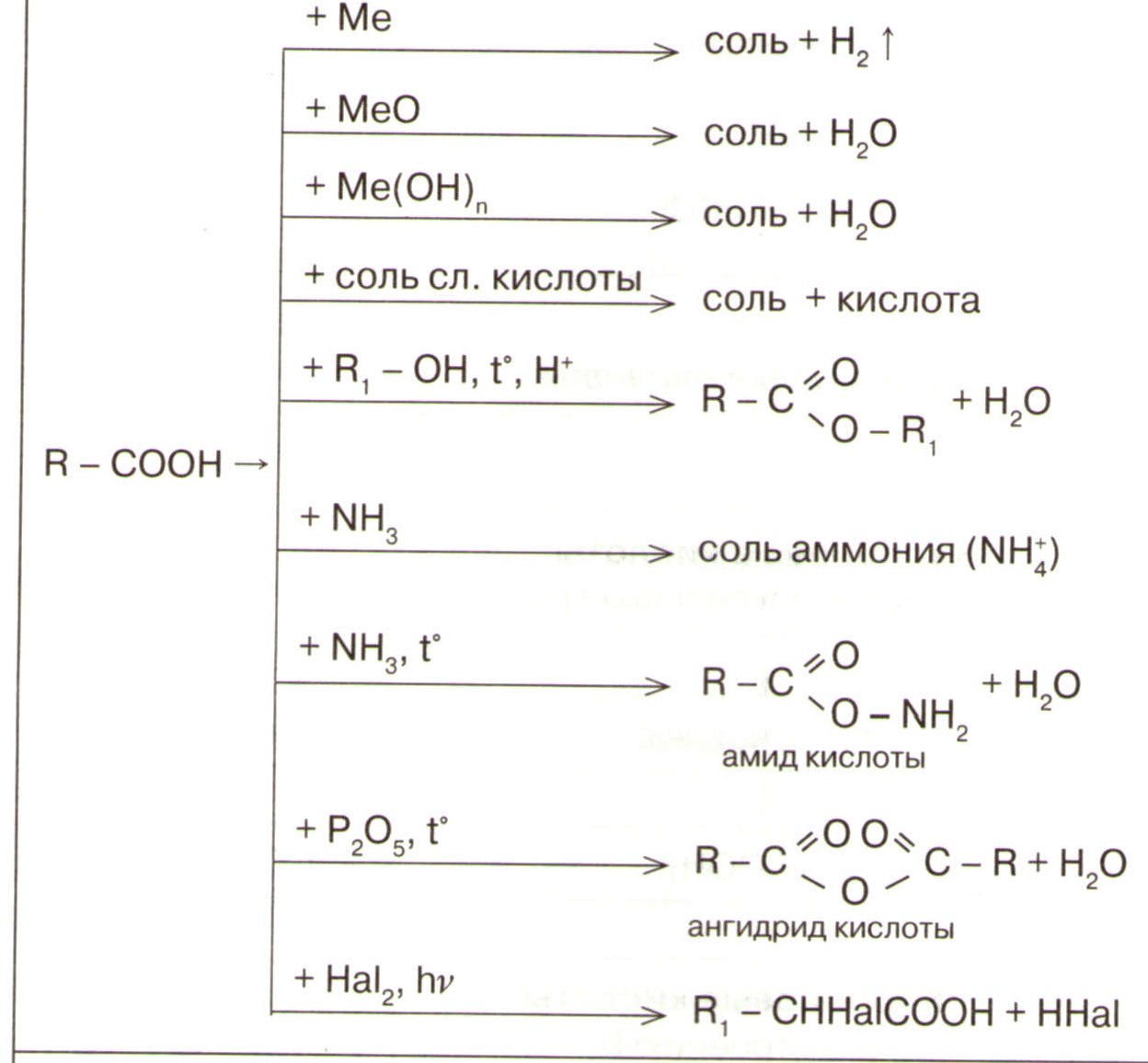
Карбоновые кислоты
эфиры
Одноатомные
Многоатомные
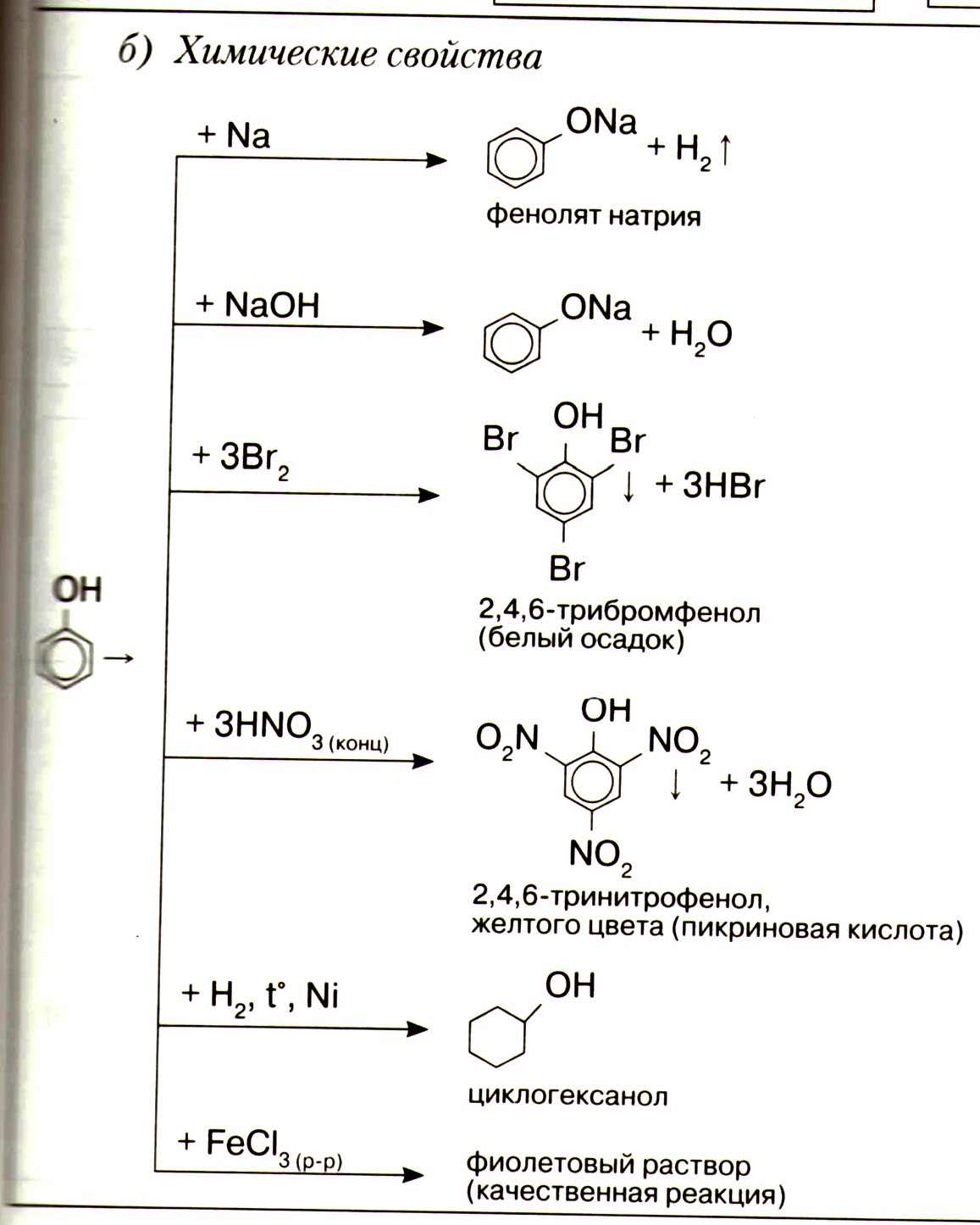
Фенолы
общая формула
CnH2n+1ОН
ROH
C

 H2−CH2
H2−CH2
OH OH
C6H5ОН
![]()
![]() СnH2nO2
СnH2nO2
R-COOR1
СnH2nO2
название
ол
Этиленгликоль
глицерин
Фенол
аль
овая
изомеры
По углеводородному скелету
межклассовая изомерия
простые эфиры
По углеводородному скелету
По положению функциональной группы
По углеводородному скелету
По углеводородному скелету
изомерия углеродного скелета, начиная с С4
![]()
межклассовая изомерия с кетонами, начиная с С3
![]()
межклассовая изомерия с непредельными спиртами и простыми эфирами (с С3
![]()
По углеводородному скелету
межклассовая изомерия
( эфиры)
По углеводородному скелету
межклассовая изомерия (кислоты)
Химические свойства
Горят
С2Н5ОН + 3O2 → 2СO2 + 3Н2О
с
 гидроксидом меди кач. реакция
гидроксидом меди кач. реакция
CH2−CH2+Cu(OH)2→CH2−CH2+2H2O
│ │ │ │
OH OH O-Cu-O
 2C2H4(OH)2+5O2→4СO2+6Н2О +Q
2C2H4(OH)2+5O2→4СO2+6Н2О +Q
C
 H2−CH2+2Na→CH2−CH2+H2
H2−CH2+2Na→CH2−CH2+H2
│ │ │ │
OH OH ONa ONa
C
 H2−CH2+HCl→CH2−CH2 +2H2O
H2−CH2+HCl→CH2−CH2 +2H2O
│ │ │ │
OH OH Cl Cl
C
 H2−CH2+ 2CH3COOH→
H2−CH2+ 2CH3COOH→
CH2−CH2 +2H2O
│ │
O O
│ │
C=O C=O
│ │
CH3 CH3
![]()
с водородом
![]()
![]() +Ag2O→RCOOH+2Ag
+Ag2O→RCOOH+2Ag
![]() +Cu(OH)2 → Cu2O+ H2O +RCOOH
+Cu(OH)2 → Cu2O+ H2O +RCOOH
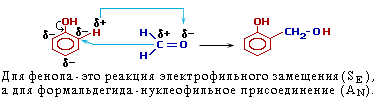
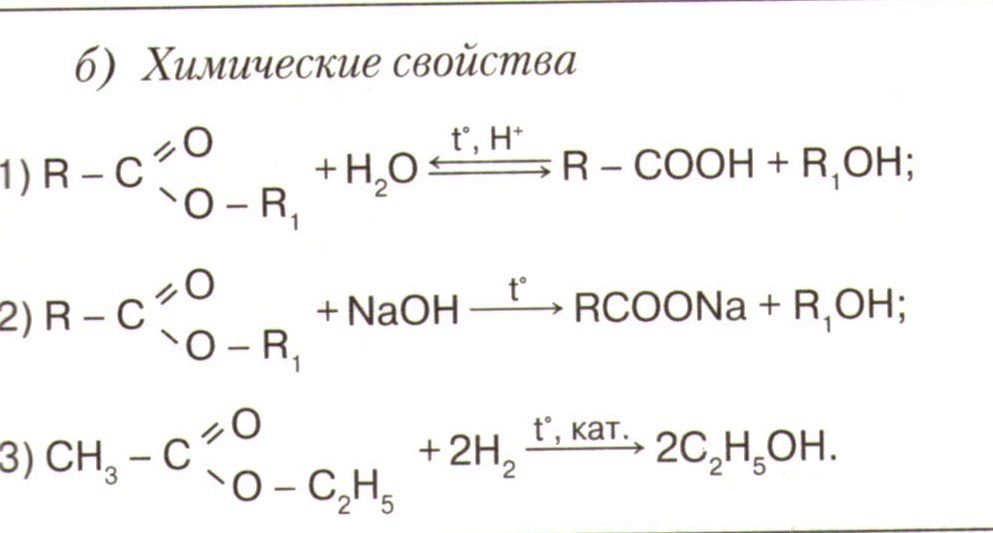
с галогеноводородами ![]()
со щелочными металлами С2Н5ОН +Na→С2Н5ОNa +Н2
с карбоновыми кислотами
С2Н5ОН + СН3СООН→Н2О+ СН3СООС2Н5
Спирты реагируют друг с другом с образованием простых эфиров
С2Н5ОН + С2Н5ОН→ С2Н 5-О- С2Н5 + Н2О
Р. Дегидратации С2Н5ОН→ С2Н4 + Н2О
С2Н5ОН + CuO→Cu + СН3СОН + Н2О
2СН3–СН2– ОН →СН2=СН – СН=СН2 +2Н2О+ Н2
Получение
1. Гидротация алкенов:
СН2 = СН2 +НОН →СН3 – СН2ОН
2. В лаборатории из галогеналканов:
CH3Cl+NaOH → CH3OH+ NaCl
3. Гидролиз сложных эфиров.
Н2О+ СН3СООС2Н5→ С2Н5ОН + СН3СООН
4. из синтез газа
СО + 2Н2 ® СН3ОН
5.крахмал®С6Н12О6(глюкоза)®2С2Н5ОН + 2СО2
С2H4+ KMnO4+H2O→ C2H4(OH)2+ KOH + MnO2
CH2−CH2+NaOH→CH2−CH2+2HCl
│ │ │ │
Cl Cl OH OH
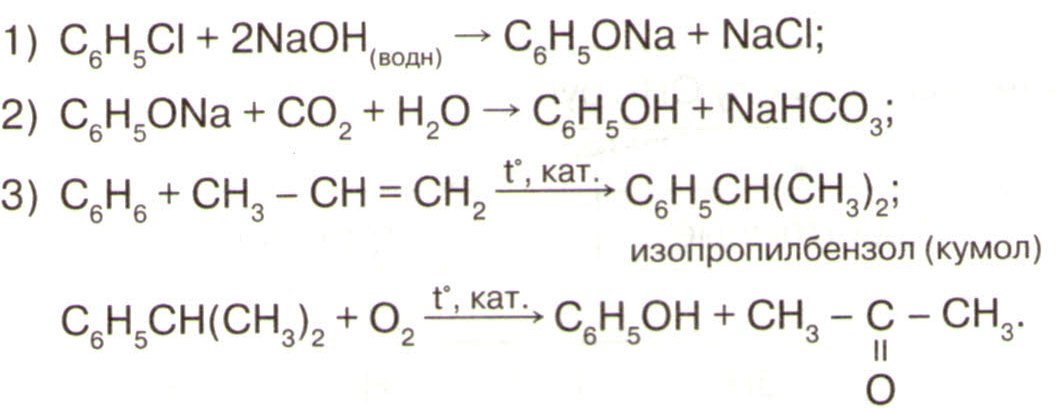
С2Н5ОН +CuO→Cu+СН3СОН+ Н2О
C2H2+ Н2О → СН3СОН
![]()
![]()
1
2
СН2=С-СН2-СН-СН-СН=С –СН3
│ │ │ │
СН3 СН3 С3Н7 С2 Н5
СН2=С-СН2-СН-СН2-С=СН –С2Н5
│ │ │
СН3 С2Н5 С2Н5
1.Формула соединения содержит 75% углерода и 25% водорода:
а) C2H6 б) C8H14 в) C4H10 г) CH4
2.Формула соединения содержит 80% углерода и 20% водорода:
а) C2H6 б) C3H8 в) C4H10 г) CH4
3.Формула соединения содержит 82% углерода и 18% водорода:
а) C2H6 б) C8H14 в) C3H8 г) C6H10
4.Формула соединения содержит 88% углерода и 12% водорода:
а) C2H6 б) C8H14 в) C4H10 г) C2H4
5.Формула соединения содержит 75% углерода и 25% водорода:
а) C3H6 б) C8H14 в) C3H6 г) C4H10
6.Формула соединения содержит 86% углерода и 14% водорода:
а) C2H6 б) C8H14 в) C4H8 г) C4H10
7.Формула соединения содержит 88% углерода и 12% водорода:
а) C5H8 б) C8H14 в) C4H10 г) C2H6
8.Формула соединения содержит 87% углерода и 13% водорода:
а) C2H6 б) C6H10 в) C4H10 г) C8H14
9.Формула соединения содержит 87,5% углерода и 12,5% водорода:
а) C2H6 б) C8H14 в) C7H12 г) C4H10
10.Формула соединения содержит 84% углерода и 16% водорода:
а) C2H6 б) C8H18 в) C4H10 г) C8H14
11.Формула соединения содержит 86% углерода и 14% водорода:
а) C2H6 б) C8H14 в) C4H10 г) C8H16
12.Формула соединения содержит 87% углерода и 13% водорода:
а) C2H6 б) C8H14 в) C4H10 г) CH4

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ