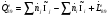Разработка энергохимико-технологической системы ЭХТС








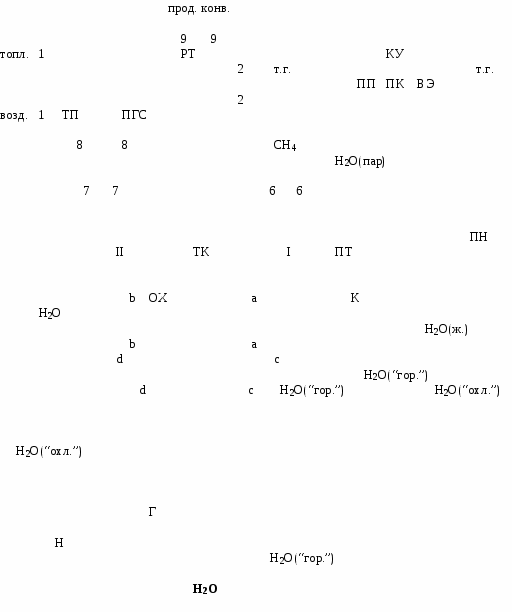 Российский химико-технологический университет
Российский химико-технологический университет
им. Д. И. Менделеева
кафедра процессов и аппаратов химической технологии
Курсовая работа по технической термодинамике:
"Разработка энергохимико-технологической системы (ЭХТС)"
Выполнил
студент группы О-31
Ситник А. С.
Преподаватель: Миносьянц С.В.
Москва, 2010
Содержание
1. Введение
2. Описание технологической схемы
3. Технологический расчет и эксергетический анализ конверсии метана
3.1 Материальный баланс конверсии метана
3.2 Энергетический баланс
3.3 Баланс механической энергии
3.4 Эксергетический КПД процесса конверсии метана
4. Технологический расчет и эксергетический анализ процесса горения
4.1 Материальный баланс процесса горения
4.2 Энергетический баланс
4.3 Эксергетический баланс
5. Разработка ЭХТС на базе печи конверсии метана
5.1 Энергетический баланс горения, определение расхода топлива
5.2 Эксергетический анализ химического реактора
6. Процесс теплообмена
6.1 Эксергетический анализ
6.2 Расчет турбокомпрессора
6.3 Определение механической мощности турбокомпрессора
6.4 Парасиловой цикл Ренкина
6.4.1 Аналитический расчёт парасилового цикла
6.4.2 Определение механической мощности ПСЦ
6.4.3 Определение термического КПД ПСЦ
6.4.4 Определение эксергетического КПД ПСЦ
Выводы
Список литературы
1. Введение
Технологические газы – смесь Н2, СО, СО2, Н2О и некоторых других – используют в агрегатах синтеза аммиака и метанола.
Преимущественно их получают путем двухступенчатой конверсии углеводородных газов, в основном, метана. В первый ступени, которой служит трубчатая печь, совершается конверсия метана с водяным паром; во второй ступени, которой является шахтный реактор, конверсия метана осуществляется кислородом воздуха. В данной работе берется в расчет только первая ступень конверсии.
Очищенный от тяжелых фракций во входном холодильнике-конденсаторе (на схеме не показан) природный газ (в данной работе – метан) сжимается турбокомпрессором ТК от давление Р6 до давления Р7. Турбокомпрессор – двухступенчатый. После сжатия в первой ступени метан охлаждается до исходной температуры T6. Охлаждение осуществляется водой в охладителе ОХ. Для охлаждения воды используется градирня Г. Подача охлажденной воды осуществляется насосом Н.
Пройдя аппарат сероочистки (на схеме не показан) нагретый до температуры Т8 газ смешивается с водяным паром и подается в трубчатую печь, в первую её ступень – подогреватель газовой смеси ПГС. Трубчатая печь состоит из двух последовательно включенных по ходу газа теплообменников: конвективного подогревателя ПГС и радиантных труб РТ. Конвективный и радиантный подогреватели конструктивно представляют систему параллельно включенных труб. Радиантные трубы содержат насадку-катализатор в форме колец Рашига или таблеток.
Химический процесс конверсии метана эндотермический, поэтому для осуществления такого превращения необходим подвод теплоты конвертируемому газу. С этой целью в топке-печи сжигается топливо. Конвертируемый газ после радиантных труб РТ трубчатой печи ТП направляется с параметрами Р9, Т9 в конвертор второй ступени – шахтный реактор (на схеме не показан). Дальнейший ход данного процесса в работе также не рассматривается.
Дымовые газы, образовавшиеся при сжигании топлива в топке трубчатой печи, передают теплоту конвертируемому газу в РТ и ПГС, потом воде и водяному пару в котле-утилизаторе КУ. Котел-утилизатор состоит из водяного экономайзера ВЭ, парового котла ПК, паросборника-сепаратора (на схеме не показан), пароперегревателя ПП.
После того как дымовые газы, передав теплоту воде в водяном экономайзере, покинут парогенератор, они с температурой 450К проходят очистку и выбрасываются дымососом D через дымовую трубу в атмосферу (в данной работе эти процессы не рассматриваются).
Питательная вода для парогенератора подается питательным насосом ПН сначала в водяной экономайзер ВЭ, затем в барабан паросборника ПС.
Из парогенератора выходит перегретый пар с параметрами Р1,Т1. Перегретый пар, получаемый в парогенераторе, используется в паровой турбине ПТ для привода турбокомпрессора и насоса, а также и для других целей, если мощность турбины превосходит суммарную мощность турбокомпрессора и насоса. После совершения работы на лопатках турбины пар конденсируется в конденсаторе К при давлении 0,05 бар и снова подается питательным насосом в парогенератор. Вода, используемая в конденсаторе К для охлаждения водяного пара, также охлаждается с помощью градирни Г.
2. Описание технологической схемы
3. Технологический расчет и эксергетический анализ конверсии метана
3.1. Материальный баланс конверсии метана
Исходные данные:
Объемный расход метана 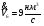 .
.
Мольный (объемный состав) газовой смеси 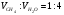
Степени превращения: 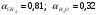
Уравнение реакции конверсии метана:
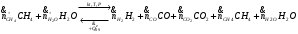
Мольные потоки на входе в реактор:

Массовый поток на входе
с
кг
кмоль
кг
с
кмоль
кмоль
кг
с
кмоль
n
m
1
1
1
355
,
35,
18
607
,
1
16
4018
,
0
Мольные потоки на выходе:
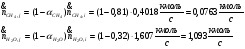
Прореагировало:
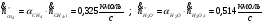
Поэлементный материальный баланс:
а) по "H":
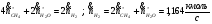
б) по "C" :
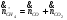
в) по "O" :
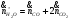
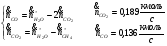
Массовый поток на выходе (проверка правильности материального баланса):
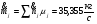
3.2 Энергетический баланс
Исходные данные:
Температура на входе в реактор и выходе из него: T8=573K, T9=1073K.
Давление на выходе из реактора: P9=2,5 МПа
Энергетический баланс:
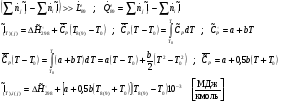
Энтальпии компонентов на входе в реактор и выходе из него
-
Компонент
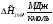
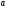
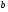


CH4
-74,8
14,32
0,075
573
-61,94
H2O
-241,8
32,30
0,002
573
-232,25
CH4
-74,8
14,32
0,075
1073
-23,873
H2O
-241,8
30,0
0,002
1073
-212,73
H2
0
27,3
-
1073
22,885
CO2
-393,5
44,14
0,022
1073
-356,87
CO
-110,5
28,41
0,004
1073
-86,4
Тепловая мощность химического реактора:
(мольные потоки – см. п. )
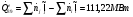
3.3 Баланс механической энергии
Допущения:
Газовые смеси подчиняются законам идеальных газов.
Параметры трубчатой печи
Число труб nтр=426 ; диаметр трубы dB=0,072м ; длина трубы LГ=42м
Диаметр зерна в зернистом слое dЗ=0,0027м
Баланс кинетической энергии: (второй закон)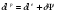
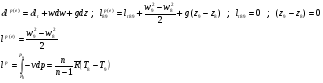
Баланс кинетической энергии записывается в виде:
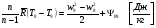
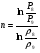
Давление P8 на входе в реактор ищем методом итераций: 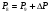
Определяем величины, не изменяющиеся в ходе итераций:
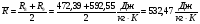
Массовый расход парогазовой смеси: 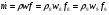
Сечение пучка труб
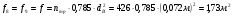
Скорость потока газов на выходе из реактора
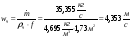
Потеря давления в реакторе происходит за счет трения и за счет местных сопротивлений.
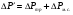 . ;
. ; 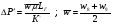
Коэффициент проницаемости зернистого слоя
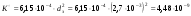
Вязкость газовой смеси определяем как среднее арифметическое средних вязкостей на входе в реактор и выходе из него:
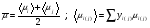
Компонент
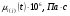
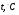

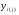
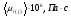
CH4
13,4+0,019t
300
19,2
0,2
20,06
H2O
8,3+0,040t
300
20,5
0,8
CH4
13,4+0,019t
800
30,5
0,0763
27,65
H2O
8,3+0,040t
800
44,3
0,411
H2
9,5+0,014t
800
22,1
0,43
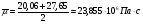
Диссипация определяется из соотношения
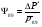
Расчет давления P8 методом итераций
Т.о. 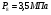
3.4 Эксергетический КПД процесса конверсии метана
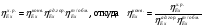
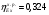
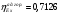
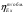 = 0,603
= 0,603
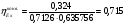
4. Технологический расчет и эксергетический анализ процесса горения
Исходные данные и допущения:
Процесс горения – адиабатный.
Процесс протекает изобарно при давлении 1атм (или близком к нему).
Исходные компоненты и продукты сгорания рассматриваются как идеальные газы.
Состав топлива (по объему): 0,5CH4 : 0,4C3H8.
Воздух, подаваемый в камеру сгорания, рассматривается как двухкомпонентная система с объемным соотношением компонентов
O2 : N2 = 21% : 79% = 1 : 3,76
Параметры топлива и воздуха на входе в камеру сгорания:
T1=Toc=T0=298,15K
P1=Poc=Pº=1 атм
Воздух, подаваемый в камеру сгорания, подается с избытком. Коэффициент избытка воздуха αизб=1,05
4.1 Материальный баланс процесса горения
Уравнение реакции горения 1 моля топлива при полном сгорании топлива
0,4CH4 + 0,5C3H8 + 3,3αизбO2 +0,1N2+ 12,408 αизбN2→1,9CO2 + 2,8H2O + 3,3(αизб-1)O2 + (3,3*3,76αизб +0,1)N2
C учетом того, что αизб=1,01, уравнение реакции запишется в виде:
0,4CH4 + 0,5C3H8 + 3,465O2 +13,028N2+ 0,1N2 →
→1,9CO2 + 2,8H2O +0,165O2 + 13,128N2

4.2. Энергетический (энтальпийный) баланс
(Определение температуры адиабатного горения.)
Рассматриваемый процесс является стационарным процессом, совершающимся в открытой термодинамической системе. В этом случае энергетический баланс записывается в виде:
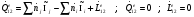
Полученное балансовое выражение является энтальпийным балансом:
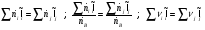
Энтальпия компонента на входе в камеру сгорания равна стандартной энтальпии образования 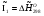 ; на выходе – определяется из соотношения:
; на выходе – определяется из соотношения:
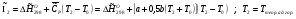
Энтальпии компонентов на входе в камеру сгорания.
-
Компонент
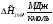
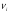
CH4
-74,8
0,4
С3H8
-103,3
0,5
O2
0
N2
0
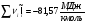
Энтальпии компонентов на выходе из камеры сгорания.
Компонент
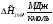
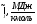 ---
---
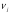
CO2
-393,5
32,20
0,022
-407,1 + 44,14·10-3T +4,52·10-6T2
1,9
O2
0
31,50
0,003
-9,23 + 31,46·10-3T + 1,7·10-6T2
0,165
H2O
-241,8
32,30
0,002
-251,2 + 30,0·10-3T + 5,36·10-6T2
2,8
N2
0
27,90
0,004
-8,5 + 27,88·10-3T + 2,14·10-6T2
13,128
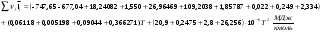
Так как
 ,то
,то
1585,11 +0,5231 T +50,02 *10-6 T2=0
В результате решения данного квадратного уравнения получаем:
Tтеор.ад.гор =2346,08K
4.3 Эксергетический баланс
Эксергетический КПД адиабатного горения:
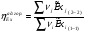 ;
;
T1=T0=298,15K ; T2=Tтеор.ад.гор.=2346,08К (см. ) ; P1=P2=P°=1атм
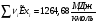 (см. )
(см. )
Для сечения 2-2 эксергии компонентов определяем по формуле:
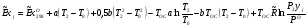
(вывод формулы – см. )
 Мольные доли компонентов:
Мольные доли компонентов:
Эксергии компонентов:
-
Компонент
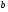
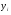
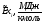
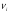
CO2
20,10
32,2
0,022
0,1056
106,8
1,9
O2
3,95
31,50
0,003
0,00917
54,46
0,165
H2O
8,60
32,3
0,002
0,1556
43,7465
2,8
N2
0,70
27,90
0,004
0,7296
48,284
13,128
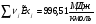
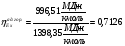
5. Разработка ЭХТС на базе печи конверсии
5.1 Энергетический баланс горения. Определение расхода топлива
Допущения:
Вся тепловая мощность, полученная при охлаждении топочных газов от температуры адиабатного горения до температуры T2=1835К, передается смеси метана и воды.
Энергетический баланс:

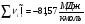 (см. )
(см. )
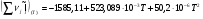 (см. )
(см. )
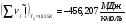
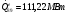 (см. )
(см. )
Расход топлива равен
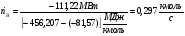
5.2 Эксергетический анализ химического реактора
Эксергетический КПД химического реактора определяется из соотношения:
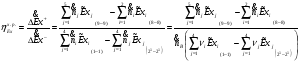
Зависимость эксергии компонента от температуры и парциального давления выражается соотношением:

Сечение 1-1: T1=Toc=T0=298,15K ; P1= Pº=1 атм
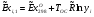
Эксергии компонентов:
-
Компонент
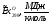
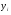
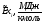
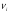
CH4
830,0
0,02287
820,635
0,4
С3H8
2149,0
0,02858
2140,2
0,5
O2
3,95
0,198
0
Эксергиями компонентов воздуха пренебрегаем
N2
0,70
0,7505
0
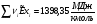
Сечение 21-21: T2=1835К ; P2= Pº=1 атм

Эксергии компонентов:
-
Компонент
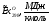
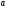
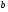
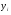
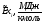
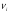
CO2
20,10
32,2
0,022
0,1056
72,55
1,9
O2
3,95
31,50
0,003
0,00917
39,49
0,165
H2O
8,60
32,20
0,002
0,1556
27,21
2,8
N2
0,70
27,90
0,004
0,7296
32,40
13,128
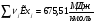
Сечение 8-8: T8=573K ; P8=3,5МПа ( )
Эксергии компонентов:
-
Компонент
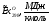
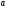
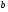
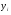
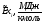
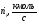
CH4
830,0
14,32
0,075
0,2
833,1
0,4018
H2O
8,60
32,3
0,002
0,8
16,68
1,607
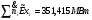
Сечение 9-9: T9=1073K ; P9=2,5МПа
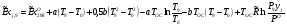
Эксергии компонентов:
-
Компонент
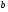
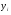
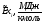
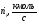
CH4
830,0
14,32
0,075
0,0763
854,0361
0,0763
H2O
8,60
32,30
0,002
0,411
21,96264
1,093
H2
0,07
28,80
-
0,41
246,3806
1,164
CO2
20,10
32,20
0,022
0,071
35,07467
0,189
CO
275,40
28,40
0,004
0,051
282,6575
0,136
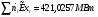
Эксергетический КПД химического реактора:
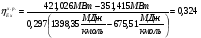
6. Процесс теплообмена
6.1 Эксергетический анализ
Допущение: участвующие в теплообмене газы рассматриваются как идеальные.
Эксергетический КПД процесса теплообмена определяется из соотношения:
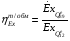
Эксергия тепловой мощности:
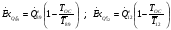
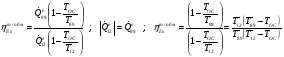
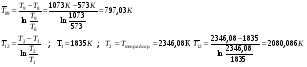
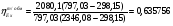
6.2 Расчет турбокомпрессора
Исходные данные:
Давление метана на входе в компрессор P6=8 бар
Температура на входе в компрессор Т6=300К
Энтропийный КПД компрессора 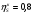
Механический КПД 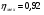
Допущения:
Давление метана на выходе из компрессора принимается равным давлению газовой смеси на входе в реактор, P7=P8=35 бар (см. ).
Реальный процесс сжатия – политропный. Показатель политропы метана k=1,31.
КПД электродвигателя и передачи принимаются за 1.
Теплоемкость воды не зависит от температуры
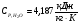
6.3 Определение механической мощности турбокомпрессора
Массовый поток метана:
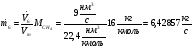
Механическую мощность турбокомпрессора находим по формуле
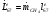
КПД компрессорной установки

Степень сжатия газа в ступени полагаем ε=3;
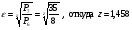
Значит, турбокомпрессор – двухступенчатый, z=2.
Работа обратимого процесса (удельная):
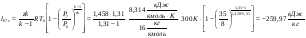
Внешняя работа (работа реального процесса):
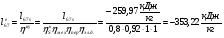
Механическая мощность турбокомпрессора:
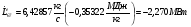
Графическое представление процесса сжатия в турбокомпрессоре.
6.4 Паросиловой цикл Ренкина
Исходные данные:
Давление водяного пара на входе в турбину P1=102 бар
Температура водяного пара на входе в турбину t1=463˚C
Давление в конденсаторе P2=0,05 бар
Энтропийный КПД турбины 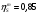
Энтропийный КПД насоса 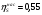
Параметры водяного пара (по 1-s диаграмме водяного пара):
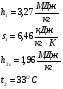
Допущение: Теплообмен между топочными газами и водой происходит без потерь тепла.
6.4.1 Аналитический расчет парасилового цикла
Расчет проводится как для реального цикла, так и для теоретического.
1-2s - Изоэнтропный процесс расширения в турбине.
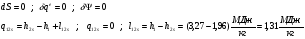
1-2 - Реальный процесс расширения в турбине.
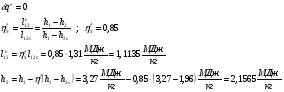
2s-3’ – Теоретический процесс конденсации.
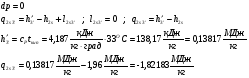
2-3’ – Реальный процесс конденсации.
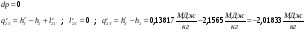
3’-4s – Изоэнтропный процесс в насосе.
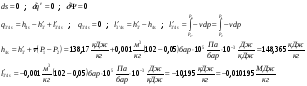
3’-4 – Реальный процесс в насосе.
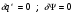
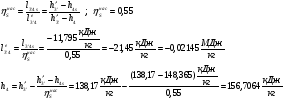
4s-1 – Теоретический процесс в котле-утилизаторе.
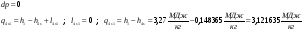
4-1 – Реальный процесс в котле-утилизаторе.
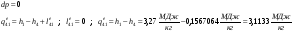
Теплота и работа обратимого и необратимого циклов.
Эти таблицы показывают справедливость 1 закона термодинамики для циклических процессов: qц=lц .
6.4.2 Определение механической мощности парасилового цикла
Энергетический баланс:

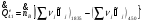
Зависимость энтальпии топочных газов от температуры в расчете на 1 кмоль топлива (без учета диссоциации продуктов сгорания):
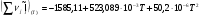 (см. )
(см. )
Разность энтальпий топочных газов в расчете на 1 кмоль топлива:
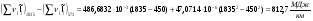
Расход топлива: 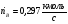 (см. )
(см. )
Тепловая мощность парогенератора
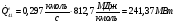
В реальном цикле
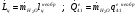
Расход воды:
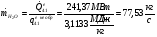
Механическая мощность паросилового цикла (паротурбинной установки):
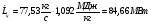
6.4.3 Определение термического КПД цикла
КПД обратимого и необратимого циклов составят соответственно:
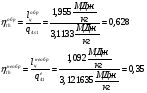
 , что очевидно.
, что очевидно.
6.4.4 Определение эксергетического КПД парасилового цикла
Эксергетический КПД цикла определяется соотношением
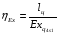
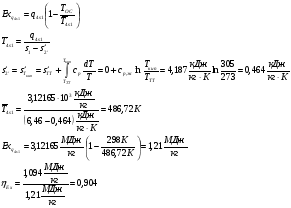
Графическое представление паросилового цикла
Выводы
В данной работе рассмотрена упрощенная схема процесса конверсии метана. Рассчитаны основные составляющие этой схемы. Учтены технологические особенности данного процесса. Определены КПД, характеризующие процессы, протекающие в данной системе. Полученные результаты удовлетворяют физическим представлениям.
В данной ЭХТС производится утилизация тепла топочных газов; эта ЭХТС не требует энергозатрат, т.к. механическая мощность паротурбинной установки достаточно велика для удовлетворения потребностей данной ЭХТС в механической работе (турбокомпрессор, питательный насос) и в электроэнергии (насос, подающий холодную воду в водооборотном цикле); возможно также получение некоторого дополнительного количества электроэнергии, которую можно использовать в различных целях.
Список литературы
Смирнов В.А., Шибаева Л.Ф., Миносьянц С.В. Термодинамические расчеты основных процессов в энерго-химико-технологических системах. Учебное пособие. – М.: МХТИ им. Д.И. Менделеева, 1988. – 68 с.
Павлов К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процессов и аппаратов химической технологии. Учебное пособие для вузов / Под ред. чл.-корр. АН СССР П.Г. Романкова. – 10-е изд., перераб. и доп. – Л.: Химия, 1987. – 576 с., ил.

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ