Синтезы органических соединений на основе оксида углерода
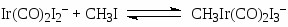
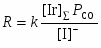
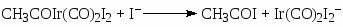
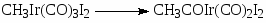
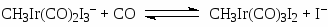

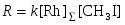
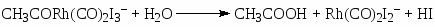
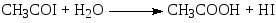
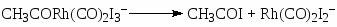
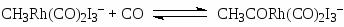
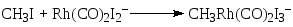
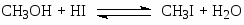
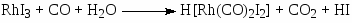
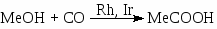
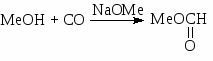
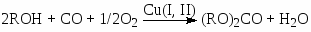
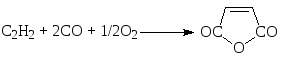
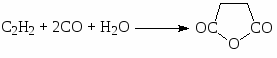
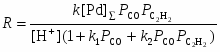
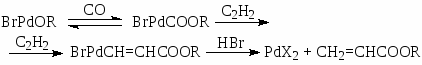
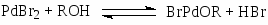
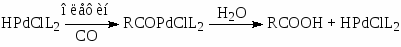
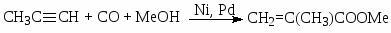
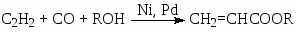
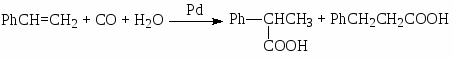
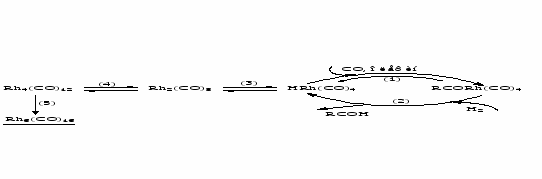
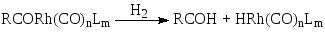
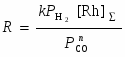
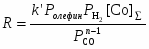
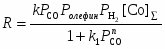
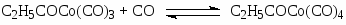
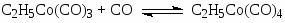
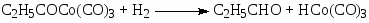
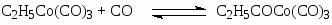
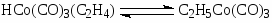
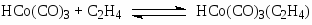
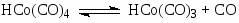
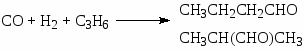 Синтезы органических соединений на основе оксида углерода
Синтезы органических соединений на основе оксида углерода
Помимо синтезов органических соединений из СО и Н2 – углеводороды, олефины, в том числе изобутилен с высокими показателями (селективность > 90%), спирты, в том числе изобутанол с выходом ~70%, метанол и др. – оксид углерода взаимодействует с различными органическими молекулами без и с участием Н2.
Оксосинтез
Первый важный промышленный синтез альдегидов и спиртов по реакции СО и Н2 с олефинами был открыт в 1939 г О. Рёленом. Процесс получил название “оксосинтез” (oxo-process), а реакцию синтеза альдегидов называют реакцией гидроформилирования, например:
(1)
В реакции используют этилен, пропилен, изобутилен, стирол и высшие -оле фины (для получения высших спиртов нормального строения). Процесс проводят в органических растворителях или в жидких олефинах.
Первым катализатором процесса были комплексы кобальта, а в качестве исходного комплекса использовали кластер Co2(CO)8. Стадии процесса – типичные реакции для металлокомплексного катализа.
Основные формы катализатора в растворе – HCo(CO)4 и C2H5COCo(CO)4.
Процесс требует высокой температуры ~ 150оС и, следовательно, высокого давления (> 30 атм) для предотвращения распада термически неустойчивых комплексов Со. Критическое давление Р > 10 атм при 120оС. Строгая кинетическая модель этого сложного процесса пока не получена. Отмечено сильное торможение оксидом углерода и важная роль координационно-ненасыщенных комплексов HCo(CO)3 и C2H5COCo(CO)3. Экспериментально полученное кинетическое уравнение (2)
(2)
превращается в уравнение (3), описывающее процесс в узком интервале РСО
, (3)
где n 2.
В ходе реакции имеет место частичное гидрирование альдегидов до спиртов. Важным показателем процесса является соотношение альдегидов нормального (n) и изостроения (i). С целью повысить соотношение n/i и смягчить условия процесса исследовали другие каталитические системы (см. таблицу).
Таблица. Катализаторы оксосинтеза.
Условия, показатели
HCo(CO)4
HCo(CO)3L L – PBu3
HRh(CO)L3 L – PPh3
T, oC
12 –160 (опт. 150)
160–200
80–120
Р, атм
200–350
50–100
15–50
Альдегиды, %
87
–
96
Спирты, %
10
80
–
n/i
80:20
88:12
92:8
Алканы, %
1
15
2
Наиболее мягкие условия проведения процесса установлены для комплексов Rh(I), которые более, чем в 104 раз активнее карбонильных комплексов Со. В случае комплексов Rh(I) кинетическое уравнение (4) заметно отличается от уравнения (3)
(4)
Нулевой порядок по олефину объясняют лимитирующей стадией
(5)
при условии, что весь [Rh] практически находится в форме ацильного комплекса родия(I).
В случае малоактивных олефинов лимитирующая стадия – взаимодействие HRh~ с олефином, в этом случае гидридные комплексы родия склонны взаимодействовать друг с другом с образованием кластеров Rh(0), часть которых образуется необратимо и приводит к дезактивации катализатора. На примере HRh(CO)4 схема превращений выглядит следующим образом:
Кластер Rh4(CO)12 при взаимодействии со смесью СО и Н2 превращается в активный HRh(CO)4, а кластер Rh6(CO)16 – уже нет. Предполагают, что свободный HRh(CO)4 принимает участие в стадиях (4) и (5). Таким образом, более активный олефин, ускоряя процесс перехода HRh~ в RCORh, уменьшает концентрацию HRh~ и тем самым “защищает” катализатор от дезактивации. Аналогичная картина имеет место и для фосфиновых комплексов родия.
Несмотря на явно более эффективный и селективный процесс в случае родиевых катализаторов, высокая стоимость родия делает кобальтовые и родиевые системы близкими по экономическим показателям. В курсе “Прикладной катализ” будут рассмотрены технологические варианты декобальтизации, т.е. процессов отделения катализатора от продуктов реакции и методы выделения родиевых катализаторов.
Различные реакции с участием СО
В реакциях СО с олефинами и алкинами участвуют также молекулы других реагентов – Н2О, ROH, RNH2 и др. Эти процессы были открыты В. Реппе в начале 40-х гг XX века и протекают в растворах комплексов Ni(0, II) и Pd(0, II). Например,
(6)
(7)
(8)
В случае олефинов активными являются гидридные комплексы палладия HPdClL, и схема механизма напоминает схему оксосинтеза
(9)
Механизм гидрокарбалкоксилирования ацетилена в растворах комплексов цис-PdBr2[P(OPh)3]2 отличается от схемы (9) – в этой системе активными комплексами являются комплексы Pd(II) (упрощенная схема):
Кинетическая модель процесса (10):
(10)
отражает образование алкоголятных комплексов палладия(II) в квазиравновесной стадии.
Процесс синтеза метилметакрилата (ММА) (8) считается в настоящее время наиболее экономически и экологически эффективным (по сравнению с ацетонциангидринным методом и окислением изобутена). Процесс разработан фирмой Shell и протекает при давлении 40 – 60 атм и температуре 110оС с очень большой скоростью (50000 моль/(моль·час)) и высокой селективностью (~100%) в растворах комплексов PdL2X2, где L – 2-PyPPh2, X – CH3SO3–, CF3SO3–, тозилат). Механизм процесса пока не ясен.
Среди новых процессов карбонилирования можно привести реакции синтеза ангидрида янтарной кислоты (11)
(11)
и ангидрида малеиновой кислоты (12)
, (12)
в которых активной формой являются комплексы Pd(I) – Pd2(CO)2Br4 (Л. Брук, О. Темкин). К промышленным процессам карбонилирования спиртов относятся процесс окислительного карбонилирования спиртов (13)
(13)
и два процесса неокислительного карбонилирования – синтез метилформиата (14) и синтез уксусной кислоты (15) по методам фирмы “Monsanto” и фирмы “Cativa”.
(14)
(15)
Процессы карбонилирования метанола до уксусной кислоты
В процессе фирмы “Monsanto” активным катализатором является комплекс Rh(CO)2I2–, а в процессе фирмы “Cativa” – Ir(CO)2I2–. Основные стадии процесса в случае комплексов родия:
(16)
(формирование активного комплекса Rh(I))
Вторым катализатором процессе является HI.
(17)
(18)
(19)
В условиях, когда концентрация воды в СН3СООН > 8% (масс) переход Rh(I) в Rh(III) в стадии (18) является медленной стадией. Распад ацильного комплекса до CH3COI и Rh(CO)2I2– или под действием Н2О (или МеОН) приводит к образованию СН3СООН
(20)
(21)
(22)
Скорость реакции описывается уравнением (23)
, (23)
что свидетельствует о существовании Rh, в основном, в форме Rh(CO)2I2–. Хотя скорость не зависит от РСО, давление СО необходимо для сохранения в растворе карбонилов Rh(I). Условия процесса – РСО = 30 атм и Т = 150–170оС. Если содержание воды < 8%, лимитирует стадия восстановительного элиминирования (20).
В ходе процесса наблюдаются реакция конверсии СО
(24) реакции образования метилацетата, диметилового эфира, этанола и пропионовой кислоты. Однако, селективность образования уксусной кислоты (на метанол) > 99%, а на СО – 90% (из-за реакции 24). Потери родия составляют 0.1г на 1 тонну кислоты, что при производительности установки 160 тыс. тонн составляет 16 кг в год.
Усовершенствование процесса при переходе к комплексам Ir (“Cativa”-процесс, BP и “Monsanto”) связано с тем, что аналогичный Rh(I) комплекс Ir [Ir(CO)2I2–] более устойчив в широком диапазоне РСО и [Н2О]. Так, комплекс устойчив при ~0.5% концентрации Н2О в отличие от комплекса Rh (> 8% H2O). Показано, что скорость присоединения CH3I к Ir(I) ~ в 150 раз выше, чем в случае Rh(I) (стадия 18), и не лимитирует процесс. Медленной стадией в этой системе считают реакцию (26) внедрения СО в метильном комплексе Ir(III), следующую за стадией замещения I– (25)
(25)
(26)
(27)
Скорость процесса описывается уравнением (28)
(28)
в предположении, что в быстрой квазиравновесной стадии
(29)
равновесие практически полностью смещено вправо и весь [Ir] [CH3Ir(CO)2I3–]. Производительность по СН3СООН в процессе “Cativa” ~ в 2 раза выше, чем в процессе “Monsanto” и составляет ~2кг/л·час.
Возможность использования растворов с низкой концентрацией воды в случае Ir приводит к тому, что в технологической схеме исключается колонна осушки. Это обстоятельство, вместе с более высокой производительностью и с более низкой ценой Ir (~ в 170 раз дешевле Rh) делает процесс “Cativa” более экономически эффективным.
Вопросы для самоконтроля
Объясните причины торможения оксидом углерода процесса оксосинтеза в случае кобальтовых и родиевых катализаторов.
Почему более активные олефины в случае родиевых катализаторов увеличивают срок жизни катализатора?
Какие процессы с участием СО связаны с именем В. Реппе?
Чем различаются кинетические модели процессов синтеза уксусной кислоты фирм “Monsanto” и “Cativa”? В чем причина различий в моделях?
Каковы достоинства технологии фирмы “Cativa”?
Литература
Катализ в промышленности, под ред. Б. Лича, М., Мир, 1986, т. 1, 2.
Шелдон Р.А., Химические продукты на основе синтез-газа, М., Химия, 1987.
Jones J.H., The Cativa™ Process for Manufacture of Acetic Acid, Platinum Metals Rev., 2000, 44 (3), pp. 94–105.
Темкин О.Н., Брук Л.Г., Комплексы Pd(II, I, 0) в реакциях окислительного карбонилирования, Кинетика и катализ, 2003, № 5.

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ