Исследовательский проект "Активность каталазы –простейший тест на ксенобиотики"




 МОУ СОШ № 13
МОУ СОШ № 13
с углубленным изучением отдельных предметов
Исследовательский проект
Активность каталазы –простейший тест на ксенобиотики

Выполнил: ученик 11класса Царев Владислав
Руководитель: учитель биологии О.П. Жмаева
ОГЛАВЛЕНИЕ.
Введение._______________________________________________ 1
Глава I. Активность каталазы растений как индикаторный
признак при биотестировании. __________________________ 3
I - 1. Биотестирование._____________________________________ 4
I - 2. Биоиндикация._______________________________________ 6
I - 3. Ферменты – биологические катализаторы._______________ 8
I - 4. Каталаза – чемпион катализа. __________________________ 12
I - 5. Методы определения активности каталазы.______________ 14
I – 6. Единицы измерения активности каталазы.______________ 18
Глава II. Корреляционный анализ взаимосвязи активности
каталазы и степени загрязнения среды обитания. _____ 20
II – 1. Исследование активности каталазы в листьях однолетних
декоративных растений в условиях городской среды._____ 21
II – 2. Определение активности каталазы сырого картофеля при
воздействии среды разной степени загрязнения. _______ 24
II – 3. Определение активности каталазы в проростках фасоли,
выращенных на средах с разной степенью загрязнения.____27
Глава III. Заключение.________________________________________32
Глава IY.Информационные источники._________________________34
Введение.
Ежегодно в мире разрабатываются и затем производятся десятки новых веществ, не свойственных живой природе, совершенно невозможно предугадать их токсическое воздействие на окружающий мир и человека. Поэтому особо остро встают вопросы комплексного изучения экологии окружающей среды. Исследование влияния различных химических соединений на биологические молекулы, в том числе на ферменты, весьма актуальны в настоящее время, поскольку они дают возможность выявить новые тест-функции для мониторинга окружающей среды.
Цель работы:
определение токсичности техногенных зон микрорайона школы с различным по интенсивности автотранспортным воздействием методом исследования активности каталазы в тканях растений.
Для достижения поставленной цели необходимо было решить следующие Задачи:
изучение различных методов биотестирования с помощью изменения активности ферментов;
модернизация прибора Лишкевича с учетом технических возможностей школьной лаборатории;
исследование устойчивости декоративных растений на загрязнение окружающей среды с помощью простейшего биотеста – изменения активности каталазы в проростках растений;
определение активности каталазы в проростках фасоли, выращенных на средах с разной степенью загрязнения;
исследование зависимости активности каталазы сырого картофеля
от степени загрязнения снега выбросами автотранспорта;
Гипотеза.
Если активность каталазы в тканях организмов снижается, то это может служить показателем степени загрязнения окружающей среды ксенобиотиками.
Объект исследования:
процесс разработки простейшего метода биотестирования токсичности зон микрорайона школы с различной грузонапряженностью.
Предмет исследования:
фермент каталаза в тканях растений.
Методы исследования.
Активность каталазы определяется газометрическим методом Лишкевича
(http://www,gjjgle.com/int/ru/options/spase/физиология растений)
К навеске исследуемого растения прибавляют 3 мл дистиллированной воды, перемеши вают и выливают в колбочку прибора Лишкевича. Двумя миллилитрами воды ополаскивают ступку и жидкость выливают в колбочку прибора. До бавляется на кончике совочка мел. В тигелек наливают 2 мл 2%-ной пере киси водорода, нейтрализованной 3 каплями 0,1 н NaOH. Тигелек при по мощи пинцета устанавливают на дно колбочки. Колбочку плотно закрыва ют пробкой, которая резиновой трубкой через тройник соединяется с уравнительным сосудом.
Через отверстие в уравнительном сосуде наливают воду до нулевого деления бюретки и выходное отверстие каучуковой трубки тройника за крывают зажимом. Далее обязательно проверяют прибор на герметичность. Для этого уравнительный сосуд опускают вниз и фиксируют в одном по ложении. Уровень воды в бюретке также должен быть в одном положении. В противном случае устраняют неисправность.
Держа мениски воды нулевого деления бюретки и уравнительного сосуда на одном уровне, опрокидывают тигелек с перекисью водорода в колбочку и в течение 4 минут легонько встряхивают колбочку. Выделяю щийся кислород вытесняет из бюретки воду, уровень которой по мере уве личения количества газа начинает опускаться.
Количество выделившегося кислорода отмечают каждую минуту, причем в момент отсчета уровень воды в уравнительном сосуде устанавли вают точно по уровню в бюретке. Опыт повторяют 2 – 3 раза, высчитывают среднее арифметическое. Активность каталазы выражается величиной, равной объему воды, вытесненной кислородом за единицу времени.
Биотестирование, как правило, используют до химического анализа, т.к. этот метод позволяет провести экспресс-оценку природной среды и выявить"горячие точки", указывающие на наиболее загрязненные участки территории. На участках, где методами биотестирования выявлены какие-либо отклонения и исследуемая среда характеризуется как токсичная, аналитическим путем необходимо установить причины этого явления.
Использование активности каталазы проростков тест-растений в качестве чувствительного критерия для биотестирования загрязнения окружающей является перспективным методом экологического мониторинга.
Глава I.
Активность каталазы растений как индикаторный признак при биотестировании.

I – 1 . Биотестирование
Под биотестированием (англ. bioassay) обычно понимают процедуру установления токсичности среды с помощью тест-объектов, сигнализирующих об опасности независимо от того, какие вещества и в каком сочетании вызывают изменения жизненно важных функций у тест-объектов. Благодаря простоте, оперативности и доступности биотестирование получило широкое признание во всем мире и его все чаще используют наряду с методами аналитической химии. Существует 2 вида биотестирования: морфофизиологический и хемотаксический. Хемотаксический метод более точный, так как в нем используется специальный прибор, а морфофизиологический позволяет более точно описать, что происходит с тест-объектами.
Тест-объект (test organism) - организм, используемый при оценке токсичности химических веществ, природных и сточных вод, почв, донных отложений, кормов и др. Тест-объекты, по определению Л.П.Брагинского - "датчики" сигнальной информации о токсичности среды и заменители сложных химических анализов, позволяющие оперативно констатировать факт токсичности (ядовитости, вредности) среды ("да" или "нет"), независимо от того, обусловлена ли она наличием одного точно определяемого аналитически вещества или целого комплекса аналитически не определяемых веществ.
Жизненная функция или критерий токсичности (toxicity criterion), используемые в биотестировании для характеристики отклика
тест-объекта на повреждающее действие среды.Тест-фукнкции, используемые в качестве показателей биотестирования для различных объектов:
для инфузорий, ракообразных, эмбриональных стадий моллюсков, рыб, насекомых - выживаемость (смертность) тест-организмов;
для ракообразных, рыб, моллюсков - плодовитость, появление аномальных отклонений в раннем эмбриональном развитии организма, степень синхронности дробления яйцеклеток;
для культур одноклеточных водорослей и инфузорий - гибель клеток, изменение (прирост или убыль) численности клеток в культуре, коэффициент деления клеток, средняя скорость роста, суточный прирост культуры;
для растений - энергия прорастания семян, длина первичного корня и др.
Биомаркеры – это организмы и их характеристики, которые позволяют диагностировать текущее состояние окружающей среды. В качестве характеристик могут выступать физиологические, биохимические, иммунологические и другие свойства (процессы) организмов.
Биотестирование, как правило, используют до химического анализа, т.к. этот метод позволяет провести экспресс-оценку природной среды и выявить "горячие точки", указывающие на наиболее загрязненные участки акватории (территории, полигона). На участках, где методами биотестирования выявлены какие-либо отклонения и исследуемая среда характеризуется как токсичная, аналитическим путем необходимо установить причины этого явления.
Биотестирование не дает ответа на вопрос о характере загрязняющего вещества, вызывавшего ту или иную реакцию тест-объекта. Тест-функции в биотестировании носят общий, неспецифический характер. Однако количество загрязняющих веществ, попадающих в окружающую среду, неуклонно возрастает и не исключено, что какое-либо вещество, или смесь веществ, может привести к возникновению специфических реакций у тест-объектов, особенно на клеточном или тканевом уровнях организации.
На наиболее загрязненных территориях тест-объекты демонстрируют минимальную выживаемость (плодовитость) в тестируемых средах, на основании чего делается вывод об острой (хронической) токсичности тестируемой среды. Токсикометрические показатели, используемые в биотестиоровании, позволяют картировать загрязненные районы.
I – 2. Биоиндикация
Биоиндикация (bioindication) – метод определения качества среды обитания организмов по видовому составу и показателям количественного развития видов биоиндикаторов и структуре образуемых ими сообществ.
Биоиндикатор (bioindicator) – организм, вид, популяция, сообщество, характеризующиеся специфическими особенностями обитания или указывающие на специфические изменения условий среды (Семенченко, 2004).
Биоиндикаторы делят на следующие группы:
индивидуальные: размер особей, плодовитость, наличие аномальных особей и т.д.;
процессы: увеличение или уменьшение скоростей процесса (например, скорости фотосинтеза);
структурные: видовая структура, число толерантных (интолерантных видов), биотические индексы и т.д.;
экосистемные: видовое разнообразие, видовая структура (Семенченко, 2004).
Биоиндикаторы загрязнения (bioindicators of contamonation) -
1) организмы, которые поглощают (накапливают) токсические вещества и способны в силу этого быть показателями загрязненности воды данным веществом;
2) организмы, свидетельствующие о загрязненности среды. По набору таких организмов в водоеме судят о качестве воды (Кузьменко и др., 1999).
В отличие от биомаркеров, биоиндикаторы не могут мгновенно реагировать на изменение экологических условий, т.к. их индикаторными свойствами являются популяционные процессы и процессы в сообществе в целом.
Основным преимуществом биоиндикаторов перед биомаркерами является тот факт, что далеко не всегда кратковременное изменение условий, на которое реагирует биомаркеры, приводит к негативным изменениям в популяциях, сообществах и экосистемах (Семенченко, 2004).
Основой задачей биоиндикации является разработка методов и критериев, которые могли бы адекватно отражать уровень антропогенных воздействий с учетом комплексного характера загрязнения и диагностировать ранние нарушения в наиболее чувствительных компонентах биотических сообществ. Биоиндикация, как и мониторинг, осуществляется
на различных уровнях организации биосферы: макромолекулы, клетки, органа, организма, популяции, биоценоза. Очевидно, что сложность живой материи и характера ее взаимодействия с внешними факторами возрастает по мере повышения уровня организации. В этом процессе биоиндикация на низших уровнях организации должна диалектически включаться в биоиндикацию на более высоких уровнях, где она предстает в новом качестве и может служить для объяснения динамики более высокоорганизованной системы.
Считается, что использование метода биоиндикации позволяет решать задачи экологического мониторинга в тех случаях, когда совокупность факторов антропогенного давления на биоценозы трудно или неудобно измерять непосредственно.
Хорошие результаты дает анализ бентосных (придонных) беспозвоночных. Оценка чистоты водоемов делается по преобладанию, либо отсутствию тех или иных таксонов.
♦ Ностак сливовидный является хорошим биоиндикатором. Наличие этого вида говорит о чистой воде. Первый признак тревоги - измельчение и нарушение правильной округлой формы изумрудных "шаров" этой водоросли.
♦ Бурное развитие других сине-зеленых водорослей, например, осциллятории - хороший индикатор опасного загрязнения воды органическими соединениями.
♦ Трубочник образует огромные скопления в илу сильно загрязненных рек, в незначительных количествах встречаются также на песчаных и каменистых грунтах более чистых рек.
♦ Мотыль образует большие скопления в силу сильно загрязненных органическим веществом рек.
♦ Крыска (эриталис) - это личинка мухи - пчеловидки из семейства журчалок. Крыска обитает в загрязненных органическим веществом водоемах с черным илом и сильным запахом сероводорода.
Таким образом, биоиндикацию можно определить как совокупность методов и критериев, предназначенных для поиска информативных компонентов экосистем, которые могли бы:
адекватно отражать уровень воздействия среды, включая комплексный характер загрязнения с учетом явлений синергизма действующих факторов;
диагностировать ранние нарушения в наиболее чувствительных компонентах биотических сообществ и оценивать их значимость для всей экосистемы в ближайшем и отдаленном будущем.
I-3. Ферменты – биологические катализаторы .
Термин “фермент” (от лат. fermentum – закваска) был предложен в начале XVII века голландским ученым Ван Гельмондом.
Почти все ферменты являются белками (но не все белки – ферменты). Представление о том, что ферменты – белки утвердилось не сразу. Для этого надо было научиться их выделять в высоко кристаллической форме. Впервые ферменты в такой форме выделил в 1926 году Дж. Самнер. После этого потребовалось еще 10 лет, в течение которых было получено еще несколько ферментов в кристаллической форме, чтобы представление о белковой природе ферментов стало доказанным и получило всеобщее признание.
Классификация ферментов
В 1961 году специальной комиссией международного биохимического союза была предложена систематическая номенклатура ферментов. Ферменты были подразделены на 6 групп в соответствии с общим типом реакции, которую они катализируют. Каждый фермент получил систематическое наименование, точно описывающее катализируемую им реакцию. Однако, поскольку многие из этих систематических названий оказались очень длинными и сложными, каждому ферменту было присвоено рабочее название для повседневного употребления.
Рабочее название складывалось из названия субстрата, типа катализируемой реакции и окончания – аза.
Группа
Катализируемая реакция
Оксидоредуктазы. 480 ферментов, большая роль в энергетических процессах
Катализирует реакции окисления – восстановления, перенос атомов H и O или электронов от одного к другому.
Трансферазы
Перенос определенных группы атомов от одного вещества к другому
Гидролазы. 460 ферментов, к ним относятся пищеварительные ферменты, входящие в состав лизосом и других органоидов, где они способствуют распаду более крупных биомолекул на простые
Реакции гидролиза, при которых из субстрата образуются два продукта.
Лиазы. 230 ферментов, участвующих в регуляциях синтеза и распада промежуточных продуктов обмена
Ферменты, катализируемые реакции разрыва связей, в субстрате без присоединения воды или окисления.
Изомеразы. 80 ферментов
Ферменты, катализирующие превращения в пределах одной молекулы, они вызывают внутримолекулярные перестройки.
Лигазы (синтетазы) (около 80 ферментов)
Катализируемое соединение 2-х молекул с использованием энергии фосфатной связи, сопряжено с распадом АТФ.
По особенностям строения молекул можно разделить на 2 группы: простые белки и сложные белки.
У сложных ферментов помимо белковой части имеется добавочная группа небелковой природы – кофактор, например, многие витамины.

Рис. 1 Строение фермента
В молекуле однокомпонентного белка выделяют особую часть, представляющую собой уникальное сочетание нескольких аминокислотных остатков, располагающихся в определенной части белковой молекулы. Ее называют активным центром фермента, который взаимодействует с молекулой субстрата с образованием фермент-субстратного комплекса. Затем фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции.
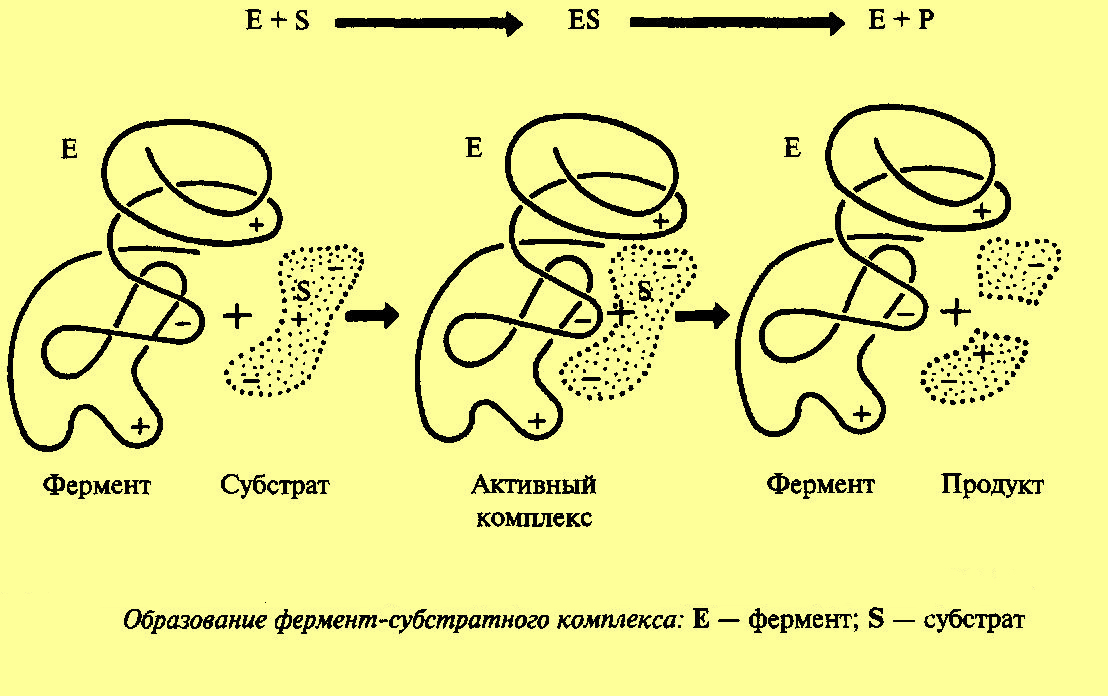
Рис.2 Схема работы фермента.
Согласно гипотезе, выдвинутой Э. Фишером, субстрат подходит к ферменту, как ключ к замку, т.е. пространственные конфигурации активного центра фермента и субстрата точно соответствуют друг другу. Субстрат сравниваем с “ключом”, который подходит к “замку” – ферменту.
Поскольку все ферменты являются белками, их активность наиболее велика при физиологически нормальных условиях:
Большинство ферментов наиболее активно работает только при определенной температуре. При повышении температуры до некоторого значения (в среднем до 50о С) каталитическая активность растет (на каждые 10о С скорость реакции повышается примерно в 2 раза). При t выше 50о С белок подвергается денатурации и активность фермента падает.
Кроме того, для каждого фермента существует оптимальное значение pH, при котором он проявляет максимальную активность.
На скорость реакции влияет также концентрация субстрата и концентрация фермента.
Все ферменты высокоспецифичны к своему субстрату и как правило, катализируют только одну вполне определенную реакцию.
Ферменты получили широкое применение в легкой, пищевой и химической промышленности, а также в медицинской практике.
В пищевой промышленности ферменты используют при приготовлении безалкогольных напитков, сыров, консервов, колбас, копченостей.
В животноводстве ферменты используют при приготовлении кормов.
Ферменты используют при изготовлении фотоматериалов.
Ферменты используют при обработке овса и конопли.
Ферменты используют для смягчения кожи в кожевенной промышленности.
Ферменты входят в состав стиральных порошков, зубных паст.
В медицине ферменты имеют диагностическое значение – определение отдельных ферментов в клетке помогает распознаванию природы заболевания (например вирусный гепатит – по активности фермента в плазме крови) их используют для замещения недостающего фермента в организме.
I - 4. Каталаза – чемпион катализа.
Рис. 3. Модель молекулы каталазы
Катала́за - гемсодержащий фермент класса оксидоредуктаз, катализирующий разложение перекиси водорода с образованием кислорода и воды; широко распространена в тканях животных и растений.
Н2О2 + Н2О2 = О2 + 2Н2О.
Каталаза представляет собой гемопротеин, простетической группой которого является гем, содержащий ион трехвалентного железа. Молекула каталзы состоит из четырех, по-видимому, идентичных субъединиц с молекулярной массой 60 000 и имеет соответственно четыре простетические группы. Феррипротопорфириновые группы гема прочно связаны с белковой частью фермента — апофермектом и не отделяются от него при диализе. Оптимальная величина рН для каталазы находится в интервале значений 6,0—8,0.
Процесс окисления с помощью цитохромов дает побочный продукт, в больших концентрациях губительный для всего живого,— перекись водорода. Совершенно ясно, что организм нужно защитить от этого крайне опасного соединения. Такая защита есть. Это фермент каталаза. Биологическая роль каталазы заключается в деградации перекиси водорода, образующейся в клетках в результате действия ряда флавопротеиновых оксидаз (ксантиноксидазы, глюкозооксидазы, моноаминоксидазы и др.), и обеспечении эффективной защиты клеточных структур от разрушения под действием перекиси водорода. Каталаза широко распространена в тканях животных, в т.ч. человека, растений и в микроорганизмах (однако фермент полностью отсутствует у некоторых анаэробных микроорганизмов). В клетках каталаза локализуется в специальных органеллах — пероксисомах.
Открытие каталазы также связано с перекисью водорода. Еще Луи Тенар, который, как мы знаем, занимался каталитическим разложением аммиака, открыл перекись водорода в 1818 году и заметил каталитическую активность по отношению к этому веществу животных тканей. Но только в 1907 году было установлено, что в этом повинен фермент, который и назвали каталазой. В кристаллическом виде получить ее удалось только через 30 лет из печени быка. Это один из наиболее активных ферментов, молекула которого разлагает в секунду 6 миллионов молекул перекиси водорода. Но что интересно, когда концентрация перекиси водорода становится незначительной, каталаза начинает катализировать реакцию окисления перекисью водорода спиртов, формальдегидов и нитратов. Ферменту простаивать нельзя!
Есть еще один фермент, содержащий железо, который также катализирует реакцию разложения перекиси водорода, это пероксидаза, открытая в самом начале нашего века. Она содержится в слюне, в соке поджелудочной железы, в печени, почках и в лейкоцитах. Имеются сведения, что в плазме крови присутствует особая пероксидаза, которая способствует реакциям некоторых производных перекиси водорода. Особенно богаты пероксидазой сок фигового дерева и корень хрена. И вообще следует заметить, что этот фермент широко распространен в живой природе.
С каталазой и пероксидазой связывают надежды на получение высокоэффективных препаратов для лечения злокачественных опухолей, так как полагают, что эти ферменты играют важную роль в росте клеток.
I-5. Методы определения активности каталазы.
Газометрический способ определения активности каталазы по Варбургу и его модификации. Сущность этого способа заключается в улавливании и измерении объема выделившегося кислорода после прибавления к водному раствору перекиси водорода экстракта каталазы [1]. Для определения активности каталазы пользуются прибором (рис. 5), который состоит из каталазника 1, бюретки 5 на 50 мл и стеклянной груши 4 или второй бюретки, соединенных каучуковыми трубками и стеклянным тройником 2. Каучуковая трубка на свободном конце тройника снабжена зажимом 3. В штативе закреплена бюретка и стеклянная груша 4. Их заполняют дистиллированной водой до половины объема.
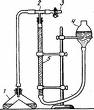 рис. 4 прибор для определения активности каталазы
рис. 4 прибор для определения активности каталазы
Растительную навеску (листья, почки, плоды и другие органы растения) массой 0,5-1 г растирают в фарфоровой ступке с кварцевым песком и добавляют 0,5 г мела для создания щелочной среды (рН > 7,7) для оптимальной активности каталазы. Во время растирания вливают небольшими порциями 20 мл воды, смесь вносят в одно колено каталазника. В другое колено помещают 5 мл 3 %-ного раствора перекиси водорода. Каталазник соединяют с каучуковой трубкой, не допуская смешивания жидкостей.
Открывают зажим и перемещением груши 4 вверх устанавливают уровень воды в бюретке на нуль. Закрывают зажим и быстрым изменением положения каталазника смешивают жидкость в обоих коленах. Затем, все время, потряхивая каталазник, по снижению уровня воды в бюретке 5 отмечают объем кислорода (в мл), выделенного в течение 3 мин.
Во время опыта каталазник нужно держать двумя пальцами в области пробки, чтобы не происходило его нагревание, так как последнее может повлиять на точность эксперимента.
Недостатками этого способа являются необходимость расчета и учета постоянного объема сосуда, зависимость от внешних условий (температуры, высоты местности над уровнем моря и атмосферным давлением), необходимость в приспособлении для механического взбалтывания прибора и по возможности исключения прикосновения руками к колбе или склянке.
Титрометрический способ определения активности каталазы по А. Н.Баху и А.И.Опарину, основанный на учете неразложившейся перекиси водорода с помощью перманганата калия, который был выбран нами в качестве прототипа. Сущность его заключается в следующем. Берут навеску пробы 1-2 г и растирают с кварцевым песком в ступке, добавляя постепенно 2-3 мл воды. Для уменьшения кислой реакции добавляют на кончике шпателя карбонат кальция до прекращения выделения пузырьков углекислого газа. Растертую массу количественно переносят в мерную колбу и доводят водой до 100 мл. Смесь оставляют стоять в течение 30-60 мин, после чего ее фильтруют. В коническую колбу на 200 мл берут пипеткой 25 мл 0,1 н. раствора пероксида водорода и добавляют туда же пипеткой 20 мл вытяжки фермента. Через 30 мин действие фермента прекращают прибавлением 5 мл 10%-ного раствора серной кислоты и титруют смесь 0,1 н. раствором перманганата калия (до образования устойчивого в течение 1 мин розового окрашивания). Одновременно ставят контроль с инактивированным нагреванием в кипящей бане в течение 5 мин ферментным раствором (20 мл). К этому раствору после охлаждения добавляют 25 мл 0,1 н. раствора Н2О2. Смесь оставляют стоять на 30 мин, после чего добавляют 5 мл 10% -ного раствора серной кислоты и титруют 0,1 н. раствором перманганата калия. Отмечают количество миллилитров перманганата калия, израсходованного на титрование всего количества пероксида водорода. По разнице между опытным и контрольным титрованиями находят количество перманганата, эквивалентное количеству разложенного ферментов пероксида водорода.
Расчет количества пероксида водорода, разложенного ферментом, ведут, исходя из того, что 1 мл 0,1 н. раствора перманганата калия соответствует 1,7 мл пероксида водорода [3].
Недостатками способа являются получение субъективных результатов в процессе титрации, необходимость постоянной проверки титра перманганата калия щавелевокислым аммонием, необходимость ежедневной проверки титра пероксида водорода, сложность расчета.
Электрофорез. Выявления каталазной активности в биологических объектах, основанный на формировании в качестве поддерживающей среды для электрофореза полиакриламидного геля (ПААГ) с использованием крахмала, проведении электрофореза и последующего окрашивания геля иодистым калием. Отличие способа состоит в том, что крахмал вводят в количестве, не превышающем 0,5 мас.%, на стадии подготовки раствора надсернокислого аммония при приготовлении разделяющего геля, а окрашивание осуществляют обработкой в 1%-ном растворе перекиси водорода рН 7,0 с последующей инкубацией в 1%-ном растворе уксусной кислоты, при этом время выдерживания в каждом из этих растворов составляет 3-10 мин [2].
Недостатками способа является наличие оборудования для проведения электрофореза, необходимость в соответствующих реактивах для приготовления ПААГ, длительность проведения анализа.
Окрашивание пробы. Определения активности каталазы в биологических объектах путем окрашивания пробы раствором, содержащим йодистый калий, с последующим анализом, пробу биологического материала обрабатывают перекисью водорода и смесью (ацетона и йодистого калия в отношении 1:1), причем анализ проводят путем фотоколориметрирования пробы на ФЭК - 56 М при длине волны 435-445 нм, а активность каталазы определяют по формуле
A=D:0,02, где A - активность каталазы в пробе;
D - оптическая плотность исследуемой пробы;
0,02 - коэффициент перевода в условные единицы активности (Е).
Газометрический метод Лишкевича –
наиболее простой способ определения активности каталазы.
5 штук не проросших семян с небольшим объемом песка растирают в фарфоровой ступке, прибавляют 3 мл дистиллированной воды, перемеши вают и выливают в колбочку прибора Лишкевича. Двумя миллилитрами воды ополаскивают ступку и жидкость выливают в колбочку прибора. До бавляется на кончике совочка мел. В тигелек наливают 2 мл 2%-ной пере киси водорода, нейтрализованной 3 каплями 0,1 н NaOH. Тигелек при по мощи пинцета устанавливают на дно колбочки. Колбочку плотно закрыва ют пробкой, которая резиновой трубкой через тройник соединяется с уравнительным сосудом.
Через отверстие в уравнительном сосуде наливают воду до нулевого деления бюретки и выходное отверстие каучуковой трубки тройника за крывают зажимом. Далее обязательно проверяют прибор на герметичность. Для этого уравнительный сосуд опускают вниз и фиксируют в одном по ложении. Уровень воды в бюретке также должен быть в одном положении. В противном случае устраняют неисправность.
Держа мениски воды нулевого деления бюретки и уравнительного сосуда на одном уровне, опрокидывают тигелек с перекисью водорода в колбочку и в течение 4 минут легонько встряхивают колбочку. Выделяю щийся кислород вытесняет из бюретки воду, уровень которой по мере уве личения количества газа начинает опускаться.
Количество выделившегося кислорода отмечают каждую минуту, причем в момент отсчета уровень воды в уравнительном сосуде устанавли вают точно по уровню в бюретке. Опыт повторяют 2 раза, высчитывают среднее арифметическое.
Активность каталазы выражается величиной, равной объему воды, вытесненной кислородом за 5 минут.
I – 6. Единицы измерения активности каталазы.
Определение количественного содержания ферментов в биологических объектах представляет известные трудности, поскольку, за редким исключением, ферменты в тканях присутствуют в ничтожно малых концентрациях. Поэтому о количестве ферментов судят по скорости катализируемой реакции в определенных, согласованных условиях измерения. При оптимальных условиях температуры, рН среды и полном насыщении фермента субстратом скорость катализируемой реакции пропорциональна концентрации фермента. О скорости ферментативной реакции судят или по скорости убыли субстрата, или по скорости образования продукта реакции.
Для выражения концентрации фермента и количественной оценки его активности в условных единицах Комиссией по ферментам Международного биохимического союза была рекомендована стандартная международная единица (Е или U): за единицу активности любого фермента принимается то количество его, которое в оптимальных условиях катализирует превращение 1 микромоля субстрата или образование 1 микромоля продукта в минуту (мкмоль/мин).
В связи с введением Международной системы единиц (СИ) предложено новое выражение активности фермента в каталах (кат, kat): 1 кат есть каталитическая активность, способная осуществлять реакцию со скоростью, равной 1 молю в 1 с (1 моль/с). Отношение международной единицы (U) к каталу можно выразить следующим образом: 1 кат = 1 моль•с–1 = 60 моль•мин–1 = 60•106 мкмоль•мин–1 = 6•107 U, или: 1 U = 1 мкмоль•мин–1 = (1/60) мкмоль•с–1 = (1/60) мккат = 16,67 нкат. Таким образом, 1 U фермента соответствует 16,67 нкат.
Рекомендовано, кроме того, измерять активность фермента при температуре 25°С, оптимуме рН и концентрации субстрата, превышающей концентрацию насыщения. В этих случаях скорость соответствует нулевому порядку реакции в отношении субстрата и будет зависеть только от концентрации фермента.
Для выражения активности в практической работе с ферментами часто пользуются произвольными понятиями удельной и молярной активности. Удельную активность фермента принято выражать числом единиц ферментативной активности на 1 мг белка (или числом каталов на 1 кг активного белка). Количество молекул субстрата, подвергающихся превращению одной молекулой фермента в продукт в процессе реакции в единицу времени при полном насыщении фермента субстратом, принято называть числом оборотов фермента, или молярной активностью (молярная каталитическая активность выражается в каталах на 1 г-моль фермента).
Так как каталитическая активность не зависит от объема раствора, в котором протекает реакция, активность фермента можно выразить величиной, равной объему воды, вытесненной кислородом за единицу времени (секунду, минуту, час). Пересчет выделившегося кислорода в мл за час на I г растительной массы проводят по формуле:
VО2 мл/г,час = V1 х m/20, где
VО2 мл/г, час - объем О2 в мл на 1 г массы за 1 час;
V1- объем О2 в мл зафиксированный в эксперименте;
m - масса навески, г;
20 - коэффициент пересчета на 1 час.
Глава II.
Корреляционный анализ взаимосвязи активности каталазы и степени загрязнения среды обитания.
II – 1. Исследование активности каталазы в листьях однолетних
декоративных растений в условиях городской среды.
Высокой декоративностью и разнообразием обладают различные виды однолетних цветущих растений, применяемые при оформлении клумб и рабаток. Эти растения широко используются в озеленении городских улиц, в санитарно-защитных зонах и на территориях предприятий. Однако неблагоприятные условия окружающей среды зачастую оказывают на них негативное влияние, так как поглощение соединений, чуждых метаболизму, приводит к разнообразным нарушениям жизненных процессов, что в свою очередь может привести как к ухудшению декоративных свойств, так и к гибели растений.
Цель работы:
определить виды декоративных растений более устойчивых к неблагоприятным условиям произрастания на урбанизированных территориях.
Объекты исследования: цветущие однолетние растения, находящиеся в средневозрастном генеративном состоянии, наиболее распространенные в посадках города Тамбова.
бархатцы прямостоячие (Tagetes ereсta), бархатцы отклоненные (Tagetes patula), пеларгония зональная (Pelargonium zonale), целозия перистая (Celosia argtntea), петуния гибридная (Petunia hybrida.).
Реактивы: мел, 3%-ный раствор перекиси водорода (Н2О2).
Оборудование: фарфоровые ступки с пестиками, пипетки на 5 мл, мерные цилиндры на 25 мл, прибор для определения активности каталазы, часы, весы с разновесами.
Методика исследования.
Известно, что активность фермента зависит от вида растения, возраста клеток, типа ткани и других факторов; оптимум действия каталазы наблюдается при рН=6,5, а в более кислых и щелочных средах активность фермента уменьшается [Цегарем М.П., Пруидзе Г.Н., 1990]. Исследовались растения, приблизительно одного возраста, сравнивались показатели активности каталазы у разных видов растений на участках с различной степенью загрязнения автотранспортом:
1) парк Победы – клумбы находились недалеко от улицы Мичуринской свысокой грузонапряженностью;
2) клумба на территории школы № 13 – низкая грузонапряженность;
3) клумба на территории садового участка в районе Чистые пруды (5 поле) – экологически чистый район (контроль).
Активность каталазы определяли по методу Лишкевича.
Растительную навеску листьев каждого вида растения массой 1 г растирают в фарфоровой ступке с кварцевым песком и добавляют 0,5 г мела для создания щелочной среды (рН > 7,7) для оптимальной активности каталазы. Во время растирания вливают небольшими порциями 20 мл воды, смесь вносят в колбу. 5 мл 3 %-ного раствора перекиси водорода вводят через воронку и быстро перекрывают кран. Затем открывают зажим в газоотводной трубке и наблюдают вытеснение воды кислородом в мерном цилиндре.
Потряхивая колбу, отмечают объем кислорода (в мл), выделенного в течение 5 мин. Измерения проводят 3 раза и фиксируют средние показатели
Пересчет выделившегося кислорода в мл за час на I г растительной массы проводят по формуле:
VО2 мл/г,час = V1 х m/12,
где : VО2 мл/г, час - объем О2 в мл на 1 г массы за 1 час;
V1- объем О2 в мл зафиксированный в эксперименте;
m - масса навески, г;
12 - коэффициент пересчета на 1 час.
Результаты исследований заносят в таблицу № 4,5,6,7. приложения.
Для сопоставления полученных результатов (активность каталазы зависит от видовой принадлежности растения) определяли % снижения активности фермента по формуле: С = А1: Аэ х 100%, где
С - % снижения активности;
А1 – активность каталазы на исследуемом участке;
Аэ – активность каталазы на контрольном участке.
Полученные результаты отражены в таблице.
Сравнение активности каталазы растений в местах с различной степенью загрязнения среды.
Места обитания
Растения
Активность каталазы (мл/г в час)/ % снижения
Парк Победы
Школа
Чистые пруды
1. Бархатцы прямостоячие
25,2/63,6%
32,4/81,8%
39,6/ 100%
2.Бархатцы отклоненные
27,6/67,6%
34,8/85,3%
40,8/100%
3. Пеларгония зональная
34,8/77,6%
42/93,1%
45,1/100%
4. Петуния гибридная
33,6/70%
45/93,7%
48/100%
5. Целозия перистая
39,6/78,5%
45,6/90,3
50,4/100%
На основании полученных результатов строим диаграмму.
Снижение каталазной активности растений в местах с различной степенью загрязнения
Наибольшей устойчивость к загрязнению среды автотранспортом обладают целозия перистая и пеларгония зональная, немного уступает им петуния гибридная, а наименьшие показатели наблюдались у бархатцев отклоненных.
Подобная картина изменений активности каталазы говорит о сложных процессах адаптаций растений, имеющих свою специфику у каждого вида растений, независимо от систематической принадлежности. По-видимому, достаточно высокие концентрации загрязняющих веществ вызывали окислительное повреждение фермента, что и привело к понижению его активности в результате накопления большого количества Н2О2, либо блокирования активного центра каталазы ксенобиотиками. Изменение активности фермента во многом связано с биологической особенностью вида и является до некоторой степени показателем реакции растительного организма на комплекс экологических воздействий. Большинство растений обладают пониженной активностью каталазы на загрязненных участках произрастания, и чем выше устойчивость вида к загрязняющим веществам, тем выше активность этого энзима, и наоборот, ингибирование активности фермента может являться диагностическим признаком слабой толерантности растений к эмиссионным нагрузкам.
II – 2. Определение активности каталазы сырого картофеля при
воздействии среды разной степени загрязнения.
 В процессе дыхания при восстановлении флавиновых нуклеотидов происходит последовательный перенос обоих водородных атомов и возникают свободные радикалы (ФАД Н > ФАД ∙ Н Н →ФАД ∙ Н2). При дефиците субстратов может накапливаться некоторое количество радикалов, непосредственно реагирующих с кислородом с образованием перекиси водорода по схеме: (2ФАД Н + О2 2ФАД + Н2О2). Такого рода процессы объясняются способностью флавопротеинов к слабому самоокислению. Образующая при этих процессах Н2О2 при высоких концентрациях оказывает токсическое действие на цитоплазму.
В процессе дыхания при восстановлении флавиновых нуклеотидов происходит последовательный перенос обоих водородных атомов и возникают свободные радикалы (ФАД Н > ФАД ∙ Н Н →ФАД ∙ Н2). При дефиците субстратов может накапливаться некоторое количество радикалов, непосредственно реагирующих с кислородом с образованием перекиси водорода по схеме: (2ФАД Н + О2 2ФАД + Н2О2). Такого рода процессы объясняются способностью флавопротеинов к слабому самоокислению. Образующая при этих процессах Н2О2 при высоких концентрациях оказывает токсическое действие на цитоплазму.
Нейтрализация перекиси водорода до Н2О и ½ О2 происходит при участии фермента каталазы по схеме:
каталаза: Фермент - Fe-OH + Н2О2 -> Фермент-Fe-O-OH + Н2О Фермент - Fe-O-OH + H2O2 -> Фермент-Fe-OH + О2 + Н2О
Н2О2 + Н2О2 -> О2 + 2Н2О
Об активности каталазы судят по объему кислорода, выделяющегося в результате разложения перекиси водорода.
Цель исследования: изучить активность фермента каталазы в сыром картофеле в зависимости от степени загрязнения среды.
Объекты исследования: сырой картофель, талая вода из снега, с разной
степенью загрязнения.
Реактивы: мел, 3%-ный раствор перекиси водорода (Н2О2).
Оборудование: фарфоровые ступки с пестиками, пипетки на 5 мл, мерные цилиндры на 25 мл, прибор для определения активности каталазы, часы, весы с разновесами.
Методика исследований.
Определение активности каталазы проводили газометрическим методом Лишкевича. Для этого использовали модернизированный прибор (фото №2), который состоит из трёхгорлой колбы, газоотводной трубки с зажимом, трубки с краном и воронкой, стакана с водой и мерным цилиндром. Необходимым условием работы прибора является его полная герметичность. Данная конструкция является более простой в работе, а основные принципы методики Лишкевича не нарушает.


Фото. №1 Фото № 2
Сырой картофель нарезают мелкими кубиками и выдерживают их сутки в талой воде из снега, взятого с точек разной степени загрязнения. Для контроля, часть нарезанного картофеля помещают в дистиллированную воду (фото № 1).
Растительную навеску (сырой картофель) массой 1 г растирают в фарфоровой ступке с кварцевым песком и добавляют 0,5 г мела для создания щелочной среды (рН > 7,7) для оптимальной активности каталазы. Во время растирания вливают небольшими порциями 20 мл воды, смесь вносят в колбу. 5 мл 3 %-ного раствора перекиси водорода вводят через воронку и быстро перекрывают кран. Затем открывают зажим в газоотводной трубке и наблюдают вытеснение воды кислородом в мерном цилиндре.
Потряхивая колбу, отмечают объем кислорода (в мл), выделенного в течение 5 мин. Измерения проводят 3 раза и фиксируют средние показатели
Пересчет выделившегося кислорода в мл за час на I г растительной массы проводят по формуле:
VО2 мл/г,час = V1 х m/12,
где : VО2 мл/г, час - объем О2 в мл на 1 г массы за 1 час;
V1- объем О2 в мл зафиксированный в эксперименте;
m - масса навески, г;
12 - коэффициент пересчета на 1 час.
Результаты исследований заносят в таблицу № 2 приложения. На основании полученных результатов строим диаграмму.
Зависимость активности каталазы в сыром картофеле от степени загрязнения среды
На диаграмме четко прослеживается прямая зависимость снижения активности каталазы от степени загрязнения среды. Чем больше грузонапряженность исследуемой территории, тем меньше активность каталазы. Это объясняется тем, что тяжелые металлы выхлопных газов ингибируют фермент каталазу, а изменение кислотности среды снижает ее активность.
II – 3. Определение активности каталазы в проростках фасоли,
выращенных на средах с разной степенью загрязнения.
Увеличение уровня загрязнения среды оказывает непосредственное влияние на изменение активности окислительно-восстановительных ферментов у ряда видов растений, а так же способствует снижению активности каталазы.
Наиболее часто при изучении устойчивости растений к неблагоприятным факторам среды учитывается активность антиоксидантных ферментов. Поддержание равновесия окислительно-восстановительных процессов в клетках при действии газов, особенно кислотогенных, имеет особое значение, так как последние вызывают сдвиг межклеточной и внутриклеточной среды в кислую сторону. Поскольку оптимумы действия большинства гидролитических ферментов находятся в кислой зоне, падение рН клеточной среды способствует их активации, что в дальнейшем может привести к усилению окислительных процессов в клетках. При негативных воздействиях в клетках растений усиливается образование активных форм кислорода, что в итоге может привести к окислительному стрессу. В последние годы образование и быструю диффузию через мембраны перекиси водорода рассматривают как проявление сигнальной функции, включающего индукцию синтеза ферментов-антиоксидантов [ШевяковаН.И. и др., 2002; Духовский П. и др., 2003].
Цель работы: исследование зависимости активности
антиоксидантного фермента каталазы в проростках
фасоли от степени загрязнения среды
автотранспортом.
Объект исследования: проростки фасоли.
Материалы и оборудование: проростки семян фасоли, фарфоровые ступки, пинцет, мел, промытый речной песок, дистиллированная вода, пипетки на 5 мл, пере кись водорода - 3%, NaOH - 0,1н, прибор для фиксирования выделившегося кислорода.
Ход работы.
Подготовка среды для проращивания семян.
Работа велась по методике, предложенной методическим пособием для учителей «Исследование состояния городской среды» под редакцией кандидата геол.- мин. наук И.Н. Рыжова: ТГПИ, 1994 г. Степень загрязнения атмосферы отражена в составе выпавшего снега, поскольку снежинки, падая в воздухе, фильтруют, очищают атмосферу приземного слоя. Низкие температуры в толще снега в холодный период года не создают условия для миграции подвижных химических элементов и соединений. Таким образом, можно определить тип самых распространенных загрязнителей воздуха и их количество.
При проведении данной работы необходимо соблюдать определенные условия:
снег должен быть отобран сразу после сильного снегопада;
проба должна быть отобрана на некотором удалении от дорог и
тротуаров (5-10 м), хорошо подходят условия парка, сквера, стадиона,
т.е. места, где обычно не ходят люди и животные;
в пробе не должно быть остатков сухих листьев, семян, хвоинок и т.п.;
посуда должна быть чистой и не реагировать с талой водой, например,
эмалированная или стеклянная, можно пластиковая.
Для проведения данного опыта брали пробы снега в районах с разной грузонапряженностью.
Карта микрорайона школы № 13
(точки забора проб снега)
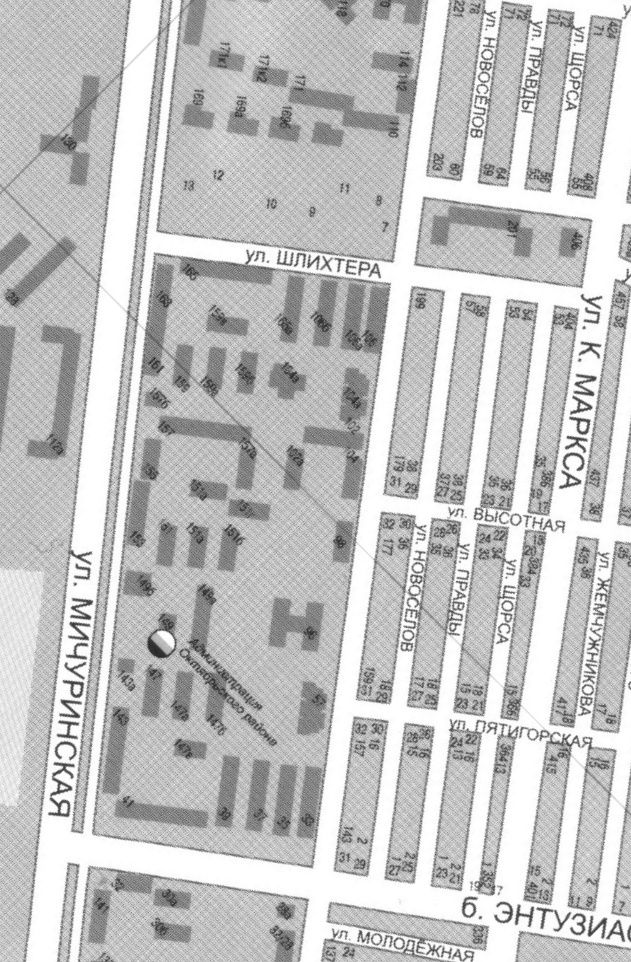
Бульвар Энтузиастов (высокая грузонапряженность)
Улица Шлихтера (средняя грузонапряженность)
Улица Николая Вирты (низкая грузонапряжонность)
Внутренний двор частного строенияутренний двор частного строения
я
пряжонность)
ществ как угарный газ, углеводороды и оксиды азота (перекресток улиц Высотная и Новоселов)
5. Школьный двор за бассейном «Надежда».
55
После того, как талая вода этих проб приобрела комнатную температуру, ее разливали в чашки Петри. Смена фасоли проращивали в чашках диаметром 10 см на влажной фильтровальной бумаге при комнатной температуре (фото 3, 4).


Фото 3. фото 4.
5 штук проросших семян с небольшим объемом песка растирают в фарфоровой ступке, прибавляют 3 мл дистиллированной воды, перемеши вают и выливают в колбочку прибора. Двумя миллилитрами воды ополаскивают ступку и жидкость выливают в колбочку прибора. До бавляется на кончике совочка мел. Затем наливают через воронку 2 мл 3%-ной пере киси водорода, нейтрализованной 3 каплями 0,1 н NaOH и быстро закрывают кран (обязательно проверяют прибор на герметичность).
В течение 5 минут легонько встряхивают колбочку. Выделяю щийся кислород вытесняет из мерного сосуда воду, уровень которой по мере уве личения количества газа опускается.Количество выделившегося кислорода отмечают каждую минуту, опыт повторяют 2 раза, высчитывают среднее арифметическое из двух повторностей. Для контроля, проращивали семена на талой воде из холодильника.
Активность каталазы выражается величиной, равной объему воды, вытесненной кислородом за 5 минут. Полученные результаты заносим в таблицу.
№ опыта
Места
Забора проб
Объем выделившегося кислорода
(мл)
1
2
среднее
1.Бульвар Энтузиастов
(высокая грузонапряженность)
3,5
3,0
3,25
2.Улица Шлихтера
(средняя грузонапряженность)
5,1
4, 8
4,95
3.Улица Николая Вирты
(низкая грузонапряжонность)
5,5
6,1
5,8
4.Школьный двор за бассейном «Надежда».
3,8
4,5
4,15
5.Внутренний двор частного строенияутренний двор частного строения
я
пряжонность)
ществ как угарный газ, углеводороды и оксиды азота
(ул. Щорса)
6,5
7,0
6,75
6. Контроль
7,3
7,5
7,4
Зависимость активности каталазы от степени загрязнения среды.
На диаграмме видна обратно пропорциональная зависимость активности каталазы от степени загрязнения среды автотранспортом. Наименьшие показатели отмечены на пробах, взятых с Бульвары Энтузиастов, а наибольшие - на улицах с малой грузонапряженностью (Н.Вирты и Щорса). Это объясняется тем, что тяжелые металлы, содержащиеся в выхлопных газах автомобилей, ингибируют деятельность фермента и реакция разложения перекиси водорода замедляется. Следовательно, активность каталазы может служить показателем загрязнения среды обитания.
Глава III. Заключение
В современных условиях природная среда подвержена комбинированному техногенному загрязнению, поэтому методы биотестирования все чаще используются для определения токсических свойств окружающих нас сред: воздуха, воды, почвы и промышленных отходов. Это обуславливается рядом обстоятельств:
указанные объекты обычно содержат большое количество ингредиентов, токсикологические свойства которых не всегда характеризуются простой суммой свойств каждого из них с учетом количественного состава, определяемого аналитическими методами;
среда часто загрязнена неустойчивыми продуктами взаимодействия и распада, которые иногда токсичнее исходных веществ;
количество присутствующих в окружающей среде загрязнителей значительно превышает число удовлетворительных физико-химических методов анализа, позволяющих контролировать их содержание на уровне ПДК ;
позволяет получить интегральную токсикологическую характеристику природных сред независимо от состава загрязняющих веществ.
В ходе данной исследовательской работы было установлено.
Достаточно высокие концентрации загрязняющих веществ вызывают окислительное повреждение фермента каталазы или блокирование активного центра его ксенобиотиками, что и приводит к понижению жизнеспособности растения в результате накопления большого количества Н2О2.
Изменение в свойствах фермента имеют адаптационный характер и дают возможность противостоять неблагоприятным условиям среды. Данная работа показала, прямую зависимость устойчивости растений к загрязнению среды обитания и активностью каталаза.
Высокие значения активности каталазы у целозии перистой и пеларгонии зональной позволяют предположить, что их ферментативный аппарат более пластичен, что позволяет им приспосабливаться к меняющимся условиям произрастания.
Наибольшая устойчивость целозии перистой и пеларгонии зональной к условиям урбанизированной среды по сравнению с другими изученными видами, позволяет рекомендовать их для высаживания в клумбы и рабатки в местах с высокой грузонапряженностью автотранспорта.
Как правило, биотестирование не дает ответа на вопрос о характере загрязняющего вещества, вызывавшего ту или иную реакцию тест-объекта. Тест-функции в биотестировании носят общий, неспецифический характер. Однако количество загрязняющих веществ, попадающих в окружающую среду, неуклонно возрастает и не исключено, что какое-либо вещество, или смесь веществ, может привести к возникновению специфических реакций у тест-объектов, особенно на клеточном или тканевом уровнях организации.
Исследования подтвердили гипотезу проекта.
Снижение активности каталазы в тканях организмов может служить показателем степени загрязнения окружающей среды ксенобиотиками.


Рис.5 Пеларгония зональная рис.6 Целозия перистая
IV.Информационные источники 
1. Ашихмина Т.Я. и др. Биоиндикация и биотестирование – методы познания экологического состояния окружающей среды. – Киров, 2005.
2. Бондарук М.М., Ковылина Н.В.. Биология. Дополнительные материалы и внеклассные мероприятия по биологии и экологии 10- 1 класы. Волгоград. Издательство «Учитель» 2007 год.
3.Брагинский Л.П. Методологические аспекты токсикологического биотестирования на Daphnia magna Str. и других ветвистоусых ракообразных (критический обзор) // Гидробиол. журн. - 2000. - Т. 36, N 5. - С. 50-70.
4. Голубев И.Р., Новиков Ю.В.. «Окружающая среда и ее охрана» книга для учителя. Москва. Издательство «Прсвещение» 1985 год.
5. Губарева Л.И., Мизирева О.М., Чурилова Т.М.. Экология человека. Практикум для вузов. Мосва. Гуманитарный издательский центр. Владос. 2003 год.
6. Долматовский Ю.А.. Автомобиль за 100 лет. Москва. Издательство «Просвещение». 1986 год.
7. Дьяченко Г.И. Мониторинг окружающей среды (Экологический мониторинг) Новосибирск. – 2003.
8. Дятлов С.Е. Роль и место биотестирования в комплексном мониторинге морской cреды // Экология моря. - 2000, вып.51. - С. 83-87.
9. Крайнюкова А.Н. Биотестирование в охране вод от загрязнения // Методы биотестирования вод. - Черноголовка, 1988. - С. 4-14.
http://www.microbiotests.be/publications/publications.html
10. Мелехова О.П., СарапульцеваЕ.И., Биологический контроль окружающей среды: биоиндикация и биотестирование / Ред., Е.И. М.: Издательский центр «Академия» 2010, 288 с. 3-е изд. ISBN 978-5-7695-7033-9.
11. Рыжов И.Н.. Исследование состояния городской среды (методическое пособие для учителей). Тамбов. Тамбовский государственный педагогический институт. 1994 год
12. Семенченко В.П. Принципы и системы биоиндикации текучих вод. – Минск: "Орех", 2004. – 125 с.
13. Стадницкий Г.В., Родинов А.И.. «Экология» учебное пособие для вузов». Москва. Издательство «высшая школа» 1988 год.
14. Стволинская Н.С., Оценка мутагенности окружающей среды // Биология в школе – 1997г. - №5.
15.Харитонов Н.П., Организация исследовательской деятельности учащихся
//Биология в школе -2004г. - №6.
17. http://ecosoft.iatp.org.ua
18. http://www.wikipedia.ru
19. http://www.microbiotests.be/
20.http://www.microbiotests.be/newsletters/Toxkit%20Newsletter%201.pdf
22 motor-transp.host1st.ru
23. www.krugosvet.ru/articles/116/1011616/1011616a1.htm
24. greenword.ru/2007/12/environmental.html
25. www.ecosystema.ru/07referats/zagr.htm


Нравится материал? Поддержи автора!
Ещё документы из категории биология:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ