Урок физики для 9 класса на тему «РАДИОАКТИВНОСТЬ. ОПЫТ РЕЗЕРФОРДА. ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА. СОСТАВ ЯДРА АТОМА»
Дата: ___________ Подпись: __________
Класс: 9 класс
Предмет: физика
Учитель Чернобаев А.Ю.
Тема: «РАДИОАКТИВНОСТЬ. ОПЫТ РЕЗЕРФОРДА. ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА. СОСТАВ ЯДРА АТОМА»
Цель урока: изучить структуру атома, а также радиоактивность, донести до учащихся сведения о строении и составе ядра.
Задачи:
Воспитательная: воспитать культуру физического труда; внимательность при объяснении нового материала.
Образовательная: изучить рентгеновское излучение, донести до учащихся сведения о строении и составе ядра.
Развивающая: способствовать развитию мыслительной деятельности.
Тип урока: комбинированный урок
Программное обеспечение: учебник, рабочая тетрадь, доска, справочный материал и предлагаемый учителем дополнительный материал.
План:
I Орг. момент
II Проверка домашнего задания
III Устный опрос по прошедшим темам: «Гипотеза Планка. Фотоэффект»
IV Изучение нового материала:
Радиоактивность
Описание опыта Резерфорда
Планетарная модель атома
Состав атома
Пример решения задачи
V Рефлексия
VI Подведение итогов
VII Домашнее задание
Ход урока:
I Орг. момент
II Проверка домашнего задания §61-64
III Устный опрос по прошедшим темам:
IV Изучение нового материала:
РАДИОАКТИВНОСТЬ
Все тела во Вселенной состоят из атомов и молекул. Действительно, атом является наименьшей частицей любого элемента, определяющей его химические свойства. Однако положение о том, что “атом является неделимой частицей”, в начале ХХ в. было опровергнуто экспериментальным путем.
Дискретность заряда ионизированного атом, явления теплового излучения, фотоэффекта, рентгеновских лучей, а также открытие электрона и другие экспериментальные факты дали Основание полагать, что атом имеет сложное строение. Действительно, как будет показано в следующем параграфе, великий английский ученый Эрнест Резерфорд (1871—1937) и его ученики экспериментально установили, что атом состоит из положительно заряженного ядра и вращающихся вокруг него электронов. В этом параграфе речь пойдет о радиоактивном явлении, благодаря которому было доказано сложное строение не только атома, но и его ядра.
В конце ХIХ в. (1896 г.) французский физик А. Беккерель (1852—1908) стал свидетелем еще одного излучения, природа которого не имела никакого аналога. Он обнаружил, что уран, расположенный в конце периодической системы д.И. Менделеева, обладает способностью самопроизвольно испускать какое-то невидимое излучение.
В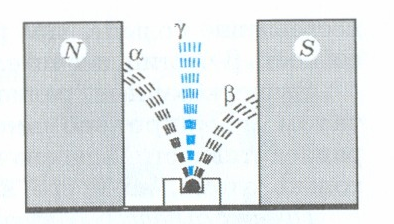 1898 г. П. Кюри и М. Склодовская-Кюри выделили из урановой руды два новых химических элемента: радий и полоний. Слово “радий” образовано от латинского - “излучать, испускать лучи”. Название полоний введено в память о Польше, откуда родом была М. Склодовская. Оказалось, что активность излучений этих двух элементов в несколько тысяч раз больше, чем у урана.
1898 г. П. Кюри и М. Склодовская-Кюри выделили из урановой руды два новых химических элемента: радий и полоний. Слово “радий” образовано от латинского - “излучать, испускать лучи”. Название полоний введено в память о Польше, откуда родом была М. Склодовская. Оказалось, что активность излучений этих двух элементов в несколько тысяч раз больше, чем у урана.
Химические элементы, которые наподобие урана и радия испускают особые излучения, называются радиоактивными элементами.
При исследовании излучения радиоактивных элементов в магнитном поле было обнаружено, что они распадаются на три вида. Их называют альфа-, бета- и гамма-лучами и соответственно обозначают греческими буквами α, β, γ. Причем α- и β-лучи отклоняются в противоположные стороны, что указывает на наличие у них электрических зарядов, противоположных по знаку. Положительно заряженные компоненты получили название α-лучей, отрицательно заряженные - β-лучей. При этом β-лучи отклонялись в магнитном поле более резко, чем α-лучи. Отсюда следует, что масса α-частиц гораздо больше, чем масса β-частиц. Действительно, позднее было установлено, что α-лучи представляют собой поток ядер атомов гелия, β-лучи — поток электронов. Поэтому их часто называют α- и β-частицами.
Гамма-лучи в магнитном поле не меняют своего начального направления. Они являются потоком самых коротковолновых электромагнитных излучений, частота которых выше частоты рентгеновских лучей. Поэтому проникающая способность γ-излучений несравненно больше, чем рентгеновских лучей. Проникающая способность β-частиц значительно выше, чем α-частиц.
Вышеуказанные радиоактивные излучения являются результатом самопроизвольного распада ядра атома. Явление радиоактивности однозначно подтверждает сложное строение не только атома, но и его ядра.
Процесс самопроизвольного испускания α-, β- и γ-лучей ядрами радиоактивных элементов называется радиоактивностью, а сами лучи— радиоактивным излучением.
ОПЫТ РЕЗЕРФОРДА.
В начале ХХ в. перед учеными были поставлены следующие вопросы: если атом - сложная частица, то какое он имеет строение? Из каких частиц состоит атом и как они расположены? Какова природа силы, связывающей отдельные частицы атома?
Ответы на эти вопросы были найдены в результате теоретических и экспериментальных исследований. В формировании современной теории строения атома большую роль сыграли экспериментальные исследования Э. Резерфорда по рассеиванию α-частиц в тонкой металлической пластинке.
В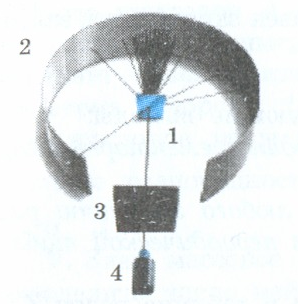
 1911 г. Эрнест Резерфорд и его ученики провели серию опытов по рассеиванию α-частиц в очень тонкой золотой или платиновой фольге (рис. 151, а). Альфа-частица, вылетающая из источника (4) радиоактивного излучения, проходит через узкое отверстие коллиматора (3) и попадает на золотую фольгу (1). Столкнувшись с атомами фольги, α-частицы изменяют направление своего движения и рассеиваются. Изредка некоторые α-частицы при этом меняют направление своего движения более чем на 90°, что видно на экране (2).
1911 г. Эрнест Резерфорд и его ученики провели серию опытов по рассеиванию α-частиц в очень тонкой золотой или платиновой фольге (рис. 151, а). Альфа-частица, вылетающая из источника (4) радиоактивного излучения, проходит через узкое отверстие коллиматора (3) и попадает на золотую фольгу (1). Столкнувшись с атомами фольги, α-частицы изменяют направление своего движения и рассеиваются. Изредка некоторые α-частицы при этом меняют направление своего движения более чем на 90°, что видно на экране (2).
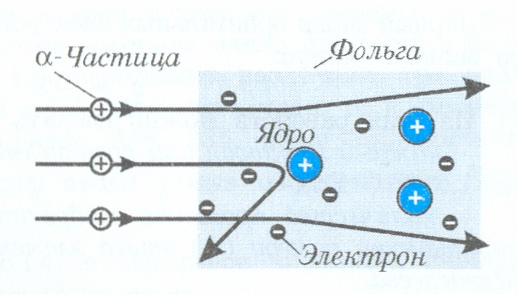
Изучив рассеивание α-частиц, Резерфорд пришел к выводу, что очень малая часть атома способствует резкому отклонению α-частиц. Кроме того, эта часть атома должна иметь значительный положительный заряд и довольно большую массу (рис. 151, в). Только тогда массивная α-частица, также несущая положительный заряд, может отклониться на большие углы. Действительно, только одноименно заряженные частицы отталкиваются друг от друга. Масса α-частицы примерно в 8000 раз больше массы электрона атома. Именно поэтому отрицательно заряженный электрон не в состоянии заметно изменить направление движения α-частицы, движущейся с большой скоростью.
ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА
Подводя итоги своих многочисленных опытов, Резерфорд предложил планетарную модель атома, которая подобна Солнечной системе. По этой модели в центре атома расположено положительно заряженное атомное ядро, вокруг которого вращаются отрицательно заряженные электроны. Такое электронное окружение ядра называется электронной оболочкой, а сами электроны — орбитальными электронами.
Ядро атома занимает очень маленькую центральную часть атома. Диаметр ядра равен 10-12 -10-13 см, а атома — порядка 10-8 см. Если представить атом как большой футбольный стадион, то размер ядра атома при этом будет соответствовать размеру ягоды вишни, упавшей посередине футбольного поля.
Многочисленными исследованиями удалось определить заряд атомного ядра (qe) химического элемента: ![]()
где Z - порядковый номер элемента в периодической системе Менделеева; е — элементарный заряд.
Решение задач:
№1. Чему равен полный заряд электронов в атоме хроме?
Дано
СИ
Решение
Cr24
Z=24
![]()
![]()
Ответ: ![]()
qe-?
№2 Полный заряд ядра атома равен 2,08*10-18 Кл, что это за элемент?
Дано
СИ
Решение
qe=2,08*10-18 Кл
![]()
![]()
Ответ: ![]()
Z -?
V Рефлексия
На каких опытах обоснована планетарная модель атома? Чему равен заряд протона и электрона?
Что вы можете сказать о размере и заряде ядра атома?
Из каких частиц состоит атомное ядро? Что означает массовое число ядра?
Что такое зарядовое число ядра? В чем заключается его физический смысл?
VI Подведение итогов
VII Домашнее задание §65-66 вопросы. Чему равен полный заряд электронов в атоме W,Ne,Ra

Нравится материал? Поддержи автора!
Ещё документы из категории физика:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ