Конспект урока для 8 класса "Оксиды, их классификация и свойства"
Тимофеева Ольга Николаевна
Приложение 4.1.4.
Конспект урока химии.
Тема урока: Оксиды, их классификация и свойства.
Класс: 8
Тип урока: изучение новой темы на основе комплексного применения ранее полученных знаний, умений и навыков.
Метод: метод проектов, проблемное обучение
Форма работы: групповая
Продолжительность урока: 45 минут
Цель урока: Получение общей информации об оксидах в процессе самостоятельной работы с опорой на применение ранее полученных знаний в комплексе новых ситуаций.
Задачи урока:
Образовательные:
1.Повторить:
классификацию, виды оксидов и основные правила составления названий неорганических веществ;
основные области применения оксидов;
агрегатное состояние веществ.
2.Установить взаимосвязи между строением и свойствами оксидов.
3.Самостоятельно применить усвоенные и закрепленные ранее знания для получения и систематизации информации о классификации, номенклатуре, строении и общих свойствах оксидов.
Развивающие:
1.Развивать:
умения для поиска взаимосвязи между изученным ранее и новым материалом;
умения устанавливать причинно-следственные связи;
умения поиска решения поставленных проблем;
логическое мышление (умения сравнивать, наблюдать, обобщать, делать выводы);
коммуникативные навыки при работе в группах;
2.Формировать навыки “сворачивания” изученной информации и представления ее в виде наглядных схем и рисунков.
3.Продолжать формировать навыки работы со справочной литературой.
4.Продолжать формировать умение оценивать свою деятельность и деятельность других участников процесса.
Воспитательные:
1.Воспитывать самостоятельность, терпимость и уважение к своим партнерам, чувство ответственности, уверенность в себе.
2.Средства обучения и оборудование:
инструктивные карточки с заданиями,
компьютер, мультимедийный проектор,
листы ватмана,
цветные маркеры,
прибор для получения газов,
образцы кислот, оксидов, щелочей, мрамор, известковая вода,
пробирки,
колба с водой,
оценочные листы.
При подготовке к уроку формируются 2 группы учащихся. В течение урока работает группа экспертов (это могут быть учителя, учащиеся 10 класса)
План урока:
I. Организационный момент
II. Постановка целей и задач (актуализация)
III. Основная часть:
организация работы в группах, погружение в проект;
выполнение заданий в группах по инструктивным картам;
оформление мини-проектов
презентация мини-проектов
IV. Рефлексия, подведение итогов
V. Домашнее задание – параграф 40, задания 1-3.
Ход урока
Время
Действия учителя
Действия учащихся
Примечание
1 мин
I. ОРГАНИЗАЦИОННЫЙ МОМЕНТ
Приветствие
6 мин
II. АКТУАЛИЗАЦИЯ
Объявляю тему урока, формулирую цели, задачи.
Акцентирую внимание на взаимосвязи ранее изученного материала с новой темой.
Демонстрирую презентацию.
Разъясняю этапы предстоящей работы учащихся, провожу инструктаж, указываю форму записи и представления изученного материала.
Разъясняю форму оценивания работы групп.
Принимают, уточняют, цели и задачи.
Смотрят презентацию, анализируют, делают выводы.
Осмысливают и конкретизируют этапы работы.
Уточняют в случае недопонимания.
2 мин
III. ОСНОВНАЯ ЧАСТЬ
1 этап: организация деятельности в группах, погружение в проект
Выдаю группам инструктивные карты – задания и необходимый дополнительный материал (справочники, реактивы).
Провожу необходимый инструктаж для каждой группы в отдельности.
Получают задания – инструкции, знакомятся с их содержанием, осмысливают, уточняют в группе или у учителя.
Распределяют роли в группах (теоретики, аналитики, оформители, докладчики).
Планируют работу.
10 мин
2 этап: выполнение заданий
Не участвую, но при необходимости консультирую учащихся.
Оказываю дифференцированную помощь.
Ненавязчиво контролирую работу проектных групп.
Активно работают в группах (каждый в соответствии со своей ролью и сообща).
При необходимости консультируются.
Продумывают форму презентации своего мини-проекта.
8 мин
3 этап: оформление мини-проектов
Выдаю необходимые для оформления опорных схем материалы: листы ватмана, маркеры.
При необходимости даю советы при подготовке презентации.
Осуществляю контроль.
Готовят презентацию: оформляют опорные схемы, обсуждают текст выступления
12 мин
4 этап: презентация мини-проектов
Раздаю листы оценок в группы и экспертам.
Организую выступления проектных групп с презентациями.
Организую работу экспертных групп.
Побуждаю учащихся других групп участвовать в обсуждении вопросов.
Задаю вопросы.
Поправляю или сам даю ответ в случае затруднения учащихся
Даю пояснения.
Осуществляют презентацию своей деятельности.
Отвечают на вопросы.
Слушают выступающих, дополняют, поправляют в случае необходимости.
Задают вопросы докладчикам.
На одну группу –6 мин. Из них:
3 мин – доклад;
3 мин – ответы на вопросы.
5 мин
IV. РЕФЛЕКСИЯ
Обобщаю и резюмирую полученные результаты
Даю оценку деятельности групп
Предлагаю оценить работу групп экспертам и учащимся (в том числе дать оценку работы своей группы)
Собираю оценочные листы
Делаю краткое обобщение по теме.
Отвечаю на вопросы учащихся
Слушают оценку экспертов
Анализируют и оценивают свою работу и работу других групп
Оформляют и сдают оценочные листы
Слушают сообщение учителя и задают в случае необходимости вопросы
Отвечают на вопросы анкеты.
1 мин
V. ДОМАШНЕЕ ЗАДАНИЕ – параграф 40, задания 1-3
ОЦЕНКА РАБОТЫ ПРОЕКТНЫХ ГРУПП
Критерии оценки
№1
№2
Процесс проектирования (активность всех членов группы, творчество, умение работать в команде)
Презентация (достигнутый результат, аргументированность, оформление)
Защита (качество доклада, полнота представления, убедительность, аргументированность, объем и глубина знаний, ответы на вопросы)
ИТОГ:
ЛИТЕРАТУРА.
Горковенко М.Ю. Поурочные разработки по химии 8 класс. М.: ВАКО, 2004 г.
Еженедельное приложение к газете “ Первое сентября” Химия №15 1999 г
Габриелян О.С. Химия 8 класс: учебник для общеобразовательных заведений – 15-е издание. М.; Дрофа, 2009 г.
Химия: Проектная деятельность учащихся/ автор-составитель Н.В. Ширшина. Волгоград: Учитель, 2007 г.
Тесты по химии 8-9 класс: Учебно-методическое пособие/ Л.С. Гузей, Н.И. Останний, А.О. Татур. изд-во, стереотип – М.: Дрофа, 2000 г.
Химия в таблицах 8-11 классы: Справочное пособие/ Автор-составитель А.Е. Насонова – 9-е изд., стереотип – М.: Дрофа, 2007 г.
Приложение №1.
Инструкционная карточка для группы №1
Инструктивная карточка для «теоретиков».
1. На какие группы делят оксиды?
2.Дайте определение понятия «основные оксиды».
3. Какое агрегатное состояние характерно для основных оксидов?
4. Вещества, с какой степенью окисления относятся к основным оксидам?
5. Какие существуют способы получения основных оксидов?
6. Назовите области применения основных оксидов?
Инструкционная карточка для группы №2
Инструктивная карточка для «теоретиков».
1. На какие группы делят оксиды?
2. Дайте определение понятия «кислотные оксиды».
3. Какое агрегатное состояние характерно для кислотных оксидов?
4. Вещества, с какой степенью окисления относятся к кислотным оксидам?
5. Какие существуют способы получения кислотных оксидов?
6. Назовите области применения кислотных оксидов?
Инструкционная карточка для группы №1
Инструктивная карточка для «оформителей».
Оформить опорную схему на ватмане по основным оксидам по следующему плану: определение – название – классификация – получение - химические свойства – применение.
Инструкционная карточка для группы №2
Инструктивная карточка для «оформителей».
Оформить опорную схему на ватмане по кислотным оксидам по следующему плану: определение – название – классификация – получение - химические свойства – применение.
Инструкционная карточка для группы №1
Инструктивные карточки для «практиков».
Взаимодействие основных оксидов с кислотными оксидами, кислотами и водой.
Последовательность действий
Уравнения химических реакций
Соблюдайте правила техники безопасности.
1. Положить немного оксида кальция, пропустить через него углекислый газ
 CaO + CO2
CaO + CO2
(опишите условия протекания реакции, допишите уравнение реакции, назовите полученное вещество, назовите тип реакции).
2. Положить немного оксида кальция, добавить 2 мл. воды.
 H2О + CаО
H2О + CаО
(опишите условия протекания реакции, допишите уравнение реакции, назовите полученное вещество, назовите тип реакции).
3. Положить немного оксида кальция , добавить 1 мл. соляной кислоты.
 HCl + CaO
HCl + CaO
(опишите условия протекания реакции, допишите уравнение реакции, назовите полученное вещество, назовите тип реакции).
Инструкционная карточка для группы №2
Инструктивные карточки для «практиков».
Взаимодействие кислотных оксидов с основными оксидами, щелочами, водой.
Последовательность действий
Уравнения химических реакций
Соблюдайте правила техники безопасности.
Углекислый газ получаем реакцией мрамора с соляной кислотой.
1. Через дистиллированную воду пропустите объемом 2 мл., пропустите углекислый газ. Полученный раствор испытайте лакмусом.
 CO2 + H2O
CO2 + H2O
(опишите условия протекания реакции, допишите уравнение реакции, назовите полученное вещество, назовите тип реакции).
2. Положить немного оксида кальция, пропустить через него углекислый газ
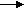 CO2+ CaO
CO2+ CaO
(опишите условия протекания реакции, допишите уравнение реакции, назовите полученное вещество, назовите тип реакции).
3. Через гидроксид кальция (известковая вода), объемом 2 мл., пропустить углекислый газ.
 CO2 + Ca(OH)2
CO2 + Ca(OH)2
(опишите условия протекания реакции, допишите уравнение реакции, назовите полученное вещество, назовите тип реакции).
Приложение №2
Применение оксидов: Всем известно, какое применение имеет (оксид водорода) в природе, в промышленности и в быту. Многие другие оксиды также широко применяются. Например, из руд, состоящих из оксидов железа Fe2 O3,Fe3 O4, получают чугун и сталь. Оксид кальция СаО ( основная составная часть жжёной, или гашеной, извести) используется для получения гашеной извести Са(ОН)2 , которая применяется в строительстве. Нерастворимый в воде оксид кремния (IV) SiO2 используется в производстве строительных материалов. Некоторые из оксидов применяют для производства красок. Так, например, основная составная часть белой краски - цинковые белила, это оксид цинка ZnO ,зелёной краски - Cr2O3 и т. д.”3
Fe2O3 – оксид железа (III) – темно-красного цвета – гематит или красный железняк – для изготовления красок.
Fe3O4 – оксид железа (II, III) – минерал магнетит или магнитный железняк, хороший проводник электричества – для получения и изготовления электродов.
CaO – оксид кальция (II) – порошок белого цвета – «негашеная» известь, используют в строительстве.
Al2O3 – оксид алюминия (III) – минерал твердый корунд – как полирующее средство.
SO2 – оксид серы (IV) или сернистый газ – бесцветный газ, имеющий удушливый запах, убивает микроорганизмы, плесневые грибки – окуривают подвалы, погреба, при перевозке и хранении фруктов и ягод.
CO2 – оксид углерода (IV), углекислый газ. Твердый оксид углерода – сухой лед. Для изготовления соды, сахара, газированных напитков, в жидком виде в огнетушителях.
SiO2 – оксид кремния (IV) – твердое, тугоплавкое вещество в природе в двух видах:
1) кристаллический кремнезем – в виде минерала кварца и его разновидностей: горный хрусталь, халцедон, агат, яшма, кремень – используют в силикатной промышленности, строительстве.
2) аморфный кремнезем SiO2 ∙ nH2O – минерал опал.
Применяют соединения оксида кремния в ювелирном деле, изготовлении химической посуды, кварцевых ламп.
Для создания цветных стекол используют следующие оксиды:
Co2O3 – синий цвет , Cr2O3 – зеленый цвет, MnO2 – розовый цвет.
Данные по применению оксидов, учащиеся находят в Интернете, учебнике.
Приложение №3 Рефлексия.
Мини – анкета для учащихся
Пригодятся ли вам знания, полученные сегодня на уроке в жизни:
Да
Нет
Не знаю
Иное
Понравилось ли вам форма проведения урока:
Да
Нет
Не очень
Не знаю
Узнали вы сегодня что-либо новое:
Да
Нет
Не знаю
Хотелось ли вам проводить уроки по такому типу (проектирование):
Да
Нет
Не знаю
Иное
Директор МБОУ СОШ №3 п.Ванино ___________/Ю.В.Корольчук/
«02»_февраля_2015г.

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ