Конспект урока по Химии "Сера, её физические и химические свойства" 9 класс
Конспект урока химии на тему «Сера, её физические и химические свойства» 9 клас
Цели урока:
1. дать общую характеристику серы, рассмотреть аллотропные модификации серы, её свойства, нахождение в природе и применение серы, используя современные технологии обучения.
2. Привести учащихся к умению создавать проблемные ситуации и видеть пути их решения.
3. Обучать аргументировано защищать свою точку зрения.
4. Развитие коммуникативных способностей.
Оборудование: Различные модификации серы, металлы – Na, Zn,AI,посуда;
компьютер.
План урока
I. Организационный момент. Проверка домашнего задания.
Экспресс-опрос:
Назовите основные физические характеристики кислорода.
Как получают кислород в промышленности и лаборатории?
С чем связана аллотропия кислорода? Сравните свойства двух аллотропных модификаций кислорода.
Что вам известно об озоновом слое земли? Какова его роль для жизни на земле?
Назовите признаки реакций горения. Чем они отличаются от реакций медленного окисления?
Где применяется кислород?
Когда и кем был открыт кислород?
Изучение нового материала.
Немало сера знаменита,
И в древности ее Гомер воспел,
С ней много тысяч лет прожито,
И человек в ней пользу разглядел.
Стадия “Вызова”
В средние века считалось, что это обязательная составная часть всех веществ. Сера-“начало начал” древнейших филисофов, алхимиков, элемент, окруженный мистикой и тайнами. Сегодня я хочу познакомить вас с этим удивительным веществом, имеющим необыкновенные свойства.
Видеоопыт
II. Стадия “Осмысление”
Вам выданы листы с таблицей.
-
Знаю
Хочу знать
Узнал
1) В течение 5-ти минут каждый из вас заполнит 1-ую графу, отвечая на вопросы: см. задание №1.
2) Перескажите друг другу ваши записи.
3) Выделите ключевые понятия по теме «Сера»
4) Какая информация у вас осталась неполной?
5) Заполните графу 2.
6) Маркировка текста
См. опорный конспект.
Идёт работа с текстом и его маркировка.
V - уже известно
+ абсолютно новое, неожиданное;
- противоречит твоим представлениям;
? хочется узнать что-то больше.
На данной стадии идёт соотношение уже известного с тем, “что узнал”. Происходит структурная организация информации в памяти. Можно спросить, у кого были значки, и какие?
III. Стадия “размышления” (рефлексия)
Учащиеся должны попробовать выразить информацию, которую получили своими словами. (Работа с графой №3 - "Что узнал?").
Выяснили, какие новые понятия они увидели в тексте. (Эти пояснения записываем в 3-ю колонку).
Синквейн: составьте синквейн по теме «Сера»
1 слово
Существительное
2 слова
Прилагательное Прилагательное
3 слова
Глагол Глагол Глагол
4 слова
Слова, выражающие основную мысль
1 слово
Метафора или синоним
Заполните лист самооценки:
Заполняется лист самооценки.
1. Я активно участвовал (а) на уроке
2. Мои ответы были аргументированы
3. Мне было интересно
4. Был невнимателен
5.Отвлекался
6.Самооценка
7.Оценка учителя
Лист самооценки ученика (цы)
Критерии самооценки (Поставьте знаки "+" -да, "- " - нет)
Раздел изучаемой темы. При изучении испытываю затруднения
1. Характеристика серы
2.Физические свойства серы
3. Химические свойства
4.Нахождение серы в природе
5. Получение серы
6.Применение серы
Таблица
-
Знаю
Хочу знать
Узнал
Задание № 1
Строение и свойства атомов.
Сера – простое вещество
Химические свойства серы.
Сера в природе
Применение серы
Опорный конспект
Положение в ПС Д.И. Менделеева
S –Сера
III –период, VI(А)группа
Порядковый номер – 16
Заряд ядра атома – 32
Протонов -16, нейтронов -16, электронов – 16
Число энергетических уровней -3
1-ый уровень – 2электрона
2-ой уровень – 8 электронов
3-ий уровень – 6 электронов: из которых 2 электрона неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют более выраженные восстановительные свойства, образуя соединения со степенями окисления +2, +4, +6. По отношению к менее электроотрицательным элементам (водород, металлы) сера проявляет окислительные свойства и приобретает степень окисления -2.
Атомы серы, как и атомы кислорода и всех остальных элементов главной подгруппы VI группы Периодической системы Д. И. Менделеева, содержат на внешнем энергетическом уровне 6 электронов, из которых 2 электрона неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют более выраженные восстановительные свойства, образуя соединения со степенями окисления +2, +4, +6. По отношению к менее электроотрицательным элементам (водород, металлы) сера проявляет окислительные свойства и приобретает степень окисления -2.
Сера – простое вещество
для серы, как и для кислорода, характерна аллотропия. Известно много модификаций серы с циклическим или линейным строением молекул различного состава.
Наиболее устойчива модификация - ромбическая сера, состоит из молекул S8 .Ее кристаллы имеют вид октаэдров со срезанными углами. Они окрашены в лимонно-желтый цвет и полупрозрачны, температура плавления 112,8 °С.
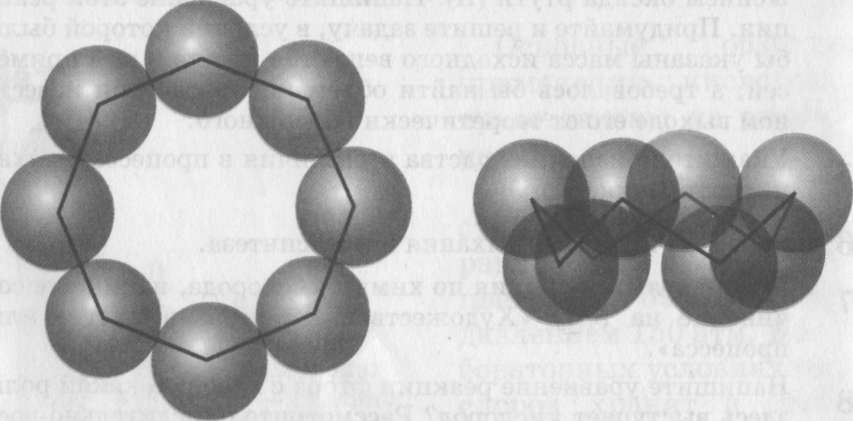
В эту модификацию при комнатной температуре превращаются все другие модификации. Известно, например, что при кристаллизации из расплава сначала получается моноклинная сера (игольчатые кристаллы, температура плавления 119,3 °С), которая затем переходит в ромбическую.
При нагревании кусочков серы в пробирке она плавится, превращаясь в жидкость желтого цвета. При температуре около 160 °С жидкая сера начинает темнеть и становится настолько густой и вязкой, что даже не выливается из пробирки, однако при дальнейшем нагревании превращается в легкоподвижную жидкость, но сохраняет прежний темно-коричневый цвет. Если ее вылить в холодную воду, она застывает в виде прозрачной резинообразной массы. Это пластическая сера. Ее можно получить и в виде нитей. Однако через несколько дней она также превращается в ромбическую серу.

Ребята, сера не растворяется в воде, она тяжелее воды, плотность ромбической серы равна 2,07г/мл, плотность моноклинической серы – 1,96г/мл, поэтому кристаллы серы в воде тонут, а вот порошок плавает на поверхности воды, так как мелкие кристаллики серы водой не смачиваются и поддерживаются на плаву мелкими пузырьками воздуха. Это процесс флотации. Сера малорастворима в этиловом спирте и диэтиловом эфире, хорошо растворяется в сероуглероде.
Химические свойства серы.
А)Взаимодействие серы с металлами
при обычных условиях сера реагирует со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром:
Hq 0+S0=Hq+2S-2
эта реакция лежит в основе удаления и обезвреживания разлитой ртути, например из разбитого термометра. Видимые капли ртути можно собрать на лист бумаги или на медную пластинку. Ту ртуть, которая попала в щели нужно засыпать порошком серы. Такой процесс называют демеркуризацией.
При нагревании сера реагирует и с другими металлами (Zn, Al, Fe), и только золото не взаимодействует с ней ни при каких условиях.
Демонстрация опытов: взаимодействие серы с AI, Na,Zn.
составьте уравнения этих реакций и электронный баланс.
Вопрос к классу: Как называются вещества, полученные в результате этих реакций и к какому классу они относятся?
Б) Взаимодействие серы с неметаллами.
Из неметаллов с серой не реагируют только азот, иод и благородные газы.
1) Сера – окислитель :
1) H2 +S =H2S (сероводород)
S0+2ē =S2- │окислитель
H2 - 2ē =2H+ │восстановитель
2) Сера – восстановитель (слайд №9)
Cера горит синеватым пламенем, образуя оксид серы (IV), сернистый газ
S +O2 = SO2
Сера в природе
Сера входит в состав:
Белков
Витаминов
Гормонов
Участвует в ОВ процессах организма
Недостаток серы приводит к хрупкости и ломкости костей
Серой богаты бобовые растения, яйца, овсяные хлопья.
Применение серы.
Сера – основное сырьё для производства серной кислоты
Для приготовления красок
Для беления тканей
Для дезинфекции
Используют в производстве спичек и бумаги, резины, красок, взрывчатых веществ, лекарств, пластмассы, косметических препаратов
В сельском хозяйстве для борьбы с вредителями растений
Для изготовления пороха.
16
Сера
16S
Внешний вид простого вещества

Светло-жёлтое хрупкое твёрдое вещество, в чистом виде без запаха
Свойства атома
Сера / Sulfur (S), 16
[Ne] 3s2 3p4
127 пм
Химические свойства
102 пм
30 (+6e) 184 (-2e) пм
2,58 (шкала Полинга)
0
+6, +4, +2, 0, -1, −2
Энергия ионизации
(первый электрон)
Термодинамические свойства простого вещества
2,070 г/см³
386 K
717,824 K
1,23 кДж/моль
10,5 кДж/моль
22,61[1] Дж/(K·моль)
Кристаллическая решётка простого вещества
орторомбическая
a=10,437 b=12,845 c=24,369 Å
Прочие характеристики
(300 K) 0,27 Вт/(м·К)
-

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ