Урок по теме: "Электролитическая диссоциация кислот, щелочей и солей"
Дата ____________ Класс _____________
Тема: Электролитическая диссоциация кислот, щелочей и солей
Цели урока: рассмотреть свойства кислот, щелочей и солей в свете теории электролитической диссоциации.
Ход урока
1. Организационный момент урока.
Решение задания. Разложить вещество на катионы и анионы.
Вещество
Катион
Анион
NaOH
Na+
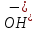
Mg(OH)2
Mg2+
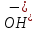
CaSO4
Ca2+
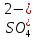
LiH
Li+
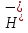
Na2O
Na+
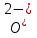
2. Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H +).
Например,
HCl -> H + + Cl -
HNO 3 -> H + + NO 3 -
Многоосновные кислоты диссоциируют ступенчато :
Н3РО4 ↔ Н+ + Н2РО-4 (первая ступень) – дигидроортофосфат ион
Н2РО-4 ↔ Н+ + НРO2-4 (вторая ступень) – гидроортофосфат ион
НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей.
Основания
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH -).
Диссоциация щелочей
Диссоциация амфотерных оснований (амфолитов)
Вспомните!
Щёлочи – это основания, растворимые в воде.
Это основания щелочных и щелочноземельных металлов:
LiOH, NaОН, КОН, Rb ОН, С s ОН, Fr ОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, R а(ОН)2, а также N Н4ОН
Амфолиты - это электролиты, которые при диссоциации одновре менно образуют катионы водорода (H +) и гидроксид-ионы ( OH -).
Примеры уравнений диссоциации щелочей
KOH -> K + + OH -;
NH 4OH ↔ NH +4 + OH -
Многокислотные основания диссоциируют ступенчато:
Ba(ОН)2 -> Bа(ОН)+ + OH- (первая ступень)
Ba(OH)+ ↔ Ba2++OH- (вторая ступень)
Примеры уравнений диссоциации амфолитов
Н2O ↔ Н+ + ОН-
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выра зить уравнением:
2ОН- + Zn2+ + 2Н2О ↔ Zn (ОН)2 + 2Н2О ↔ [Zn(ОН)4]2-+ 2Н+
Соли
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH+4) и анионы кислотных остатков.
Например, диссоциация средних солей :
(NH4)2SO4 -> 2NH+4+ SO2-4;
Na3PO 4 -> 3 Na + + PO 3- 4
Кислые же и основные соли диссоци ируют ступенчато:
Например,
Диссоциация кислых солей
Диссоциация основных солей
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
KHSO4 -> K + + HSO -4
HSO -4 ↔ H + + SO 2-4
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
Mg( OH )Cl -> Mg( OH )++ Cl -
Mg ( OH )+↔ Mg2+ + OH-
3. Закрепление изученного материала.
Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
Ca(OH)2
Na2CO3
Na3PO4
HNO3
KOH
Ba(OH)2
H2SO3
Ca(NO3)2
Ca3(PO4)2
H2S
NaOH
HBr
П. 2, упр.6-8, задача 2 на стр.13
№1. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
HF, Mg(OH)2, CaCl2, Zn(NO3)2,Ba(OH)2, K2SO4, H2SiO3, FeI3, NiCl2, H3PO4

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ