Синтез и свойства полилевоглюкозана и некоторых его производных
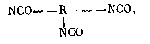 Синтез и свойства полилевоглюкозана и некоторых его производных
Синтез и свойства полилевоглюкозана и некоторых его производных
Ограниченность запасов ископаемых органических ресурсов заставляет обратить особое внимание на использование растительного сырья, представляющего собой уникальный, постоянно возобновляемый, природный комплекс органических соединений. Создание новых способов переработки всей биомассы растительного сырья и изыскание рациональных путей максимального использования отдельных компонентов в соответствии с их потенциальной ценностью как органических соединений требуют углубленных исследований механизмов превращений компонентов растительного сырья при различных типах деструктивных воздействий. В этой связи исследование возможностей использования мономеров, получаемых при переработке растительного сырья для производства полимерных и других соединений, является важной народнохозяйственной задачей.
Из существующих промышленных методов переработки целлюлозосодержащих материалов только методы кислотного гидролиза ведут к получению продуктов, сохраняющих состав элементарного звена полисахарида (целлюлозы); существующие гидролитические методы разложения растительного сырья, в том числе и целлюлозы, сопровождаются в основном распадом элементарных звеньев.
Еще в 1918 г. Пикте и Саразин [1] при термообработке хлопковой целлюлозы в интервале температур 350-400° при пониженном давлении получили левоглюкозан (1,6-ангидроглюкопиранозу) с выходом до 30%. Однако в течение длительного времени эти данные не удавалось воспроизвести. Отдельные сообщения различных авторов указывали на более низкие выходы левоглюкозана. В 50-х годах нами были начаты исследования, направленные на изучение закономерностей термического распада целлюлозы и выявление причин, вызывающих изменения процесса деполимеризации и выхода левоглюкозана. Ставилась задача по разработке термической деполимеризации целлюлозы с высоким выходом левоглюкозана, который мог бы послужить исходным органическим соединением для синтеза олигомерных, полимерных и других его производных.
Результаты исследований механизма разрыва гликозидной связи при термической обработке целлюлозы и образования левоглюкозана подробно рассмотрены нами в обзоре [2].
Термический распад целлюлозы до левоглюкозана включает разрыв С-О-С-связи 1,4 и образование новой ангидросвязи 1,6 с сохранением состава элементарного звена целлюлозы. В ходе этого процесса, происходящего при 300-400°, целлюлоза сохраняет свои гидроксильные группы. Кроме того, при термическом распаде образуется новая конформация глюкопиранозного звена - переход от С-1 к 1-С, а также переход всех гидроксильных групп из экваториальных положений в оксиальные.
Исследования закономерностей термического распада целлюлозы показали, что ее деструкция происходит в две стадии. Первая стадия характеризуется резким уменьшением степени полимеризации п и низким выходом левоглюкозана. Для второй стадии характерны высокий выход левоглюкозана и постоянная величина степени полимеризации. На первой) стадии термораспада целлюлозы происходит разрыв цепных молекул с накоплением фрагментов с га=200-300 для хлопковой целлюлозы и 30 - 50 - для гидратцеллюлозы. На второй стадии после достижения постоянного значения п выход левоглюкозана достигает максимальной величины [3-9]. Следовательно, легкогидролизуемые полисахариды не позволяют получить высокий выход левоглюкозана. Для удаления этих полисахаридов следует проводить гидролиз 1% -ной серной кислотой до достижения предельных значений п. Термораспаду подвергаются в основном кристаллические области целлюлозы с предельным значением п.
Присутствие неорганических компонентов изменяет направление деполимеризации целлюлозы. Зависимость выходов левоглюкозана от содержания неорганических компонентов исследована в работах [8, 10]. Эти данные показывают, что термический распад целлюлозы с преимущественным образованием левоглюкозана становится возможным для обеих ее структурных модификаций и протекает наиболее полно при содержании золы менее 0,002%. Немаловажное значение имеет также быстрый вывод левоглюкозана на сферы реакции. Осуществление этой реакции в вакууме позволило провести термическую деполимеризацию целлюлозы с выходом левоглюкозана 73% [8].
Необходимость использования высокого вакуума делала указанный метод технически малодоступным. Поэтому позднее была исследована возможность осуществления направленного термораспада целлюлозы в токе перегретого водяного пара или инертного газа [11] при пониженном давлении.
Проведенные исследования [12-14] позволили разработать основы новой технологии комплексной переработки растительного сырья, согласно которой гидролитические процессы используются только для превращения легкогидролизуемых полисахаридов в монозы или фурфурол. Труд-ногидролизуемые полисахариды и лигнин превращаются в ряд ценных продуктов в результате термораспада в одном технологическом цикле. При таком комплексном методе переработки суммарный выход продуктов достигает 78% вместо 30-40 в современной гидролизной промышленности.
Для реализации разработанного технологического процесса комплексной переработки растительного сырья с применением гидролитических и термических процессов на Краснодарском химическом комбинате были созданы и освоены камеральная и полузаводская установки, на которых получено более 2 т левоглюкозана.
Возможность получения промышленных количеств левоглюкозана позволила начать исследования по синтезу полилевоглюкозана, его эфиров и других производных. Следует отметить, что синтез высокомолекулярных полисахаридов из моноз химическими методами является одним из перспективных направлений современной химии полимеров. Особый интерес в данном случае представляет то, что исходный мономер получают при переработке растительной биомассы.
Полимеризация левоглюкозана и его эфиров. Левоглюкозан (1,6-ан-гидроглюкопираноза) может представлять интерес для синтеза полимеров различного строения благодаря наличию в нем способного к размыканию семичленного цикла и трех вторичных гидроксилов. Установлена повышенная реакционноспособность гидроксильных групп при втором и четвертом атомах углерода.
К началу нашего исследования (1959 г) были опубликованы отдельные работы (Пикте, Ирвин, Принсгейм) по термической полимеризации левоглюкозана, приводящей к получению низкомолекулярных разветвленных продуктов, но не имелось сведений о возможности полимеризации эфиров левоглюкозана. Более того, в ранних работах Шуерх [15] отрицалась возможность проведения такого синтеза. В этой связи интересно обратить внимание на попытку Шорыгина и Макаровой-Землянской [16] синтезировать полиэфир из триметиллевоглюкозана при действии на него металлического натрия в жидком аммиаке. Авторы полагали, что при этом воздействии произойдет разрыв простых эфирных связей и раскрытие ангидроцикла, что приведет к образованию полимера. Однако в результате реакции был получен фенол. Эти исследования представляют интерес, так как впервые показали возможность превращения углеводов в ароматические соединения.
Первоначальным толчком к попытке осуществить полимеризацию левоглюкозана путем раскрытия ангидроцикла послужила информация о том, что биохимический декстран по своему строению представляет полимер, состоящий из ангидроглюкозных единиц, связанных между собой 1,6-ангидросвязью.
С целью получения синтетического декстрана на первом этапе исследования нами была изучена полимеризация левоглюкозана в присутствии ряда катализаторов. Полученные полимеры хорошо растворимы в воде, пиридине и ДМФ; водные растворы полимеров имели, однако, весьма низкую приведенную вязкость.
Наиболее эффективными катализаторами оказались хлорное железо, хлористый алюминий, бензолсульфокислота и эфират трехфтористого бора. Была исследована полимеризация в присутствии различных количеств эфирата трехфтористого бора. Лучшие выходы полимеров получены в присутствии 2-5 мол.% катализатора. Молекулярные массы полилевоглюкозанов, определенные светорассеянием в ДМФ, составили (37,5-67,0) - 103.
Рентгеноструктурный анализ полилевоглюкозана подтвердил его аморфную структуру, что хорошо согласуется с представлениями о разветвленности этих полимеров.
Позднее Абкин с сотр. провели полимеризацию левоглюкозана радиационным методом в твердой фазе. Было исследовано влияние на полимеризацию левоглюкозана γ-облучения, его продолжительности и других факторов. Во всех случаях получали разветвленный полимер с низкой приведенной вязкостью (0,04 дл/г).
Чтобы избежать реакций передачи цепи, приводящих к образованию разветвленных полисахаридов, нами была проведена защита гидроксильных групп левоглюкозана ацетильными, метильными и этильными группами. При полимеризации триацетата левоглюкозана в толуоле при температуре от 0 до 50° в присутствии эфирата трехфтористого бора, хлористого алюминия и хлорного железа полимер не образуется.
Иные результаты получены при полимеризации простых эфиров левоглюкозана. Так, при полимеризации триметиллевоглюкозана в абсолютном толуоле при 20-50° в течение 20-24 ч в присутствии эфирата трехфтористого бора наблюдалось образование полимера. Выход полимера и его ММ были наибольшими при использовании 6 мол.% BF3. Анализ ИК-спектра исходного триметиллевоглюкозана и его полимера показал отсутствие в макромолекулах гидроксильных групп.
Полученные полимеры хорошо растворимы в хлороформе и крезоле и нерастворимы в воде, спирте, ацетоне и эфире. Растворы полимеров в хлороформе имели довольно высокую приведенную вязкость (0,12 - 0,28 дл/г); молекулярные массы, определенные светорассеянием в хлороформе, составляли (280-394) 10*.
Данные рентгеноструктурного анализа свидетельствуют о том, что полимеры триметиллевоглюкозана - кристаллические вещества (в отличие от самого полилевоглюкозана).
Политриметиллевоглюкозан обладает более высокой термостойкостью по сравнению с полилевоглюкозаном. Он разлагается только при 270°.
В результате этого исследования впервые получен линейный высокомолекулярный полисахарид, предложен механизм катионной полимеризации триметиллевоглюкозана и сделаны выводы относительно механизма полимеризации левоглюкозана [17].
В последние годы исследования полимеризации триметиллевоглюкозана ведутся Пономаренко с сотр., которые всесторонне изучают механизм катионной полимеризации простых эфиров левоглюкозана, базируясь преимущественно на кинетических и термодинамических данных полимеризации одного из простейших представителей этого класса гетероциклических мономеров - 2, 3, 4-три-О-метиллевоглюкозана (ТМЛГ). Процесс инициировали солями оксония и тритилия с комплексными про-тивоионами SbCle_, SbF6_, PF6_, BFt~, СОг, а также (GF3SО2) 2О. Основные кинетические, активационные и термодинамические параметры получены при исследовании полимеризации ТМЛГ под действием оксониевой соли Etj+О~SbGl6 при 20° в хлористом метилене. Для полимеризации этого мономера характерно наличие индукционного периода, после завершения которого процесс протекает стационарно вплоть до глубоких степеней превращения [18]. При исследовании инициирования ТМЛГ триалкилоксониевой солью найдено, что первичное взаимодействие мономера с инициатором осуществляется путем реакции оксониевого иона с метоксильными группами мономера; ряд последовательных реакций переоксонирования предшествует образованию активного центра полимеризации, определяя продолжительность индукционного периода [19]. Методом [20], основанным на измерении кинетического изотопного эффекта полимеризации ТМЛГ, показана оксониевая природа активного центра, а также наличие специфической сольватации последнего молекулами мономера, что обеспечивает высокую стереоспецифичность полимеризации, ведущей к получению а- (1-"-6) - связанных метилированных полисахаридов. Высокая стереорегулярность полисахаридов, полученных в присутствии противоионов PF6~, SbF6~, BF4~, доказана методом ЯМР 13С и измерением углов оптического вращения растворами синтезированных полимеров. Наблюдаемые в ряде исследованных случаев нарушения в стереорегулярном строении обусловлены, по мнению авторов, реакцией между противоионом и активным центром, конкурирующей с актом роста цепи [21].
Найденные закономерности полимеризации ТМЛГ, несомненно, существенно облегчают выбор условий синтеза полиглюканов регулярного строения.
Исследования по полимеризации эфиров левоглюкозана, а позднее по сополимеризации левоглюкозана и его эфиров были продолжены в Институте химии древесины АН ЛатвССР Перникис.
Полимеризация триметиллевоглюкозана и триацетиллевоглюкозана. Были найдены оптимальные условия полимеризации триметиллевоглюкозана: осуществление процесса в растворе хлористого метилена при концентрации мономера 75% в присутствии в качестве катализатора эфирата фтористого бора (5 мол.%) при - 20° в течение 48 ч. В этих условиях образуется стереорегулярный линейный полимер триметиллевоглюкозана с наибольшим выходом (75-85%) и высокой приведенной вязкостью (1,25-1,40 дл/г).
Полученный полимер представляет собой белый порошок с т. пл.265-270° (из термомеханических кривых), плотностью 1,246 г/см. Полимер растворим в хлороформе, о-, п - и w-крезоле, в смеси фенол: тетрабромэтан =1: 3 (при нагревании), а также в некоторых эфирах ненасыщенных кислот.
Константа Хаггинса для раствора гомополимера в хлороформе равна 0,326, что характерно для линейных полимеров.
ММ полимеров, определенные методом светорассеяния в растворе в хлороформе, составляли (394-500) 103.
Рентгеноструктурный анализ показал, что политриметиллевоглюкозан является кристаллическим полимером; по данным ИК-спектроскопии, полимер не содержит гидроксильных групп.
Политриметиллевоглюкозан имеет удельное вращение 190-220°, обусловленное наличием 1-6-ά-глюкозидной связи. Доказательство этого служит также тот факт, что единственным продуктом гидролиза полимера является 1,6-а-глюкоза.
В отличие от триметилцеллюлозы политриметиллевоглюкозад нерастворим в воде, спирте, ацетоне, дихлорэтане и в других органических растворителях, а хорошо растворим только в хлороформе, что можно объяснить особенностями его строения. По-видимому, политриметиллевоглюкозан имеет более плотную упаковку кристаллических цепей, чем триметилцеллюлоза, что приводит к увеличению сил межцепного взаимодействия и, следовательно, к уменьшению его растворимости [22-24].
В отличие от простых эфиров левоглюкозана триацетиллевоглюкозан был заполимеризован с использованием в качестве катализатора пятихлористой сурьмы. Показано, что оптимальными условиями полимеризации являются концентрация мономера 3-3,5 моль/л, количество катализатора 2-4 мол.%, температура 010°. Политриацетиллевоглюкозан представляет собой белый порошок, растворимый в хлороформе и дихлорэтане (М= (4,5-5,0) • 10\ [a] 20D=160-180° (1% в хлороформе)).
С целью получения линейного, неразветвленного полилевоглюкозана было проведено дезацетилирование политриацетиллевоглюкозана метилатом натрия. В результате омыления ацетильных групп получен водорастворимый полилевоглюкозан с М=4,8-103 и [a] 20D=160 (2% в воде). Методами турбидиметрического титрования и ГПХ определено его узкое ММР. Периодатное окисление, гидролиз полимера и хроматографический анализ образующихся продуктов показали, что элементарные звенья полилевоглюкозана на 90% связаны ацетильной 1,6-связью [25].
Валуевой [26-30] был осуществлен синтез на основе лювоглюкозана мононенасыщенного эфира, содержащего метакриловую группу у третьего гидроксила. В ходе синтеза метакрилового эфира использовалась предварительная селективная защита второго и четвертого гидроксилов левоглюкозана: бензиловая, тозиловая и фенилборонатная защиты. Наибольший интерес из этих защит представляет фенилборонатная. Впервые показана возможность образования 2,4-фенилборонатного цикла в молекуле левоглюкозана.
Монометакриловые эфиры левоглюкозана активны в реакциях радикальной полимеризации и сополимеризации с другими виниловыми мономерами. Получены сополимеры монометакрилового эфира левоглюкозана с некоторыми мономерными электролитами, например со стиролсульфоатом натрия. Продукты сополимеризации представляют собой линейные полимеры, содержащие в боковой цепи углеводные фрагменты и ионогенные группы. Эти сополимеры интересны прежде всего как модели природных полисахаридов, таких как сульфированные хондроитины, муко-полисахариды соединительной ткани, гепарины и т.д., имеющих в своем составе ионогенные группы. С другой стороны, синтез таких полимеров может иметь прикладное значение как способ получения новых биосовместимых медицинских материалов - заменителей плазмы крови, антикоагулянтов и т.д.
Исследование сополимеризации левоглюкозана и его эфиров. Сополимеры ангидридов Сахаров с соединениями других классов в литературе не описаны. Левоглюкозан близок по структуре к циклическим ацеталям, в частности к диоксолану, что позволило осуществить сополимеризацию с кислородсодержащими циклическими соединениями. Исследование сополимеризации кислородсодержащих циклических соединений проведено в направлении подбора условий полимеризации и каталитических систем, а также определения относительной реакционной способности мономеров.
Осуществлена сополимеризации ТМЛГ и триацетиллевоглюкозана (ТАЛГ) с эпихлоргидрином (ЭХГ) [31], 3,3-бис- (хлорметил) оксациклобутаном (ОЦБ) [32, 33], тетрагидрофураном (ТГФ) [34, 35] и стиролом [36, 37]. Установлен следующий ряд относительной активности в ряду циклических эфиров: ТГФ>ОЦБ>ЭХГ>ТМЛГ.
Сополимеризации ТМЛГ с ЭХГ проведена в органических растворителях с применением ВР3-О (С2Н5) 2, SbCl5 и SnCl4 в качестве катализаторов. С увеличением доли ТМЛГ в мономерной смеси выход сополимеров уменьшается и наблюдается образование гомополимера ТМЛГ. Кинетические кривые расходования мономеров показывают, что ЭХГ полностью вступает в реакцию как при эквимольном соотношении мономеров, так и при избытке ТМЛГ. Константы сополимеризации, рассчитанные для широкого соотношения исходных мономеров и небольших степеней превращений, свидетельствуют о большей активности эпихлоргидрина в данной системе.
В зависимости от соотношения исходных мономеров получены полиэфиры с содержанием гидроксильных групп от 4 до 16%, хлора - от 13 до 26%. В реальных условиях при взаимодействии левоглюкозана с эпихлоргидрином в диоксане возможно протекание параллельных реакций, в частности сополимеризация диоксана с эпихлоргидрином и левоглюкозана с диоксаном; не исключена возможность тройной сополимеризации [38-41].
При сополимеризации ТМЛГ с ОЦБ образование сополимеров происходит с выходом 70-80%. Исследован процесс в зависимости от концентрации катализатора, температуры, продолжительности полимеризации я состава исходной смеси мономеров. При сополимеризации ТМЛГ с ОЦБ наблюдается образование двух фракций сополимеров, отличающихся по составу и растворимости.
Сополимеризация ТМЛГ с ТГФ осуществлена в растворе хлористого метилена при - 20 - +30°. Кинетические кривые расходования мономеров в процессе сополимеризации показывают, что при любых соотношениях мономеров не происходит их полного исчерпывания. Экспериментальные кривые изменения состава сополимера ТМЛГ и ТГФ свидетельствуют об обогащении сополимера звеньями ТГФ при всех соотношениях исходных мономеров. Образование сополимеров ТМЛГ с кислородсодержащими циклическими соединениями было доказано путем их фракционирования с последующим анализом фракций.
Осуществлена сополимеризация ТМЛГ со стиролом в среде органического растворителя с применением эфирата трехфтористого бора в качестве катализатора [36, 37].
Исходя из схемы полимеризации [36], трудно предположить регулярное чередование в сополимерах звеньев ТМЛГ и стирола в связи с различной активностью оксониевого и карбониевого ионов. В ходе сополимеризации не исключено также, что образуются блок-сополимеры. Возможность перехода во время реакции иона оксония в карбониевый была показана инициированием полимеризации стирола и метилметакрилата "живым" полимером ТМЛГ, полученным в присутствии эфирата трехфтористого бора.
Наличие в молекуле левоглюкозана трех вторичных гидроксильных групп позволяет синтезировать простые и сложные олиго - и полиэфиры левоглюкозана, полиуретаны, эпоксиды и другие реакционные олигомеры.
Простые олигоэфиры левоглюкозана и окиси пропилена получены в присутствии основных и кислотных катализаторов. Характеристика этих олигоэфиров приведена в работах [42-45]. В присутствии основных катализаторов присоединение окиси пропилена происходит по гидроксильным группам, не затрагивая 1,6-ангидроцикла, о чем свидетельствуют отрицательные значения угла удельного вращения олигоэфиров. Олигоэфиры, полученные в условиях основного катализа, содержат главным образом вторичные гидроксильные группы. Количество первичных гидроксильных групп в зависимости от исходного соотношения мономеров колеблется в пределах 5-13% от их общего содержания.
Реакция оксипропилирования с кислотными катализаторами проходит не только по гидроксильным группам, но и вызывает раскрытие 1,6-ангидроцикла, сопровождающееся нарастанием вязкости образующихся продуктов и усложнением их состава.
Олигоэфиры левоглюкозана имеют узкое ММР, причем менее однородные продукты получены при увеличении мольной доли окиси пропилена в олигоэфире [44].
При дегалогенировании хлоргидринов левоглюкозана едким натром получаются глицидиловые эфиры, отверждение которых приводит к образованию покрытий с повышенными прочностными свойствами [46, 47]. По лучены и исследованы хлор - и фосфорсодержащие олигоэфиры левоглюкозана [48], сложные олигоэфиры и другие олигомеры [49].
Простые и сложные полиэфиры левоглюкозана использованы для синтеза полиуретанов различного строения. Исследована кинетика взаимодействия левоглюкозана с фенилизоцианатом. При взаимодействии левоглюкозана или его олигоэфиров с диизоцианатами в растворе абсолютного-диоксана или этилацетата при мольном соотношении гидроксильных и изоцианатных групп 2: 1 образуются аддукты строения:
которые могут служить "сшивающей" составляющей при реакции, с простыми и сложными полиэфирами [50, 51]. Получены и охарактеризованы пленки и покрытия на основе левоглюкозана и его эфиров и диизоцианатов [52-54]. Синтезированы пенополиуретаны на основе простых и сложных полиэфиров левоглюкозана, установлено влияние количества гидроксильных групп, степени раскрытия 1,6-ангидроцикла на их свойства [55-59]. Показано, что высокая теплостойкость и жесткость пенополиуретанов на основе левоглюкозана в значительной степени обусловлена его бициклическим строением.
Значительный интерес представляет синтез новых непредельных производных левоглюкозана для трехмерной полимеризации. Непредельные эфиры моносахаридов являются активными мономерами, легко полимеризующимися в присутствии ионных или радикальных инициаторов. Синтез непредельных эфиров левоглюкозана осуществлен в 5 н. растворе NaOH с использованием в качестве ацилирующего агента хлорангидридов акриловой и метакриловой кислот. Свойства синтезированных мономеров охарактеризованы в работах [60-63].
Повышенная функциональность олигомеров левоглюкозана и соответственно высокая степень сшивания приводят к увеличению прочности, твердости и теплостойкости полимеров.
Синтез производных левоглюкозана и возможные пути их использования. Разработаны методы синтеза 2,3 - и 4-дезоксипроизводных левоглюкозана [64]. Особый интерес представляет соединение, которое может быть получено из левоглюкозана, а именно стронциевая соль окси-D-э-тиленгликолевой кислоты [65].
В последние годы начаты исследования по синтезу ряда антибиотиков на основе левоглюкозана. В лаборатории химии углеводов Института органической химии АН СССР в последнее время начали развиваться работы по использованию моносахаров для синтеза 14-членных макролидных антибиотиков. В качестве исходного соединения был выбран левоглюкозан, бициклическая структура которого обеспечивает высокую регио- и стереоселективность необходимых превращений [66-70].
Так был синтезирован феррилевоглюкозанат цинка, который является эффективным препаратом в борьбе с болезнями культурных растений - розеточностью и хлорозом [71, 72]. Это же соединение является стимулятором роста кормовых дрожжей [73].
Интересные результаты были получены при применении левоглюкозана вместо толуолсульфамида при производстве флуоресцентных пигментов для печатных художественных и рекламных красок [74, 75].
Проведены также лабораторные и заводские испытания, показавшие возможность использования технического левоглюкозана в литейной промышленности для получения стержневых смесей [76].
Здесь следует отметить то, что исследования закономерностей термического распада целлюлозы, а также факторов, определяющих оптимальное направление процессов образования левоглюкозана, были проведены в нашей стране впервые. Их результаты публиковались уже с 1957 г.; за рубежом первое сообщение о достижении высокого выхода левоглюкозана появилось лишь в 1964 г. [77].
Исследования зарубежных авторов по синтезу других производных левоглюкозана обобщены в обзоре [78].
По вопросу полимеризации левоглюкозана и его эфиров следует отметить, что Шуерх сомневался в возможности получения синтетического аолисахарида на основе левоглюкозана [15]. После ознакомления с нашими исследованиями Шуерх повторил наши опыты по синтезу линейного полисахарида - полиметиллевоглюкозана и получил аналогичные данные [79]. Шуерх сообщил о работе, в которой он синтезировал различные эфиры левоглюкозана. С использованием больших количеств катализатора им был получен полимер бензильного производного левоглюкозана, дебензилирование которого привело к линейному полимеру левоглюкозана [80]. С целью получения аналогов биохимического декстрана Шуерх с сотр. синтезировали разветвленные стереорегулярные 1,6глюкоаиронаны со случайным распределением по длине основной цепи 3-0-L-D-глюкопиранозильными боковыми ответвлениями [81]. Однако полученный полимер пока еще не моделирует биохимический декстран; это важная проблема ждет дальнейших исследований.
Рассмотренные выше результаты работ по полимеризации и сополиме-ризации левоглюкозана и его эфиров, а также по получению других производных левоглюкозана свидетельствуют о том, что левоглюкозан является ценным органическим продуктом и может быть использован в качестве исходного мономера для получения разнообразных высокомолекулярных соединений.
Литература
1.Picler Л., Sarasin J. Helv. chim. acta, 1918, В.1, S.87.
2.Голова О.П. Успехи химии, 1975, т.44, № 8, с.1454.
3.Голова О.П., Крылова Р.Г. Докл. АН СССР, 1957, т.116, № 3, с.419.
4.Голова О.П., Пахомов А.М., Андриевская Е.А., Крылова Р.Г. Докл. АН СССР,
5.1957, т.115, № 6, с.1122.
6.Голова О.П., Пахомов А.М., Андриевская Е.А. Докл. АН СССР, 1957, т.112, № 3, с.340.
7.Голова О.П., Крылова Р.Г., Николаева И.И. Высокомолек. соед., 1959, т.1, № 4, с.1295.
8.Голова О.П., Крылова Р.Г., Николаева И.И. Высокомолек. соед., 1959, т.1, № 9, с.1305.
9.Голова О.П., Крылова Р.Г. Докл. АН СССР, 1960, т.135, № 6, с. 1960.
10.Крылова Р.Г. Дис. на соискание уч. ст. канд. хим. наук, М.: ИОХ АН СССР, 1962.162 с.
11.Голова О.П., Эпштейн Я.В., Дурнишъ Л.И. Высокомолек. соед., 1961, т.3, № 4, с.536.
12.Эпштейн Я.В., Голова О.П., Дурнишъ Л.И. Изв. АН СССР. Отд. хим. н., 1959, с.1126.
13.Голова О.П., Сергеева В.И., Калниньш А.И., Максименко Н. С, Панасюк В.Г., Одинцов П.И., Эпштейн Я.В.А. с.115665 (СССР). - Опубл. в Б.И., 1958, № 10.
14.Голова О.П., Эпштейн Я.В., Сергеева В.Н., Калниньш А.И., Одинцов П.Н., Максименко Н.С. Гидролизн. и лесохим. пром-сть, 1961, № 7, с.4.
15.Голова О.П., Эпштейн Я.В., Максименко Н. С, Минакова В.И., Калниньш А.И., Сергеева В.Н., Прохоров А.В., Аисуп И.А. А. с.167856 (СССР). - Опубл. в Б.И., 1965, № 2.
16.Main А.М., Quin, Schuerch С. J.organ. Chem., 1962, v.27, № 5, p.1825.
17.Шорыгин П.П., Макарова-Землянская Н.Н. Докл. АН СССР, 1939, т.23, с.908.
18.Коршак В.В., Голова О.П., Сергеев В.А., Мерлис Н.М., Шнеер Р.Я. Высокомолек. соед., 1961, т.3, № 3, с.477.
19.Пономаренко В.А., Сахаров А.М., Берман Е.Л., Лысенко 3.И. Перспективы использования древесины в качестве органического сырья, Рига: Зинатне, 1982, с.171.
20.Lysenko Z. N., Berman Е. L., Sakharov А.М., Rabovsky А.В., Ponomarenko V.А. Ргос.21-st Mikrosymp. programme bookley. Ser. Macro. Karlovy Vary, 1980, v. k-32, M20.
21.Сахаров A. M., Берман E.Л., Лысенко 3. H., Галимов Э. M. Докл. АН СССР, 1980, т.250, № 1, с.138.
22.Берман Е.Л., Горковенко А.А., Пономаренко В.А. В кн.: Тез. докл. VII Всес. конф. Химия и биохимия углеводов. Пущино, 1982, с.140.
23.Коршак В.В., Сергеев В.А., Сурная Я.А., Перникис Р.Я. Высокомолек. соед., 1963, т.5, № 2, с.1593.
24.Перникис Р.Я., Коршак В.В., Сергеев В.А., Сурна Я.А. Изв. АН ЛатвССР. Сер. хим., 1964, № 3, с.291.
25.Перникис Р.Я., Коршак В.В., Сергеев В.А., Сурна Я.А. Изв. АН ЛатвССР, 1964, с.5.

Нравится материал? Поддержи автора!
Ещё документы из категории промышленность, производство:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ