Конспект урока "Кислород. Оксиды. Горение" 8 Класс
Урок-зачет по химии в 8 классе «Кислород. Оксиды. Горение»
Цели урока:
- обобщить и систематизировать знания учащихся, полученные при изучении данной темы
- знать состав, строение, свойства, применение и получение кислорода, уметь устанавливать причинно- следственные связи между строением, свойствами и применением кислорода
- уметь составлять уравнения различных реакций, уравнивать их.
-уметь доказывать химические свойства кислорода, записывать уравнения реакций взаимодействия кислорода с простыми веществами.
- уметь работать самостоятельно и в коллективе – по командам, уметь выделять главное, составлять схемы, алгоритмы ответов, сравнивать, делать выводы.
Ход урока.
Вступительное слово учителя. Китайский философ Конфуций в свое время сказал: «Учиться и время от времени от времени повторять изученное – разве это не приятно?!» Пусть это высказывание станет девизом нашего урока.
Я приглашаю вас в волшебную страну, где правит Кислород. Сегодняшний урок пройдет в форме игры. За правильные ответы в течение урока выбудете получать жетоны-«огоньки».
Задание №1. Химический лабиринт.
Чтобы добраться до финиша, начните прохождение лабиринта с верхней левой клетки. Если суждение, вписанное в эту клетку, правильно, то продолжайте путь по стрелке с обозначением «да», если ошибочно, то по стрелке «нет» (Приложение 1). (учащиеся приходят к клетке, в которой высказывание Д. И. Менделеева)
Задание №2. Экологическое.
Знание условий горения веществ необходимо человеку для того, чтобы управлять этим процессом. Наша экономика несет немалый урон от пожаров и возгораний.
- Что является причинами пожаров? (небрежность человека при обращении с легковоспламеняющимися веществами и источниками энергии, нарушение правил пожарной безопасности)
Большой вред наносят пожары лесам. Они возникают в результате непотушенных костров, реже грозовых разрядов. Пожары приводят к гибели птиц, животных, ценных пород древесины и всего живого. А ведь лес играет решающую роль в поддержании кислорода в атмосфере. Леса всего мира ежегодно высвобождают 55,5 млн. т кислорода, обеспечивая всему живому возможность дышать. Поэтому отправляясь в лес, помните, что это бесценное сокровище, а главный его враг огонь.
- Назовите правила пожарной безопасности в лесу, с ними вы познакомились на уроках ОБЖ. Как обустроить место для костра? (Место для костра, а так же пространство вокруг него на метр-полтора очищают от сухой травы, мха, хвои, веток. Непосредственно в месте будущего костра снимают дерн, а в торфяных местах высыпают подушку из песка. Так же кострище желательно обложить по периметру камнями – это сбережет тепло и укроет костер от ветра) Почему необходимо убирать за собой мусор, особенно стеклянную тару? (В процессе разложения вся химия попадает в почву и грунтовые воду, затем в родники. Различные химические вещества вступают между собой в реакции и могут непредсказуемо влиять на здоровье человека. В поисках еды, на "туристические" свалки выходят животные. Вместе с пищей они поглощают целлофан и другие неперевариваемые предметы, что влечет их гибель. На битом стекле в лесу могут легко пораниться отдыхающие дети, туристы, грибники и животные. )
Однако если пожар возник, необходимо принять меры, чтобы как можно быстрее его потушить или хотя бы ограничить.
- Какими средствами можно потушить пламя?
- В каких случаях вода непригодна для тушения огня? (горючих органических жидкостей, загоревшегося газа, электроустановок, так как в последнем случае создается угроза жизни человека, ибо вода электропроводна) Чем можно тушить горящие жидкости? (песком, содой, использовать накидки из огнезащитной ткани или тяжелое покрывало)
- А какие меры пожарной безопасности нужно соблюдать в кабинете химии? (ЗАПРЕЩАЕТСЯ пользоваться газовыми горелками и открытыми нагревательными приборами, если вблизи находятся сосуды с легковоспламеняющимися летучими веществами.
ВОСПРЕЩАЕТСЯ вести работы с легколетучими и легковоспламеняющимися органическими веществами, легкими бензинами, ацетоном, и т.д. без работающей вентиляции.)
- Необходимо так же знать, как оказать первую помощь при термических ожогах? (Если позволяют условия и ожог без нарушения целостности ожоговых пузырей, то обожженный участок в течение 15 минут промывают под струей холодной водопроводной воды. Это оказывает обезболивающее, а, следовательно, противошоковое действие и позволяет в определенной мере “оживить” обожженные кожные ткани. Струя холодной воды поможет также отмочить прилипшую к коже одежду. Прилипшие к коже обгоревшие остатки одежды ни в коем случае нельзя снимать, отдирая их тела! Нужно наложить на них повязку, используя стерильный бинт, а если его нет, то из полос полотняной материи, предварительно проглаженной утюгом. При обширных ожогах пострадавшего завертывают в чистую ткань или простыню.)
И, несмотря ни на что, огонь – это удивительно! Это источник тепла и света, давний друг человека, с его помощью совершается много полезных дел, и даже происходят чудеса. Сейчас вы увидите, как появится Змей Горыныч звучит музыка Видеосюжет «Фараонова змея».
Задание 3. Восстанови шпаргалку.
1. Li + ? = Li2O
2. ? +О2 = AlCl3
3. C3H8 + O2 = ? + ?
4. ? + O2 = P2O5
5. HgO = Hg + ?
6. H2S + O2 = ? + ?
7. C3H6 + O2 = ? + ?
Задание 4. Выберите правильные утверждения. Если они подходят кислороду ставим знак О2, если нет – прочерк.
В промышленности получают из воздуха
Хорошо растворим в воде.
Взаимодействует с простыми и сложными веществами
Применяют в качестве топлива.
Сложное вещество.
При обычных условиях – бесцветный газ.
Собирают вытеснением воздуха.
Принимает участие в процессах окисления.
Простое вещество.
В лаборатории получают из «марганцовки».
Малорастворим в воде
Газ, имеющий запах
Разлагается при нагревании.
Поддерживает горение
Входит в состав минералов, горных пород, песка, воды.
Легче воздуха.
Получают из природного газа.
При обычных условиях жидкость.
Входит в состав воздуха.
Необходим для дыхания.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
+
-
+
-
-
+
+
+
+
+
+
-
-
+
+
-
+
-
+
+
Задание 5 Игра " крестики-нолики ".
-
I.
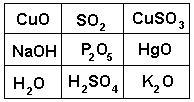
II.
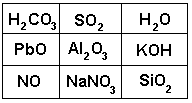
1. Найти оксиды. 2. Написать уравнения химических реакций их получения.
Задание 6. Самый умный
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mg + O2 = 2MgO + 1204 кДж
Задача 2. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена (C2H2) .
Дополнительные задания:
1. Соотнесите формулы веществ с названиями:
1) Н2О,
2) FeO,
3) KCl,
4) Fe2O3,
5) Al2O3,
6) Na2S,
а) оксид алюминия,
б) сульфид натрия
в) оксид железа(III),
г) оксид водорода (вода),
д) хлорид калия,
е) оксид железа(II),
2. Рассчитайте массовую доля кислорода в оксиде азота(II).
3. Сколько грамм железа нужно для получения 3 моль оксида железа(III):
4Fe + 3O2 = 2Fe2O3?
Подведение итогов урока. Выставление оценок (Каждый ученик ставит себе оценку за урок сам, и оценка обсуждается с учителем)


Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ