Конспект урока на тему "Правило смещения химического равновесия. Принцип Ле Шателье"
УМЕНЬШЕНИЕ - Q T + Q РАСХОДОВАНИЕ С ОБРАЗОВАНИЕ Р УВЕЛИЧЕНИЕ

«



 Правило смещения химического равновесия.
Правило смещения химического равновесия.
гомог.

 Принцип Ле Шателье»
Принцип Ле Шателье»
Г А З





Г А З



 Конспект №12
Конспект №12
«Реакции между растворами
электролитов»
Реакции между растворами кислот солей и щелочей идут необратимо если в результате образуются:
А) нерастворимые соединения;
Б) вещества выделяющиеся в виде газа:
 CO2 SO2 NH3
CO2 SO2 NH3


 H2S; H2CO3 ; H2SO3 ; NH4OH
H2S; H2CO3 ; H2SO3 ; NH4OH
H2O H2O H2O
В) малодиссоциирующие вещества:
H2O, слабые кислоты.

Конспект №13 «Основные физические величины»
V-объем (мл. . л., м3)
Vм-молярный объем газов (л/моль)
Ar –относительная атомная масса
Мr –относительная молекулярная масса
n- количество вещества (моль)
M – молярная масса (г/моль)
- плотность (г/мл, г/см 3, кг/л)
N – число структурных частиц
NA- постоянная Авогадро
t – температура (0С)
- массовая доля
- объемная доля
С- молярная концентрация (моль/л)
p- давление (Па)
DB- относительная плотность газа по воздуху
DH2-относительная плотность газа по водороду
- доля выхода продукта реакции от теоретически возможного
- скорость реакции (моль/л с)
Конспект №14 «Взаимосвязь основных
NA = 6 × 1023частиц
N=NA×n
n(моль) M = m n V(газа) n VM(газов)=22,4л/моль = m(вещества) m(раствора) C= моль/л(М) n V(раствора) V(газа) V(cмеси) = M=(Mr,Ar)г/моль VM =

















Конспект №1 Составитель Прянин А.К. г.Энгельс гимназия №8
Свойства основных классов неорганических соединений.
КОк
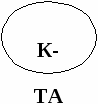
К-ТА
СОЛЬ
Н2О
РАЗЛ.
Ме
Р 1 1 Н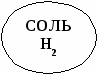



2 Р Ме
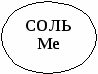



 Ме
Ме
M Al H


H2
MeO H2


ООк
СОЛЬ
СОЛЬ
Н2О
Р
3 ЩЕЛОЧЬ




О Р
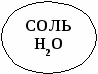
СОЛЬ Н2О

Р Н Р




Н

С ОЛЬ
ОЛЬ
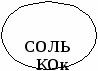
5 Н






Н Р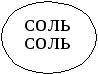



Н Кроме SiO2
ЭЛЕКТРОЛИЗ
Н2 + О2
РАЗЛ.


ЭЛЕКТРОЛИЗ
Н2 + О2
1. HNO3 и конц.H2SO4 взаимодействуют со всеми Ме кроме золота и платины , но при этом выделяется не Н2,
а другие продукты. 2. Менее активные металлы восстанавливаются более активными металлами из состава
их солей. 3. Реакция характерна только для оксидов активных металлов (см. консп. №10)
4. Реакция характерна только для SiO2. 5. Менее сильные кислоты вытесняются более сильными кислотами
из состава их солей (см. консп. № 9) 6. Верно только для нестойких кислот.
Р Н 



 Э -положение металлов в электрохимическом ряду напряжения.
Э -положение металлов в электрохимическом ряду напряжения.

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ