Урок по теме: "Азотная кислота. Строение молекулы и получение"
Дата_____________ Класс_______________
Тема: Азотная кислота. Строение молекулы и получение.
Цели урока: знать строение, свойства и применение азотной кислоты, особые свойства азотной кислоты (взаимодействие с металлами); уметь доказывать химические свойства азотной кислоты, записывать уравнения реакций в свете представлений об электролитической диссоциации и окислительно-восстановительных процессах.
Ход урока
1. Организационный момент урока.
2. Изучение нового материала.
HNO3 - Азотная кислота
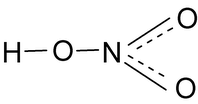
Опытным путём доказано, что в молекуле азотной кислоты между двумя атомами кислорода и атомом азота две химические связи абсолютно одинаковые – полуторные связи. Степень окисления азота +5, а валентность равна IV.
Физические свойства
Азотная кислота HNO3 в чистом виде - бесцветная жид кость с резким удушливым запахом, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см3. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
Под действием света азотная кислота частично разлагается с выделением NО2 и за cчет этого приобретает светло-бурый цвет:
N2 + O2 грозовые эл.разряды→ 2NO
2NO + O2 → 2NO2
4НNО3 свет→ 4NО2↑(бурый газ) + 2Н2О + О2
Азотная кислота высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты, так что нужно остерегаться их вдыхания. Азотная кислота окисляет многие органические вещества. Бумага и ткани разрушаются вследствие окисления образующих эти материалы веществ. Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок – ксантопротеиновая реакция). То есть – это ожог кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках.
Получение
1. Лабораторный способ
KNO3 + H2SO4(конц) → KHSO4 + HNO3 (при нагревании)
2. Промышленный способ
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 → 4NO + 6H2O (Условия: катализатор – Pt, t = 500˚С)
б) Окисление кислородом воздуха NO до NO2
2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O ↔ 4HNO3
или 3NO2 + H2O ↔ 2HNO3+NO (без избытка кислорода)
Применение
в производстве минеральных удобрений;
в военной промышленности;
в фотографии — подкисление некоторых тонирующих растворов;
в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише).
в производстве взрывчатых и отравляющих веществ
3. Закрепление изученного материала
№1. Степень окисления атома азота в молекуле азотной кислоты
a. +4
b. +3
c. +5
d. +2
№2. Атом азота в молекуле азотной кислоты имеет валентность равную -
a. II
b. V
c. IV
d. III
№3. Какими физическими свойствами характеризуют чистую азотную кислоту?
a. без цвета
b. не имеет запаха
c. имеет резкий раздражающий запах
d. дымящая жидкость
e. окрашена в жёлтый цвет
№4. Установите соответствие между исходными веществами и продуктами реакции:
a) NH3 + O2
1) NO2
b) KNO3 + H2SO4
2) NO2 + О2 + H2O
c) HNO3
3) NO + H2O
d) NO + O2
4) KHSO4 + HNO3
№5. Расставьте коэффициенты методом электронного баланса, покажите переход электронов, укажите процессы окисления (восстановления; окислитель (восстановитель):
NO2 + О2 + H2O ↔ HNO3
4. Домашнее задание
П.19, упр. 3-6, задачи 1-2 на стр.60

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ