Урок по теме: "Соли аммония"
Дата_____________ Класс_______________
Тема: Соли аммония.
Цели урока: знать строение молекулы аммиака, физические и химические свойства, области применения; уметь доказывать химические свойства аммиака: записывать уравнения реакций аммиака с кислородом, водой, кислотами и рассматривать их с точки зрения теории электролитической диссоциации и окислительно-восстановительных процессов.
Ход урока
1. Организационный момент урока.
2. Изучение нового материала.
Соли аммония
Соли аммония - это сложные вещества, в состав которых входят ионы аммонияNH4+, соединённые с кислотными остатками.
Например,
NH4Cl – хлорид аммония
(NH4)2SO4 - сульфат аммония
NH4NO3 – нитрат аммония
(NH4)3PO4 – ортофосфат аммония
(NH4)2HPO4 – гидроортофосфат аммония
NH4H2PO4 – дигидроортофосфат аммония
Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
Получение
1 способ- Аммиак + кислота: NH3 + HNO3 → NH4NO3
2 способ- Аммиачная вода + кислота: 2NH4OH + H2SO4 → (NH4)2SO4+ 2Н2O
Химические свойства
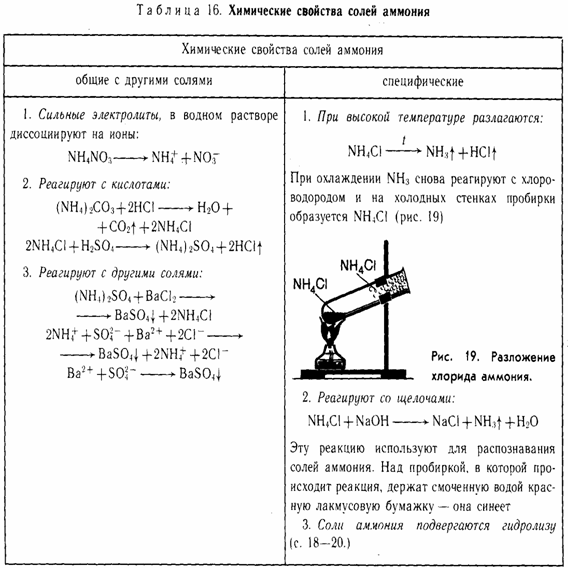
ОБЩИЕ
1. Сильные электролиты (диссоциируют в водных растворах)
NH4Cl → NH4+ + Cl-
2. С кислотами (реакция обмена)
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2
CO32- + 2H+ → Н2O + CO2
3. С солями (реакция обмена)
(NH4)2SO4 + Ba(NO3)2 → BaSO4↓ + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- → BaSO4 ↓ + 2NH4+ + 2NO3-
Ba2+ + SO42- → BaSO4 ↓
СПЕЦИФИЧЕСКИЕ
1. Разложение при нагревании.
a) если кислота летучая
NH4Cl → NH3 + HCl (при нагревании)
NH4HCO3 → NH3 + Н2O + CO2
б) если анион проявляет окислительные свойства
NH4NO3 → N2O + 2Н2O (при нагревании)
(NH4)2Cr2O7 → N2 + Cr2O3 + 4Н2O (при нагревании)
2. Качественная реакция на NH4+ - ион аммония. При нагревании со щелочами выделяется газ аммиак
NH4Cl + NaOH → NaCl + NH3 + Н2O (при нагревании)
3. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O → NH4OH + HCl
NH4+ + Н2O → NH4OH + H+
Применение
Нитрат аммония (аммиачная селитра) NH4NO3 применяют как азотное удобрение и для изготовления взрывчатых веществ — аммонитов;
Сульфат аммония (NH4)2SO4 — как дешёвое азотное удобрение;
Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 — в пищевой промышленности при производстве мучных кондитерских изделий в качестве химического разрыхлителя, при крашении тканей, в производстве витаминов, в медицине;
Хлорид аммония (нашатырь) NH4Cl — в гальванических элементах (сухих батареях), при пайке и лужении, в текстильной промышленности, как удобрение, в ветеринарии.
3. Закрепление изученного материала
№1. Заполните таблицу – запишите молекулярные, полные и краткие ионные уравнения для следующих солей аммония:
Соли
Химические свойства, общие с другими солями (1 – 3)
Специфические свойства (1 – 2)
1. Хлорид аммония
2. Карбонат аммония
3. Сульфид аммония
4. Сульфат аммония
5. Нитрат аммония
№2. Ответьте на вопрос: Гидрокарбонат аммония иногда применяют при выпечке кондитерских изделий. Какие свойства гидрокарбоната при этом используют? Ответ подтвердите уравнениями реакций.
4. Домашнее задание.
П. 18, упр.12-14 на стр.42

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ