Окислительно–восстановительные реакции. Окисление и восстановление
Дата _____________ Класс ____________________
Тема: Окислительно–восстановительные реакции. Окисление и восстановление.
Цели урока: закрепить ЗУН об окислительно-восстановительных реакциях; проверить умения уравнивать записи ОВР методом электронного баланса.
Ход урока.
1. Организационный момент.
2. Решение задач по теме.
№1. Определите степень окисления атомов химических элементов по формулам их соединений: H2S, O2, NH3, HNO3, Fe, K2Cr2O7
№2. Определите, что происходит со степенью окисления серы при следующих переходах:
А) H2S → SO2 → SO3
Б) SO2→ H2SO3 → Na2SO3
Какой можно сделать вывод после выполнения второй генетической цепочки?
На какие группы можно классифицировать химические реакции по изменения степени окисления атомов химических элементов?
№3. Расставьте коэффициенты в УХР методом электронного баланса, укажите процессы окисления (восстановления), окислитель (восстановитель); запишите реакции в полном и ионном виде:
А) Zn + HCl = H2+ ZnCl2
Б) Fe + CuSO4 = FeSO4 + Cu
№4. Даны схемы уравнений реакций:
СuS + HNO3(разбавленная) = Cu(NO3)2 + S + NO + H2O
K + H2O = KOH + H2
Расставьте коэффициенты в реакциях используя метод электронного баланса.
Укажите вещество - окислитель и вещество - восстановитель.
3. Самостоятельная работа по вариантам

4. Домашнее задание
П. 5, упр. 8, задание по карточкам
К1.
Составить молекулярное и ионное уравнение реакции
Al + HCl →
Сu + HNO3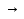
К2.
Составить молекулярное и ионное уравнение реакции
Ca + HNO3 →

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ