Урок по теме: "Окислительно–восстановительные реакции. Окисление и восстановление"
Дата _____________ Класс ____________________
Тема: Окислительно–восстановительные реакции. Окисление и восстановление.
Цели урока: сформировать понятие об окислительно-восстановительных реакциях; научить учащихся уравнивать записи ОВР методом электронного баланса.
Ход урока
1. Организационный момент урока.
Составить ионные уравнения реакций цепочки:
Са СаО
СаО Са(ОН)2
Са(ОН)2
2. Изучение нового материала.
Рассмотрите приведённые ниже схемы уравнений реакций. В чём их существенное отличие? Изменились ли степени окисления элементов в этих реакциях?
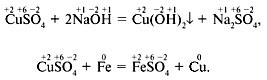
В первом уравнении степени окисления элементов не изменились, а во втором изменились – у меди и железа.
Вторая реакция относится к окислительно-восстановительным.
Реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ и продуктов реакции, называют окислительно-восстановительными реакциями (ОВР).
СОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ.
Существуют два метода составления окислительно - восстановительных реакций - метод электронного баланса и метод полуреакций. Здесь мы рассмотрим метод электронного баланса.
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем.
Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Рассмотрим этот метод на примере.
Расставить коэффициенты в реакции, схема которой:
HCl + MnO2 = Cl2 + MnCl2 + H2O
Алгоритм расстановки коэффициентов
1.Указываем степени окисления химических элементов.
![]()
Подчёркнуты химические элементы, в которых изменились степени окисления.
2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов.
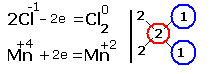
За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное (взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит, перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2тоже -1.
Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно, и перед HCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение:
![]()
Рассмотрим более сложное уравнение:
H2S + KMnO4 + H2SO4 S + MnSO4 + K2SO4 + H2O
Расставляем степени окисления химических элементов:
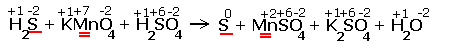
Электронные уравнения примут следующий вид
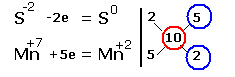
Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции
![]()
Основные положения теории окислительно-восстановительных реакций
1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом.
Например:
Al – 3e- = Al3+
Fe2+ - e- = Fe3+
H2 – 2e- = 2H+
2Cl- - 2e- = Cl2
При окислении степень окисления повышается.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом.
Например:
S + 2е- = S2-
Сl2 + 2е- = 2Сl-
Fe3+ + e- = Fe2+
При восстановлении степень окисления понижается.
3. Атомы, молекулы или ионы, отдающие электроны называются восстановителями. Во время реакции они окисляются.
Ато мы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются.
Так как атомы, молекулы и ионы входят в состав определенных веществ, то эти вещества соответственно называются восстановителями или окислителями.
4. Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов - окисления и восстановления.
Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
3. Домашнее задание
П. 5, упр.6-7, задача 3 на стр. 22

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ