Конспект урока "КОРРОЗИЯ МЕТАЛЛОВ" 9 Класс




УРОК ПО ТЕМЕ
«КОРРОЗИЯ МЕТАЛЛОВ»
9 класс
Разработку урока подготовил
учитель химии
МАОУ «СОШ №36» г. Перми
Сыропятова Е.В.
Оглавление.
Цели и задачи урока_____________________________2 стр.
Ход урока
Вступительное слово учителя________________2 – 3 стр.
Изучение нового материала__________________3-5 стр.
Первичная проверка усвоения знаний__________5 стр.
Контроль знаний____________________________5-6 стр.
Выводы по уроку, домашнее задание________________6 стр.
Приложение_____________________________________7 стр.
Тема урока: «Коррозия металлов».
Цель урока: создание условий для восприятия и первичного закрепления нового учебного материала, осмысление связей и отношений в объектах изучения.
Задачи урока:
Образовательные:
формирование представления о коррозии металлов как самопроизвольном окислительно-восстановительном процессе, её видах, причинах, механизме и способах защиты;
формирование личностных УУД.
Развивающие:
развитие умений проведения химического эксперимента с соблюдением правил техники безопасности, построения логических цепочек и умения делать выводы из наблюдений, прогнозировать решение некоторых проблем;
развитие познавательных УУД.
Воспитательные:
развитие коммуникативных УУД.
Тип урока: изучение нового материала.
Методы и приемы обучения: метод проблемного изложения материала, метод поисковой беседы, исследовательский метод.
Оборудование: компьютер, мультимедиа, таблицы: «Коррозия металлов», «Защита металлов от коррозии», опорный конспект «Коррозия металлов».
Реактивы для выполнения демонстрационных опытов: раствор NaCl, Al, Fe, Cu, Zn, медная проволока, 7 пробирок, фенолфталеин.
Ход урока
1 этап. Вступительное слово учителя (подготовка к изучению нового материала) – 5 мин.
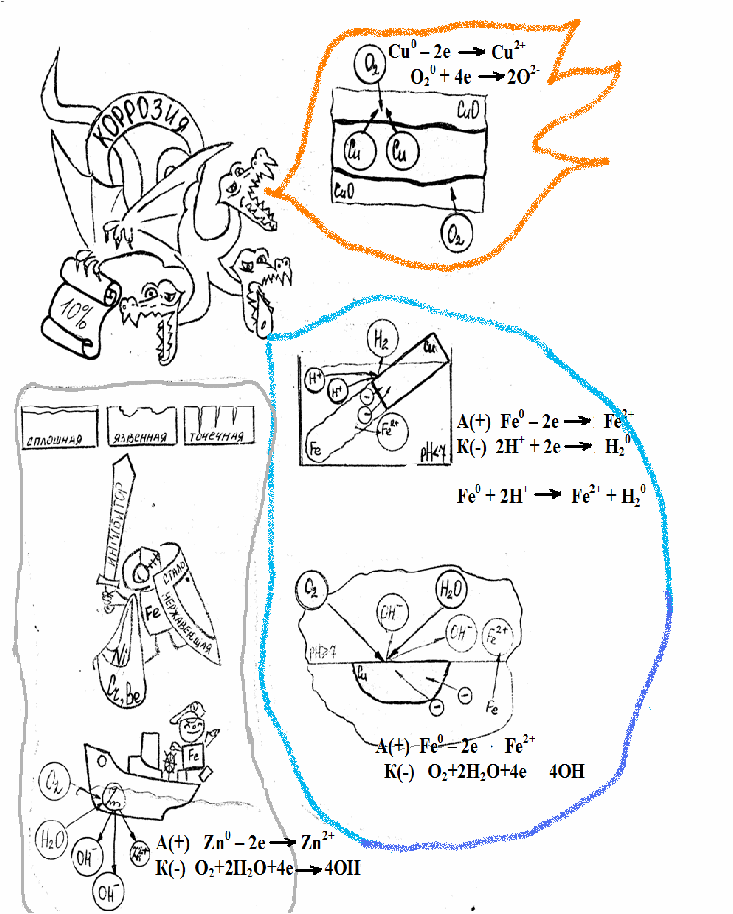
Урок начинается с чтения сказки, главным персонажем которой является дракон. В сказке дракон олицетворяется с процессом коррозии.
«В царство металлов проник дракон. Он захватил символ Парижа – Эйфелеву башню. И только постоянная химиотерапия помогает сопротивляться разрушительному действию сил дракона. Также по вине дракона 31 января 1957 года обрушился железный мост в Квебеке (Канада), введенный в эксплуатацию в 1947 году. Рухнуло одно из самых высотных сооружений в мире – 400-метровая антенная мачта в Гренландии. Одна только «Железная колонна» (Дели) успешно противостоит ненасытному дракону. На протяжении десятков лет колонна является предметом оживленных споров между учеными, которые даже в эпоху высоких технологий не в состоянии объяснить, почему за свою 1600-летнюю историю она практически не поддалась воздействию дракона».
Учащиеся определяют тему урока «Коррозия металлов» и совместно с учителем определяют цели и задачи урока.
2 этап. Изучение нового материала – 15 мин.
1. Определение коррозии металлов – процесс разрушения металлов и их сплавов под воздействием окружающей среды
Me0 – ne = Me+n
2. Определение факторов, способствующих коррозии.
а) роль кислорода воздуха в коррозии железа (учащийся представляет результаты заранее проведенного домашнего эксперимента). В две пробирки была налита вода, в одной из них кипяченая. В обе пробирки были помещены железные гвозди, очищенные наждачной бумагой. Пробирки закрывались резиновыми пробками. Происходит обсуждение результатов эксперимента, учащиеся делают выводы о влиянии кислорода на процесс коррозии.
б) коррозия металлов при наличии двух условий:
электропроводной среды
контакта двух различных металлов
В начале урока закладывается серия опытов. Наливают в семь пробирок раствора поваренной соли. В каждую пробирку прибавляют по 2-3 капли фенолфталеина. Помещают в каждую пробирку тщательно зачищенные кусочки металлов: 1-алюминий, 2-железо, 3-медь, 4-цинк, 5-алюминий, обвитый медной проволокой, 6-железо, обвитое медной проволокой, 7-цинк, обвитый медной проволокой.
Учащиеся наблюдают появление розового окрашивания, отмечая, где оно появляется быстрее. Делают выводы. Анализ результатов позволяет перейти к следующей части урока.
Виды коррозии
По характеру разрушения металла различают коррозию сплошную, язвенную и точечную (демонстрация фотографий коррозии металлов).
химическая (газовая) коррозия – происходит в сухих газах, при полном отсутствии влаги.
вос-ль Сu0 – 2e→ Cu2+ /2/ окисление
ок-ль O20+4e→2O2-/1/ восстановление
Вывод: кислород оказывает огромное влияние на процесс коррозии, являясь одним из наиболее агрессивных ее факторов.
электрохимическая коррозия – происходит в среде электролита с возникновением электрического тока. Это такая коррозия, в результате которой наряду с химическими процессами (процесс окисления), происходят электрические (перенос электронов от одного участка изделия к другому).
Учитель вспоминает еще раз о разрушении Эйфелевой башни, она ржавеет и разрушается. Это сложный процесс, который включает несколько стадий. Суммарно оно выглядит следующим образом:
4Fe + 6H2O(влага) + 3O2(воздух) → 4Fe(OH)3 (учащиеся самостоятельно рассматривают окислительно – восстановительые процессы, делают выводы).
Однако химически чистое железо почти не корродирует. Техническое железо, содержащее различные примеси, например, в чугунах и сталях, ржавеет. Если на контакт двух металлов (железо и медь) попадает раствор электролита, например, соляная кислота, то образуется гальванический элемент, и начинается окислительно-восстановительная реакция. В результате реакции более активный металл (железо) окисляется и переходит в раствор, а ионы водорода восстанавливаются на менее активном металле (меди):
в-ль Fe0 – 2e →Fe 2+ (ок-ие)
ок-ль 2H+ + 2e → H2 (вос-ие)
Способы защиты металлов от коррозии.
Далее учитель рассказывает о том, что еще в Древнем Египте было замечено, что латунные изделия (сплав меди и цинка) со временем покрываются слоем губчатой меди, а цинк окисляется. В средние века было рассмотрено отбеливание монет из сплава меди с серебром в растворе винного камня, при этом медь растворялась, а на поверхности монеты оставалось серебро.
1.Защитные поверхностные покрытия:
а) металлическое (цинк, олово, никель, свинец)
б) неметаллические (лаки, краски, эмали…)
2.Создание сплавов с антикоррозионными свойствами – легирование
металлов (никель, кобальт, хром, вольфрам…)
3. Введение ингибиторов
4. Протекторная защита
3 этап. Первичная проверка усвоения знаний – 15 мин.
Разбираем результаты демонстрационных опытов, записываем уравнения, рассматривая их как окислительно-восстановительные процессы (работа в группах), предоставляем результаты работы в группах. По окончании работы еще раз делаются выводы.
4 этап. Контроль знаний – 8 мин.
Самостоятельная работа «Коррозия металлов» по вариантам.
Вариант №1
Что такое «коррозия»? Какие факторы способствуют замедлению коррозии металлов?
На стальной крышке поставлена медная заклепка. Что разрушится раньше – крышка или заклепка? Почему?
Вариант №2
Какие виды коррозии вам известны?
Почему луженный (покрытый оловом) железный бак на месте повреждения защитного слоя быстро разрушается?
Вариант №3
Какие факторы, способствуют усилению коррозии?
Какие металлы при взаимном контакте в присутствии электролита быстрее разрушаются Cu или Zn, Al или Fe? Почему?
Вариант №4
Перечислите способы борьбы с коррозией?
Почему на оцинкованном баке на месте царапины цинк разрушается, а железо не ржавеет?
IV. Подведение итогов урока, домашнее задание – 2 мин.
Д/з: §10, упр.1, 2,4.
РЯД НАПРЯЖЕНИЯ МЕТАЛЛОВ
Li, Rb, К, Ва, Sr, Са, Mg, Al, Be, Mn, Zn, Cr, Ga, Fe, Cd, Tl, Co, Ni, Sn, Pb, H, Sb, Bi, As, Cu, Hg, Ag, Pd, Pt, Au.

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ