Конспект урока "Свойства кислот как электролитов"
 Тема урока " Свойства кислот как электролитов"
Тема урока " Свойства кислот как электролитов"
Тип урока: урок открытия новых знаний
Цель: создать условия для полноценного восприятия материала по теме
Предметные задачи:
систематизировать знания учащихся о химических свойствах кислот; формировать умение записывать химические уравнения с учетом ТЭД, научить учащихся, используя ряд напряжения металлов и таблицу растворимости прогнозировать возможность протекания химических реакций с кислотами.
дать первоначальные представления о качественных реакциях;
научить школьников применять знания о химических свойствах кислот при написании ионных уравнений реакций
Метапредметные задачи: способствующие формированию УУД
регулятивных: учить принимать участие в учебном сотрудничестве, осуществлять целеполагание и прогнозирование учебной задачи
познавательных: умение структурировать знания, постановка и формулирование проблемы, осуществлять моделирование, выбор наиболее эффективных способов решения учебных задач
коммуникативных :планирование учебного сотрудничества со сверстниками, сотрудничество в поиске и сборе информации, умение выражать свои мысли
Личностные задачи:
способствовать воспитанию культуры интеллектуального труда; чувства ответственности, уверенности в себе, требовательности к себе;
умение работать в коллективе.
Планируемые результаты обучения: обучающиеся научатся осознано воспринимать и оценивать содержание материала урока, участвовать в практическом применении полученных знаний
Методы обучения: эвристический, самостоятельная работа, частично-поисковый и проектный метод обучения.
Технологии: проблемное, практико- ориентированное, исследовательское обучение.
Форма организации учебной деятельности учащихся: частично поисковая деятельность, создание проблемных ситуаций.
Методы и приемы обучения: словесный, частично-поисковый, проблемное изложение
Средства обучения: лабораторный эксперимент, таблица растворимости, учебник, доска.
Оборудование: карточки-задания для самостоятельной практической работы, оборудование и реактивы для ученического эксперимента; выставка продуктов, содержащих кислоты; презентация по теме, выполненная в программе Power Point.
ХОД УРОКА
I. I. Организационное начало урока. Самоопределение к деятельности.
Введение в тему. Что объединяют эти рисунки? Почему? Мы продолжаем с вами изучать кислоты. Что изучили? Что необходимо рассмотреть?
Девиз урока: «Просто знать еще не все, знания надо уметь использовать». (И.В.Гете)
II. Подготовка к работе на основном этапе
1. Какая кислота обугливает органические вещества? (серная кислота)
2. Какая кислота находится в желудке человека? (соляная кислота)
3. Какую кислоту применяют для консервирования овощей? (уксусная кислота)
4. Какая кислота содержится в газированных напитках? (угольная кислота)
5. Какая кислота содержится в косточках вишни, абрикосов. Эта кислота и ее соли являются сильнейшими ядами (синильная кислота)
6. Кислота очень приятна на вкус и её добавляют в лимонады, мармелад; особенно много ее содержится в кока-коле (фосфорная кислота)
7. Какая кислота содержится в крапиве и в выделениях муравьев? (муравьиная кислота)
Выпишите формулы неорганических кислот, какие группы по признакам классификации вы могли бы предложить:
Работа в вариантах: работа с таблицей №10 «Классификация кислот» стр.210 учебника.
1вариант - по 1-3 признакам
2 вариант - по 4-6 признакам
III. Усвоение новых знаний и способов действий.
Перед Вами 3 факта о кислотах. О какой способности, признаке кислот идет речь
фосфорную кислоту используют для очистки железа от ржавчины (оксидов железа)
на Курилах, на острове Кунашир можно увидеть озеро с молочно-белой водой из-за наличия в ней кислот — соляной и серной.
уксусную кислоту используют для гашения питьевой соды в быту
Как вы думаете, какими химическими свойствами будут обладать кислоты? Предположите свойства кислот. Решение учебной проблемы. Для выдвижения гипотезы – беседа: что с позиций ТЭД отличает кислоты от других классов неорганических веществ? С какими веществами будут реагировать кислоты?
На примере разных кислот можно убедиться в том, что растворы кислот проявляет перечисленные свойства ( данная работа выполняется на основе химического эксперимента с составлением наблюдаемых реакций в молекулярном и ионном виде)
Предлагаю химические свойства изучить самостоятельно, работая в группах и индивидуально.
Инструктаж по Т.Б. (ученики называют правила техники безопасности при выполнении практической работы).

IV. Реализация построенного проекта. Первичное закрепление знаний.
Учитель: вспомнить слова М. Фарадея: “Ни одна наука не нуждается в эксперименте в такой степени как химия. Ее основные законы, теории и выводы опираются на факты, поэтому постоянный контроль опытом необходим”. Поэтому опытным путем докажем химические свойства кислот, соблюдая технику безопасности.
Каждая группа получает инструктивную карту (всего пять карт, содержащих по одному вопросу), выполняют по ней экспериментальную задачу, отвечают на вопросы, пишут уравнения и делают выводы. На индивидуально- групповую работу отводится 5-7 минут.
Вопросы:
1.Как можно доказать наличие в растворе кислотной среды? (растворы соляной, серной, уксусной, лимонной кислот).
2.Известно, что гашеная известь, входит в состав штукатурки, стеновых покрытий, строительных материалов. Устойчива ли она к действию кислот?
3. Почему нельзя варить кислые щи, борщ или компот из свежих ягод в алюминиевой кастрюле?
4. Почему металлические конструкции в природе постепенно разрушаются. Все ли металлы подвергаются такому разрушению?
5. Почему после того, как вы съели кислое яблоко, нельзя чистить зубы?
Затем идет обсуждение результатов работы каждой группы. (Один ученик пишет уравнения в молекулярном, полном ионном и сокращенном ионном виде на доске, другой объясняет результаты опыта. Все остальные ребята делают записи в тетради).
Инструктивная карта №1
Как можно доказать наличие в растворе кислотной среды?
Цель эксперимента: определить окраску индикаторов в растворах разных кислот ( соляной, серной, фосфорной).
Ход эксперимента:
1. в растворы разных кислот внести несколько капель индикатора метилового оранжевого;
2. капнуть соляной кислоты на полоску универсального индикатора.
Что наблюдаете?
Составьте уравнения электролитической диссоциации серной, фосфорной и соляной кислот.
Сделайте вывод о распознавании кислот.
Инструктивная карта №2
Почему металлические конструкции в природе постепенно разрушаются. Все ли металлы подвергаются такому разрушению?
Цель эксперимента: Исследовать действие кислот на различные металлы.
Ход эксперимента: В две пробирки налить по 1-2 мл соляной кислоты; в одну поместить цинковую гранулу, в другую – медную проволоку.
Что наблюдаете? Составьте уравнение реакции между соляной кислотой и цинком в молекулярном и ионном виде.
Сделайте вывод об активности металлов и взаимодействии кислот с некоторыми металлами.
Инструктивная карта №3
Почему в алюминиевой кастрюле нельзя варить щи или компот из свежих ягод?
Опорные знания: алюминий, из которого изготовлена кастрюля, покрыт неядовитой оксидной пленкой.
Цель эксперимента: определить, будет ли реагировать оксид алюминия с кислотами.
Ход эксперимента:
1. в одну пробирку налейте 1-2 мл с серной кислоты
2. в другую - 1-2 мл с соляной кислоты,
3. добавьте в них немного оксида алюминия.
Что наблюдаете? Составьте уравнение реакции между оксидом алюминия и серной кислотой в молекулярном и ионном виде. Сделайте вывод о взаимодействии кислот с оксидами металлов.
Инструктивная карта №4
Известно, что гашеная известь, входит в состав штукатурки, стеновых покрытий, строительных материалов . Устойчива ли она к действию кислот?
1. Опорные знания: гашеная известь Сa (OH)2 ;взаимодействие кислот с основаниями, реакция нейтрализации, реакции обмена.
Цель эксперимента: определить, будет ли реагировать гашеная известь с кислотами.
Ход эксперимента:
1.в две пробирки налейте по 1-2 мл гидроксида кальция Сa (OH)2,
2. добавьте в них несколько капель фенолфталеина. Что наблюдаете?
3. в одну из них прилейте немного серной, а в другую - азотной кислоты.
Что наблюдаете? Составьте уравнение реакции между Сa (OH)2 и азотной кислотой в молекулярном и ионном виде. Сделайте вывод о взаимодействии кислот с основаниями.
Инструктивная карта №5
Почему после того, как вы съели кислое яблоко, нельзя чистить зубы?
Опорные знания: В состав эмали зубов входят соли: карбонаты и фосфаты кальция (Сa CO3, Сa3 (PO4)2 ); угольная кислота неустойчивая, разлагается на воду и углекислый газ.
Цель эксперимента: определить, как реагируют соли с кислотами.
Ход эксперимента:
1.в одну пробирку поместите немного карбоната кальция СaCO3
2. в другую пробирку поместите немного фосфата кальция Сa3 (PO4)2.
3. добавьте в них немного соляной кислоты.
Что наблюдаете?
Составьте уравнение реакции между СaCO3 и соляной кислотой в молекулярном и ионном виде. Сделайте вывод о взаимодействии кислот с солями.
На доске прикрепляю карточки
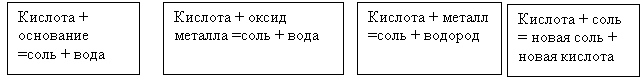
Подведение итогов работы группы:
Кислота и ОСНОВАНИЕ
Образуют соль и воду.
Именно вот это свойство
Взяли все кислоты в моду.
Возьмём любой нерастворимый гидроксид,
Который с кислотой любезничать спешит,
А в результате – соль с водою.
В кислоту внесёшь ОКСИД ты
Настоящего МЕТАЛЛА,
Без сомненья соль и воду
Ты получишь, если надо.
Кислота, кроме азотной,
И МЕТАЛЛ до водорода,
Образуют соль охотно
И, конечно, водород.
А если кислоту с СОЛЬЮ взять
Получатся другая соль и кислота опять.
Учитель: Зная химические свойства кислот, можно применять их в практической деятельности, в повседневной жизни. И я вам в качестве подарка приготовила ПОЛЕЗНЫЕ СОВЕТЫ
Физкультминутка
4 . Закрепление материала
***Как всякая кислота, уксус легко удаляет остатки мыла с того, что вы вымыли. Поэтому в уксусе принято полоскать после стирки шерстяные и шёлковые изделия.
***Ржавые пятна с книжных страниц выводится раствором лимонной кислоты.
***Пятна от рыбьего жира выводят с одежды крепким раствором уксуса ( 1 ст. ложка на один стакан воды ).
***Вещи из пёстрых тканей, испачканные кофе или чаем, простирывают в холодной воде, слегка подкислённой уксусной кислотой.
***Если оконные стёкла загрязнены, их можно вымыть раствором уксуса ( 2 ст. л на стакан воды )
Химические метки:
Работа в группах: на стенах класса есть метки, где записаны формулы. Выбрать по 3 вещества, реагирующих с серной кислотой : Аu, Zn, CuO, CO2, NaOH, FeCl 2 , Na 2 SiO 3 , ВаCl2
Составить молекулярные и ионные уравнения реакций.
VII. Домашнее задание
П. 37 упр.1,стр.209, задача* Предложите ионные реакции для очистки сточных вод автотранспортного предприятия от катионов Pb2+ и Cu2+, оказывающих токсическое действие на живые организмы.
Итоги урока. Рефлексия. Благодарю вас за работу на уроке и хочу привести слова Д.И. Менделеева: «Сами трудясь, вы сделаете многое для себя и для близких, а если в труде успеха не будет, будет неудача, не беда – попробуйте ещё».
Учащимся предлагается самоанализ собственной деятельности:
-достиг ли ты цели урока?(+ -)
-пригодятся ли тебе в жизни знания по теме урока?(+ -)
- За что могу похвалить себя, одноклассников?
- Что больше всего понравилось?
- Что было очень трудным? Что удивило?
-как ты оцениваешь свою деятельность на уроке?

Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Чтобы скачать документ, порекомендуйте, пожалуйста, его своим друзьям в любой соц. сети.
После чего кнопка «СКАЧАТЬ» станет доступной!
Кнопочки находятся чуть ниже. Спасибо!
Кнопки:
Скачать документ